0 引言
【研究意义】紫花苜蓿(Medicago sativa L.)是重要的多年生豆科牧草,具有生产潜力大,营养价值高、适应性广等特点[1,2],不论用来青饲、青贮、干草,还是放牧,都是最经济可靠的优质蛋白饲料来源[3],在畜牧业发展、农业产业结构调整和生态文明建设中具有重要的地位与作用。次生壁(secondary cell wall,SCW)是植物细胞停止生长后,由纤维素、半纤维素和木质素等物质在初生壁内侧沉积形成有规则的疏水性网络结构[4]。LI[5]和KOKUBO[6]等研究表明细胞壁会显著影响水稻、大麦等作物的茎秆强度,与作物的产量,抗逆性和抗胁迫性直接相关。因此,探究紫花苜蓿次生壁的合成调控对提高其产量和品质具有重要意义。【前人研究进展】近十几年来,关于次生壁合成调控的研究取得了显著进展,NAC(NAM、ATAF1/2、CUC2)结构域转录因子和MYB(MYELOBLASTOSIS)结构域转录因子是调控维管组织导管细胞和纤维细胞次生壁合成的转录开关因子[7,8]。NAC结构域转录因子有VASCULAR- RELATED NAC DOMAIN1-7(VND1-7)[9]、NAC SECONDARY WALL THICKENING PROMOTING(NST1)、NST2和SECONDARY WALL-ASSOCIATED NAC DOMAIN 1(SND1)[10,11,12]。MYB家族转录因子中有很多成员是次生壁合成网络的次级调控因子,大部分处于NAC转录因子的下游,其中MYB46[13]和MYB83[14]被NAC转录因子直接调控。NAC转录因子和MYB转录因子形成分层级的调控网络作用于纤维素、半纤维素和木质素合成基因,调控细胞壁的次生加厚过程[15]。【本研究切入点】目前,次生壁合成调控网络在百日草(Zinnia elegans)、拟南芥(Arabidopsis thaliana)等模式植物中阐释比较清晰[9,16],但在非模式植物中研究很少。紫花苜蓿是一种高度杂合的同源四倍体植物,自交不亲和,遗传背景十分复杂,且全基因组测序尚未完成,通过传统分子生物学方法逐一地对次生壁合成调控网络中涉及的大量基因进行研究,效率低,难度大。利用高通量转录组测序(RNA-Seq)能够全面快速地获取紫花苜蓿茎在不同生长发育时期的几乎所有转录本信息并且不需要其基因组信息[17],可系统分析次生壁发育相关的基因网络变化。【拟解决的关键问题】本研究通过对紫花苜蓿不同发育时期的茎样本进行RNA-Seq,深入研究与次生壁加厚密切相关的纤维素、木质素合成基因和转录因子在紫花苜蓿分枝期、现蕾期、初花期和盛花期的表达情况,以期比较全面地了解紫花苜蓿次生壁合成的基因网络变化和表达模式,为紫花苜蓿次生壁合成调控网络的分子机制研究奠定基础,同时为紫花苜蓿品质和产量性状的分子遗传改良提供参考基因资源。1 材料与方法
1.1 试验材料
材料为‘中苜1号’紫花苜蓿(Medicago sativa L. cv. ‘Zhongmu No.1’),由中国农业科学院北京畜牧兽医研究所提供。2015年7月于中国农业科学院北京畜牧兽医研究所昌平基地取单株‘中苜1号’茎枝若干,在人工气候室扦插培养(光照强度>450 μmol·m-2;温度25℃;16 h光照/8 h黑暗;空气湿度60%—80%),将扦插成活的植株移栽至昌平基地。2016年4月开始观测记录‘中苜1号’扦插材料的生长发育时期,在中国苜蓿生育期划分的基础上结合美国单株苜蓿生育阶段划分标准[18]确认试验材料的生长时期。分别采集紫花苜蓿分枝期(S1,株高16—25 cm,无花蕾)、现蕾期(S2,1个或2个花芽有花蕾,无花和荚果)、初花期(S3,仅有一个花芽开花,无荚果)和盛花期(S4,不少于2个花芽完全开花)的主茎,顶部和基部各去除3节,保留茎中部。每个时期的茎样设3次生物学重复,取样后立即置于液氮中速冻,保存于-80℃冰箱。用于物质含量测定的茎样65℃烘箱烘干,粉碎,过70目筛,收集待用。1.2 近红外光谱法测定
采用FOSS5000近红外光谱快速品质分析仪(丹麦FOSS公司),仪器光源为卤钨灯,硫化铅探测器,谱区范围:1 100—2 500 nm。光谱间隔2 nm,扫描次数32次。每个样品设置3次重复,放入分析仪检测盒中进行光谱扫描,利用建立的紫花苜蓿近红外检测模型,获取样品NDF(中性洗涤纤维)、ADF(酸性洗涤纤维)、Lignin(木质素)、ASH(灰分、无机物)和DM(干物质)成分含量。纤维素含量=ADF-ASH- Lignin[19]。1.3 总RNA提取、cDNA文库构建及转录组测序
采用Trizol试剂(购于Invitrogen公司)提取‘中苜1号’茎的总RNA。通过1%的琼脂糖凝胶电泳检测总RNA的完整性,使用Agilent Bioanalyzer 2100 system对RNA精确质检。将检测合格的总RNA送至北京诺禾致源科技股份有限公司测序,构建cDNA文库,在Illumina HiSeqTM2500测序仪上进行测序,输出数据为pair-end序列(2×150 bp)。1.4 基因功能注释
测序输出数据为原始序列(raw reads),对原始序列进行质控(QC),经过滤去除接头序列和低质量序列得到干净序列(clean reads),以FASTQ文件格式存储。以紫花苜蓿的近缘物种蒺藜苜蓿基因组(http://www.medicagogenome.org/ downloads)作为参考基因组,利用软件HISAT2(v2.2.0.4)将clean reads比对到参考基因组序列,使用Cufflinks[20](v2.1.1)软件将比对结果组装构建转录本,选择最完整的转录本作为Unigene。使用Blast(v2.2.28)将Unigene序列与Nr(NCBI non-redundant protein sequences)、Nt(NCBI nucleotide sequences)、MTGD(Medicago truncatula Genome Database)、KOG(euKaryotic Ortholog Groups)等公共数据库比对,匹配率≥80%且E-value≤1E-5,获取Unigene注释信息。本研究所有基因注释ID都以蒺藜苜蓿基因组基因ID表示。1.5 基因表达量计算和差异基因筛选
通过FPKM法计算基因表达量,得到的FPKM值可直接用来表示基因的表达水平[21]。参照AUDIC等[22]方法,以Fold change(差异表达倍数)≥2或≤0.5(表达上调或下调),FDR(False discover rate)≤0.05为筛选条件,在3个相邻时期转录组比较组合中(S2 VS S1,S3 VS S2,S4 VS S3)选取差异表达基因。FDR值越小,表达差异越显著。利用TopGO(v2.10.0)软件在GO(Gene Ontology)数据库中对差异表达基因进行富集和功能注释;同时利用KOBAS(v2.0.12)软件在KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库中搜索差异表达基因的KEGG注释信息[23],确定差异表达基因参与的代谢途径。1.6 实时荧光定量PCR验证
随机选择8个与次生壁加厚相关的差异表达基因,利用Primer-NCBI在线设计引物(表1),进行实时荧光定量PCR验证分析。将RNA采用第1链cDNA合成试剂盒(Invitrogen)反转录为cDNA,以cDNA为模板,MsActin为内参,采用TaKaRa(日本)公司的SYBR®Premix Ex Taq™II(Tli RNaseH Plus)试剂盒,在ABI 7500FAST荧光定量PCR仪(ABI公司,美国)进行荧光定量检测。每个样品设3次技术重复,依照2-∆∆CT法计算相对表达量[24]。Table 1
表1
表1实时荧光定量PCR所用的引物
Table 1Primers used for real-time quantitative PCR
| 基因Gene | 正向引物Forward primer (5′-3′) | 反向引物Reverse primer (5′-3′) |
|---|---|---|
| MTR_1g061510 | AGCGTTTGCTTTCTTCAT | TCAACATTGGCACTATCA |
| MTR_1g097300 | ATGGGCAGATGACGATGT | TGTTGCTGGTCAAGGACA |
| MTR_2g080010 | CTGGTTGTGACTTGGGTAA | GAAGCAGCACTCATTTGG |
| MTR_4g100630 | AAGGTGATTGGCGTGGAA | AACAGGCTGGACCGTCTC |
| MTR_4g055520 | CAACTCAGTCGGAACACC | ACAACCCATTCATTAGCC |
| MTR_5g029190 | AGAGTTCCAAGGGAGACC | GTACCAGCACGAGATGAC |
| MTR_8g063270 | TTGGTCACAATGGAGGAG | AATACTGCCGATACACGA |
| MTR_8g086600 | TATGGCGTAATGAGCAGT | CACCAAACTCGGTATCCT |
| MsActin | CAAAAGATGGCAGATGCTGAGGAT | CATGACACCAGTATGACGAGGTCG |
新窗口打开
2 结果
2.1 次生壁主要物质含量测定结果
近红外光谱法测定结果显示(图1),紫花苜蓿茎的纤维素和木质素含量在不同发育时期变化较大,特别是纤维素含量在初花期和盛花期显著提高,初花期含量相较于分枝期提高2.7倍。总体上随着紫花苜蓿茎的成熟,次生壁中纤维素和木质素含量逐渐升高。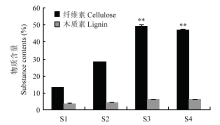 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同发育时期次生壁主要物质含量
**表示在P=0.01水平差异显著
-->Fig. 1The main substance contents of secondary cell wall at different developmental stages
** The significance of difference at P=0.01
-->
2.2 测序质量评估及差异基因筛选结果
4个发育时期的12个样本测序共得到5 872.8万—7 037.2万条原始序列,质控得到5 446.4万—6 726.9万条有效序列,占原始序列94.8%—96.9%。与蒺藜苜蓿基因组进行基因序列比对,成功比对4 071.2万— 4 979.9万条序列,比对率为70.3%—74.5%(表2)。对12个转录组文库进行比对和重新组装,共获得 69 059个转录本,选择41 734(60%)个转录本作为Unigene。Table 2
表2
表2紫花苜蓿不同发育时期转录组数据统计
Table 2Statistics of transcriptome data of alfalfa at different developmental stages
| 时期 Stage | 原始序列 Number of raw reads | 干净序列 Number of clean reads | 有效比例 Effective reads ratio (%) | 比对序列(比对率) Mapped reads (mapping rate, %) |
|---|---|---|---|---|
| S1 (1) | 58727902 | 56892710 | 96.88 | 41240452(72.49) |
| (2) | 59862774 | 57099848 | 95.38 | 40712494(71.30) |
| (3) | 61687826 | 58670710 | 95.11 | 41556816(70.83) |
| S2 (1) | 68365004 | 65280896 | 95.49 | 48181746(73.81) |
| (2) | 59183420 | 57246310 | 96.73 | 41334794(72.21) |
| (3) | 57476718 | 54464104 | 94.76 | 38285488(70.29) |
| S3 (1) | 67718246 | 64663300 | 95.49 | 47080518(72.81) |
| (2) | 59841736 | 57110206 | 95.44 | 42231928(73.95) |
| (3) | 64822722 | 61923384 | 95.53 | 45205064(73.00) |
| S4 (1) | 70372410 | 67268986 | 95.59 | 49751232(73.96) |
| (2) | 65021778 | 62200418 | 95.66 | 46345782(74.51) |
| (3) | 70020964 | 66866296 | 95.49 | 49799182(74.48) |
新窗口打开
经筛选得到相邻时期间(S2 VS S1,S3 VS S2,S4 VS S3)的差异表达基因(图2),其中97.87%的基因在4个时期均有表达。现蕾期与分枝期的差异表达基因为2 648个,上、下调基因分别为2 111个和537个;初花期与现蕾期的差异表达基因为 2 283个,上、下调基因分别为1 521个和762个;盛花期与初花期的差异表达基因为1 354个,上、下调基因分别为875个和479个。
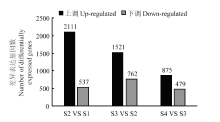 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2相邻发育时期的差异表达基因
-->Fig. 2Differentially expressed genes at adjacent developmental stages
-->
2.3 纤维素合成酶基因的差异表达分析
根据基因功能注释,在相邻时期间的差异表达基因中筛选获得10个纤维素合成酶基因(cellulose synthase gene)。结果显示(图3),紫花苜蓿茎细胞壁次生加厚过程中,多个纤维素合成酶基因表达水平上调,特别是在初花期和盛花期,基因表达量较分枝期发生显著增加,而现蕾期与分枝期相比,表达量显著上调或下调的差异基因较少。基因MTR_2g087960、MTR_3g005560和MTR_4g055520的表达水平在初花期显著下调。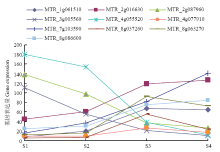 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3紫花苜蓿纤维素合成酶差异表达基因变化趋势
-->Fig. 3Tendency of differentially expressed genes of cellulose synthase in alfalfa
-->
2.4 木质素合成途径中的基因差异表达分析
将差异表达基因在KEGG Pathway数据库中注释分析,获得苯丙氨酸次生代谢中木质素单体合成途径中的差异表达基因[25],KEGG Pathway map ID:mtr00940(http://www.genome.jp/kegg-bin/show_ pathway/mtr00940)。17个差异表达基因分别注释为苯丙氨酸氨基裂解酶(phenylalanine ammonia-lyase,PAL)、肉桂酸-4-羟基化酶(Cinnamate 4-hydroxylase,C4H)、4-羟基肉桂酰辅酶A连接酶(4-(hydroxy)cinnamoyl-CoA ligase,4CL)、肉桂酰辅酶A还原酶(Cinnamoyl-CoA reductase,CCR)、肉桂醇脱氢酶(Cinnamyl-alcohol dehydrogenase,CAD)、咖啡酸/5-羟基阿魏酸-O-甲基转移酶(Caffeic acid/5- hydroxyferulic acid O-methyltransferase,COMT)、阿魏酸-5-羟化酶(Ferulate 5-hydroxylase,F5H)等木质素单体合成途径中的关键合成酶基因(图4)。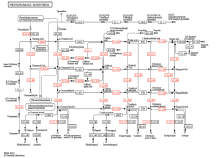 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4苯丙氨酸生物合成途径(KEGG Pathway map ID:mtr00940)
红色字体为差异表达基因 Red fonts represent the differentially expressed genes 4.3.1.24-PAL:苯丙氨酸氨基裂解酶Phenylalanine ammonia-lyase;1.14.1311-C4H:肉桂酸-4-羟化酶Cinnamate 4-hydroxylase;6.2.1.12-4CL:4-羟基肉桂酰辅酶A连接酶4-(hydroxy)cinnamoyl-CoA ligase;1.1.1.195-CAD:肉桂醇脱氢酶Cinnamyl-alcohol dehydrogenase;1.2.1.44-CCR:肉桂酰辅酶A还原酶Cinnamoyl-CoA reductase;2.1.1.68-COMT:咖啡酸/5-羟基阿魏酸-O-甲基转移酶Caffeic acid/5-hydroxyferulic acid O-methyltransferase;1.11.1.7-F5H:阿魏酸-5-羟化酶Ferulate 5-hydroxylase
-->Fig. 4Phenylpropanoid biosynthetic pathways in KEGG
-->
利用GraphPad Prism 7(v7.03)软件对差异表达基因在4个时期的表达水平做进一步分析(图5)。结果发现,木质素单体合成途径中上游基因PAL、C4H、4CL和CCR的表达水平变化趋势与多数纤维素合成酶基因一致,在初花期和盛花期表达量显著上调,其中MTR_1g064090(PAL1)、MTR_1g111240(C4H)和MTR_2g104960(CCR)的基因表达量相比分枝期上调10倍以上。而下游调控基因CAD和COMT的表达变化趋势与上游调控基因相反,在分枝期和现蕾期表达水平较高,在初花期和盛花期表达水平显著下调。
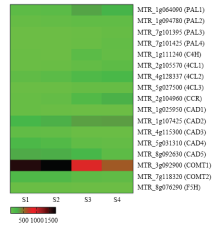 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5紫花苜蓿木质素单体合成途径中的差异表达基因在不同时期的表达模式
每种颜色代表相应的表达量数值,数值越大,颜色越深,表达量越高
-->Fig. 5The expression pattern of differentially expressed genes in the biosynthesis pathway of monolignol at four developmental stages in alfalfa
Each color represents the value of the corresponding relative expression. The higher the value, the darker the color, the higher the expression
-->
2.5 次生壁发育相关的转录因子
基于转录组测序数据中不同发育时期差异表达的转录因子,参考北京大学植物转录因子数据库PlantTFDB(http//planttfdb.cbi.pku.edu.cn/)公布的蒺藜苜蓿转录因子家族序列信息,共获得27个可能与次生壁合成调控相关的差异转录因子(表3)。Table 3
表3
表3差异表达转录因子的表达水平
Table 3Expression level of differentially expressed transcription factors
| 基因编号 Gene ID | 功能注释 Annotation | 各时期表达水平Expression level in different stage | |||
|---|---|---|---|---|---|
| 分枝期基因表达量 Vegetative stage S1 FPKM | 现蕾期基因表达量 Flower bud stage S2 FPKM | 初花期基因表达量 Early flower stage S3 FPKM | 盛花期基因表达量 Late flower stage S4 FPKM | ||
| MTR_1g097300 | NAC | 12.403 | 13.226 | 21.621 | 35.229 |
| MTR_2g080010 | NAC | 1.540 | 3.843 | 7.426 | 18.357 |
| MTR_2g086880 | NAC | 33.043 | 31.087 | 8.358 | 6.853 |
| MTR_3g020660 | NAC | 385.234 | 422.944 | 299.484 | 146.194 |
| MTR_3g096400 | NAC | 96.763 | 84.318 | 41.216 | 32.870 |
| MTR_4g071000 | NAC | 57.353 | 47.716 | 23.960 | 13.293 |
| MTR_7g088680 | NAC | 109.184 | 158.200 | 144.869 | 57.010 |
| MTR_8g063550 | NAC | 44.158 | 45.300 | 24.684 | 14.415 |
| MTR_8g094580 | NAC | 9.635 | 5.681 | 8.183 | 45.460 |
| MTR_8g102240 | NAC | 28.735 | 31.436 | 8.333 | 2.337 |
| MTR_2g027860 | MYB | 30.240 | 28.630 | 29.435 | 2.922 |
| MTR_2g067420 | MYB | 13.905 | 19.856 | 16.880 | 39.448 |
| MTR_4g100630 | MYB | 59.384 | 51.660 | 56.960 | 106.325 |
| MTR_5g037080 | MYB | 70.012 | 68.362 | 27.492 | 9.111 |
| MTR_5g081860 | MYB | 91.251 | 93.449 | 42.293 | 23.468 |
| MTR_7g098250 | MYB | 43.106 | 33.475 | 38.290 | 7.848 |
| MTR_8g028655 | MYB | 48.585 | 44.426 | 46.506 | 11.516 |
| MTR_8g077990 | MYB | 183.746 | 180.296 | 182.021 | 61.130 |
| MTR_3g095040 | WRKY | 62.637 | 31.081 | 45.651 | 22.087 |
| MTR_4g130900 | WRKY | 28.780 | 25.144 | 10.463 | 4.972 |
| MTR_5g074400 | WRKY | 5.302 | 4.382 | 7.358 | 29.193 |
| MTR_7g028590 | WRKY | 85.935 | 55.326 | 18.849 | 14.161 |
| MTR_2g087295 | BHLH | 25.578 | 26.346 | 8.913 | 2.969 |
| MTR_8g103065 | BHLH | 64.793 | 57.041 | 25.039 | 12.918 |
| MTR_2g005450 | C3H | 48.817 | 38.594 | 15.205 | 12.965 |
| MTR_1g074310 | ERF | 2.023 | 14.732 | 53.587 | 83.728 |
| MTR_3g074130 | ERF | 103.755 | 156.880 | 178.889 | 225.599 |
新窗口打开
差异表达的转录因子主要有NAC家族和MYB家族转录因子共18个,也有少量WRKY、BHLH、ERF、C3H等转录因子。8个转录因子在现蕾期到初花期上调表达,初花期到盛花期表达水平变化差异较小,19个转录因子在现蕾期到初花期或初花期到盛花期显著下调。这些转录因子涉及植物的生长发育调控、形态建成、抗逆胁迫等各种生物代谢途径。
2.6 实时荧光定量PCR验证
通过对qRT-PCR和RNA-seq数据进行相关性分析(图6),结果较为一致,相关系数在0.571—0.994,证明转录组测序数据具有较高的可重复性和准确性。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6实时荧光定量PCR与RNA-seq相关性分析
-->Fig. 6Correlation between qRT-PCR and RNA-seq
-->
3 讨论
在紫花苜蓿茎生长发育过程中,3个相邻时期比较组合中(S2 VS S1,S3 VS S2,S4 VS S3)表达上调基因的数量皆大于表达下调基因的数量,但差异表达基因的数量在不断减少,其中上调表达基因显著减少,在盛花期,上调表达基因和下调表达基因数量接近,总体上反应了紫花苜蓿茎从分枝期到盛花期在生 物过程、细胞代谢、分子功能等方面增强趋势较为明显,但在生长后期趋势变缓。JUNG等[26]研究表明紫花苜蓿茎的细胞壁物质组分与生长发育时期密切相关。营养生长时期仅初生木质部维管组织细胞壁有少量木质素沉积,进入生殖生长时期,节间伸长逐渐停止,次生木质部和韧皮部细胞大量生成且迅速沉积木质素,髓薄壁细胞也开始木质化。随着苜蓿茎的成熟,果胶质含量逐渐降低,纤维素含量逐渐升高。纤维素是植物细胞壁组分中含量最多的化合物,它的排列模式决定了细胞壁的结构[27]。ZHANG等[28]发现OsCESA4、OsCESA7和OsCESA9 3个基因发生突变后,水稻植株均出现明显的脆性,同时纤维素含量降低,次生壁变薄,植株表型异常。本研究中27个功能注释与紫花苜蓿纤维素、木质素合成密切相关的基因差异表达,其变化趋势与次生壁中纤维素和木质素含量测定结果基本一致,即随着生长发育时期的变化,表达水平逐渐提高。研究表明,初花期是紫花苜蓿次生壁合成调控的转折期,纤维素和木质素含量与其合成基因表达量在初花期均显著增加。MTR_2g016630(Ces)和MTR_7g103590(Ces A1)等纤维素合成酶基因表达水平在初花期显著上升,木质素合成途径中,MTR_1g064090(PAL1)、MTR_1g111240(C4H)和MTR_2g104960(CCR)基因表达量在初花期或盛花期相比分枝期增加10倍以上。上述差异表达基因很可能参与调控紫花苜蓿纤维素和木质素的含量/组分变化,为筛选影响次生壁加厚进程的主效基因提供了理论依据。
次生壁的合成加厚过程涉及大量转录因子(TFs)的调控,对差异表达的MYB和NAC转录因子与拟南芥中参与次生壁合成调控的转录因子进行同源进化分析。图7-A中MTR_8g102240与AtSND2、AtSND3组成一类,相似性为90%。ZHONG等[29]研究表明AtSND2和AtSND3是由AtSND1直接调控的次级转录因子,参与调控次生壁的加厚。MTR_8g102240可能具有AtSND2和AtSND3类似的功能。图7-B中MTR_2g067420与AtMYB58和AtMYB63有94%的相似性。AtMYB58和AtMYB63在次生壁物质沉积加厚的细胞内特异性表达,受转录开关因子AtSND1及其下游转录因子AtMYB46调控,通过结合木质素单体合成途径中的关键酶如4CL、F5H等启动子上的AC元件激活基因表达,是木质素生物合成中重要的调控因子[30,31],MTR_2g067420也可能具有类似功能。MTR_8g102240和MTR_2g067420可作为候选基因,利用突变体确定其表型,通过过表达或抑制该基因表达进行后续功能验证分析。近期研究结果表明WRKY[32]、BHLH[33]、KNAT7[34]、C3H[35]等转录因子在拟南芥、苜蓿、杨树中参与次生壁的合成调控,WANG等[32]在苜蓿和拟南芥中发现WRKY12可与NST2的启动子区结合抑制髓细胞中木质素、木聚糖和纤维素的沉积;AtC3H14是MYB46的靶蛋白,能激活大多数次生壁生物合成基因的表达[36]。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7差异表达转录因子系统进化分析
A:NAC结构域转录因子系统发育分析;B:MYB结构域转录因子系统发育分析。利用MEGA7.0软件,将差异表达的10个NAC家族转录因子和8个MYB家族转录因子的基因序列分别与拟南芥中参与次生壁合成调控的转录因子利用最大简约法构建系统进化树,经Bootstrap校正后得到最终结果
-->Fig. 7Phylogenetic analysis of differentially expressed transcription factors
A: Phylogenetic analysis of NAC domain transcription factors; B: Phylogenetic analysis of MYB domain transcription factors.Using MEGA7.0 software to construct the phylogenetic tree of 10 differentially expressed NAC transcription factors and 8 differentially expressed MYB transcription factors with the transcription factors involved in the secondary cell wall synthesis in Arabidopsis respectively by maximum parsimony method, and obtain the final phylogenetic tree which was corrected by Bootstrap
-->
4 结论
获得紫花苜蓿‘中苜1号’在4个生长发育时期茎的基因表达谱数据,共获得54个差异表达基因,其中稳定上调基因24个,稳定下调基因30个。这些基因可能参与紫花苜蓿次生壁的合成调控。The authors have declared that no competing interests exist.
