0 引言
【研究意义】磷(P)是植物生长发育所必需的第二大矿质营养元素,其参与植物体内的生物大分子合成及物质和能量转化。中国2/3以上的耕地处于缺磷状态,成为农业发展的限制因子[1]。虽然外施磷肥能解决土壤中磷素匮乏的问题,但我国磷矿资源短缺,用于农业生产的磷肥尚需进口;且磷素在土壤中易被固定,仅处于根区表层的磷易被植物吸收利用[2]。目前我国蔬菜生产施肥量大,绝大多数蔬菜产区土壤中的磷含量已经高于蔬菜需磷水平,但可被蔬菜作物吸收利用的磷却很有限,这时植物表现的缺磷症状称为“遗传学缺磷”[3]。这一特点使土壤磷素积累,引发农业资源污染与磷矿枯竭[4]。因此,探究蔬菜作物对磷高效吸收的生理机制对于蔬菜的安全高效生产与农业可持续发展具有重要意义。【前人研究进展】腐殖酸是由动植物遗骸经过微生物降解,辅以地球化学的一系列过程积累起来的有机物质。刘秀梅等[5]研究发现它具有提高土壤保水保肥能力、刺激植物生长等作用。韩玉国等[6]研究表明黄腐酸为腐殖酸中一个水可溶级分,其分子量低,功能团密集,具有更强的生理活性,在农业生产应用中备受关注。目前的研究表明,腐殖酸作为肥料添加剂用于保持土壤肥力的研究已取得长足进展;CANELLAS等[7]总结了近年来腐殖酸肥料在影响园艺作物肥料利用效率、植株生长、开花坐果、产品成熟、品质形成和抗性诱导等方面具有显著促进效果。刘秀梅[5]、李春越等[8]在试验中发现腐殖酸可作为土壤磷素增效剂,活化土壤中固定态磷,改善肥料物理性状,提高其稳定性和有效性,以达到有效磷缓释的效果。【本研究切入点】目前研究多集中于腐殖酸作为肥料添加剂增强磷素利用的方面,且涉及的腐殖酸多未经纯化,成分复杂,重现性有待考证;且针对腐殖酸或黄腐酸调控蔬菜作物适应低磷胁迫的生理与分子机制的研究相对较少。【拟解决的关键问题】本试验拟通过研究黄腐酸在低磷条件下对番茄幼苗生长及磷素吸收、分配与利用的调控作用,对黄腐酸缓解蔬菜作物“遗传学缺磷”的概念和原理做出合理解释,为黄腐酸在提高蔬菜作物磷素利用效率的应用和推广提供理论依据和技术支撑。1 材料与方法
试验于2017年2—7月在农业部黄淮海设施农业工程科学观测实验站进行。日光温室环境控制条件为:光周期12 h/12 h,昼/夜温25—30℃/18—23℃,相对湿度50%—70%。1.1 试验设计
供试黄腐酸由山东泉林嘉有肥料有限责任公司提供。以‘金棚1号’番茄(Solanum lycopersicum L.)为试材,采用常规基质育苗技术进行幼苗培育,待幼苗长至三叶一心时,将长势一致的番茄幼苗移植于装有5 L Hoagland营养液[9]的水培盆中进行营养液栽培,每盆4株,缓苗7 d后进行试验处理。试验设7个处理:对照(Control)采用Hoagland营养液培养;T0—T5采用磷含量为原Hoagland营养液1%的Hoagland减磷营养液(10 μmol·L-1)培养,模拟低磷胁迫环境,因降低NH4H2PO4所造成的氮素缺乏采用相应量的NH4NO3补齐,并向T0—T5处理的Hoagland减磷营养液中加入相应质量的黄腐酸,使处理液中黄腐酸的终浓度为0、0.04、0.08、0.12、0.16和0.20 g·L-1。试验采用随机区组设计,每个处理15盆,每5盆作为1个重复,共计3次重复。每3 d更换一次处理液,处理25 d后结束试验,期间取样进行指标分析。
1.2 测定项目与方法
植株生长:处理至25 d时,对番茄幼苗进行拍照,记录各处理植株表型;测定茎叶鲜重和根鲜重,计算根冠比。光合作用性能:处理至25 d时,以第2—3片完全展开的功能叶为待测试材,称取0.5 g叶片,采用80%丙酮浸提法测定叶绿素含量[10];采用LI-6400便携式光合仪,于上午9:30—10:30测定净光合速率(PN)[10];采用FMS-2便携式调制荧光仪测定暗适应下叶片PSⅡ最大光化学效率(Fv/Fm)和过剩光能(EX)[11]。
磷素吸收与分配:处理至25 d时,将番茄幼苗根、茎、叶组织分离,于烘箱中烘干,研磨成粉备用。取0.1 g相应组织的粉末,采用钼锑抗比色法测定P含量[12];计算各器官的P积累和分配量,以及整株的P吸收量,计算公式为:P积累(器官)=P含量(器官)×干重(器官);P吸收=P积累(根)+P积累(茎)+P积累(叶);P分配(器官)=P积累(器官)/P吸收×100%。
有机酸含量:处理至10 d时,取2 g番茄幼苗根系组织,采用高效液相色谱法测定7种有机酸含量[12]。
根系排酸分析:本指标测定过程期间不更换处理液,各处理液起始pH均调节至6.8,处理10 d后测定处理液的pH,用以评估根系排酸能力。
基因表达分析:处理至5 d和25 d时,取0.3 g番茄根系,采用RNA提取试剂盒(Invitrogen)提取番茄根系总RNA,并用反转录试剂盒(Fermentas)将所提的RNA反转录成cDNA,再以实时荧光定量PCR(qRT-PCR)技术进行基因表达分析[11],引物序列见表1。
Table 1
表1
表1引物序列
Table 1Primers sequence
| 基因名 Gene name | 引物序列 Primer sequences | |
|---|---|---|
| 激动蛋白 Actin | F: TTCCGTTGCCCAGAGGTCCT | R: TCGCCCTTTGAAATCCACATC |
| 磷转运蛋白1 Phosphate transporter 1 (PT1) | F: ATAAAAATGCAAAATAATCC | R: AGCCACCCGAAGAACAACTG |
| 磷转运蛋白1 Phosphate transporter 1 (PHO1) | F: GCTCAGAGATGAACTAGTC | R: GTTCCAGTGACCACGTCG |
| 质膜质子泵1 Plasma membrane H+-ATPase 1 (HA1) | F: CGCGAGCTTCAATGGGCACA | R:GCTCCCATCACGACACCAACAGT |
| GRAS蛋白1 GRAS1 | F: TCTTCACGCTGGACTCGTCAC | R: CCCACTCAAAGGCGAACCA |
新窗口打开
1.3 数据分析
采用Microsoft Excel 2007进行数据处理,SPSS 17.0进行统计分析,不同小写字母表示处理间差异显著(P<0.05)。2 结果
2.1 黄腐酸对低磷胁迫下番茄幼苗生长和光合作用性能的影响
图1显示,与对照相比,低磷胁迫(T0)显著抑制番茄幼苗的生长(P<0.05),且对根系生长的抑制效应大于茎叶,表现在根冠比下降;并造成叶片花青素沉积加深的症状。在低磷胁迫下,随着黄腐酸施用量的增加(T1—T5),番茄幼苗根系和茎叶的生长量及根冠比均呈现先增后降的趋势,以T2增幅最大,这与黄腐酸缓解番茄低磷胁迫的表型相吻合;且外源添加黄腐酸也能在一定程度上降低由低磷胁迫引起的叶片花青素沉积。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1黄腐酸对低磷胁迫下番茄幼苗生长、根茎鲜重及根冠比的影响
不同小写字母表示处理间差异显著达5%水平,CK、T0—T5分别表示对照,低磷胁迫下添加0、0.04、0.08、0.12、0.16和0.20 g·L-1黄腐酸。下同
-->Fig. 1Effects of fulvic acid on growth, fresh weight of root and shoot, and ratio of root to shoot under P deficiency
Different lowercase letters indicate that the difference between the treatments is significantly up to 5 %. CK, T0-T5 respectively represent the control, adding 0, 0.04, 0.08, 0.12, 0.16 and 0.20 g·L-1 fulvic acid under low-phosphorus stress. The same as below
-->
图2表明,与对照相比,低磷胁迫(T0)可显著抑制番茄叶片的PN、叶绿素含量和Fv/Fm,并造成EX激增(P<0.05)。表明低磷胁迫可造成叶绿素积累受阻,光能和活跃的电子能过剩,光合电子链破坏,进而降低番茄幼苗的光合作用。低磷胁迫下,随着黄腐酸施用量的增加(T1—T5),番茄叶片的PN、叶绿素含量和Fv/Fm均呈现先增后降的趋势,且均以T2增幅最大;而EX呈先降后升趋势,也以T2变化最为显著。说明外源施用黄腐酸能在一定程度上缓解由缺磷造成的叶片光合作用性能抑制等症状。
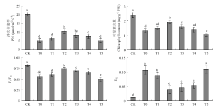 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2黄腐酸对低磷胁迫下番茄叶片净光合速率、叶绿素含量、暗适应下PSII最大光化学效率和过剩光能的影响
-->Fig 2Effects of fulvic acid on PN, chlorophyll content, Fv/Fm and EX in tomato leaves under P deficiency
-->
2.2 黄腐酸对低磷胁迫下番茄幼苗磷吸收、分配及相关基因表达的影响
图3显示,低磷胁迫下,随着黄腐酸施用量的增加(T1—T5),番茄幼苗根、茎、叶中的磷含量和磷积累及磷吸收总量均呈现先增后降的趋势,且以T2增幅最大。但根据磷在根、茎、叶中分配比例来看,低磷胁迫使磷分配由根转向茎,而对叶的影响相对较小;而随着黄腐酸施用量的增加(T1—T5),根中的磷分配呈先增后降的趋势,叶片中的磷分配呈先降后增趋势,而茎中磷分配呈递增趋势。这表明外源施用黄腐酸不仅能提高低磷胁迫下番茄幼苗磷吸收能力,还能影响磷在不同器官中的分布。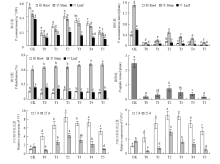 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3黄腐酸对低磷胁迫下番茄幼苗磷吸收、分配及相关基因表达的影响
-->Fig. 3Effects of fulvic acid on P uptake, apportion, and genes’ expression in tomato seedlings under P deficiency
-->
植物中存在一系列磷转运调控基因,其中PT1在根中表达,促进根系从环境中吸收磷酸盐[13];而PHO1则定位在根系木质部,负责将磷酸盐装载至木质部,进而向茎叶组织转运[14]。图3显示,低磷胁迫初期(5 d),PT1和PHO1的表达量上升,表明番茄对低磷胁迫具有自主调控与适应机制;而胁迫后期(25 d),PT1和PHO1的表达量下降,说明长期缺磷已造成mRNA转录受阻。而低磷胁迫下添加黄腐酸,在处理后5 d和25 d时均能显著提升PT1和PHO1的表达水平,其峰值出现在T2处理。
2.3 黄腐酸对低磷胁迫下番茄根系有机酸积累、分泌及相关基因表达的影响
根系通过向环境释放有机酸,可将难溶态磷转化为可溶性的磷酸盐,提高作物对磷的吸收,缓解植物的低磷胁迫[15]。图4显示,低磷胁迫下,番茄根系总有机酸含量显著上升(P<0.05);除酒石酸外,其余6种有机酸均达到差异显著水平(P<0.05)。与此对应,低磷胁迫下,根系有机酸的积累使培养液的pH较对照显著降低(P<0.05)。说明番茄在低磷胁迫下通过根系积累有机酸,并增强有机酸分泌,降低了根系生长介质的pH;这对培养介质的磷素活化和番茄抵抗低磷胁迫具有重要意义。而外源施用黄腐酸可进一步加强根系总有机酸的积累和分泌,以T2效果最佳。但就单一有机酸积累来看,T2处理促进根系草酸、苹果酸、柠檬酸、琥珀酸和酒石酸的积累,而抑制乳酸和乙酸的积累。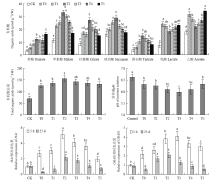 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4黄腐酸对低磷胁迫下番茄根系有机酸积累、分泌及相关基因表达的影响
-->Fig. 4Effects of fulvic acid on accumulation and secretion of organic acids, and genes' expression in tomato roots under P deficiency
-->
HA1和GRAS1分别是控制根系H+外排[16]和促进根系发生及植株生长[17]的关键基因。图4显示,HA1和GRAS1的表达量在低磷胁迫初期(5 d)上升,后期(25 d)下降;而低磷胁迫下添加黄腐酸,在处理后5 d和25 d时均能显著提升HA1和GRAS1的表达水平,以T2和T3较为显著。
3 讨论
许多研究表明,黄腐酸对植物具有促进生长,增强矿质营养吸收和利用,提高光合速率,增强作物抗性等功能,且其生理活性高于一般腐殖酸[18,19]。当前研究观点认为,黄腐酸乃至腐殖酸具有“生物刺激素”的功能,其发挥功效的原因是黄腐酸中含有一些植物激素类似物[18]。研究表明,土壤添加黄腐酸、腐殖酸、或施用腐殖酸复合肥均能不同程度的增强作物的磷素利用效率[5,7-8]。其作用形式包含3个方面:腐殖酸刺激作物根系的生长,增加土壤耕层根系覆盖度,增强磷素吸收[6,20];腐殖酸改变土壤微生物群落或影响作物根系分泌物,影响土壤碱性磷酸酶活性,促进磷素活化[18,19];腐殖酸利用自身巨大的吸附性能,吸附土壤中易容态速效磷,降低速效磷在土壤中的淋失,达到保磷缓释的目的[21]。因此在土壤环境中研究黄腐酸提高作物适应低磷胁迫的机制时,难以分清是黄腐酸对植物刺激的直接效应,还是黄腐酸对土壤微生态或磷素影响的间接效应。本试验采用营养液栽培模式,在无土壤肥力、微生物和土壤酶干扰的条件下,研究黄腐酸在低磷胁迫条件下对番茄幼苗生长、光合作用、磷素吸收和分配,以及有机酸代谢和泌酸行为的影响。因此本研究中黄腐酸的作用应是对番茄幼苗适应低磷胁迫的直接调控效应。缺磷会造成植物体内生物大分子合成和能量代谢受阻,使光合作用器损伤,降低Fv/Fm,导致光能向化学能转化受阻,引起EX激增,形成光氧化破坏;进而增强叶绿素氧化降解和PN下降[22]。而细胞组分中磷骨架的缺乏和PN下降引起的碳同化受阻是缺磷抑制植物生长的根本原因[23]。根系对有机酸的积累和分泌是植物适应低磷胁迫的重要生理机制[24]。本研究中黄腐酸缓解番茄上述缺磷症状的根本原因在于其能促进根系有机酸的积累和外排,降低培养介质的pH,使与钙、镁、铁等阳离子结合的磷酸盐沉淀活化,增强根系对磷素的吸收。前人研究表明,多数植物根系在缺磷条件下会积累有机酸,其主要为柠檬酸和苹果酸,而根系作为有机酸的代谢库,其有机酸含量与有机酸分泌之间存在显著正相关[15]。本研究发现,虽然缺磷会导致乳酸和乙酸含量增加,但考虑这两类有机酸是无氧呼吸产物,且长势较好的T2处理(0.08 g·L-1黄腐酸)中乳酸和乙酸的含量均低于T0;说明这两类有机酸不属于番茄适应低磷胁迫的代谢反应产物,而应作为胁迫后的毒害产物看待[12]。另外,有机酸产生于碳水化合物的异化过程,黄腐酸对低磷胁迫下光合机能的维护也为有机酸的持续产生和外排奠定了物质基础;因此黄腐酸调控的有机酸积累和光合能力提升在番茄抵抗低磷胁迫过程中形成了相辅相成的良性循环效应。细胞质pH介于7—7.5,根系储存的有机酸多以有机酸盐的形式存在,其向根外的分泌需要借助HA1外排的H+,以平衡电荷[16];但该过程需要消耗ATP,而长期缺磷导致的反应底物不足可能是胁迫后期mRNA合成受阻和ATP代谢障碍的根本原因。
目前,腐殖酸已被证实具有模拟生长素和赤霉素的生理功能[25,26],而这两类激素是控制根系发生和植物生长的正向调控因子。GRAS1是响应生长素[27]和赤霉素[28]的关键转录因子,其参与了这两类激素诱导的细胞分裂和膨大进程,具有促进生长和根系发生的作用。本研究发现,黄腐酸能促进GRAS1的表达,这可能与黄腐酸中含有生长素或赤霉素类似物有关。而GRAS1的上调表达亦为黄腐酸提高低磷胁迫下番茄的生长势和根冠比做出了合理的解释。此外,根冠比的提升一方面增加了番茄幼苗的磷吸收能力,另一方面也有利于形成更大的根系有机酸库以应对低磷胁迫。缺磷可引起植物赤霉素合成水平下降和DELLA蛋白积累,进而诱发根系构型转变和花青素沉积[29]。GRAS1可通过阻断DELLA恢复赤霉素信号[28],因此,本研究中黄腐酸对番茄叶片花青素沉积的恢复效应和促根过程可部分归因于黄腐酸中的赤霉素类似物对GRAS1表达的正向激活调控,但目前尚难从黄腐酸中分离和鉴定这些激素类似物。此外,PT1和PHO1等磷转运蛋白不仅可对磷缺乏做出响应,也受到生长素信号的影响[30];黄腐酸诱导的PT1和PHO1表达可能依赖于生长素信号途径,但确凿证据尚需进一步验证。
4 结论
黄腐酸缓解番茄幼苗“遗传学缺磷”的生理机制在于其蕴含的生长素和赤霉素类似物能激活GRAS1转录因子和磷转运蛋白相关基因(PT1和PHO1),促进植株生长和根系发生。而根系发生促进了养分吸收,并增大了根系有机酸库和泌酸量,进一步增强磷素的活化和吸收。改善的矿质营养基础为低磷胁迫下光合作用的进行提供了物质保障,较强的光合作用和碳同化能力在促进植株生长的基础上保证了有机酸合成的底物和能量的供应,从而形成良性生理循环以抵抗低磷胁迫。The authors have declared that no competing interests exist.
