0 引言
【研究意义】生长素是一类重要的植物激素,参与植物生长发育的许多方面,涉及细胞分裂与伸长、形态建成、环境胁迫响应等[1,2,3]。然而,对生长素介导的花青苷积累研究较少。明确生长素调节花青苷的机理,对研究生长素信号途径和调节果树生长发育具有重要意义。【前人研究进展】自从生长素(吲哚乙酸)在20世纪30年代被首次发现以来,人们对生长素信号转导的分子机制已经进行了广泛研究。遗传分析和生理生化试验表明,TIR1(Transport Inhibitor Response 1)作为生长素受体感知生长素信号[4]。Aux/IAA阻遏蛋白能够与生长素响应因子相互作用,抑制其蛋白活性,进而负调节生长素信号[5]。此外,SCFTIR1泛素连接酶复合体在生长素信号途径中扮演核心调控者的角色,它能够通过泛素化降解Aux/IAA阻遏蛋白传递生长素信号[6,7]。当植物感受到生长素信号,TIR1蛋白复合体降解Aux/IAA阻遏蛋白,释放生长素响应因子,从而实现生长素介导的植物生长[8,9]。其中,ARF(auxin response factor)被鉴定为一类重要的生长素响应调控因子[10],ARF转录因子调节生长素响应基因的表达[5]。迄今为止,在拟南芥和水稻中分别鉴定了23和25个ARF [11,12]。通过对ARF氨基酸序列进行比对分析,发现ARF蛋白都含有一个保守的DNA绑定结构域(DBD)和一个保守的羧基末端二聚化结构域(CTD)[13]。作为转录因子,ARF蛋白能够通过结合下游靶基因的AuxRE序列(TGTCTC/GAGACA)调节基因的表达,进而影响多种植物生长发育过程[14,15]。研究表明,ARF转录因子参与植物多种发育过程。在拟南芥中,ARF参与植物胚胎形成(ARF5、ARF17)[16]、根系生长(ARF7、ARF10、ARF16、ARF19)[17,18]、花器官发育(ARF2、ARF3、ARF6、ARF8)[19,20]及衰老过程(ARF1、ARF2)[21]。但水稻ARF的功能不同于拟南芥,OSARF1参与根系形成和种子萌发[22],OsARF12影响植株对铁离子的吸收和积累[23]。最近的研究显示,OsARF19调节叶片倾斜角度[24]。李慧峰等[25]对苹果ARF全基因组进行了初步分析。王意程等[26]研究发现,MdARF3响应生长素处理,并且可能参与生长素介导的花青苷积累过程。【本研究切入点】作为多年生木本植物,苹果中关于ARF转录因子的功能研究较少。【拟解决的关键问题】本试验从‘嘎拉’苹果中鉴定并分离一个苹果ARF基因MdARF5,并通过转基因分析和烟草瞬时表达试验,揭示MdARF5在调节苹果花青苷积累过程中的重要作用,为揭示ARF转录因子调节花青苷积累提供理论基础。1 材料与方法
试验于2017年3—8月在山东农业大学园艺科学与工程学院果树分子生物学实验室进行。1.1 试验材料
试验所用的植物材料有苹果‘嘎拉’(Royal Gala)幼苗和‘王林’(Orin)苹果愈伤组织。对长势一致的盆栽‘嘎拉’苹果幼苗用不同浓度的生长素(IAA)进行处理(0、2.5、5、7.5和10 µmol∙L-1)。溶液少量多次浇灌至完全浸透,处理6 h后取样,液氮速冻后保存备用。
‘王林’苹果愈伤组织用来进行遗传转化。苹果愈伤组织放置在继代培养基(MS培养基+1.5 mg·L-1 2,4-D+0.5 mg·L-1 6-BA)室温(24℃)、暗处培养。每隔15 d更新继代一次。
采用本氏烟草(Nicotiana benthamiana)进行瞬时表达试验。
1.2 基因克隆
根据在苹果(‘金冠’)参考基因组数据库中检索到的序列设计引物MdARF5-F/R(表1),以‘嘎拉’苹果幼苗的cDNA为模板进行PCR扩增。PCR反应程序为:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸2 min,34个循环;72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳并回收目的条带,连接到克隆载体pMD18-T进行测序。所用的定量引物见表1。Table 1
表1
表1基因克隆和载体构建所用的引物序列
Table 1Primers used for gene expression analysis and vector construction in this study
| 引物名称 Primer name | 序列(5′-3′) Sequence (5′ to 3′) |
|---|---|
| MdARF5-F | ATGATGGGTTCGGTGGAGGAGAAGC |
| MdARF5-R | GGGACGGCCACCTTCGGACATGGTG |
| MdARF5 (qRT)-F | CCATACCCGATTTCAAATCTATG |
| MdARF5 (qRT)-R | TGGCTTCCAAACTTGGCTACGGT |
| ACTIN (qRT)-F | AGGCGCGCAAATTACCCAATCC |
| ACTIN (qRT)-R | AGGCGCGCAAATTACCCAATCC |
| MdMYB1 (qRT)-F | GAAAGAGCTGCATATCCCAG |
| MdMYB1 (qRT)-R | CTATTCTTCTTTTGAATGATTCC |
| MdDFR (qRT)-F | GTTGAGGGAGATAGGGTTTGAG |
| MdDFR (qRT)-R | GGTAAATGTAAAACAATAGAGAGG |
| MdUFGT (qRT)-F | GGAAGTGGTTTTGTCGCCTG |
| MdUFGT (qRT)-R | CATTATTATTGAGCAACGAACAGC |
| MdF3H (qRT)-F | GCCGATCACCTACACCGAG |
| MdF3H (qRT)-R | GTACAAGAAGTGGGAAGGC |
| MdCHI (qRT)-F | GCTACAAATGCGGTGATAG |
| MdCHI (qRT)-R MdCHS (qRT)-F MdCHS (qRT)-R MdMYB1 (LUC)-F MdMYB1 (LUC)-R | CGCCTCCACTACAACCTCC GGCAAGTGCTGTCGGATT CCCAAAGAAATAACCACAAG TTGAGTACAGAGACATTAACTGAGAT CTCTTATCTGCTAGCAGCTAAG |
新窗口打开
1.3 RNA的提取与实时荧光定量PCR分析
苹果幼苗及愈伤组织的RNA提取采用天根生化科技有限公司的Plus植物总RNA提取试剂盒(DP437)。以提取的RNA为模板,按照Clontech SMARTTM Library试剂盒说明书进行反转录,合成cDNA第一链。以MdACTIN(GenBank accession number: CN938024)为内参基因,使用Ultra SYBR Mixture试剂盒(康为世纪)进行实时荧光定量PCR分析。荧光定量PCR使用的仪器为BIO-RAD IQ5,所有PCR都设3个循环。PCR反应体系:2×UltraSYBR Mixture 10.0 μL,cDNA 1.0 μL,加去离子水至20 μL。PCR反应程序:94℃预变性10 min,94℃变性15 s,56℃退火15 s,65℃延伸15 s,40个循环,每次循环第2步进行荧光采集。最后采用2-△△CT法进行定量数据分析。所用定量引物见表1。1.4 苹果愈伤组织转化和鉴定
构建MdARF5-pCAMBIA-1300超表达载体,并将其转化农杆菌LBA4404。取15 d左右生长状态良好的苹果愈伤组织与转化的农杆菌室温孵育20—30 min。将愈伤组织用纱网过滤并吸干表面的菌液,置于继代培养基上培养1—2 d。随后,将苹果愈伤组织转移至筛选培养基(继代培养基+100 mg·L-1潮霉素+500 mg·L-1头孢霉素)。PCR检测得到的阳性转基因愈伤组织,在筛选培养基上继代3代以上,进行后续试验。1.5 苹果愈伤组织着色试验
选择生长状态一致的野生型(WT)和转基因(MdARF5-L1和MdNAC029-L2)苹果愈伤组织进行着色试验。将愈伤组织放置到持续强光(光子通量密度约为100 μmol·s-1·m-2)、低温(16℃)培养箱内进行培养,观察愈伤着色情况。用花青苷提取液(95%无水乙醇+1.5 mol·L-1 HCl)提取苹果愈伤组织内的花青苷[27]。提取过程在暗处进行。使用分光光度计(UV-1600,岛津公司,日本),在530、620和650 nm波长下检测样品吸光度并计算花青苷含量[27]。计算公式:OD=(A530-A620)-0.1×(A650-A620)。
1.6 烟草瞬时表达试验
本氏烟草叶片用来进行瞬时表达试验。MdARF5的ORF序列连接到pGreenII 62-SK载体(MdARF5- pGreen 62-SK)。MdMYB1结合位点序列连接pGreen 0800-LUC(MdMYB1-pGreen 0800-LUC)。活体成像系统被用来检测荧光强度。具体方法参照AN等[27]。MdMYB1启动子序列及潜在NAC结合位点见图1。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1MdMYB1启动子序列
灰色标注表示潜在NAC结合位点
-->Fig. 1Promoter sequence of MdMYB1
The grey mark represents the potential NAC binding site
-->
1.7 统计学分析
使用R(3.0.2)软件进行统计学分析。每个试验至少重复3次,所有结果都是基于3个平行试验的平均值。2 结果
2.1 苹果MdARF5的克隆及进化树分析
通过RT-PCR技术克隆获得一条大约2 500 bp的条带(图2)。对克隆得到的片段测序分析,结果显示,该基因片段的开放阅读框(ORF)长度为2 691 bp,编码一个含896个氨基酸的蛋白质。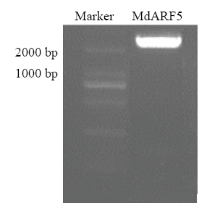 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2苹果MdARF5 RT-PCR扩增产物电泳
-->Fig. 2Electrophoresis of RT-PCR products for cloning of MdARF5
-->
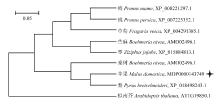
将苹果MdARF5蛋白序列与拟南芥、梨、桃等8个不同物种的ARF5蛋白序列进行分析并构建进化树(图3)。进化树分析结果表明,苹果MdARF5与梨PbARF5亲缘关系最近,同源性最高。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3苹果MdARF5及其同源基因的进化树分析
-->Fig. 3Phylogenetic tree analysis of MdARF5 in apple and its homologous
-->
2.2 生长素对MdARF5及花青苷合成相关基因的影响
实时荧光定量PCR分析MdARF5对生长素的响应。结果显示,在不同浓度生长素素处理下(0、2.5、5、7.5和10 µmol∙L-1 IAA),MdARF5表达量显著上调(图4-A)。同时,花青苷合成相关基因(MdMYB1、MdDFR、MdUFGT、MdF3H、MdCHI、MdCHS)表达下调(图4-B)。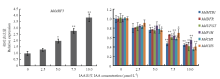 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4MdARF5及花青苷合成相关基因对生长素的响应
*差异显著(P<0.05),**差异极显著(P<0.01)。下同
-->Fig. 4Analysis of MdARF5 and anthocyanin biosynthesis genes expression in response to IAA
* indicate significant difference (P<0.05), ** indicate very significant difference (P<0.01). The same as below
-->
2.3 超表达MdARF5抑制花青苷积累
为了进一步研究MdARF5的功能,构建MdARF5- pCAMBIA-1300植物超表达载体(图5-A)。将重组超表达载体转化农杆菌LBA4404,通过农杆菌介导的遗传转化侵染苹果愈伤组织。定量PCR检测转基因株系MdARF5表达量(图5-B)。获得L1和L2两个转基因株系。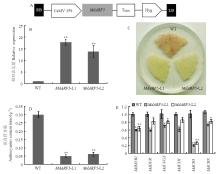 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5MdARF5 在苹果愈伤组织中超表达对花青苷积累的影响
A:MdARF5-pCAMBIA-1300结构示意图;B:定量PCR分析MdARF5在转基因苹果愈伤组织L1和L2中的表达水平;C:野生型(WT)和转基因(MdARF5-L1和MdARF5-L2)苹果愈伤组织花青苷积累情况分析;D:检测花青苷含量;E:定量PCR检测花青苷合成基因的表达,其在WT中的表达量设定为1
-->Fig. 5Effects of MdARF5 gene over-expression on anthocyanin accumulation in apple calli
A: Schematic diagram of the MdARF5-pCAMBIA-1300 construct; B: RT-PCR analysis of the expression level of MdNARF5 in L1 and L2 transgenic apple calli; C: Phenotypes of wild-type (WT) and transgenic (MdARF5-L1 and MdARF5-L2) apple calli on the anthocyanin accumulation; D: Detection of the anthocyanin contents; E: qRT-PCR analysis of the expression levels of anthocyanin biosynthetic genes, the value for WT was set to 1
-->
对获得的MdARF5转基因苹果愈伤组织进行强光、低温处理,10 d后,转基因苹果愈伤组织(MdARF5- L1和MdARF5-L2)比野生型愈伤积累的花青苷少(图4-C、D)。
实时荧光定量PCR检测花青苷合成基因的表达。结果显示,超表达MdARF5明显抑制花青苷合成结构基因的表达(图4-E)。
2.4 MdARF5转录因子抑制MdMYB1的表达
利用PlantCARE软件(http://bioinformatics.psb. ugent.be/webtools/plantcare/html/)对MdMYB1启动子序列进行分析,发现其序列包含一个MdARF5转录因子的潜在结合位点(图6-A、图1)。为了验证MdARF5对MdMYB1的调控作用,构建MdARF5-pGreen 62-SK和MdMYB1-pGreen 0800 LUC载体,并转化烟草叶片。如图6-B、C所示,由于自主激活作用,转化MdMYB1- pGreen 0800 LUC载体,叶片表现出较强的荧光强度。而同时转化MdARF5-pGreen 62-SK和MdMYB1-pGreen 0800 LUC,叶片的荧光强度显著降低。这些结果说明,MdARF5能够直接抑制MdMYB1的表达。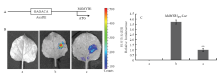 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6瞬时试验显示MdARF5对MdMYB1表达的影响
A:图示MdMYB1启动子包含一个潜在的MdARF5的结合位点。B:烟草叶片瞬时表达试验。a:混合注射pGreen 62-SK和pGreen 0800 LUC菌液;b:混合注射pGreen 62-SK和MdMYB1-pGreen 0800 LUC菌液;c:混合注射MdARF5-pGreen 62-C:SK和MdMYB1-pGreen 0800 LUC菌液。C:相对发光强度,c的荧光强度设定为1
-->Fig. 6Transient expression assays showing that MdARF5 inhibits the expression of MdMYB1
A: Schematic diagram of the MdMYB1 promoter showing the potential MdARF5 binding sites; B: Transient expression assays in tobacco leaf. a: pGreen 62-SK/pGreen 0800 LUC; b: pGreen 62-SK/MdMYB1-pGreen 0800 LUC; c: MdARF5-pGreen 62-C: SK/MdMYB1-pGreen 0800 LUC. Representative images of Nicotiana benthamiana leaves 72 h after infiltration were shown; C: Quantitative analysis of luminescence intensity, the value for c was set to 1
-->
3 讨论
苹果(Malus domestica)是世界上最重要的经济作物之一。中国苹果种植和产量常年居于世界前列[28]。通常红皮苹果更受人们欢迎[29],花青苷作为一种重要的次生代谢产物,有助于果皮的着色[30,31,32]。MdMYB1转录因子已经被鉴定能够通过激活花青苷合成相关基因的表达,促进花青苷的积累[33]。花青苷的生物合成受到多种植物激素信号的影响。其中,生长素在调节花青苷的生物合成过程中发挥重要作用[34]。虽然前人的研究已经表明,生长素抑制植物花青苷的合成[35,36],但是,生长素在调节花青苷积累过程中的作用及其潜在的分子机制还不清楚。本研究发现MdARF5响应生长素处理,并且通过转基因技术验证了在苹果愈伤组织中超量表达MdARF5抑制花青苷积累。ARF转录因子能够结合下游靶基因的AuxRE序列调节基因的表达[37]。通过对MdMYB1启动子序列进行分析[27],发现其序列包含一个MdARF5转录因子的潜在结合位点。同时,烟草瞬时表达试验也验证了MdARF5确实可以直接抑制MdMYB1的表达。后期将通过酵母双杂交试验(Y2H)和电泳凝胶迁移率试验(EMSA)[38],进一步验证MdARF5蛋白对MdMYB1启动子的结合。
4 结论
克隆获得苹果生长素响应因子基因MdARF5,MdARF5能够响应生长素处理。MdARF5转基因苹果愈伤组织表现出抑制花青苷积累的表型。烟草瞬时转化试验表明MdARF5直接抑制MdMYB1的表达。研究结果为深入研究ARF转录因子调节植物花青苷积累提供了参考。The authors have declared that no competing interests exist.
