0 引言
【研究意义】朱砂叶螨( Tetranychus cinnabarinus)是一种可危害多种农作物的多食性害螨[1]。由于朱砂叶螨的防治主要依赖化学药剂,且该螨具有繁殖快、世代周期短、可孤雌生殖等特点,导致其抗性问题尤为突出[2]。抗性机制研究是开展有效的抗性治理的基础,近年来关于螨类抗性的研究在靶标、代谢机制等方面都取得了较为显著的进展,筛选出多种与抗性相关的靶标和代谢酶基因,在此基础上进一步开展相关基因的功能验证是当前螨类抗性研究的一大热点[3]。以此前筛选出的一条朱砂叶螨谷胱甘肽 S-转移酶(GST)基因为对象,通过原核表达和RNAi等技术在蛋白、分子水平验证其与药剂敏感性的关系,对进一步明确该螨的解毒代谢机制,开展有效的抗性治理具有重要意义。【前人研究进展】GST是生物体内重要的代谢酶之一。诸多研究均表明GST广泛参与了昆虫对氧化胁迫的响应过程,以及对植物次生毒素、杀虫剂的解毒代谢过程[4]。GST主要参与II相代谢,可催化亲水基团和外源有毒物质的结合,提高其可溶性,进而促使其排出体外,起到降低对有机体毒性的作用[5]。笔者研究团队针对朱砂叶螨的抗性机制开展了大量的工作,通过一系列研究表明GST可能介导了该螨对多种杀螨剂的抗药性,如通过增效剂实验证明抑制GST活性可导致朱砂叶螨对甲氰菊酯和丁氟螨酯的敏感性提高,并且在相应抗性品系中也检测到GST酶活性较敏感品系有显著提高,表明GST酶活性与朱砂叶螨对这两种药剂的敏感性密切相关[6,7]。在此基础上借助二斑叶螨基因组注释了朱砂叶螨转录组数据,得到了大量编码GST的基因信息[8]。通过克隆获得了Dleta和Mu家族两个GST基因家族的14个基因,利用qPCR技术检测了这些基因在不同螨态的表达模式,并发现多个基因的表达在药剂胁迫下具有可诱导性,其中 TcGSTM7的表达丰度最高,表明该基因可能广泛参与了朱砂叶螨生长发育中的生物过程,并且可能与该螨对药剂胁迫的抵御过程有关[9]。【本研究切入点】害螨在受到药剂胁迫时,可通过提高相应解毒代谢酶基因的表达来增强对外源毒素的代谢能力,这是一种重要的抗性机制。在前期研究的基础上,进一步通过RNAi以及异源表达技术验证该基因的功能。【拟解决的关键问题】利用异源表达技术获得TcGSTM7的重组蛋白,检测其与药剂的互作效应。通过RNAi有效沉默目的基因表达,分析其对朱砂叶螨药剂敏感性的影响。1 材料与方法
试验于2015—2016年在西南大学植物保护学院农药毒理与科学应用实验室完成。1.1 试验材料
供试朱砂叶螨最初采自重庆市北碚区田间,至今饲养已超过15年。将朱砂叶螨置于室内光照恒温培养箱中饲养,饲养条件为温度(26±1)℃;相对湿度55%—70%;14 h光照/10 h黑暗的人工温室中。寄主植物为新鲜盆栽豇豆苗。1.2 试验方法
1.2.1 TcGSTM7蛋白结构分析 通过Blast在NCBI数据库注释TcGSTM7(GenBank登录号:KM076640)蛋白的功能结构域,利用SWISS MODEL构建该蛋白的三维结构,并使用PyMOL软件对蛋白的功能区进行标注。1.2.2 TcGSTM7原核表达 通过带酶切位点的引物PCR扩增 TcGSTM7全长序列,引物信息见表1。利用双酶切将该基因连接到pColdII质粒(TaKaRa)上,进行序列验证后将重组质粒转入 E. coli BL21(DE3)的感受态细胞内。涂布于含卡纳霉素(50 μg·mL-1)的LB平板中,于37℃培养过夜。次日,挑单菌落培养,当OD550接近0.6时,加入IPTG至终浓度1 mmol·L-1,15℃培养24 h,收菌。
Table 1
表1
表1dsRNA合成、qPCR以及异源表达相关引物信息
Table 1Primers used in the synthesis of dsRNA, qPCR analysis and heterogeneous expression
| 引物名称Primer name | 正向引物Forward primer | 反向引物Reverse primer |
|---|---|---|
| TcGSTM7 with T7 promoter | TAATACGACTCACTATAGGG CTCCATTATCTGGCTCGTAAAC | TAATACGACTCACTATAGGG GAATCGACTGAAACTGTTGCTC |
| TcGSTM7JC (qPCR) | GGAACCTTCGAGGGGCTGTTG | GGTAAGGAAGACCCAAATTGTG |
| TcGSTM7 with restriction enzyme site | GGGAGCTCGTATGGCACCAGTTATCGGTTATTGG | TCTCGAGTCAATATGGCTTTTGAATTGTGTC |
新窗口打开
1.2.3 重组蛋白纯化及酶活性检测 取适量的菌液在PBS缓冲体系下进行超声破碎,上清液直接上Ni柱进行纯化。纯化后的蛋白参照WANG等[7]的方法检测GST酶活性。重组蛋白与药剂的互作效应参照SHI等[10]的方法进行检测。
1.2.4 TcGSTM7特异dsRNA的合成 严格按照说明书步骤,使用Trizol(Invitrogen)提取朱砂叶螨总RNA,对得到的RNA进行琼脂糖电泳,检测其完整性。选取OD260/280和OD260/230在1.8—2.2的RNA进行后续试验。使用PrimeScriptTM RT reagent Kit(TaKaRa)合成第一链cDNA,操作按相应说明书进行。以cDNA为模板,通过PCR扩增 TcGSTM7特异片段(引物信息见表1),并利用TranscriptAid T7 High Yield Transcription Kit(ThermoFisher)合成dsRNA。
1.2.5 饲喂dsRNA 将豇豆叶片剪成2.5 cm×2.5 cm大小的叶碟,然后置于60℃的烤箱烘烤1 min。将10—15 µL dsRNA溶液(约20 µg)滴在经去RNA酶处理的培养皿内,然后把烘烤后的叶片正面朝下覆盖在液滴上,使叶面充分接触试剂,室温放置5 h使叶片充分吸收dsRNA溶液。以绿色荧光蛋白(GFP)和RNAse-free water作为对照,重复3次。用毛笔将3日龄健康活泼的雌成螨轻轻挑到处理好的叶片上,每个叶片接30—50头螨,饲养48 h后进行后续检测。
1.2.6 qPCR检测 提取经dsRNA处理后的朱砂叶螨总RNA,并经DNA酶(Promega)处理后反转录成cDNA作为qPCR模板。qPCR反应体系和条件参照GoTaq® qPCR Master Mix(Promega)试剂盒说明书,使用 Mx3000PTM实时定量PCR仪进行扩增反应。基因表达量的计算参考SCHMITTGEN等[11]的方法进行分析。引物信息见表1。
1.2.7 生物测定 生物测定参考FENG等[12]的药膜法。具体步骤如下:参照之前的生物测定结果,将杀螨剂原药用少量丙酮溶解后加清水稀释成LC30和LC50的浓度[6,7]。吸取1.2 mL药液加入到1.5 mL的离心管中,轻轻转动离心管,使药剂在管内壁形成一层均匀的药膜,然后倒掉多余的药液,放置通风橱内抽风至液体完全挥发,每个浓度处理设3个重复。对照单独用同剂量的丙酮加清水处理离心管,方法相同。每个药膜管放置30头健康一致的雌成螨,在室内正常饲养条件下放置24 h后检查死亡率。死亡标准为用毛笔尖轻触螨体,螨体无反应或只有足轻微抽搐即视为死亡。对照死亡率<10%则为有效测定,用对照死亡率对结果进行校正,计算方法:校正死亡率={(处理组死亡率-对照组死亡率)/(1-对照组死亡率)}×100%。
2 结果
2.1 TcGSTM7蛋白结构分析
在对TcGSTM7进行原核表达之前,首先对其编码蛋白的结构进行了预测和3D建模。与数据库比对的结果显示,TcGSTM7蛋白的N端具有一个“thioredoxin-like”结构域,该结构域的序列特征与数据库中Mu家族GST蛋白一致。此外,在N端还存在GSH的结合位点(G-site)。在该蛋白的C端则具有催化底物结合域(H-site)。二级结构预测结果显示其具有9个 α螺旋和4个 β折叠结构,并且呈经典的“ βαβαββα”排列方式。其中4个 β折叠均位于N端,而 α螺旋中,第1、2个也位于N端,4—9个位于C端,第3个 α螺旋位于N端和C端之间。GST Mu家族蛋白的特征区域以及活性中心均如图1所示。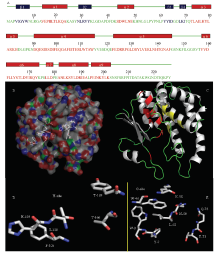 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1TcGSTM7蛋白结构图 A:氨基酸序列中的 α螺旋(红色标注)和 β折叠(深蓝色标注)Amino acid sequence of predicted α-helices (red) and β-strands (mazarine);B:三维蛋白结构及其活性位点H-site和G-site Surface of the protein structure with locations of the H-site and G-site;C:蛋白骨架,红色部位为GST-N-Mu标签序列,黄色部位为GST-C-Mu标签序列Protein structure. Features of GST-N-Mu are marked in red, and features of GST-C-Mu are marked in yellow;D、E:活性位点H-site和G-site氨基酸立体结构示意图 Stereo views of the active site showing amino acid residues around the H-site and G-site
-->Fig. 1Protein structural models of TcGSTM7
-->
2.2 表达TcGSTM7重组蛋白
利用双酶切技术将目的基因与pCold II载体连接形成重组质粒,转入大肠杆菌进诱导表达后,经SDS-PAGE电泳检测,在上清液和沉淀中均发现在26 kD的位置出现了特异性条带,该条带位置与预测的目的蛋白一致(图2-A)。使用镍柱对上清液中的蛋白进行纯化,电泳检测显示洗脱液中含有纯度较高的重组蛋白,而流穿液中没有出现蛋白条带(图2-B),表明纯化效果较好。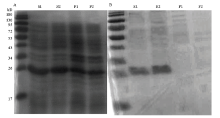 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2TcGSTM7重组蛋白SDS-PAGE电泳图 A:大肠杆菌经IPTG诱导后表达的重组蛋白条带Expression of the recombinant protein after induction by IPTG。S1、S2:经细胞破碎后在上清液中的蛋白条带Content in the supernatant after cell disruption。P1、P2:沉淀中的蛋白条带Content in the precipitate after cell disruption;B:经过柱纯化后的重组蛋白电泳图Purified recombinant protein。E1、E2:洗脱液中的重组蛋白Content in the eluant。F1、F2:流穿液电泳图Content in the liquid flow-through
-->Fig. 2SDS-PAGE analysis of TcGSTM7 recombinant protein
-->
2.3 重组蛋白酶酶活性检测以及药剂抑制效果
以CDNB和GSH为底物测定了TcGSTM7重组蛋白的酶活性。结果显示,TcGSTM7重组蛋白具有典型的GST催化活性,其酶活性为673.26 nmol·min-1·mg-1,其动力学常数 Km为0.71 mmol·L-1, Vmax为109.54 nmol·min-1·mg-1。与此前笔者实验室测定的数据相比,重组蛋白的酶活性是粗酶活性的10余倍[6,7]。酶活性抑制试验结果表明,甲氰菊酯和丁氟螨酯均可有效抑制TcGSTM7重组蛋白的催化活性,IC50分别为0.038和0.2 mmol·L-1(表2)。Table 2
表2
表2TcGSTM7重组蛋白酶活性以及药剂抑制效果
Table 2Enzyme characteristics of TcGSTM7 recombinant protein and IC50 of acaricides
| 酶学特性Enzyme characteristics | 杀螨剂IC50 Acaricides IC50 | ||||
|---|---|---|---|---|---|
| 蛋白浓度 Protein concentration (μg·mL-1) | 酶活性 Specific activity (nmol·min-1·mg-1) | Km (mmol·L-1) | Vmax (nmol·min-1·mg-1) | 甲氰菊酯 Fenpropathrin (mmol·L-1) | 丁氟螨酯 Cyflumetofen (mmol·L-1) |
| 177.27±19.28 | 673.26±25.63 | 0.71±0.06 | 109.54±14.59 | 0.038±0.009 | 0.20±0.05 |
新窗口打开
2.4 沉默 TcGSTM7表达后对朱砂叶螨药剂敏感性的影响
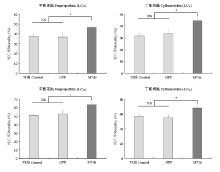
朱砂叶螨在经dsRNA处理后的叶片上饲喂48 h后,qPCR检测显示,其体内 TcGSTM7的表达量显著下调,沉默效率达到52.88%,并且清水与GFP处理组之间的表达没有显著性差异,表明通过饲喂法可有效沉默靶基因的表达(图3)。在明确了 TcGSTM7表达量下调的基础上,进一步通过生物测定检测了朱砂叶螨对甲氰菊酯和丁氟螨酯敏感性的变化。结果表明,经dsRNA处理后,朱砂叶螨对LC30和LC50的甲氰菊酯敏感性分别上升了9.0%和12.3%,对LC30和LC50的丁氟螨酯敏感性分别上升了12.9%和11.0%,且均达到显著水平( P<0.05),而GFP处理组和对照组之间无显著性差异(图4),表明 TcGSTM7的表达与朱砂叶螨对这两种药剂的敏感性密切相关。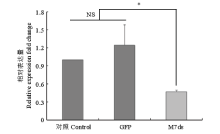 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3TcGSTM7沉默效率检测*表示在 P<0.05水平下差异显著
-->Fig. 3Silence efficiency of RNAi on TcGSTM7 Significant difference at P<0.05 level
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4沉默 TcGSTM7对甲氰菊酯和丁氟螨酯敏感性的变化
-->Fig. 4Susceptibility change to fenpropathrin and cyflumetofen after silencing TcGSTM7
-->
3 讨论
GST是生物体中一种重要的多功能催化酶,这类酶由多个家族的基因编码,广泛参与了哺乳动物、昆虫以及蜱螨对外源有毒物质的代谢过程[13]。研究表明昆虫对主流杀虫剂的抗药剂均与GST的酶活性变化有关[14]。螨类的抗性问题在节肢动物中尤为突出,但是与昆虫相比,其GST介导的抗性机制的相关研究还相对滞后。笔者实验室前期在蛋白水平研究证明利用专一性抑制剂抑制朱砂叶螨GST酶活性后可增强其对甲氰菊酯和丁氟螨酯的敏感性。同时基于朱砂叶螨的转录组数据对其GST基因进行了注释,通过qPCR检测发现 TcGSTM7在多个螨态均具有较高的表达丰度,表明此基因可能参与了朱砂叶螨的多种生命活动,此外, TcGSTM7的表达还具有明显的药剂诱导性,因此将其作为本研究的目的基因[6-7,9]。研究显示昆虫中与药剂敏感性有关的GST大多属于Delta和Epsilon家族,重组蛋白功能分析也证实它们与药剂存在互作效应[15,16]。而螨类的GST与昆虫存在较大差异,没有昆虫中重要的Epsilon家族的GST,但是有在哺乳动物中存在的Mu家族GST,且Mu家族GST与螨类的药剂敏感性有密切关系。在二斑叶螨的研究中就发现 TuGSTM9重组蛋白的酶活性远高于其他Delta家族的GST,抑制试验结果也表明该蛋白与噻螨酮、哒螨灵、四螨嗪等药剂存在互作效应[17],而Delta家族的 TuGSTd05则被证实可以直接代谢丁氟螨酯[18]。笔者在解析了朱砂叶螨TcGSTM7蛋白结构的基础上,利用原核表达分离纯化了其重组蛋白,酶活性检测表明该蛋白具有GST的催化活性,并且其酶活性是此前研究中检测到的GST总蛋白粗酶活性的10倍左右,说明TcGSTM7重组蛋白的纯度和活性均较高。将TcGSTM7重组蛋白与甲氰菊酯和丁氟螨酯反应后,其酶活性出现了显著降低,表明它与这两种药剂存在结合效应,可能具有代谢外源有毒物质的作用。
在蛋白水平分析了TcGSTM7与甲氰菊酯和丁氟螨酯互作效应的基础上,本研究进一步利用RNAi在基因水平验证了 TcGSTM7表达对朱砂叶螨药剂敏感性的影响。结果显示通过饲喂dsRNA可有效抑制朱砂叶螨体内 TcGSTM7的表达。生物测定结果则证实降低 TcGSTM7的表达后,朱砂叶螨对不同剂量的甲氰菊酯和丁氟螨酯的敏感性均出现了显著的提高。这在分子水平也证实了 TcGSTM7可以影响朱砂叶螨的药剂敏感性。此外,结合RNAi和生物测定结果可以发现虽然对 TcGSTM7表达的抑制率达到了52.88%,但对朱砂叶螨的药剂敏感性的影响却仅为10%左右,这个现象表明生物具有非常复杂的解毒代谢系统。目前在昆虫和螨类中发现参与药剂代谢的有GST、P450、CCE等多种解毒酶类,每一种酶均是由庞大的基因家族所构成,这些酶在解毒代谢过程中具有协同作用。以埃及伊蚊( Aedes aegypti)为例,表达谱分析结果显示,经双硫磷筛选后有大量GST、P450、CCE出现了过表达的现象[19]。YANG等[20]通过基因芯片检测了烟粉虱( Bemisia tabaci)对噻虫嗪抗性、敏感品系间的基因表达差异,也发现多种解毒酶基因的表达均出现了上调现象。橘小实蝇( Bactrocera dorsalis)的幼虫在甲氰菊酯的胁迫下,体内多种解毒代谢酶基因的表达都有显著的提高[21]。类似的结果在致倦库蚊( Culex quinquefasciatus)、铜绿蝇( Lucilia cuprina)、微小牛蜱( Rhipicephalus microplus)等多种生物对菊酯类药剂抗性的研究中多有发现,表明这种协同效应在昆虫的抗性机制中是普遍存在的[22,23,24]。朱砂叶螨对药剂的敏感性同样受多种解毒代谢酶的影响,陈秋双等[25]在朱砂叶螨的生物测定过程中加入了增效剂,结果显示P450、CCE和GST均参与了其抗药性的形成;WEI等在基因表达水平的研究也表明CCE、P450等均参与了朱砂叶螨对丁氟螨酯和甲氰菊酯的抗药性[26,27]。此外,SHI等[28]还发现沉默朱砂叶螨单个P450基因对其甲氰菊酯敏感性的影响有限,但是同时沉默6个P450基因造成的改变则非常明显。在二斑叶螨的研究中也发现了同样的现象,高新菊等检测了二斑叶螨对四螨嗪和甲氰菊酯抗性品系与敏感品系之间的代谢酶活性差异,发现抗性品系中P450、CCE、GST、ACP以及ALP等酶的活性均显著高于敏感品系[29,30]。这些结果与本研究的结果一致,说明单一沉默朱砂叶螨 TcGSTM7的表达虽然可改变其对甲氰菊酯和丁氟螨酯的敏感性,但仅造成10%左右的死亡率变化也证明可能不止一个GST或者不止GST一种解毒代谢酶参与了此过程。因此,如果在实际应用中要通过沉默GST的表达来达到抗性治理的目的,采用多基因同时作为靶标是更好的选择。
4 结论
TcGSTM7的表达可影响朱砂叶螨对甲氰菊酯和丁氟螨酯的药剂敏感性,并且其重组蛋白与这两种药剂存在互作效应,证明该基因可能参与了朱砂叶螨对甲氰菊酯和丁氟螨酯的代谢过程。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
