0 引言
【研究意义】磷素是小麦生长过程中重要的大量元素之一,对小麦籽粒产量和淀粉品质的形成有重要的调控作用。但是,新疆大部分耕地土壤肥力较差,磷素缺乏,长期以来,大量施用磷肥已成为缓解土壤磷素胁迫、实现小麦高产稳产的重要措施之一。然而,面对即将枯竭的磷矿资源和大量施用磷肥带来的环境风险,深入细化地研究磷素对小麦淀粉产量和品质形成的作用具有重要意义。小麦淀粉粒表面存在微孔和微通道结构,是外界酶、酸、水等物质与淀粉粒首要的作用位点[1],因此,微通道的数量和结构可影响工业中对特殊淀粉的要求[2-3]。探索磷素对淀粉粒微观特性的影响及其机理可为不同磷营养条件下小麦淀粉的生物合成及品质变化机理的研究提供新途径。【前人研究进展】小麦、玉米和高粱等禾本科作物淀粉粒表面均能观察到微孔和微通道[1,4]。微通道的直径一般约为100 nm,表面的微孔与内部蜿蜒的通道相通并一直延伸到脐点,这种结构是淀粉粒本身的属性特征[5]。淀粉粒晶体一般分为五级结构,其四级结构——淀粉小体是构成淀粉粒的基本单元,从其中“缺陷小体”的角度可以在结构上解释淀粉粒微孔和微通道的形成[6]。GRAY[7]研究发现在玉米微通道中存在蛋白、磷脂、微管物质和微纤维等。FANNON等[8]提出假设,在玉米和高粱胚乳的造粉体中存在微管,这些微管以淀粉发生中心(淀粉粒脐点)呈放射状向外与质体被膜相连,淀粉分子逐渐以微管为中心发育形成淀粉粒,最终淀粉粒微通道成为造粉体微管的残体。迄今为止,关于小麦淀粉粒微通道的起源及生物学意义的研究鲜见报道。前人及石河子大学农学院冬小麦课题组研究发现,外界高温、干旱等环境因素对玉米和小麦籽粒淀粉合成以及淀粉粒表面的微孔和微通道结构有一定的影响[9-11],并认为微通道的形成可能与淀粉降解酶和合成酶之间的平衡被打破有关。胚乳发育过程中淀粉的生物合成是一个复杂的生物学过程,涉及众多酶的共同作用,包括淀粉合成酶[12]以及淀粉降解酶[13-14]。BENMOUSSA等[15]发现在玉米淀粉粒的微通道蛋白中包含淀粉合成的关键酶-腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)和颗粒淀粉合成酶(GBSS)。基于此研究,推断微通道结构对淀粉合成以及淀粉粒形态建成有重要意义。施磷肥是改善土壤磷胁迫、提高小麦产量和品质的有效途径。然而,过量施磷会对经济发展和生态环境带来一定的负面效应。AGPase是淀粉合成的关键酶之一,其活性受3-磷酸甘油酸和无机磷酸的影响,其中无机磷酸对该酶活性有抑制作用,从而影响淀粉的合成[16]。NI等[17]研究发现施磷显著提高了成熟期小麦籽粒中的总淀粉、直链淀粉和支链淀粉含量。石河子大学农学院冬小麦课题组前期研究表明,施磷显著提高了新冬20号小麦籽粒淀粉中B型淀粉粒的比例[18],并对淀粉粒微观结构有显著影响。【本研究切入点】目前,尽管关于小麦淀粉粒微通道结构的形态及其对淀粉理化性质的影响已有研究报道,然而,关于小麦淀粉粒微孔和微通道的生物学意义和起源的研究却鲜见报道。【拟解决的关键问题】本研究采用新疆冬小麦主栽品种新冬23号,研究不同磷素水平下淀粉粒微观结构、淀粉合成酶与降解酶相关基因的表达以及α和β-淀粉酶关键基因的变化,旨在探究磷素对淀粉粒微观特性的影响及形成机理,为进一步研究小麦淀粉生物合成提供新途径。1 材料与方法
1.1 试验材料及设计
供试材料选用新疆主栽冬小麦品种新冬23号,种子由石河子大学麦类作物研究所提供。试验材料于2014年10月至2015年6月种植在石河子大学农学院试验站(44°17′N, 86°03′E)。试验地前茬为向日葵,土壤为灰漠土。0—20 cm土层含碱解氮63 mg·kg-1、速效磷15 mg·kg-1、速效钾208 mg·kg-1。播种时按75 kg·hm-2施加尿素,灌溉方式为滴灌,冬前浇水3次,返青至成熟每隔10—12 d浇水1次,共浇6次。在拔节期、抽穗期和扬花期分别按45、75和120 kg·hm-2将尿素随水施入。
试验为随机区组设计,每个处理重复3次,小区面积2.4 m×3 m,小区之间设置宽度为50 cm的隔离带。设3个磷素供应水平,施磷量(以P2O5计)分别为0、105和210 kg·hm-2,分别用CK(对照)、CP(常规施磷)和HP(高量施磷)表示,所用肥料为重过磷酸钙,播种后160 d(大约5%的植株已返青)开沟条施。CK用同样方式开沟,但不施磷肥。
1.2 取样
取同日开花的麦穗挂牌标记,分别在花后7、14、21、28和35 d取样。取样时剥取穗中部的籽粒,一部分经液氮速冻后-80℃保存;另一部分于105℃杀青30 min,80℃烘干至恒重备用。1.3 淀粉粒的提取及形态观察
取小麦籽粒置于去离子水中4℃过夜,剥去果种皮,切除胚,研磨成匀浆。淀粉粒的提取过程参照PENG等[19]的方法。通过离子溅射仪(DentonVacuum- Moorestown,USA)将提取纯化的淀粉粒镀金膜,然后用扫描电镜(JEOL JFC-1600,Japan)观察拍照,加速电压5—15 KV。1.4 淀粉粒的酶解
1.4.1 淀粉粒内源酶解试验(小麦种子萌发试验) 3种磷素条件下,待籽粒成熟后,选取籽粒饱满度一致的小麦种子,用0.1%氯化汞溶液消毒15 min,蒸馏水漂洗3次,每次5 min,用滤纸吸干附着水。将种子均匀摆放在铺两层滤纸的灭菌发芽盒中,每盒种50粒,25℃暗培养。每天用蒸馏水浇灌,保持湿润。2 d后于人工气候室培养,光照16 h,温度28℃;暗培养8 h,温度16℃。于第6天取样。提取胚乳淀粉粒,通过扫描电镜观察、拍照。1.4.2 外源蛋白酶酶解 取2 g淀粉粒悬浮于40 mL酶解缓冲液中,加入蛋白酶XIV(196 U·g-1淀粉,sigma,USA,来源:灰色链霉菌),置于4℃摇床200 r/min振荡24 h,于4℃ 4 000r/min离心20 min,收集淀粉粒,去离子水漂洗3次,酒精漂洗1次,用布氏漏斗收集淀粉粒,室温晾干。
1.4.3 外源淀粉葡萄糖苷酶酶解 准确称取25 mg淀粉粒于2 mL离心管中,加入1 mL含50 U的淀粉葡萄糖苷酶(Sigma-Aldrich,USA),酶解的具体操作参照TANG等[20]的方法,酶解完成后使用3,5-二硝基水杨酸法测定产生的还原糖浓度[10],然后将剩余的淀粉粒用扫描电镜观察拍照。
1.5 淀粉粒的染色及激光共聚焦显微镜观察
将蛋白酶XIV处理过的淀粉粒用汞溴红甲醇溶液染色并制成临时玻片,具体操作过程参照KIM等[1]的方法,再用激光共聚焦显微镜(Zeiss, Oberkoche, Germany)观察、拍照。1.6 淀粉合成酶与降解酶相关基因的检测
1.6.1 引物设计 根据NCBI公布的小麦籽粒淀粉合成酶与降解酶相关基因的序列,设计agp1、agp2、ss1、ss2、ss3、ss4、gbss1、gbss2、amy1、amy2、amy3、amy4、bam1、bam2、bam3、bam4、bam5、bam6和bam7的引物,由上海生工合成。小麦actin(NCBI DN551593)作为内参基因。通过梯度PCR验证引物特异性,同时优化PCR条件。1.6.2 RNA的提取和cDNA的合成 将保存于-80℃的新鲜样品切除胚,采用Fruit-mate(TaKaRa,9192,Japan)和RNAiso plus(TaKaRa, 9108, Japan)试剂盒提取RNA。琼脂糖凝胶电泳检测总RNA质量。使用TIANScript cDNA第一链合成试剂盒(Tiangen,KR104-02,China)合成cDNA,以其为模板扩增actin以检验cDNA质量。
1.6.3 实时荧光定量PCR 采用实时荧光定量PCR仪(Roche LightCycler 480 Ⅱ)检测各基因的表达情况,具体操作按SYBR Premix Ex Taq试剂盒(TaKaRa,RR420A,Japan)说明书进行。
1.7 amy4、bam1和bam5的原位杂交检测
1.7.1 探针的合成 通过扩增分别获得amy4、bam1和bam5基因片段,将其与pEASY-T3克隆载体连接,获得阳性克隆,由上海生工进行测序。提取测序正确的阳性克隆质粒,根据测序结果中片段插入载体的方向,使用NcoⅠ(TaKaRa,1160A,Japan,10 U·μL-1)或PstⅠ(TaKaRa,1073A,Japan,15 U·μL-1)限制性内切酶进行酶切线性化,然后用Dig RNA标记试剂盒(Roche,REF11175025910,USA)通过体外转录合成探针(表1)。Table1
表1
表1原位杂交探针序列
Table1Probe sequences used for in situ hybridization
| 目标基因 Target gene | 探针序列 Probe sequence (5′-3′) |
|---|---|
| amy4 | UUGGUUUCCGAUGGUGUUGUCCAAGAACAGGCAGCUCGCAAUGGCGGGAUCAUUAAGAACGGGAGAGAAAUCCUAUUGCAGGCUUUUAAUUGGGAAUCCCAUAAACACAAUUGGUGGAGUAAUUUAGAGGGCAGAGUUGCCGACAUUGCUA |
| bam1 | ACUCAGGAAUGCAAGGCCUCAUGGCAUCAACAAGAGCGGCCCUCCUGAGCACAAGCUGUUUGGAUUCACCUACCUCCGGCUGUCGAAUCAGUUGGUGGAGGGACAAAACUAUGUCAAUUUCAAGACCUUUGUUGACAGAAUGCAUGCCAACCUGCCUCAUGACCCAU |
| bam5 | UGAACCGGAACCUGUUCGACGGCGACAACUGGCGACGGUUCGUCGCGUUCGUGAAGACCAUGGCCGACGGCGGCGCGAGGACGGCGCUGCCCAGGUGCGACACUGGGCACUCGGAUCUGUACGUGGGGUUCGUUGA |
新窗口打开
1.7.2 石蜡切片的制作 石蜡切片的制作参照AUSUBEL等[21]的方法并加以改进。将-80℃保存的新鲜样品横切后置于4%多聚甲醛(含0.1%DEPC,pH 7.2—7.6)中,微真空条件下室温固定4 h,然后通过梯度浓度(30%—100%)酒精脱水,分别用3﹕1、1﹕1和1﹕3的酒精氯仿混合液逐级透明,每级3 h,再用纯氯仿继续透明3 d。透明的样品使用一系列氯仿石蜡混合物在不同温度下(3﹕1,40℃;1﹕1,40℃;1﹕3,45℃)逐级浸蜡,每级4 h,最后将样品置于纯石蜡中55℃继续浸蜡3 d(花后21 d及之前的籽粒)或5 d(花后28 d和35 d的籽粒)。浸蜡后的样品按常规方法包埋成蜡块,然后在石蜡切片机(Kedee,1508A,China)上切成10—25 μm厚的切片(花后28 d和35 d的样品切片前需要先切出籽粒的横截面,再将其倒扣于DEPC水中软化数小时)并转移到粘附载玻片(Citoglas,REF188105W,China)上。
1.7.3 原位杂交 石蜡切片经二甲苯脱蜡后复水,然后使用敏感性加强型原位杂交检测试剂盒Ⅰ,POD(Boster,MK1030,China)进行原位杂交。完成杂交后的切片使用体视显微镜(Zeiss Discovery V20,Germany)观察拍照。
1.8 石蜡切片的I2-KI染色
脱蜡后的切片用I2-KI(0.1%)染色5 min,去离子水冲洗干净,用体视显微镜(Zeiss Discovery V20,Germany)观察拍照。1.9 数据分析
使用Microsoft Excel和SPSS 13.0软件进行数据分析,所有数据为至少3次重复的平均值,采用Duncan法进行多重比较。基因相对表达量按下面的公式计算:ΔCt(目标基因)=Ct(目标基因)-Ct(同一样品的
actin) (1)
相对表达量=2-ΔCt (目标基因) (2)
2 结果
2.1 小麦胚乳淀粉粒微观结构的变化
为探究不同施磷条件下新冬23号小麦淀粉粒的结构特性变化,将提取的淀粉粒进行扫描电镜观察。如图1A-C所示,A型淀粉粒呈圆盘状,直径大于10 μm;B型淀粉粒呈球形或不规则形状,直径小于10 μm,不同磷处理下淀粉粒形态未发生明显改变。另外,对比CK和HP处理,CP处理条件下的淀粉粒表面更容易观察到微孔。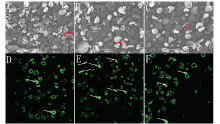 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1通过扫描电镜和激光共聚焦显微镜观察成熟小麦籽粒淀粉粒(A和D、B和E、C和F分别是CK、CP和HP处理条件下籽粒胚乳中淀粉粒。A、B、C是通过扫描电镜观察到的淀粉粒,D、E、F是通过激光共聚焦显微镜观察到的经汞溴红染色的淀粉粒。白框中是表面有微孔的淀粉粒,左下角插入的放大图(×2000)是红框中淀粉粒。白色箭头指向的是淀粉粒中的短通道或空腔(通过微孔连接到外表面)。CK:P2O5 0 kg·hm-2;CP:P2O5 105 kg·hm-2;HP:P2O5 210 kg·hm-2)
-->Fig. 1Starch granules isolated from mature wheat seeds and observed using SEM (×500) and CLSM(×400)(Starch granules were isolated from the wheat grain samples under the CK (A and D), CP (B and E), and HP (C and F) conditions, respectively. (A-C) indicate the starch granules were observed using SEM and (D-F) indicate the starch granules were stained with merbromin then observed using CLSM. The “pinholes” along the equatorial grooves and on flat surfaces of the granules were visualized with box. The magnified insets (×2000) (A, B, C) were the starch in red box. The white arrows indicate short channels and/or cavities (connected to the exterior by channels) within the granules. CK: P2O5 0 kg·hm-2; CP: P2O5 105 kg·hm-2; HP: P2O5 210 kg·hm-2)
-->
为了更深入观察磷素对淀粉粒内部微观结构的影响,将蛋白酶XIV酶解处理的淀粉粒经汞溴红染色,通过激光共聚焦显微镜观察(图1-D—F)。CP处理条件下的淀粉粒内部显示出更多的荧光(图1-E中箭头所示),而CK淀粉粒的荧光主要出现在边缘,HP处理条件下的淀粉粒荧光介于CP和CK之间,说明不同水平磷素条件下小麦淀粉粒内部的微通道结构发生了变化。
为进一步研究淀粉粒内部微通道结构的变化,通过扫描电镜观察淀粉粒在内源(种子萌发时产生的降解酶)和外源淀粉酶(淀粉葡萄糖苷酶)酶解条件下的形态变化(图2)。发现小麦籽粒发芽6 d时淀粉粒表面出现数量较多的孔洞,其中CP处理下淀粉粒表面的孔洞最多,说明降解程度最高;HP处理次之;CK淀粉粒表面孔洞较少,降解程度最低(图2-A—C)。外源淀粉葡萄糖苷酶处理使淀粉粒表面也出现很多孔洞,赤道凹槽重新出现,并使部分淀粉粒分成两部分(图2-E、F箭头所示),B型淀粉粒被降解程度相对较小。相比CK,HP和CP处理下淀粉的酶解程度较强,很容易观察到被水解成两半的A型淀粉粒。说明不同磷素供应下原淀粉粒表面和内部结构的变化对酶作用位点的分布和数量有重要影响。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2新冬23号小麦淀粉粒酶解照片(A、B、C分别是CK、CP和HP小麦籽粒发芽6 d的淀粉粒照片。D、E、F分别是CK、CP和HP小麦淀粉粒在50 U淀粉葡萄糖苷酶于37℃处理72 h照片。白色箭头指示被酶解成两半的淀粉粒)
-->Fig. 2SEM micrographs of wheat starch granules with enzymes(Starch granules were isolated from the wheat grain under the CK (A), CP (B), and HP (C) conditions at 6 days post germination, respectively. D, E, and F indicate starch granules from CK, CP, and HP samples treated with 50 U amyloglucosidase per 25 mg starch at 37℃ for 24 h, respectively. The white arrows indicate the starch granules are split in half by enzymatic digestion)
-->
淀粉粒上的微孔和微通道结构可以促进酶、水等物质进入淀粉粒内部[22],该效应可通过淀粉粒的酶解效率的提高而体现出来[10]。为确定磷处理条件下淀粉粒微孔、微通道的变化是否存在同样的效应,将相同质量的淀粉粒经淀粉葡萄糖苷酶水解后测定产生的还原糖浓度(表2)。与对照相比,磷处理条件下的淀粉粒水解产生的还原糖浓度显著提高,且HP处理下的还原糖浓度显著高于CP处理。此结果验证了淀粉粒微孔微通道的变化。
Table 2
表2
表2不同磷处理下的小麦成熟期淀粉粒经淀粉葡萄糖苷酶水解后产生的还原糖浓度
Table 2Concentrations of reducing sugars after amyloglucosidase digestion of starches isolated from mature wheat grains grown in different phosphorus rate treatments
| 处理 Treatment | 还原糖 Reducing sugar (μg·mL-1) |
|---|---|
| CK | 1425.47±37.93c |
| CP | 1874.92±60.84b |
| HP | 2064.08±0.42a |
新窗口打开
2.2 小麦籽粒发育过程中淀粉合成酶与降解酶相关基因的表达
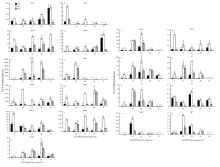
不同磷水平处理下淀粉合成与降解相关酶基因的相对表达量如图3所示。小麦籽粒发育过程中8个淀粉合成相关酶基因和11个淀粉降解相关酶基因均有表达,但在不同磷处理下的表达模式不同。CP处理下淀粉合成与降解相关酶基因的表达量显著高于CK和HP处理。淀粉合成相关酶基因的表达峰值主要出现在灌浆前期和中期,而淀粉降解相关酶基因的表达峰值则主要出现在籽粒灌浆的中后期。3种磷素处理下,agp1和agp2的表达模式相似,花后7—28 d,CP处理下的表达量显著高于CK和HP。gbss1与gbss2的表达模式不同,gbss1在花后14和21 d表达量较高,CP处理下花后21 d达到峰值,且显著高于CK和HP;gbss2的表达量明显低于gbss1,CP处理下gbss2表达量在各时期都显著高于CK和HP,花后7 d达到峰值。3种磷处理下ss1、ss2、ss3和ss4的表达模式相似,均在籽粒发育中期表达量较高,CP处理下分别在花后21、21、14和21 d达到表达量峰值(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同施磷水平对小麦籽粒发育过程中淀粉合成酶与降解酶相关基因的表达(图中数据为3次重复的平均值±标准误,不同字母代
-->Fig. 3Relative expression of genes involved in starch synthesis and degradation in a developing wheat endosperm under different phosphorus application rates(Values are mean ± S.E. of three replications. Columns with different letters are significantly different at P<0.05. A-K: Genes involved in starch degradation. L-S: Genes involved in starch synthesis)
-->
如图3所示,4个α淀粉酶基因中,amy1和amy4在不同磷水平下的表达模式相似,均在籽粒发育前期和中期表达量较低,在灌浆末期表达量急剧升高。amy2的表达模式则相反,3个磷处理下都在花后7 d表达量最高。4个α淀粉酶基因中amy3表达量最高,HP和CP处理下表达模式基本呈先下降后上升的趋势,CP处理下花后35 d达到表达峰值,而CK条件下表达量在各时期变化不大。HP和CP处理下bam1、bam2、bam4和bam7的表达模式相似,基本呈先上升后下降的趋势,CP处理下bam1和bam2分别在花后21和14 d表达量最高,bam4和bam7都在花后28 d表达量最高,而CK条件下这4个基因的表达量都很低。CP处理下bam3的表达峰值出现在花后14 d,而CK和HP条件下表达量都较低。Bam5在CK和CP处理下的表达模式相同,在花后7 d表达量最高,而HP处理下则是花后28 d表达量最高。CK条件下bam6的表达量很低,而HP和CP处理下表达较为丰富,且CP处理下花后21 d表达量最高(图3)。
2.3 小麦籽粒发育过程中amy4、bam1和bam5表达的空间分布
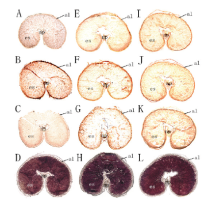
为探究不同施磷水平下小麦淀粉粒微通道结构变化和淀粉降解酶基因的表达部位之间的关系,利用原位杂交技术对降解酶基因amy4、bam1和bam5进行定位(图4和图5)。籽粒横切面I2-KI染色(图4-D、H、L和D、H、L)用以表征小麦籽粒腹沟处的空腔是其固有特征,不是切片时的机械破损。原位杂交结果表明,花后7 d时amy4、bam1和bam5在果种皮和早期胚乳中都有表达(图未给出),随着籽粒的发育,CK条件下的整个胚乳直到成熟均可以检测到这3个基因的表达(图-4A—C和图5-A—C),而CP和HP处理下,花后28 d(图4-E—G,图4-I—K)和35 d(图5-E—G,图5-I—K)时这3个基因的表达主要集中于胚乳的边缘,且这一现象在CP处理下更显著。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4花后28 d小麦籽粒横切面amy4、bam1和bam5的原位杂交和I2-KI染色(×25)(CK(A—C)、CP(E—G)和HP(I—K)处理下amy4(A、E、I)、bam1(B、F、J)和bam5(C、G、K)的杂交部位呈现红棕色的杂交信号,CK(D)、CP(H)和HP(L)处理下小麦籽粒横切面的淀粉粒被染成蓝紫色。l:糊粉层;es:胚乳:np:珠心突起;p:果种皮。切片厚度≤20 μm。下同)
-->Fig. 4In situ localization of amy4, bam1, and bam5 transcripts and starch accumulation in wheat caryopses at 28 DPA (×25)(Hybridization sites of amy4 (A, E, I), bam1 (B, F, J), and bam5 (C, G, K) transcripts were visualized as reddish-brown signals in median transverse sections of wheat grains under the CK (A-C), CP (E-G), and HP (I-K) conditions, respectively. Starch granules were stained with I2-KI in median transverse sections of wheat grains under the CK (D), CP (H), and HP (L) conditions, respectively. al: Aleurone; es: Endosperm; np: Nucellar projection; p: Pericarp. The thickness of these sections was less than 20 μm. The same as below)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5花后35 d小麦籽粒横切面amy4、bam1和bam5的原位杂交和I2-KI染色(×25)
-->Fig. 5In situ localization of amy4, bam1, and bam5 transcripts and starch accumulation in wheat caryopses at 35 DPA (×25)
-->
3 讨论
小麦胚乳中A、B型淀粉粒的发生具有严格的时序性,A型淀粉粒主要出现在花后7 d左右,花后14—21 d为快速增长期;B型淀粉粒则从花后14 d左右开始出现,花后21 d左右出现直径小于5 μm的B型淀粉粒[12]。A、B型淀粉粒的形状和分布是受遗传和环境因素控制的[10-11, 23],本研究中不同磷水平下A、B型淀粉粒的基本形态未发生明显变化,同时石河子大学农学院冬小麦课题组前期研究发现CP处理下B淀粉粒,特别是该群体中0—5 μm范围的淀粉粒含量变化较大[18],说明磷素对淀粉粒的分化和发育进程有重要影响。此外,石河子大学农学院冬小麦课题组发现常规施磷可显著增加籽粒淀粉含量并可加速籽粒成熟,因此,施磷处理可能主要通过影响B淀粉粒的合成来影响总淀粉的积累量。另外,由于新疆在小麦籽粒灌浆后期干热风频发,合理范围内增施磷肥促进籽粒早熟,可以在一定程度上减弱干热风导致的籽粒减产。微孔和微通道是小麦淀粉粒的固有特征,,且A型和B型淀粉粒微通道结构不同,其中A型淀粉粒通道较多,B型淀粉的微通道大部分被蛋白阻塞[1]。因此,可以从淀粉粒形态建成的角度解释淀粉粒微通道结构的形成和变化的原因。PENG等[24]通过蛋白质N端测序技术和抗体免疫杂交证实小麦中分子量为150 kD的淀粉粒结合蛋白是淀粉分支酶SBE的同工型SBEIc,该酶与A、B型淀粉粒的双向分布有关,主要和A型淀粉粒结合。CAO等[25]研究表明,小麦中A型淀粉粒的形成与较高的淀粉合成酶活性有关;通过蛋白组学分析表明,B型淀粉粒的形成可能与淀粉合成酶SSI-1的磷酸化有关。然而,由于蛋白提取方法所限,这些蛋白均未被细化为哪些是与淀粉粒微通道有关的。因此,提取小麦淀粉粒通道蛋白并对其进行鉴定和功能验证,对解释淀粉粒微通道的生物学起源和意义具有重要意义。
前人研究表明,AGPase在作物胚乳中对无机磷酸和3-PGA并不敏感,说明它可能受转录水平的调节[26]。WANG等[27]研究认为SSS、SBE和DBE可能在转录水平上调节淀粉的合成,而GBSSI可能在转录水平和转录后水平上调节淀粉的合成[28]。此外,RADCHUK等[29]在大麦中的研究表明,籽粒发育后期的β-淀粉酶活性来源于bam1和bam2的表达,因此,本研究中磷处理下较高的淀粉合成与降解相关酶基因表达水平可能造成了对应酶活性的增强。
本研究中,灌浆后期籽粒的淀粉降解酶关键基因amy4、bam1和bam5的原位杂交结果表明,CP处理下淀粉酶基因在胚乳外缘的表达量增加。与此相对应的是,通过电镜更容易在CP处理下的淀粉粒表面和赤道凹槽部位观察到微孔;通过激光共聚焦显微镜的观察表明淀粉粒内部的微通道结构也发生了变化。此外,外源淀粉葡萄糖苷酶处理中CP条件下的淀粉粒酶解程度较高;石河子大学农学院冬小麦课题组的前期研究亦表明,发芽6 d时,CP处理下的小麦籽粒胚乳中淀粉粒降解程度和α-淀粉酶活性最高[30],也验证了淀粉粒内部通道结构的变化(可能是数量增多,孔径变大),为酶解处理的淀粉粒提供了更多的降解作用位点[4]。另外,HP和CP水平下新冬23号小麦在灌浆后期籽粒α-和β-淀粉酶活性也达到最大值(数据未显示),据此推断磷处理下灌浆后期淀粉降解酶基因表达量的增加和降解酶活性的提高可能造成了淀粉粒微通道结构的变化。前人在玉米中的研究认为,高温增加了淀粉粒表面的孔洞数量,推断可能是高温打破了淀粉合成酶和降解酶间的平衡,引起淀粉粒的自溶[9]。本研究中大部分取样时期CP处理下籽粒淀粉合成酶和降解酶活性均显著高于对照,推断这两类酶亦存在动态平衡,磷处理可能也会影响该平衡关系,造成淀粉粒表面微观结构的变化。
小麦胚乳细胞是由胚乳外缘的分生组织分化而来,因此,较成熟的细胞分布在胚乳的中心部位,而较幼嫩的细胞分布在胚乳的边缘[31]。CP处理下胚乳边缘酶基因表达量较高,说明胚乳外缘的分生组织细胞保持着较旺盛的代谢活性,此部位淀粉合成与降解关键酶基因的转录水平更高。BENMOUSSA等[15]提出造粉体和淀粉粒的微通道可能有以下功能:(1)促进淀粉的聚合和淀粉粒的生物合成;(2)在种子萌发过程中为淀粉的降解提供反应位点[4]。基于此,CP处理下胚乳细胞造粉体微管结构可能发生了变化,增加了ADP-葡萄糖的转运,进而促进了淀粉分子的聚合和淀粉粒的形成,这与CP处理下总淀粉含量显著高于CK和HP(数据未显示)以及淀粉合成相关酶基因表达量的增强是一致的。之后,随着淀粉粒的发育,造粉体微管转变成为微管残体,即微通道和微孔,为淀粉的酶降解提供了反应位点[15]。另外,HP和CP处理下小麦籽粒的成熟度高于CK,可能也是造成不同磷处理间淀粉粒微观结构和淀粉酶基因表达差异的原因。因此,要进一步探索磷处理下淀粉粒微观结构的变化及其与淀粉合成的关系,需观察小麦籽粒整个灌浆期淀粉粒微孔和微通道结构的动态变化。
4 结论
不同磷素供应下小麦胚乳淀粉粒形态未发生明显改变,但是淀粉粒内部微通道结构存在差异。常规施磷条件下,小麦胚乳淀粉合成与降解相关酶基因的表达量显著高于对照和高量施磷。常规施磷下胚乳外缘淀粉酶基因转录水平的提高可能影响了淀粉合成酶和降解酶之间的平衡,进而影响了淀粉粒的合成和微观特性的变化。The authors have declared that no competing interests exist.
