0 引言
【研究意义】家蚕(Bombyx mori)作为鳞翅目昆虫的模式生物,因能够吐丝结茧而具有非常重要的经济价值。家蚕同其他昆虫一样,体壁由几丁质和蛋白质构成,体内没有内骨骼的支持。几丁质在自然界中广泛存在于低等植物、菌类、藻类、昆虫、甲壳类动物中,是除纤维素以外的又一重要多糖,其分子结构是由D-N-乙酰氨基葡萄糖通过重复的β (1,4) 糖苷键聚合而形成直链形的大分子。在昆虫体内,几丁质和蛋白质结合形成一种稳定的结构用来支撑和保护虫体[1-2]。目前报道的能与几丁质结合的蛋白主要是表皮蛋白。家蚕的表皮蛋白基因约占总基因数的1.5%[3],而表皮蛋白中的CPR家族研究报道最多,而CPAP家族的表皮蛋白是除CPR家族以外的最大的一类表皮蛋白,因此,对CPAP家族表皮蛋白的功能及其几丁质结合的研究具有重要意义。【前人研究进展】在昆虫体内,几丁质能够与蛋白质相结合形成一种稳定的结构,从而发挥不同的功能。目前已经报道的能与几丁质结合的蛋白主要包括表皮蛋白、几丁质酶、30K蛋白、ATP合成酶等[4],其中,表皮蛋白与几丁质结合的强度最高,被研究的较为广泛。关于家蚕表皮蛋白的研究主要集中于表皮、围食膜和丝腺。研究者对家蚕前部丝腺进行了蛋白质组学和转录组学的分析,分别鉴定到了33和53个表皮蛋白[5-6];WANG等[7]通过转录组学技术在家蚕吐丝器中鉴定到了106个表皮蛋白;ZHONG等[8]通过Shotgun技术对家蚕围食膜蛋白进行鉴定,鉴定到有2个表皮蛋白;FU等[9]对家蚕的气管和鳞毛进行了蛋白质组学研究,在气管中鉴定到21个表皮蛋白,鳞毛中有7个表皮蛋白,这些表皮蛋白具有一定的组织特异性;SHI等[10]通过Shotgun技术对不同时期的翅原基进行蛋白鉴定,发现在不同时期翅原基的表皮蛋白存在差异,有些蛋白在家蚕吐丝后才会转录,其中RR-2类蛋白所占的比例最大;DONG等[11]通过几丁质亲和层析及LC-MS/MS联用,在家蚕表皮中鉴定到了103个表皮蛋白,约占家蚕总表皮蛋白的49%。表皮蛋白的种类很多,根据其结构域的特点可以将其分为以下几类:CPR家族、CPT家族、CPF&CPFL家族、CPLCA家族、CPLCG家族、CPLCW家族、CPLCP家族、CPAP(cuticular proteins analogous to peritrophins)家族等[3,12-17]。CPR家族的表皮蛋白分布最广、数量最多,也是研究最为广泛的一类,由Rebers和Riddiford最先发现其保守序列并命名的,因此其保守序列又被称为R&R保守基序,随后,研究者不断对其进行扩展,将R&R保守基序分为3类R&R-1、R&R-2、R&R-3[18-22]。CPAP家族的表皮蛋白是仅次于CPR家族的第二大类表皮蛋 白[11],CPAP又被称为Gasp-Obstructor家族,该家族的蛋白具有1个或3个ChtBD2几丁质结合结构域[13],其保守的结构域为CX11-24CX5CX9-14CX12-16CX6-8C,除了在昆虫中发现了这类表皮蛋白外,在低等生物线虫中也存在这个家族的表皮蛋白[23],该家族的表皮蛋白根据其保守结构域的数量及组织特异性可以分为3类:CPAP1(含有1个ChtBD2结构域)、CPAP3(含有3个ChtBD2结构域)、PMP(只在围食膜特异表达的CPAP家族表皮蛋白),DONG等[11]鉴定到表皮中有8个CPAP家族的表皮蛋白能够与几丁质进行结合,其中包括3个CPAP1类和5个CPAP3类的蛋白。有研究者通过对CPR家族、CPT家族的部分表皮蛋白进行分析,发现这些表皮蛋白与几丁质的结合均离不开表皮蛋白的β折叠结构[24-28]。然而,对不同的表皮蛋白家族是如何与几丁质进行结合的研究很少,只有关于CPR家族中的R&R-2结构域的表皮蛋白的研究。【本研究切入点】CPAP家族的表皮蛋白作为第二大类表皮蛋白,笔者实验室已对家蚕CPAP家族的表皮蛋白进行了鉴定[11],关于该类蛋白家族的功能及结合几丁质的机理未见报道。【拟解决的关键问题】在家蚕丝腺中克隆表达CPAP家族的CPAP3类表皮蛋白BmCPAP3-G,对其进行原核表达和抗体制备,同时对该蛋白的表达特征进行分析。对该蛋白进行生物信息分析,表达其单个的和成对的结构域,进一步探索其结构域与几丁质结合的关系。1 材料与方法
试验于2014年9月至2016年4月在西南大学完成。1.1 材料与试剂
选取家蚕大造作为试验材料,由重庆市西南大学家蚕基因组生物学国家重点实验室家蚕基因资源库提供。幼虫在(25±1)℃、相对湿度60%、自然光照条件下用桑叶进行饲喂。试验材料为4龄第3天至上蔟第3天的表皮和丝腺(小蚕期为眠和起的材料,5龄后为隔天取材),材料于-80℃冰箱保存;取幼虫5龄第5天的头部、表皮、中肠、马氏管、脂肪体、生殖腺、前部丝腺、中部丝腺前区、中部丝腺中区、中部丝腺后区和后部丝腺,并用液氮迅速冷冻置于-80℃冰箱保存备用。宿主菌大肠杆菌Trans1 T1和Transetta (DE3)购自北京全式金公司;pMD19-T-simple vector克隆载体购自TaKaRa公司;pET28a表达载体为笔者实验室保存;Taq DNA聚合酶、限制性内切酶、T4 DNA连接酶、IPTG、Ampicilline、Kanamycin购自Promega公司;引物由上海生工生物工程技术服务有限公司合成;其他未标明试剂均为国产分析纯。
1.2 BmCPAP3-G的生物信息学分析
基于家蚕基因组数据库SilkDB(http://silkworm. swu.edu.cn/silkdb/)下载的BmCPAP3-G(注释基因编号BGIBMGA007677)的核苷酸和氨基酸序列,利用Primer Premier 5.0设计引物,通过SMART网站预测蛋白质的信号肽及结构域,BmCPAP3-G具有3个相同的结构域,在ExPASy网址上预测蛋白质的分子量和等电点。利用同源比对软件Clustalx和GeneDoc对这3个结构域进行同源比对,分别用domain_1、domain_2、domain_3、domain_1-2、domain_2-3表示BmCPAP3-G的第1个结构域、第2个结构域、第3个结构域、前两个结构域、后两个结构域。本研究中涉及到的引物包括家蚕持家基因Bmactin3、BmCPAP3-G及其各个结构域,引物序列详见表1。
Table1
表1
表1引物序列
Table1Primer sequences
 |
新窗口打开
1.3 BmCPAP3-G的克隆及BmCPAP3-G蛋白的原核表达及抗体制备
1.3.1 BmCPAP3-G的克隆 利用总RNA提取试剂盒(Omega公司产品),提取家蚕大造3龄第5天前部丝腺cDNA为模板,进行PCR扩增,反应条件:94℃预变性5 min;94℃变性40 s、58℃退火40 s、72℃延伸1 min,30个循环;72℃延伸10 min。扩增完成用1.2%琼脂糖凝胶电泳进行分离、按照Axygen公司的胶回收试剂盒方法回收目的片段,将片段连接到pMD19-T-simple载体上,转化入大肠杆菌Trans T1菌株,挑选单克隆,并进行菌液PCR检测、双酶切鉴定和测序验证。1.3.2 BmCPAP3-G蛋白的原核表达 将测序正确的质粒命名为BmCPAP3-G-pMD19-T-simple,将pET28a质粒载体与BmCPAP3-G-pMD19-T-simple重组质粒用Nde I和Xho I进行双酶切,将酶切产物进行切胶回收纯化,构建BmCPAP3-G-pET28a重组表达质粒,经菌液PCR、双酶切验证后,转入大肠杆菌Transetta (DE3)菌株,同时转化pET28a质粒。用终浓度为0.1 mmol·L-1的IPTG于37℃和16℃分别诱导表达4 h和20 h,收集诱导后的菌体,用结合缓冲液(50 mmol·L-1 Tris-HCl,150 mmol·L-1 NaCl,0.2% TritonX-100,pH 8.0)重悬,超声破碎,离心,分别收集菌体沉淀和上清,再用结合缓冲液重悬沉淀,用12% SDS-PAGE检测蛋白的表达情况。以蛋白表达量比较高且为可溶状态的表达条件进行大量诱导表达。利用镍柱亲和层析的方法对体外表达的重组蛋白进行纯化,分别用20、50、100、200、500、1 000 mmol·L-1咪唑梯度洗脱,SDS-PAGE检测纯化后的效果,取目的蛋白较纯的洗脱液进行透析,将缓冲液置换为PBS,分别用SDS-PAGE电泳和Bradford定量法检测蛋白质的纯度及浓度。
1.3.3 MALDI-TOF/TOF鉴定及多克隆抗体制备 从检测胶上挖取目的蛋白点,通过清洗、DTT及IAA处理,胰蛋白酶酶解成肽段后冷冻干燥,用ZipTipC18脱盐。上样检测前将肽段溶解在50%乙腈、0.1% TFA的溶液中,将样品与等体积的CHCA基质混匀,上机进行鉴定。
鉴定为目的蛋白后将纯化好的样品送至南京钟鼎生物技术有限公司制备多克隆抗体。
1.4 BmCPAP3-G的表达特征分析
1.4.1 半定量RT-PCR检测BmCPAP3-G的表达情况 提取家蚕5龄第5天各组织及4龄第3天到上蔟第3天的丝腺、表皮的总RNA,合成cDNA。以1.2设计的引物及反应条件进行PCR扩增。选择家蚕持家基因Bmactin3为内参基因,反应程序为94℃预变性5 min,94℃变性40 s,53℃退火35 s,72℃延伸40 s,共25个循环,最后72℃延伸10 min。对PCR扩增产物进行1.2%琼脂糖凝胶电泳,溴化乙锭染色观察。1.4.2 Western blot检测BmCPAP3-G蛋白的表达情况 提取家蚕5龄第5天各组织及4龄第3天到上蔟第3天的丝腺、表皮的总蛋白,利用Western blot检测BmCPAP3-G蛋白的表达情况。Western blot采用半干法转印,在电流1.3 A,电压25 V条件下转膜15 min;用含有5%脱脂奶粉的TBST(150 mmol·L-1 NaCl,20 mmol·L-1 Tris-HCl,pH 8.0,0.05% Tween 20)将膜封闭1 h;用制备好的BmCPAP3-G多克隆兔抗体按照1:20 000比例的稀释液孵育2 h,内参为α-tubulin抗体;TBST清洗膜后以HRP标记的羊抗兔IgG按照1:40 000稀释孵育2 h;再用TBST缓冲液清洗膜,最后用ECL显色液显色,置于CLINX化学曝光仪观察扫描显色结果。
1.5 BmCPAP3-G蛋白与几丁质结合方式
按照1.2中表达重组蛋白的方法原核表达BmCPAP3-G的domain_1、domain_2、domain_3、domain_1-2、domain_2-3蛋白,并进行纯化。用结合缓冲液(20 mmol·L-1 HEPES,15 mmol·L-1 NaCl,pH 7.4)平衡几丁质层析柱,将纯化好的蛋白与等体积的2×结合缓冲液(40 mmol·L-1 HEPES,30 mmol·L-1 NaCl,pH 7.4)混合后与几丁质进行室温中等速度孵育2 h,用10倍体积的漂洗缓冲液(40 mmol·L-1 HEPES,150 mmol·L-1 NaCl,pH 7.4)漂洗未结合的蛋白,收集漂洗液,加入2倍体积的8 mol·L-1尿素室温中等速度孵育1 h后收集洗脱液,配制12%的SDS-PAGE胶,电泳和Western blot检测各收集组分。2 结果
2.1 BmCPAP3-G的克隆、原核表达及抗体制备
通过对BmCPAP3-G进行生物学信息分析,发现该蛋白含有18个氨基酸组成的信号肽,位于第15号染色体上,含有3个相同的ChtBD2(SMART accession number:SM00494)结构域,对这3个结构域进行了同源性比对,发现其同源性比较高,特别是半胱氨酸和芳香族氨基酸(图1-A),对家蚕表皮中已经报道过的4个CPAP家族的表皮蛋白也进行了同源性比对,发现在不同的表皮蛋白中,半胱氨酸及芳香族氨基酸均比较保守(图1-B)。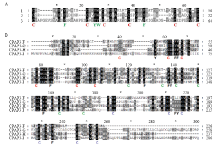 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1BmCPAP3-G结构域及CPAP3家族表皮蛋白的序列比对
A:BmCPAP3-G 3个结构域的同源性分析Sequence alignment of three BmCPAP3-G domains;B:CPAP家族表皮蛋白的同源性分析Sequence alignment of the CPAP family cuticle proteins
-->Fig.1Sequence alignment of three BmCPAP3-G domains and the CPAP family cuticle proteins
-->
利用设计的原核表达引物(表1),以家蚕幼虫5龄第5天的前部丝腺cDNA为模板进行PCR的扩增,构建原核表达载体pET28a- BmCPAP3-G进行原核表达。图2为在0.1 mmol·L-1 IPTG诱导作用下不同条件的表达情况,在16℃诱导培养20 h和37℃诱导培养4 h下转入pET28a-BmCPAP3-G重组载体的菌株在30 kD附近表达有特异条带,与目的蛋白预测的分子量大小一致,说明BmCPAP3-G重组蛋白获得了表达,且为可溶性表达,在16℃条件下蛋白表达量较高。
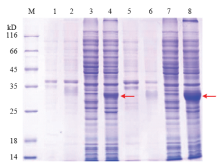 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2重组蛋白的电泳检测
M:标准蛋白Protein molecular weight standard;1:37℃,4 h条件下诱导pET28a的沉淀检测Precipitation of pET28a induced under 37℃, 4 h;2:37℃,4 h条件下诱导pET28a-BmCPAP3-G的沉淀检测Precipitation of pET28a-BmCPAP3-G induced under 37℃, 4 h;3:37℃,4 h条件下诱导pET28a的上清检测Supernatant of pET28a induced under 37℃, 4 h;4:37℃,4 h条件下诱导pET28a-BmCPAP3-G的上清检测Supernatant of pET28a-BmCPAP3-G induced under 37℃, 4 h;5:16℃,20 h条件下诱导pET28a的沉淀检测Precipitation of pET28a induced under 16℃, 20 h;6:16℃,20 h条件下诱导pET28a-BmCPAP3-G的沉淀检测Precipitation of pET28a-BmCPAP3-G induced under 16℃, 20 h;7:16℃,20 h条件下诱导pET28a的上清检测Supernatant of pET28a induced under 16℃, 20 h;8:16℃,20 h条件下诱导pET28a-BmCPAP3-G的上清检测Supernatant of pET28a-BmCPAP3-G induced under 16℃, 20 h
-->Fig. 2SDS-PAGE analysis of recombinant proteins
-->
随后,利用该条件大量地诱导表达重组蛋白,并进行镍柱亲和层析,通过20、50、100、200、500、1 000 mmol·L-1咪唑浓度梯度进行洗脱,发现BmCPAP3-G重组蛋白在200和500 mmol·L-1咪唑浓度下被大量洗脱下来(图3-A)。镍亲和层析柱纯化后的重组蛋白经过SDS-PAGE胶检测后条带比较单一,因此,通过透析将缓冲液置换为PBS缓冲液后,进行SDS-PAGE 检测,发现溶液置换后的目的蛋白条带仍然是单一的(图3-B)。
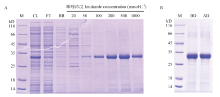 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3BmCPAP3-G重组蛋白的纯化
A:BmCPAP3-G重组蛋白的镍柱亲和层析Purification of BmCPAP3-G recombinant protein by Ni affinity chromatography;B:BmCPAP3-G重组蛋白透析结果The result of dialyzed BmCPAP3-G recombinant protein。M:标准蛋白Protein molecular weight standard;CL:16℃,20 h条件下诱导pET28a-BmCPAP3-G的上清蛋白Supernatant of pET28a-BmCPAP3-G induced under 16℃, 20 h;FT:流穿液Flow-through;BB:结合缓冲液Binding buffer;BD:透析前Before dialyzed;AD:透析后After dialyzed
-->Fig. 3Purification of BmCPAP3-G recombinant protein
-->
挖取透析后BmCPAP3-G重组蛋白的电泳检测条带,利用5800 MALDI-TOF/TOF进行质谱鉴定。通过搜库比对后发现挖取的胶块在SilkDB数据库中与BGIBMGA007677相匹配,而BGIBMGA007677即为DONG等[11]报道的BmCPAP3-G在家蚕数据库的基因编号,表明表达的重组蛋白确实是家蚕表皮蛋白BmCPAP3-G。表2为质谱鉴定到的特异肽段。用纯化的重组蛋白BmCPAP3-G免疫新西兰兔制备多克隆抗体。最终制备了效价较高的多克隆抗体,可用于后续的试验。
Table 2
表2
表2BmCPAP3-G重组蛋白质谱鉴定的特异肽段
Table 2The unique peptides of the BmCPAP3-G recombinant protein
| 序列 Sequence | 名称 Name | 登录号 Accession |
|---|---|---|
| TQLEPPISTPHCSR | gasp precursor [Bombyx mori] | BGIBMGA007677 |
| YQCSPGLAYDR | gasp precursor [Bombyx mori] | BGIBMGA007677 |
| YYICLEGVAR | gasp precursor [Bombyx mori] | BGIBMGA007677 |
新窗口打开
2.2 BmCPAP3-G的表达特征分析
2.2.1 BmCPAP3-G表达特征 以家蚕幼虫5龄第5天的各组织cDNA为模板,用设计的表达谱引物进行PCR扩增,然后电泳检测BmCPAP3-G的表达情况。结果显示BmCPAP3-G在头、表皮、生殖腺中高量表达,在中肠、脂肪体和丝腺中有少量表达(图4-A、4-B)。以家蚕4龄眠期到上蔟时期的丝腺和表皮cDNA为模板进行表达谱分析,结果显示BmCPAP3-G在丝腺的眠期和起蚕期的表达量比较高,其余时期均较低(图4-C),BmCPAP3-G在表皮中随着时间的增长表达量越来越低。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4BmCPAP3-G的表达谱分析
A:BmCPAP3-G的组织表达情况Tissue expression profile of BmCPAP3-G。He:头Head;Cu:表皮Cuticle;Mg:中肠Midgut;Fb:脂肪体Fat body;Go:生殖腺Gonad。B:BmCPAP3-G在不同区段丝腺的表达情况Expression profile of BmCPAP3-G in different sections of silk gland。ASG:前部丝腺Anterior silk gland;A-MSG:中部丝腺的前区Anterior sub-compartment of middle silk gland;M-MSG:中部丝腺的中区Middle sub-compartment of middle silk gland;P-MSG:中部丝腺的后区Posterior sub-compartment of middle silk gland;PSG:后部丝腺Posterior silk gland。C:BmCPAP3-G在不同时期丝腺的表达情况Expression profile of BmCPAP3-G in the silk gland at different stages。D:BmCPAP3-G在不同时期表皮的表达情况Expression profile of BmCPAP3-G in the cuticle at different stages。IV-M:4龄眠期The 4th moulting stage;V-1:5龄第1天Day 1 of the 5th instar;V-5:5龄第5天Day 5 of the 5th instar;V-7:5龄第7天Day 7 of the 5th instar;W-1:上簇第1天Day 1 of wandering;W-2:上簇第2天Day 2 of wandering;W-3:上簇第3天Day 3 of wandering
-->Fig. 4Expression pattern of BmCPAP3-G
-->
2.2.2 BmCPAP3-G蛋白的检测 为了进一步验证BmCPAP3-G蛋白的表达情况,同样选取了头、表皮、中肠、丝腺等组织及从4龄第3天到上蔟期的表皮和丝腺,用BmCPAP3-G的多克隆抗体进行了Western blot检测,结果显示5龄第5天时,BmCPAP3-G在头和表皮中有高量表达,在丝腺中的表达量很低;从不同时期的丝腺来看BmCPAP3-G在4龄眠期表达量最高,其余时期表达量均比较低,从不同时期的表皮来看,该蛋白随着表皮的发育表达量越来越低,这与之前的转录水平结果是一致的(图5)。
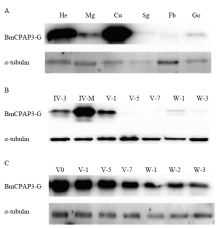 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5BmCPAP3-G蛋白的检测
A:BmCPAP3-G的组织表达情况Western blot analysis of BmCPAP3-G in different tissues。Sg:丝腺Silk gland。B:BmCPAP3-G在不同时期丝腺的表达情况Western blot analysis of BmCPAP3-G in the silk gland at different stages。C:BmCPAP3-G在不同时期表皮的表达情况Western blot analysis of BmCPAP3-G in the cuticle at different stages。IV-3:4龄第3天Day 3 of 4th instar larvae;V-0:5龄起蚕Day 0 of 5th instar larvae
-->Fig. 5Detection of the BmCPAP3-G protein
-->
2.3 BmCPAP3-G蛋白与几丁质结合方式
通过原核表达获得了具有活性的BmCPAP3-G蛋白,通过几丁质亲和层析技术,发现该蛋白能够与几丁质进行结合(图6)。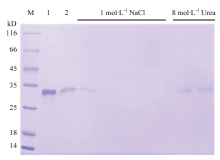 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6重组蛋白BmCPAP3-G的几丁质结合验证
M:标准蛋白Protein molecular weight standard;1:BmCPAP3-G蛋白The protein of BmCPAP3-G;2:流穿液Flow-through
-->Fig. 6Chitin binding assays of the recombinant protein BmCPAP3-G
-->
为了探索BmCPAP3-G与几丁质的结合方式,对其结构域进行了原核表达及纯化,从而探索结构域对于几丁质的结合的影响。分别设计了domain_1、domain_2、domain_3、domain_1-2、domain_2-3的原核表达引物,以家蚕幼虫5龄第5天的前部丝腺cDNA为模板进行BmCPAP3-G各结构域的PCR扩增和原核表达,获得了在上清中表达的domain_3、domain_1-2、domain_2-3,并进行了纯化,domain_1、domain_2没有表达成功(图7)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7各个结构域重组蛋白原核表达纯化
A:各个结构域的重组蛋白检测SDS-PAGE of recombinant protein domains;B:结构域3重组蛋白的纯化Purification of the recombinant domain_3;C:结构域1-2的重组蛋白纯化Purification of the recombinant domain_1-2;D:结构域2-3的重组蛋白纯化Purification of the recombinant domain_2-3。M:标准蛋白Protein molecular weight standard;C:对照Control;D:结构域Domain;FT:流穿液Flow-through;BB:结合缓冲液Binding buffer
-->Fig. 7The expression and purification of recombinant protein domains
-->
通过原核表达的方法表达出了有活性的domain_3、domain_1-2、domain_2-3,将这些重组蛋白分别与几丁质进行孵育,探索其单个的结构域是否能够与几丁质进行结合,从而对CPAP家族的表达蛋白与几丁质结合的方式进行探索。如图8所示,单个的结构域3也可以与几丁质进行结合,但是结合能力较弱,用考马斯亮蓝染色的方法检测均无法看出,通过Western blot的方法可看到洗脱液中有条带,而两个结构域串联的重组蛋白domain_1-2、domain_2 -3均能够与几丁质进行结合,并且其结合能力较domain_3强。
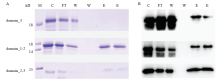 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8结构域重组蛋白的几丁质结合
A:考马斯亮蓝染色检测结构域的几丁质结合能力Chitin binding assays of the domain by coomassie blue staining;B:Western blot检测结构域的几丁质结合能力Chitin binding assays of the domain by Western blot。M:标准蛋白Protein molecular weight standard;C:BmCPAP3-G的结构域The domain of BmCPAP3-G;FT:流穿液Flow-through;W:洗涤缓冲液Wash buffer;E:洗脱缓冲液Eluant buffer
-->Fig.8Binding assays of the recombinant protein of domains
-->
3 讨论
表皮蛋白是昆虫体内庞大的一类蛋白家族,在家蚕中亦是如此,并且其中将近一半的表皮蛋白能够与几丁质进行结合。在这些表皮蛋白中,最大的一类为CPR家族,CPR家族的表皮蛋白分布最广、数量也最多,由REBERS等最先发现其保守序列并命名的[20];其次是CPAP家族,该类家族是在家蚕表皮中排行第二的表皮蛋白家族,但是关于CPAP家族的表皮蛋白的研究很少。BmCPAP3-G是在家蚕表皮中报道的一个能够与几丁质结合的表皮蛋白,本研究发现该蛋白不仅在表皮中存在,在丝腺中也存在,从其时期表达结果来看,BmCPAP3-G在眠期和起蚕期表达量最高,在食桑期的表达量迅速消失。而在前期有研究者对丝腺中特异表达的R&R-2结构域的表皮蛋白进行了时期表达谱检测,发现在5龄期的各个时间点表达量均很高,推测该蛋白能够保护丝腺细胞,防止剪切力及外力对丝腺细胞进行破坏[29],因此,推测CPAP家族的表皮蛋白与CPR家族的表皮蛋白在丝腺中发挥的功能不一致,CPAP家族的表皮蛋白可能并不像R&R结构域的表皮蛋白那样构成几丁质层,而只是参与几丁质层在眠期降解再形成的过程。目前已经报道的能够与几丁质结合的有CPR家族、CPAP家族、CPT家族及Chitin_bind 3结构域的表皮蛋白家族[4,11,29-31]。那么,它们是如何与几丁质进行结合的呢?有报道R&R-2结构域的表皮蛋白与几丁质结合过程中芳香族氨基酸起到了至关重要的作用[32]。笔者通过生物信息学分析发现CPAP家族的3个ChtBD2结构域中保守的氨基酸也是芳香族氨基酸,暗示了芳香族氨基酸确实在与几丁质结合过程中起到了关键的作用。下一步可以对其单个结构域中的芳香族氨基酸进行突变,看是否还能够与几丁质进行结合,进而探究其与几丁质是如何结合的。
为了检测拥有3个几丁质结合结构域对于BmCPAP3-G蛋白的意义,分别对其结构域进行原核表达,表达出了有活性的domain_3、domain_1-2和domain_2-3重组蛋白,并将原核表达的结构域进行几丁质亲和层析验证,发现其均能够与几丁质进行结合,并且结合几丁质的能力有差异。单个的结构域就可以与几丁质进行结合,两个结构域比单个结构域结合几丁质的结合能力要强。
4 结论
BmCPAP3-G具有信号肽,分子量为27 kD,等电点为4.82,由3个相同的ChtBD2结构域组成。通过表达有活性的重组蛋白BmCPAP3-G并制备其多克隆抗体,发现该蛋白在眠期和起蚕期表达量高,推测其在丝腺内膜的更新过程中发挥着重要作用。对其结构域进行原核表达,获得了重组蛋白domain_3、domain_1-2和domain_2-3,发现BmCPAP3-G与几丁质的结合由单个的结构域即可完成,结构域的串联能够增强其结合能力。The authors have declared that no competing interests exist.
