0 引言
【研究意义】蚕丝业起源于中国,5 000多年来为中华民族文化、经济和社会发展作出了重大贡献[1]。目前,在中国各大蚕区,蚕桑生产仍是千万农户重要的经济来源。据最近统计数据显示,中国的蚕茧产值与丝绸工业产值分别约为200亿元和2 000亿元[2]。但是,每年因蚕病暴发造成的损失占蚕业生产总收入的20%左右,其中因感染家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)引发的家蚕核型多角体病,又称脓病或血液型脓病,造成的损失占其中的60%以上。因此,在经典遗传学研究的基础上进一步解析家蚕对BmNPV抗性的遗传基础,开发其紧密连锁标记,定位克隆抗性基因,可以为通过分子标记辅助育种及转基因等技术培育高抗家蚕品系提供理论依据[3],并将为从根本上解决BmNPV对蚕业的损害打下基础。【前人研究进展】在经典遗传学的指导下,育种专家们筛选并培育了一些较强抗性的家蚕品系,如NB(N11)[4-5]、CVDAR(CDR)[6]、华康1号(871C×872C)[7-8]、华康2号(秋丰N×白玉N)[8-9]等。基于对这些抗性材料不同组配方式后代的抗性鉴定和经典遗传分析,研究人员对抗性的遗传规律做了大量研究,并得出抗性遗传的基本规律:家蚕对BmNPV的抗性受常染色体上一对显性主基因和性染色体上微效修饰基因控制,有杂种优势和偏父遗传效应,属于质量-数量性状[4,10-13]。YAO等以高抗材料NB和高敏感材料306为双亲利用RAPD技术筛选并验证,分别得到了与抗性基因连锁的分子标记OPA-18700[14]和OPF-072023(AY380833)[15];赵远[16]于2007年用同样的双亲材料的回交群体在第3、第25号染色体上筛选到8个与抗NPV基因连锁的分子标记并进行了定位。之后吕鹏[17]在2014年用同样的材料,采用简化基因组测序(SLAF-seq)和群体分离分析(BSA)相结合的方法发现了4个与抗性性状紧密连锁的标记,并将抗性基因初步定位在家蚕第23号染色体一段0.67 Mb的区域,对此区域的候选基因进行表达与测序分析,最终推测两个酯酶基因可能涉及家蚕对NPV的抗性。【本研究切入点】尽管这些结果极大地推动了BmNPV抗性的连锁定位研究,并丰富了对家蚕抗性的遗传基础的认识,但目前为止,研究人员仍然没有能够定位并克隆出控制家蚕BmNPV抗性的主基因。【拟解决的关键问题】以高抗BmNPV家蚕品系99R为抗性亲本组配连锁及定位分析群体材料,通过分子连锁分析试验,并结合已有的研究报道分析探讨,以期进一步认识家蚕对BmNPV的抗性遗传基础,为最终定位抗性基因打下基础。1 材料与方法
1.1 材料与组配方式
家蚕抗BmNPV品系:99R,以抗性基础材料CVDAR通过杂交选育建立[18],由广西蚕业科学技术研究院提供;871C,经抗病主基因载体品系湘M与受体亲本871杂交培育而成[19-20],来自中国农业科学院蚕业研究所。感性品系:871B、Dazao-N和N4,其中871B为实用种亲本,后二者为试验用基础品系,均由西南大学家蚕基因库提供。根据家蚕雌完全连锁特性,用99R与Dazao-N,871C与N4分别组配F1及BC1回交群体,所用的连锁群体(BC1F)组配方式分别为:(Dazao-N×99R)F1♀×Dazao-N♂,(871C×N4)F1♀×N4♂,用以进行99R和871C抗性的连锁分析。
1.2 病原复苏与纯化
接种BmNPV病原于871B的5龄起蚕,待蚕发病后,割破尾足取脓汁,或收集病蚕尸体并将其裂解过滤取上清,室温放置3—4 d后经差速离心提纯,血球计数器计数后将原液保存于4℃冰箱备用。1.3 攻毒方法与取材
首先对99R和Dazao-N进行浓度梯度添毒,病毒浓度梯度为5×109、1×109、1×108、1×107、1×106个多角体/mL,其中每个品系各浓度梯度设定3个重复,每个重复区取30头4龄起蚕,逐头置于24孔的二重皿中,并于26℃、12 h光照12 h黑暗环境饲养。99R用5×109、1×109、1×108、1×107个多角体/mL 4种浓度添毒;Dazao-N用1×109、1×108、1×107、1×106个多角体/mL 4种浓度添毒。具体方法:用移液器取5×109个多角体/mL的病毒液800 μL,其余浓度各400 μL的病毒液均匀涂抹于直径为9.5 cm的桑叶叶片上,待稍晾干后用打孔器打成直径为1.5 cm的小叶片,单头喂食家蚕,待其完全吃完(未吃完的蚕淘汰),尽量保证99R品系每头蚕最终食入的病毒剂量分别约为1×108、1×107、1×106和1×105个多角体,Dazao-N品系每头蚕最终食入的病毒剂量分别约为1×107、1×106、1×105和1×104个多角体。12 h后再喂食正常桑叶。4—8 d后调查统计因感染BmNPV死亡头数,用SPSS 17.0 probit模块(概率单位回归)计算两品系对BmNPV的半致死剂量(LD50)。对99R和871C的BC1F个体均用同样的方法按每头蚕2×106个多角体(2×108个多角体/mL)攻毒,发病后逐头收集病蚕,并置于-80℃冷冻保存。
1.4 SSR、PCR标记的来源
根据MIAO等[21]在2005年公布的家蚕SSR标记图谱信息(除1号即Z染色体外),在华大基因公司合成标记引物;没有找到多态标记的连锁群,利用本研究小组已经设计的PCR标记引物或用SSR Hunter在这些染色体的随机区域搜索SSR位点,用Primer 5设计针对其侧翼序列的引物并由华大基因公司合成。1.5 DNA提取及多态性标记的PCR检测
99R和Dazao-N及其F1代的基因组DNA参照陈冬妹等[22]的方法进行提取,之后用前述SSR、PCR标记引物进行PCR扩增。SSR-PCR反应体系和反应程序设置参照文献[23]进行。扩增产物用3%聚丙烯酰胺PAGE凝胶电泳结合银染方法进行分型;普通PCR反应体系:10×缓冲液1.5 μL,25 mmol·L-1 MgCl2 1.2 μL,2.5 mmol·μL-1 dNTPs 1.2 μL,10 pmol·μL-1 Fprimer 0.6 μL,10 pmol·μL-1 Rprimer 0.6 μL,5 U·μL-1 Taq DNA聚合酶0.12 μL,10 ng·μL-1 DNA模板1 μL,加入ddH2O 至终体积15 μL。反应条件为94℃ 4 min;94℃ 40 s,55—57℃(根据不同引物调整)40 s,72℃ 30—90 s(根据不同引物调整),32个循环;72℃ 10 min。普通PCR产物在1.5%琼脂糖凝胶上点样4 μL,电泳,EB染色后,用Bio-Rad电泳凝胶成像系统分析条带。筛选出在两个亲本间有明显多态性的标记引物。1.6 99R品系对BmNPV抗性的连锁分析
对(Dazao-N×99R)F1♀×Dazao-N♂,即BC1F群体,先后于2014年10月和2015年5月在实验室进行攻毒试验,攻毒方法及剂量见1.3,4—8 d后,通过表型观察辅以显微镜检,选择发病表型典型并能检测到多角体富集的个体作为连锁分析材料。逐头提取基因组DNA,利用所筛选出的多态性标记引物进行PCR扩增,对扩增产物用3%聚丙烯酰胺PAGE凝胶电泳或2%琼脂糖凝胶电泳显色拍照,统计各个标记引物在每一个体DNA中的扩增带型;杂合型(两条带,F1带型)记为“1”,纯合型(一条带,Dazao-N带型)记为“2”,未扩增出带记为“0”。统计结果进行T检验(**为P<0.01),并用P值相对应的负对数(-lgP)表示各个连锁群的连锁情况,以各连锁群号为横坐标,- lgP为纵坐标作图,显示抗性连锁群。1.7 标记AY380833的连锁验证
调出GenBank中已公开的与BmNPV抗性基因连锁的SCAR序列(AY380833),合成一对特异性引物:F(5′-ATTCTGAGGGCGGACAAG-3′),R(5′-AATTGACGGGAAGTTTAGTGAG-3′),逐个提取两个BC1F群体即(Dazao-N×99R)F1♀×Dazao-N♂和(871C×N4)F1♀×N4♂中攻毒后发病个体的基因组DNA,分别进行连锁检测。2 结果
2.1 两亲本对BmNPV的抗性性能鉴定
为了确定对BC1分离群体的攻毒浓度,首先对抗性亲本99R和感性亲本Dazao-N的抗性性能进行鉴定(表1、表2)。LD50(99R)=2.92×106个多角体/头,LD50(Dazao-N)=9.78×105个多角体/头。基于此LD50数据,结合冢本1963年提出的家蚕对BmNPV抗性的坪区理论以及孟智启[12]验证的家蚕对BmNPV抗性具有杂种优势的特点,选择介于两亲本半致死剂量之间且略高于其均值的攻毒浓度——2×106个多角体/头 (2×108个多角体/mL)作为BC1分离群体的攻毒剂量,这样尽可能使连锁分析材料中所取的发病个体均为敏感性个体。Table 1
表1
表1两个亲本品系因感染BmNPV累计死亡头数
Table 1The number of cumulative mortality infected by BmNPV in two parental B. mori strains
| 品系 Strain | 添食剂量 Adding dose(个多角体/头) | 供试头数 Number of test | 因BmNPV感染死亡头数 Number of dead for BmNPV |
|---|---|---|---|
| 99R | 1×108 | 90 | 75 |
| 1×107 | 90 | 54 | |
| 1×106 | 90 | 33 | |
| 1×105 | 90 | 20 | |
| Dazao-N | 1×107 | 74 | 58 |
| 1×106 | 97 | 50 | |
| 1×105 | 87 | 17 | |
| 1×104 | 84 | 6 | |
| PBS | 50* | 0 |
新窗口打开
Table 2
表2
表2两个亲本品系感染BmNPV毒力测定
Table 2Toxicity measurement of two parental B. mori strains after BmNPV infection
| 品系 Strain | 回归方程 Equation of linear regression (y=) | 半致死剂量 LD50 | 95%置信限 95% Confidence limit | 回归方程χ2 Regression equation χ2 |
|---|---|---|---|---|
| 99R | 0.577x-3.731 | 2.92×106 | 6.217-6.713 | 1.030 |
| Dazao-N | 0.778x-4.659 | 9.78×105 | 5.793-6.213 | 0.547 |
新窗口打开
2.2 多态性标记筛选
对已公布的家蚕SSR标记图谱中的标记引物[21]以及自行设计的PCR标记引物,在抗性亲本99R和感性亲本Dazao-N的基因组DNA中进行PCR扩增,最终得到覆盖家蚕所有常染色体的多态性标记,其引物信息如表3所示。Table 3
表3
表3各常染色体上用于连锁分析的多态性标记的引物序列信息
Table 3The primer sequence information of polymorphism markers used for linkage analysis on autosomals
| 引物名称 Primer name | 染色体号Chromosome | 上游引物 Forward primer (5′-3′) | 下游引物 Reverse primer (5′-3′) | 产物长度 Product length (bp) |
|---|---|---|---|---|
| NS0223 | 2 | TGTTGGATGAGCAATAGTAGGC | ATGCGAAGGATGGTCAGATT | 581 |
| 03-12M | 3 | CATTGAAATCACCGTTAGCG | AAGTAACACAAATAGGTGCTACTGA | 247 |
| 04-15M | 4 | CGTTATCGTCGTCTGTTCTTCTA | CTGCTGTTGAAGGTCGCTATT | 1064 |
| S0504 | 5 | AGGACTTAGAAGCTACGATGGAATA | CCTGCCTGTTATCTGTTTTGAATG | 203 |
| S0608 | 6 | CCGTCCGTTTTCGTGCG | AACCTCAATTTAATGTATCGCACTGT | 199 |
| 07-6M | 7 | ATCATTTTGGAGTTGGGAGA | TTGTATTCATTGGAGTATTTGGA | 207 |
| S0820 | 8 | GAGGTACCAGTGATTGCAGACGT | CCCAGGTGTACTCGGAGTCATTTA | 290 |
| S0903 | 9 | CAGGAACAGGGATGTGGACTTG | TTGCTATCGGAGCTCTGGGA | 252 |
| 10-13M | 10 | TAGCTACAGTACGTAGTGAACTTCA | TGAGCCGCAATGGTGTT | 241 |
| S1125 | 11 | CAGAATCAAATACGTGCCTCAGTT | GGAGGAGCGTTTGCGTGTTA | 200 |
| S1215 | 12 | GCACTTTATCTCCTCAGCTACCG | TTGGAATAGAGTGGCACGGTTT | 211 |
| NS1316 | 13 | GATAACCATTCACCACCTACCG | GGACAAACGAGTTCAGGGACA | 809 |
| S1404 | 14 | CCATTTGCCGCACTTCCATC | TGCGTGTTAGTTACCTTGTGCG | 125 |
| 15-11.37M | 15 | ACAGACAGCGTGCTATTGATT | AGTGCCACCTTGGTATTTGA | 219 |
| S1604 | 16 | ACAGCATCCAGGTCCGTTCC | GCCGAGTAAAGTATTTGCGTCAT | 217 |
| 17-17M | 17 | ATCCTAAAGTCCCAAAGAAATG | CGTATGACCCTTGTAACAGAAC | 1101 |
| S1807 | 18 | TTTATTTGTTAGGCTCGTTACTGTCA | CAAAAGCACAGCTACTTCCGC | 111 |
| 19-8M | 19 | CAGCCGTTCCATCCTTTA | CGTTTAGTTGCAGCACCTATT | 202 |
| S2005 | 20 | GCCGCAAAACAATCAAGTGG | CGTATTTTAGTGTATGACTCGGATGA | 256 |
| S2117 | 21 | TCACAACGGAATAGTTCACGAGG | TCTCGGACGTCACAGTAACTCG | 128 |
| S2205 | 22 | ATTGTAGGGTTTATACTGGCATTGTT | TGGTAACTAAAACATAATTTGGCATCA | 216 |
| S2209 | 22 | AGCGAGTTGTGATTTCTACTTGGA | GCTTACCATTGGGGTTTGACAT | 278 |
| 3233 | 23 | CACATTGTTGCCACTTTGATTAC | CGTATCTATTTCTGCCACCACTA | 1384 |
| S2431 | 24 | TGAGCTCTGAAAACCGACCCT | AGCATGTTAATGTCATTAGCGACTC | 284 |
| S2523 | 25 | GAGAAGATCACGGTATTCATTTAACTG | AGCAATGGCGAGCGGTG | 227 |
| S2612 | 26 | CAAACCTTGAACTCTGCGACTGA | CGCCCGTTTAGATAAAGCTGTACA | 315 |
| 27-14M | 27 | GGTTGATTATGATGACCGACTT | ACAGCCGCATTAGTGAACG | 1206 |
| S2711 | 28 | AAAATGGGAAAGTGCGTGTCA | GCAACATCAATCCAACCAACCC | 115 |
新窗口打开
2.3 99R抗性的连锁分析
用经攻毒后确认的连锁分析群体中的发病感性个体,对表3所列27个连锁群的多态性标记进行连锁分析,图1-a中实线表示2014年9月(共44个个体)连锁检测结果,其中第11号连锁群(Chr11)上的多态性标记S1125和第22号连锁群(Chr22)上的多态性标记S2205均与抗性存在显著的连锁关系(P(S1125)=0.002772(P<0.01),P(S2205)=7.74E-05(P<0.01)),但Chr11的带型与理论相反,不予考虑,最终确定Chr22上的多态性标记S2205与抗性连锁。为了验证本次试验的连锁结果,于2015年5月重新攻毒取材(共24个个体),并进行连锁分析,结果如图1-a的虚线,表现出不存在与抗性连锁的标记,标记S2205的两次连锁分析带型结果分别如图1-b、1-c。这些结果表明99R的抗性连锁分析结果并不能在验证性试验中得到重复,即连锁分析的结果不具有重复性,因而不能进行下一步的定位试验。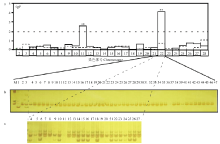 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1两次连锁分析结果a:T检验显示每个染色体的抗性连锁分析显著性水平(**:P<0.01),实线和虚线分别为第一次、第二次连锁分析结果 T test showed the significance level of resistance linkage analysis on each chromosome, (**:P<0.01), twice linkage analysis results were shown as a solid line and dotted line, respectively;b:Chr22上S2205的第一次连锁扩增结果(M:Marker,1—3:多态带型,其中1为99R带型,2为Dazao-N带型,3为F1带型,4—47为44个连锁个体的连锁带型 First linkage analysis amplification result of S2205, a polymorphism marker on Chromosome 22. (M: Marker, 1-3: Polymorphic bands, 1: 99R band, 2: Dazao-N band, 3: F1 band, 4-47: Linkage analysis band of 44 linkage individuals);c:S2205的第二次连锁扩增结果(4—27:24个连锁个体的扩增带型Second linkage analysis amplification result of S2205 (4-27: Linkage analysis band of 24 linkage individuals)
-->Fig. 1Linkage analysis results in two repeated experiments
-->
2.4 AY380833标记的连锁验证
AY380833是GenBank中已公布的与家蚕对BmNPV抗性紧密连锁的分子标记,其在基因组上的具体位置不明[15]。本研究中,筛选到了覆盖家蚕所有常染色体的多态性标记,如果能通过标记分型找到与标记AY380833连锁的多态性标记,那么此多态性标记所在的染色体即为标记AY380833所在的染色体,进一步在该染色体上加密标记可快速定位抗性区域。为此,首先调查了标记AY380833与99R抗性的连锁情况。基于此标记的序列信息,设计并合成一对特异性引物,用2014年9月所取的99R连锁分析材料中的31个个体对其进行连锁验证分析,图2-a表示所选的代表性的21个个体的连锁检测带型结果,显示其与99R的抗性之间不连锁。另外,有研究表明AY380833在871C中也与其抗性连锁[20]。笔者利用保存在西南大学家蚕基因库、来源于中国农业科学院蚕业研究所的BmNPV抗性品系871C,与另一个感性品系N4配制了连锁群体,经测定,LD50(871C)=2.52×107个多角体/头,LD50(N4)=5.25×105个多角体/头,通过分析确定了用2×106个多角体/头的攻毒剂量对其进行攻毒取材(共40个感病个体),分析AY380833与871C抗性的连锁关系,代表性的21个个体的连锁检测带型结果如图2-b,表明其与871C的抗性不连锁。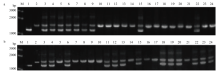 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2标记AY380833的连锁验证a:抗性亲本99R的回交后代连锁分析扩增结果(M:Marker,1—3:多态带型,其中1为99R带型,2为Dazao-N带型,3为F1(Dazao-N × 99R)带型,4—24:BC1F(Dazao-N × 99R)×Dazao-N 21个连锁个体的扩增带型) The linkage analysis amplification result of the backcross population of resistant parent 99R (M: Marker, 1-3: Polymorphic bands, 1: 99R band, 2: Dazao-N band, 3: F1(Dazao-N × 99R) band, 4-24: Linkage analysis band of 21 BC1F(Dazao-N × 99R)×Dazao-N linkage individuals);b:抗性亲本871C的回交后代连锁分析扩增结果(M:Marker,1—3:多态带型,其中1为871C,2为N4,3为F1(871C × N4),4—24:BC1F(871C × N4) × N4 21个连锁个体的扩增带型) The linkage analysis amplification result of the backcross population of resistant parent 871C (M: Marker, 1-3: Polymorphic bands, 1: 871C band, 2: N4 band, 3: F1(871C × N4)band, 4-24: Linkage analysis band of 21 BC1F(871C × N4) × N4 linkage individuals)
-->Fig. 2Verification of linkage analysis using marker AY380833
-->
3 讨论
本研究以家蚕抗性品系(99R和871C)和感性品系(Dazao-N和N4)为亲本,组配了连锁分析分离群体(回交群体BC1F)和定位分析分离群体(回交群体BC1M),对家蚕对BmNPV的抗性进行了连锁分析。在完成回交群体配制的基础上,通过对其进行攻毒试验,选取感病个体用于后续对抗性性状的遗传学分析,规避了可能的“假阳性”抗性个体的干扰。1963年,冢本提出了家蚕对BmNPV抗性受一对显性基因控制的“坪区”理论,该理论表明,用处于双亲半致死浓度之间“坪区”内的攻毒剂量处理分离群体时,可以有效区分群体中的抗性个体和感性个体[12]。赵远[16]在对其用于抗性遗传连锁分析的分离群体进行攻毒试验时,选择了1.86×108和1.86×106个多角体/mL这两个病毒浓度,来选取分离群体中的抗性个体和感性个体。尽管其并未指明这两个浓度与其双亲的半致死浓度之间的关系,但其调查结果表明这两个浓度均介于双亲半致死浓度之间。故依据上述的坪区理论,加之抗性的杂种优势,笔者选择了2×106个多角体/头(即2×108 NPV/mL)这一介于99R和Dazao-N双亲半致死剂量之间且略高于均值的浓度作为分离群体攻毒浓度,以确保取材的准确性。通过这种方法,对99R和Dazao-N为亲本所配制的连锁分析群体材料进行了两次连锁分析(图1),结果差别较大,第一次的分析在Chr22上找到了一个与抗性连锁的多态性标记(S2205),但在第二次的分析中并没有重复得到这一结果,也没有找到其他的连锁关系。2007年,赵远[16]利用BmNPV抗性亲本NB和感性亲本306,组配了连锁分析和定位分析的材料,对抗性进行了连锁定位分析,得到8个与抗性连锁的标记,位于家蚕第3和第25号染色体上;2014年,吕鹏[17]用同样的亲本和分离群体组配方式,也对抗性进行了连锁定位分析,但其最后定位得到与抗性连锁的区段位于第23号染色体。结合本研究结果,笔者发现,截止目前关于家蚕BmNPV抗性的连锁定位分析,其结果不可重复性是一个普遍的问题。那么这是否意味着现有的连锁及定位分析结果是不准确的呢?也不如此。吕鹏[17]对其在23号染色体定位区域内的部分候选基因进行了分析,尤其是其对定位区域内的两个羧酸脂酶基因进行了克隆,发现了双亲之间的序列差异,作者推断其功能可能与家蚕对BmNPV的抗性有关。这表明在现有连锁及定位分析得到的染色体或区域中,的确可能包含与BmNPV抗性相关的基因。总结发现,目前在NB与306这对亲本为材料的研究中,共检测到3条染色体或其区域存在对BmNPV抗性的连锁关系。结合本文试验结果,在99R品系中,至少也应有一条染色体存在与其抗性的连锁关系。进一步说明,家蚕对BmNPV的抗性,不同品系其抗性遗传基础具有很大的差异性,而同一品系可能具有多个控制抗性的位点。因此,笔者推测造成家蚕对BmNPV抗性的连锁定位分析结果不可重复或不一致的原因,可能与家蚕对BmNPV抗性的遗传基础较为复杂有关。
刘晓勇等[15]利用RAPD技术在NB和306中筛选得到了一个与家蚕BmNPV抗性紧密连锁的分子标记OPF-072023(AY380833),其在后续的研究及育种中都被证明与NB抗性紧密连锁。本研究为了验证此标记是否与99R的抗性性状相连锁,对其用99R与Dazao-N的BC1F连锁个体进行分析,结果表明该标记与99R的抗性并不连锁。曹锦如等[24]在2008年用标记AY380833辅助抗性品系选育,发现在多品系检测中该标记并非与抗性完全相关,与本研究结果相似。对这一结果较合理的解释是不同抗性品系其控制抗性的遗传基础不同,所以NB中与抗性连锁的位点(AY380833)在99R或其他抗性品系中并不与抗性连锁。考虑到钱荷英等[20]在2013年检测发现AY380833在抗性品系871C中显示为阳性,与其抗性紧密相关,笔者同样配制了871C与另一感性品系N4的连锁分析群体,并检测了该标记与其抗性的连锁情况,结果表明其在该连锁分析群体中与抗性也不连锁。这说明即使是同一抗性品系,与不同的感性亲本组配连锁定位分析材料时,其能被检测到的抗性连锁位点也可能不同,暗示了871C可能也具有多个抗性位点,这也进一步支撑了上述NB和99R的相关结论。另一方面,目前关于家蚕抗BmNPV的反向遗传学研究,如通过蛋白组和转录组等组学数据,筛选并鉴定到了抗、感品系中差异表达并有可能参与抗性的大量基因[25-30],这些基因涉及了众多的生物学过程,如细胞骨架构建、转录翻译调控、细胞周期、能量代谢、细胞压力应答等[30-32]。这些结果均反映了家蚕对BmNPV抗性或敏感性遗传调控基础的复杂性。
经典遗传学的研究结果表明家蚕对BmNPV的抗性是受一对显性主基因及微效修饰基因的共同控制,且杂合个体具有杂种优势,是一种质量-数量性状[4,10-13]。家蚕的抗性性状在分离世代中每一个体的表型值无法准确测定,所以研究者为了简化定位过程,着重考虑了其质量性状遗传特征,参考运用质量性状研究的方法快速鉴定主效基因。综合本研究及前人的结果,笔者认为家蚕对BmNPV抗性是一种复杂性状,在符合“质量-数量性状”结论的同时,其数量性状特征突出,在后续抗性相关基因的筛查和克隆研究中应给予足够重视。
家蚕对BmNPV抗性受很多因素的影响,比如添毒时期和浓度、蚕的体质等,同时,其数量性状的特征也使得蚕体抗性水平受温湿度、桑叶质量等外界环境影响较大,而由于所取材料的样本较小,加之不同批次攻毒取材相对来说是独立进行的,所以每次所取得样本之间可能存在差异,导致目前连锁分析的结果不具有可重复性。这毫无疑问会给后续的精细定位及候选基因筛查带来困难,因此改进现有的研究方法,提高结果分析的准确性十分必要。基于上述对家蚕对BmNPV抗性的遗传基础分析,笔者认为可从以下几方面进行改进。第一,由于抗性具有数量性状特征,所以可以考虑引入一些数量性状定位的研究方法。但由于抗性这一性状本身的特殊性,使得研究者不能精确测定分离群体中的每个个体的抗性,因此常规的QTL定位方法并不适合于家蚕对BmNPV抗性的研究,所以,选择性基因分型(selective genotyping)或基于极端个体的QTL定位方法可以作为较适合的参考方法。其原理与现有定位方法类似,只不过为了得到表型较准确的个体,需要加大攻毒的群体规模,同时选择更合适的攻毒浓度,例如更低的病毒浓度下攻毒选取感性个体,或更高的病毒浓度处理下选择抗性个体;第二,利用现有保存的大量家蚕品系进行关联分析。关联分析是目前数量性状定位中常用的方法,其优点是基于品系的关联分析不需要确定单个个体的表现值水平,而是评估每个品系的表现值水平[33],这使得这种方法比较适合家蚕BmNPV抗性这一性状的定位分析,且这种方法具有定位精度高,能综合分析多个品系抗性位点的特性[34];第三,将连锁分析与关联分析相结合的方法,即配制多亲本重组近交系,利用其进行连锁及关联分析。这种基于多亲本的重组近交系群体进行数量性状定位的方法,既规避了连锁分析与关联分析的一些不足,又集合了两者的诸多优点,是一种越来越受到研究人员关注的定位策略[35-36]。
4 结论
通过对家蚕BmNPV抗性品系99R的抗性性状进行连锁分析,发现结果不具重复性,同时对已公布的与抗性位点紧密连锁的分子标记AY380833,用抗性品系(99R和871C)与感性品系组配回交连锁分析群体进行连锁验证,发现其与两者的抗性性状均不连锁。综合本研究和前人的研究结果,对该性状的遗传基础进行了分析讨论,进一步说明家蚕对BmNPV的抗性,不同品系其抗性遗传基础具有很大的差异性,同一品系可能具有多个控制抗性的位点。并且,笔者认为家蚕对BmNPV抗性是一种复杂性状,在符合“质量-数量性状”结论的同时,其数量性状特征很突出,在后续抗性基因鉴定及品系和品种培育研究中应给予足够重视。基于此提出了一些抗性位点定位方法的改进意见,以期能为后续准确地定位家蚕BmNPV抗性基因提供一定的参考及启发。The authors have declared that no competing interests exist.
