0 引言
【研究意义】柑橘全爪螨(Panonychus citri)又名柑橘红蜘蛛,是一种世界性分布的害螨[1]。由于柑橘全爪螨具有对环境适应性强、寄主范围广及发生持续时间长等特点,曾一度为美国柑橘作物上最为严重的经济害螨之一[2-3]。另外,在欧洲、澳大利亚等热带及亚热带地区都有柑橘全爪螨发生危害。在中国,柑橘全爪螨危害柑橘长达50多年,在福建、重庆、江西、浙江等主要产业基地危害尤为严重[4]。尽管可以使用捕食螨等对其进行生物防治[4-5],但目前对该螨最有效的控制方法仍是化学防治。许多研究指出,由于农药的大量长期和不合理使用,柑橘全爪螨对多种常用杀螨剂已产生了严重的抗药性,对其防治工作提出了更高的要求[6-7]。超氧化物歧化酶(superoxide dismutase,SOD)是生物体内重要的抗氧化酶系,在节肢动物适应各种不良环境,如重金属胁迫[8]、温度胁迫[9-10]、农药胁迫[11-12]以及紫外线胁迫[13]等过程中起着非常重要的作用。因此,对柑橘全爪螨SOD基因进行异源表达,研究其抗氧化功能,对揭示SOD在柑橘全爪螨环境适应性增强、抗药性发展中的作用具有重要意义。【前人研究进展】中华蜜蜂(Apis cerana cerana)幼虫和蛹通过上调SOD3基因表达量以应对氯化汞(HgCl2)胁迫[14];意大利蜜蜂(Apis mellifera ligustica)在生长发育过程中,食物中较高水平蛋白供给能够显著增强幼虫的抗氧化活性[15];德国小蠊(Blattella germanica)通过上调SOD基因能应对高效氯氰菊酯胁迫[16];橘小实蝇(Bactrocera dorsalis)多个SOD基因在阿维菌素、高效氯氰菊酯和马拉硫磷等胁迫条件下均出现了不同程度的表达上调[17];褐飞虱(Nilaparvata lugens)若虫在受到高温胁迫时,其SOD活性显著升高,且活性随着温度的升高而上升[18];在紫外线胁迫下,果蝇(Drosophila melanogaster)SOD2基因、棉铃虫(Helicoverpa armigera)SOD3基因的表达量显著提高[13,19]。近年来,原核表达系统作为重要技术手段被广泛应用于SOD基因功能的研究。例如,在大肠杆菌中过量表达果蝇CuZnSOD可以显著减少百草枯对大肠杆菌的氧化损伤[20]。【本研究切入点】笔者课题组前期研究发现,柑橘全爪螨在极端温度胁迫下SOD活性显著增强[10]。最近,笔者课题组克隆获得了3个柑橘全爪螨SOD基因cDNA全序列,解析了其转录子在极端温度、杀螨剂、重金属和紫外线胁迫下的表达模式,发现3个SOD基因均有不同程度的上调。其中PcSOD3上调幅度最大,暗示PcSOD3在柑橘全爪螨应对不良环境胁迫的过程中可能起着至关重要的作用[21]。【拟解决的关键问题】构建pET28a-PcSOD3重组表达质粒,在大肠杆菌BL21(DE3)菌株中实现异源表达,并分离纯化PcSOD3重组酶。经Western blot验证后,利用WST-1法测定PcSOD3重组酶的抗氧化活性,以期进一步明确PcSOD3的生理功能。1 材料与方法
试验于2015年8月至2016年4月在西南大学昆虫分子生态实验室完成。1.1 供试螨源
供试柑橘全爪螨为室内饲养品系,该品系于2008年采集自位于重庆市北碚区歇马镇的中国农业科学院柑橘研究所苗圃,带回后转接到西南大学现代农业科技示范园网室中的枳壳苗上,供试前该品系未接触任何化学药剂。1.2 主要试剂
高保真DNA聚合酶PrimerSTARTM Max Premix购自TaKaRa公司,限制性内切酶BamH I和Hind III购自NEB公司,pET28a原核表达载体购自Novagen公司,T4 DNA连接酶购自Promega公司,原核表达用BL21(DE3)菌株购自北京全式金生物技术有限公司,重组蛋白提取试剂盒QIAexpress® Ni-NTA Fast Start购自Qiagen公司,转膜试剂Trans-Blot® TurboTM RTA Mini PVDF Transfer Kit购自Bio-Rad公司,重组蛋白Western印迹试剂如6×组氨酸标签鼠源一抗、HRP标记的兔抗鼠二抗以及化学发光检测试剂BeyoECL star均购自江苏碧云天生物技术公司,SOD活性测定试剂盒购自南京建成生物工程研究所。药敏试验中所用药剂无水氯化铬(chromic chloride,CdCl2)购自成都市科龙化工试剂厂,叔丁基过氧化氢(t-butylhydroperoxide)和过氧化氢异丙苯(cumene hydroperoxide)均购自Sigma公司。1.3 表达载体构建
根据笔者课题组前期测序获得的柑橘全爪螨PcSOD3的cDNA序列(GenBank登录号为KJ700411)[21],采用在线软件SignalP4.1预测其编码氨基酸序列的信号肽,并设计PCR引物扩增编码成熟肽的cDNA片段。其中,上下游引物5′端分别加入BamH I与Hind III酶切位点(下划线部分)。上游引物为5′-CGGGATCCGCTCACAAATTACCCGATTTAC-3′,下游引物为5′-CCAAGCTTTTAAGATTTTGATCTAG CTAATCGATC-3′。以柑橘全爪螨第一链cDNA为模板,利用高保真酶PrimerSTARTM Max Premix进行目的片段扩增,反应体系与条件均按照试剂盒说明书进行。PCR产物经琼脂糖凝胶电泳确认片段大小后,采用TaKaRa核酸纯化试剂盒进行纯化备用。随后,直接利用BamH I与Hind III对纯化后的PCR产物和pET28a载体分别进行双酶切,其中BamH I与Hind III对PcSOD3双酶切进行20 h以保证酶切效率,而pET28a载体酶切时间为4 h。利用核酸纯化试剂盒及胶回收试剂盒对酶切后的PcSOD3和pET28a载体分别进行纯化,并使用T4 DNA连接酶进行连接,将连接产物转化入Trans 5α菌株,接种到含有30 μg·mL-1卡那霉素(Kanamycin)的培养基,在平板上挑取单菌落,PCR筛选阳性克隆后送公司测序确保获得正确的pET28a-PcSOD3重组表达质粒。1.4 柑橘全爪螨PcSOD3重组蛋白诱导表达
将1.3中经测序验证的pET28a-PcSOD3重组质粒转化到BL21(DE3)菌株中用于诱导PcSOD3重组蛋白表达。首先将阳性克隆菌株涂布于含30 μg·mL-1卡那霉素的LB平板中,于37℃培养过夜。次日,挑取单菌落至含有250 mL培养基的1 L锥形瓶中扩大培养,当OD600达0.6时,加入100 mmol·L-1 IPTG至终浓度为0.4 mmol·L-1,摇床参数设置为18℃,160 r/min,培养18 h,然后在4℃以4 000×g离心20 min收集菌体沉淀保存于-20℃冰箱备用。以pET28a空载体为对照,即pET28a质粒转化到E. coli BL21(DE3)表达菌株,并以相同条件诱导。1.5 重组蛋白纯化及验证
1.5.1 重组蛋白纯化 将1.4中收集获得的菌体沉淀,参照QIAexpress® Ni-NTA Fast Start重组蛋白纯化试剂盒操作说明,获得PcSOD3重组蛋白。简言之,菌体沉淀于冰上融解后加入10 mL裂解液重悬,于冰上放置30 min使其充分裂解,随后在4℃,14 000 ×g离心30 min分离破碎菌体沉淀,保留上清液,取5 μL上清液(标记为CL)用于SDS-PAGE以观察目的蛋白的表达情况。剩余上清液全部倒入Fast Start Column中,收集过柱液并取5 μL(标记为FT)用于SDS-PAGE以观察蛋白过柱后的损失情况。随后用2 mL Native Wash Buffer洗脱柱子,重复1次。收集2次的洗脱液各5 μL,分别加入5 μL的2×SDS-PAGE上样缓冲液,标记为W1和W2,-20℃保存用于SDS-PAGE分析。最后,使用1 mL Native Elution Buffer洗脱收集重组蛋白,标记为E1,重复1次,标记为E2。同样各取5 μL用于SDS-PAGE分析。将收集的空载体(P)、CL、FT、W1、W2、E1和E2电泳样品放置水浴锅中,煮沸3—5 min。待样品冷却后进行SDS-凝胶电泳,电压为300 V,20—30 min。然后用考马斯亮蓝溶液对凝胶进行染色,完成后用脱色液脱色,直到凝胶的背景颜色由蓝转为透明为止,利用Bio-Rad凝胶成像仪拍照。1.5.2 重组蛋白的Western印迹 取1.5.1中得到的重组蛋白液(E1)10 μL,采用TGX Stain-Free polyacrylamide gels试剂盒制作免染凝胶和自发荧光Unstained Standards Marker进行电泳,结束后,可直接在电泳成像仪中观察分析结果。按照转膜试剂Trans-Blot® TurboTM RTA Mini PVDF Transfer Kit说明书对SDS-PAGE电泳胶上的目的蛋白转移至PVDF膜,转膜结束后可在凝胶成像仪中检查转膜情况。转膜成功后,用Western洗涤液将PVDF膜漂洗2 min,以去除转膜液。随后,吸尽洗涤液并加入Western封闭液,4℃封闭过夜。用洗涤液多次洗涤PVDF膜,吸尽洗涤液,然后加入由Western一抗稀释液稀释 1 000倍后的鼠抗6×组氨酸抗体,于室温下在摇床上缓慢摇动孵育2 h。随后,加入由Western二抗稀释液稀释1 000倍的HRP标记兔抗鼠二抗,于室温下在摇床上缓慢摇动孵育2 h。最后,利用Western洗涤液清洗PVDF膜3次,每次5 min。洗涤完成后,将PVDF膜放置于干净的透明保鲜膜上(尽量减少褶皱),用移液器滴加BeyoECL star化学发光显色液,立刻将保鲜膜整体置于凝胶成像仪下拍照。
1.6 重组蛋白的生化特性测定
1.6.1 BSA蛋白浓度标准曲线制作 采用BCA法制作重组蛋白浓度测定的标准曲线,并利用此曲线对重组蛋白的浓度进行计算。在总体积为220 μL的测定体系中加入200 μL的BCA工作液中,再加入不同体积的浓度为1 mg·mL-1的蛋白标准品(牛血清蛋白,BSA),剩余体积由浓度为0.1 mol·L-1、pH 7.4的PBS缓冲液补齐,将反应液于37℃放置25 min,最终利用微量滴度酶标仪在562 nm处测定OD值,根据OD值在Excel中绘制标准曲线,设置3个生物学重复。测定重组蛋白浓度时,在200 μL的BCA工作液中加入5 μL重组蛋白液E1,5 μL PBS缓冲液(0.1 mol·L-1、pH 7.4),37℃孵育25 min,在562 nm下测定OD值,设置3次重复。最后,根据标准曲线求出PcSOD3蛋白浓度。1.6.2 柑橘全爪螨PcSOD3重组蛋白酶活性测定 采用WST-1法测定PcSOD3的活性,试剂盒购自南京建成生物工程研究所,操作按照试剂盒说明书进行。于室温下(25℃),向96孔微量酶标板中,分别加入下列试剂(表1)。根据测得的OD值,首先公式(1)计算SOD抑制率。在此反应体系中,将SOD抑制率达50%时所对应的酶量为定义为1个SOD活性单位(Unit,U),由此得到公式(2)计算SOD活性。
SOD抑制率(%)=
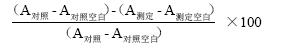
SOD活性(U·mg-1)= SOD抑制率÷50%×稀释倍数

Table 1
表1
表1柑橘全爪螨PcSOD3重组蛋白酶活性测定体系
Table 1The reaction system for the measurement of the activity of recombinant PcSOD3 of P. citri
| 试剂 Reagent (μL) | 对照孔 Control well | 对照空白孔 Control blank well | 测定孔 Test well | 测定空白孔 Test blank well |
|---|---|---|---|---|
| 检测样本 Test sample | — | — | 20 | 20 |
| 双蒸水 Double distilled water | 20 | 20 | — | — |
| 酶工作液 Enzyme working solution | 20 | — | 20 | — |
| 酶稀释液 Enzyme diluent | — | 20 | — | 20 |
| 底物 Substrate | 200 | 200 | 200 | 200 |
新窗口打开
1.6.3 温度、pH对柑橘全爪螨PcSOD3重组蛋白酶活性的影响 为了探究温度对柑橘全爪螨PcSOD3重组蛋白酶活性的影响,将纯化的重组蛋白酶液与PBS(pH 7.4)按照1﹕9的体积比稀释并混合均匀,分别置于15、25、35、45、55、65、75和85℃中水浴保温1 h。然后将不同温度处理后的重组蛋白酶液置于冰上,按照1.6.2中描述的方法测定酶活性。每个处理设置3个生物学重复。
此外,为了明确不同pH对柑橘全爪螨PcSOD3重组蛋白酶活性的影响,使用不同pH的PBS溶液(pH设定为3.0、4.0、5.0、6.0、7.0、8.0和9.0)稀释10倍,于37℃水浴1 h,按照1.6.2中描述的方法测定酶活性。同样,每个处理设置3个生物学重复。
1.7 纸片琼脂糖扩散法药敏试验
为了明确PcSOD3重组蛋白酶在大肠杆菌中的过表达是否可以有效提高大肠杆菌的抗氧化能力,参考Kirby-Bauer法即K-B纸片琼脂糖扩散法测定了过表达PcSOD3的大肠杆菌对3种可造成氧化损伤的化学物的耐受能力。首先将BL21(DE3)菌株中含有PcSOD3重组质粒的阳性克隆在1.4节条件下诱导重组蛋白表达4 h,取100 μL诱导表达后的菌液,均匀涂布在培养基平板(卡那霉素浓度为30 μg·mL-1),于37℃恒温箱中倒置孵育1 h。将直径6 mm的圆形滤纸片在培养基平板上在4个方向上均匀放置,然后将10 μL不同浓度(表2)的3种氧化药剂按浓度梯度从高到低(氯化铬:400、200、100和50 mmol·L-1;叔丁基过氧化氢:150、100、50和25 mmol·L-1;过氧化氢异丙苯:200、100、50和25 mmol·L-1),顺时针方向分别滴在4张纸片,药剂通过纸片不断向其周围区域扩散形成递减的浓度梯度,因此在纸片周围抑菌浓度范围内形成透明的抑菌圈。使用游标卡尺以十字交叉法测量抑菌圈直径,抑菌圈直径大小反映大肠杆菌对氧化药剂的敏感程度。利用SPSS 16.0软件中的t测验方法对数据进行差异显著性分析(P<0.05)。Table 2
表2
表23种氧化性药剂的浓度信息
Table 2The concentrations of three oxidizing reagents
| 药剂名称 Reagent | 浓度 Concentration (mmol·L-1) | |||
|---|---|---|---|---|
| 氯化铬 Chromic chloride | 400 | 200 | 100 | 50 |
| 叔丁基过氧化氢t-Butylhydroperoxide | 150 | 100 | 50 | 25 |
| 过氧化氢异丙苯 Cumene hydroperoxide | 200 | 100 | 50 | 25 |
新窗口打开
2 结果
2.1 pET28a-PcSOD3重组质粒的构建
利用添加BamH I和Hind Ⅲ酶切位点的引物,以柑橘全爪螨cDNA为模板扩增PcSOD3的开放阅读框(去除信号肽部分)。将pET28a载体(图1-A)和由高保真DNA聚合酶扩增得到的PcSOD3目的片段(图1-B)分别进行BamH I和Hind Ⅲ双酶切。结果如图1所示,其中PcSOD3目的片段约为750 bp,而经过双酶切的pET28a载体长度约为5.0 kb。酶切产物经纯化回收后,在T4 DNA连接酶作用下进行重组,将连接产物转化进入Trans 5α感受态细胞并接种到培养基平板(含30 μg·mL-1卡那霉素),然后对阳性克隆进行菌液PCR检测(图1-C),并抽提质粒进行测序验证。测序结果表明,PcSOD3正确插入pET28a中,且不含信号肽部分,据此成功构建了pET28a-PcSOD3重组质粒。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1柑橘全爪螨pET28a-PcSOD3重组质粒的构建
-->Fig. 1Construction of the recombinant plasmid of pET28a-PcSOD3
-->
2.2 PcSOD3重组蛋白的诱导表达和分离纯化
根据分子量大小预测结果,原PcSOD3蛋白大小为24.8 kD,去掉线粒体转运信号肽(3 kD),加上载体自带的6×组氨酸标签序列(3.5 kD),最后PcSOD3重组蛋白大小应为25.3 kD。结果如图2所示,在泳道CL、E1和E2中均检测到大量重组蛋白,分子量约为25 kD,这与预期分子量大小基本一致。然而,pET28a空载体转化的BL21(DE3)大肠杆菌中并未表达目的蛋白。此外,由于使用菌体裂解后的上清液进行重组蛋白的分离纯化,表明重组蛋白主要以可溶性蛋白的形式表达。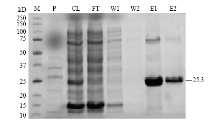 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2柑橘全爪螨PcSOD3重组蛋白的分离纯化
-->Fig. 2Expression and purification of the recombinant protein of PcSOD3M:蛋白分子量Protein Marker;P:空载体经IPTG诱导Vector only by IPTG induced;CL:含可溶性蛋白的上清液Cell lysate supernatant;FT:过柱液Aliquot of the flow-through fraction;W1、W2:先后2次洗脱液 The 1st and 2nd wash through of the column;E1、E2:先后2次收集的重组蛋白液The 1st and 2nd eluted recombinatant protein
-->
2.3 PcSOD3重组蛋白的Western blot鉴定
重组蛋白液经SDS-PAGE电泳并转到PVDF膜上,随后利用6×组氨酸抗体对重组蛋白进行Western blot验证。由图3可见,在分子量约为25 kD附近出现了特异性的免疫印迹条带,与PcSOD3重组蛋白预测分子量大小一致,说明该蛋白条带即为PcSOD3重组蛋白。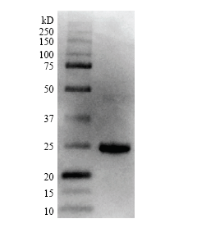 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3PcSOD3重组蛋白的Western blot检测
-->Fig. 3Confirmation of the PcSOD3 recombinant protein by Western blot
-->
2.4 PcSOD3重组蛋白酶生化特性
根据Bradford法制作蛋白浓度标准曲线为y=1.03x+0.08(R²=0.999),其中y为562 nm下的吸光度,x为蛋白质量。通过此标准曲线计算得到纯化后的PcSOD3重组蛋白浓度为0.332 mg·mL-1。利用WST-1法测定了不同温度处理1 h后,PcSOD3重组酶的活性。当处理温度为25℃时,PcSOD3重组酶活性最高为40.2 U/mg protein。当处理温度为15℃时,酶活性无显著变化,但随着处理温度逐渐升高至45℃时,酶活性剧烈下降至25.0 U/mg protein。不过,处理温度从45℃升至75℃的过程中,PcSOD3重组酶活性却无显著降低,处理温度为85℃时,活性降至最低为20 U/mg protein(图4-A)。PcSOD3重组酶活性在不同pH反应体系中的变化呈抛物线趋势,最高活性出现在pH 7.0的反应体系中,约为47.3 U/mg protein。当反应体系pH<7.0时,PcSOD3重组酶活性随反应体系pH增加而逐渐增强;当反应体系pH>7.0时,PcSOD3重组酶活性随反应体系pH增加而迅速下降(图4-B)。上述结果表明PcSOD3重组酶的最适前处理温度为25℃,最适反应pH为7.0。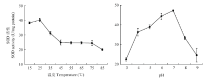 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同温度及pH对PcSOD3重组蛋白活性的影响
-->Fig. 4The effects of various temperatures and pH values on the activities of the PcSOD3 recombinant protein
-->
2.5 药敏试验
氯化铬药敏试验结果表明(图5-A、5-A’),抑菌圈的大小随着氯化铬浓度的降低而减小。在所有氯化铬测试浓度下,对过量表达PcSOD3大肠杆菌产生的抑菌圈均显著小于对空载体对照产生的抑菌圈(P<0.05),平均较对照缩小近20%。叔丁基过氧化氢药敏试验结果与氯化铬药敏试验非常相似,在150 mmol·L-1浓度下叔丁基过氧化氢对过量表达PcSOD3大肠杆菌产生的抑菌圈与对照相比缩小约25%(图5-B、5-B’)。同样,过氧化氢异丙苯测试结果与前两者结果类似,在测试的4个浓度中,浓度为200 mmol·L-1的过氧化氢异丙苯对过量表达PcSOD3大肠杆菌产生的抑菌圈与对照相比缩小约15%(图 5-C、5-C’)。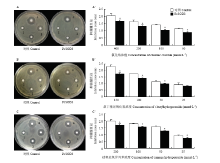 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5三种氧化药剂K-B纸片扩散法药敏试验
-->Fig. 5Kirby-Bauer disc diffusion assays of three oxidative reagentsA:氯化铬Chromic chloride,1、2、3、4代表试剂浓度依次为50、100、200、400 mmol·L-1 1, 2, 3, 4 represented the concentration of reagent was 50, 100, 200, 400 mmol·L-1, respectively;B:叔丁基过氧化氢t-Butylhydroperoxide,1、2、3、4代表试剂浓度依次为25、50、100、150 mmol·L-1 1, 2, 3, 4 represented the concentration of reagent was 25, 50, 100, 150 mmol·L-1, respectively;C:过氧化氢异丙苯Cumene hydroperoxide,1、2、3、4代表试剂浓度依次为25、50、100、200 mmol·L-1 1, 2, 3, 4 represented the concentration of reagent was 25, 50, 100, 200 mmol·L-1, respectively;A’、B’和C’分别为不同浓度的氯化铬、叔丁基过氧化氢和过氧化氢异丙苯的抑菌圈直径。*表示处理和对照间差异显著(独立样本t测验,P<0.05) A’, B’ and C’ represented inhibition zones of different concentrations of chromic chloride, t-butylhydroperoxide and cumene hydroperoxide, respectively. * meant significantly different between treatment and control (Independent sample t test, P<0.05)
-->
3 讨论
为了进一步验证SOD基因的抗氧化功能,原核表达技术的运用在昆虫的研究中非常普遍,例如在中华蜜蜂和烟粉虱(Bemisia tabaci)的研究中,通过获得有活性的重组超氧化物歧化酶蛋白,发现相应的SOD基因具有抗氧化功能[14,22]。在家蝇(Musca domestica)的研究中,也通过原核表达获得了具有活性的MnSOD重组蛋白,证明MnSOD在家蝇抗氧化胁迫过程中发挥了重要的功能[23]。另外,在大肠杆菌中过量表达果蝇的SOD基因,可以显著提高重组菌株对百草枯的耐药性,降低由氧化性药剂诱导产生的氧化损伤[20]。中华蜜蜂SOD3基因在大肠杆菌中过量表达,可以显著提高大肠杆菌细胞在过氧化氢异丙苯、氯化汞和氯化铬胁迫过程中抗氧化应激能力[14]。柑橘全爪螨对各种逆境表现出较强的适应性,SOD基因在该过程中可能发挥重要的保护功能,利用基因过表达的研究方式,可以进一步阐释基因的生物功能,但目前该技术在螨类的研究中应用较少。本研究利用原核表达技术,开展了螨类SOD基因离体功能研究,结果对螨类SOD基因功能的探索具有重要参考价值。大量研究表明在真核生物细胞中,蛋白质在翻译时,其N-末端的转运肽或信号肽结构会引导新生的多肽进入到不同亚细胞器中或胞外,而信号肽随即被相应的酶水解,该结构并不承担蛋白本身的功能行使[24-25]。本研究采用BL21(DE3)大肠杆菌诱导表达PcSOD3重组蛋白,为了避免线粒体转运信号肽对蛋白质功能的影响,在构建柑橘全爪螨PcSOD3原核表达载体时,笔者去除了其前体蛋白的分泌信号肽,成功构建了pET28a-PcSOD3重组质粒。
通过原核表达方式了解蛋白质的功能,必须要解决的前提条件是获得可溶性的重组蛋白。由于PcSOD3作为大肠杆菌的异源基因,表达量过高时,会出现二硫键不能正确配对,真核糖蛋白无法糖基化等原因,合成时易出现折叠错误,主要形成非可溶性的包涵体,包涵体并不具备蛋白质的正常功能[26-28]。所以,要降低表达速率,通过降低温度减小IPTG浓度,增加培养液的含氧量,同时延长诱导时间,以获得足量的且具有生物活性的可溶性重组蛋白[24]。不同蛋白质在结构上差异较大,要形成可溶性重组蛋白,诱导条件也相差甚远,因此,原核表达前应对最适诱导表达条件进行探索。本研究中,经过前期大量摸索得到了适合PcSOD3表达的诱导条件,实践证明该条件下PcSOD3能够以可溶性蛋白的形式大量表达。
研究中获得的重组蛋白,经Western blot检测,确定为PcSOD3重组蛋白。SOD酶活性测定试剂盒的原理是试剂本身反应会产生自由基(O2-),SOD通过歧化该自由基生成O2和H2O2,从而发生显色反应。经过不同pH反应体系和不同前处理温度的测试,明确了PcSOD3重组酶的基础生化特性,该重组蛋白在中性反应体系中活性最高,最适前处理温度为25℃。值得注意的是,在不同pH反应体系中PcSOD3重组酶活性最高测得为47.3 U/mg protein,而在不同前处理温度实验中测得最高活性为40.2 U/mg protein,二者之间活性相差近18%,究其原因可能是因为不同前处理温度试验中反应体系的pH为7.4而并非7.0。
过氧化氢异丙苯、叔丁基过氧化氢和百草枯等氧化性药剂也能引起细胞内产生氧化损伤,所以,这些药剂被广泛应用于纸片药敏试验中,用于验证SOD等的抗氧化活性[17,27]。本研究采用氯化铬、叔丁基过氧化氢和过氧化氢异丙苯3种氧化性药剂,诱导大肠杆菌细胞内产生氧化应激反应,并采用K-B纸片琼脂糖扩散法测定了上述3种药剂对过表达PcSOD3大肠杆菌抑制效果,结果表明过表达PcSOD3的大肠杆菌对3种药剂的耐受能力显著增强,说明PcSOD3具有抗氧化功能。
4 结论
在大肠杆菌中成功表达了柑橘全爪螨PcSOD3,该蛋白主要以可溶性蛋白的形式表达,利用镍柱亲和层析法纯化得到了PcSOD3重组蛋白,经Western blot验证该重组蛋白即为PcSOD3重组蛋白。WST-1法测定了PcSOD3重组酶的活性,并证明该重组蛋白具有抗氧化活性,同时明确了该重组酶最适反应pH以及前处理温度等生化性质。K-B纸片琼脂糖扩散法测定了氯化铬、叔丁基过氧化氢和过氧化氢异丙苯3种氧化性药剂对过表达PcSOD3大肠杆菌抑制效果,结果表明过表达PcSOD3的大肠杆菌对3种药剂的耐受能力显著增强,说明PcSOD3具有抗氧化功能。研究结果为进一步阐释PcSOD3在柑橘全爪螨抗氧化损伤过程中的重要功能提供了新的证据。The authors have declared that no competing interests exist.
