0 引言
【研究意义】蛋白质的磷酸化修饰是蛋白质翻译后修饰中最常见、最重要的一种共价键修饰[1],它可以调控靶蛋白的功能、位置及结合特异性[2]。生物体的细胞发育、增殖、信号转导、凋亡、肌肉收缩等大部分生命活动几乎都受蛋白质磷酸化和去磷酸化这一可逆过程的调节[3]。磷酸化的肌球蛋白是维持细胞骨架活性及细胞功能的重要效应因子[4-5]。肌球蛋白轻链周期性的磷酸化与去磷酸化的状态,是细胞发生运动和收缩的必备条件[6],对肌球蛋白与肌动蛋白的相互作用具有重要的调控作用。【前人研究进展】肌球蛋白和肌动蛋白是肌原纤维中含量最丰富的两种蛋白质,分别约占肌原纤维蛋白总量的50%和20%[7]。GOLL等[8]提出宰后肌动蛋白与肌球蛋白相互作用的改变,即僵直过程中所形成的肌动球蛋白的解离可能也是导致嫩度改善的原因之一。其他研究也得出了相似结论,牛、羊宰后24 h内肌球蛋白与肌动蛋白相互作用的加强使得肌节长度缩短,肉品嫩度显著降低,而在解僵成熟阶段肌球蛋白和肌动蛋白的结合减弱,使得肌节变长,这可能促进了宰后成熟过程中肌肉嫩度的增加[9]。TAKAHASHI等[10-11]研究也表明,肌节长度的增加说明僵直后肌球蛋白和肌动蛋白之间的相互作用发生改变,弱化了肌原纤维的紧密结构。1973年,PERRIE等[12]首次在兔骨骼肌中发现肌球蛋白轻链2的磷酸化现象,随后人们围绕其磷酸化的形成机制和功能作用做了一系列相关的研究。有研究表明,肌球蛋白轻链2的磷酸化修饰会破坏肌肉粗丝和细丝的相互作用,使肌球蛋白重链头部远离粗丝[13-15],促进了肌球蛋白单体与活跃的收缩细丝的结合,并且调控肌球蛋白的活性[16],同时对肌节的长度也会产生影响[17-18]。【本研究切入点】肌球蛋白轻链2磷酸化会影响肌球蛋白与肌动蛋白的相互作用,但在宰后成熟过程中,肌球蛋白轻链2的磷酸化水平及肌动球蛋白解离是如何变化的,以及如何调控肌动球蛋白解离和肌节收缩的机制并不明确。因此,本研究通过分析宰后肌肉中肌球蛋白磷酸化与肌动球蛋白解离之间的关系,初步探索肌球蛋白的磷酸化修饰对肌动球蛋白解离以及其对肉品嫩度的影响。【拟解决的关键问题】以羊背最长肌(ovine longissimus dorsi)为原料,通过分析宰后肌肉肌球蛋白轻链2的磷酸化水平、肌动球蛋白解离程度、肌动球蛋白ATPase活性和肌节长度等指标的变化,探究宰后成熟过程中肌肉中肌球蛋白轻链2的磷酸化修饰对肌动蛋白与肌球蛋白相互作用的影响。1 材料与方法
试验于2015年3—7月在中国农业科学农产品加工研究所肉品质与加工实验室进行。1.1 材料与试剂
1.1.1 材料 宰后立刻取羊(5只)的背最长肌,剔除可见的筋膜及结缔组织,4℃分别放置0、6、24、48和72 h时取样,电镜样品放置于2.5%的戊二醛固定液(pH 7.2)中保存;其余样品装于冻存管液氮速冻后,-80℃保存。1.1.2 试剂 蛋白浓度测定试剂盒购自美国Pierce公司;三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺、ATP酶活性测定试剂盒购自美国Sigma公司;Pro-Q Diamond、SYPRO Ruby染色液购自美国Invitrogen公司;氯化钠、碳酸钠、碳酸氢钠、乙醇、乙酸、乙腈等为国产分析纯试剂,购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 蛋白提取 肌浆及肌原纤维蛋白的提取参照LAMETSCH等[19]的方法:将1 g肌肉组织加入6 mL预冷的蛋白提取液(0.1 mol·L-1 Tris,0.01 mol·L-1 二硫代苏糖醇(DL-Dithiothreitol,DTT),pH 8.3,蛋白酶抑制剂(50 mL/片),磷酸酶抑制剂(10 mL/片))中,用Ultra Turrax T25匀浆机进行匀浆(2次,15 s/次),然后离心(20 000×g,4℃,30 min),得到上清液(肌浆蛋白溶液)和沉淀(肌原纤维蛋白)。沉淀溶解于5%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液(60℃)后匀浆30 s,80℃加热20 min,即得到肌原纤维蛋白溶液。蛋白浓度用二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒测定。肌动蛋白及肌动球蛋白的提取参考OKITANI等[20]的方法,并稍作修改:取2 g肉样,加入25 mL Weber-Edsall 溶液(0.6 mol·L-1 KCl,0.04 mol·L-1 NaHCO3,0.01 mol·L-1 Na2CO3,蛋白酶抑制剂50 mL/片,pH 7.2),用Ultra Turrax T25匀浆机匀浆3 次(30 s/次,中间间隔10 s)。匀浆液置于4℃培养箱内,摇床震荡24 h后,用两层尼龙网过滤除去不溶物质,取10 mL溶液,即为总肌动蛋白溶液。取10 mL剩余溶液加入20 mL超纯水稀释,使提取液中KCl的浓度至0.2 mol·L-1,然后4℃摇床振荡60 min ,离心(4℃,15 000×g,20 min),上清液即为游离肌动蛋白溶液。将沉淀溶解于3 mL KCl-Tris溶液中(0.6 mol·L-1 KCl,0.02 mol·L-1 Tris-HCl,pH 7.2),即为肌动球蛋白溶液。蛋白浓度用BCA试剂盒测定。
1.2.2 肌球蛋白磷酸化水平的测定 将肌原纤维蛋白样品与上样缓冲液等体积混合后在沸水浴中加热5 min,冷却后离心(12 000×g,1 min),取上清液上样,肌原纤维蛋白的上样量为5 µg。浓缩胶浓度为4%,分离胶浓度为15%(用于分析肌球蛋白轻链2的磷酸化水平),分离胶浓度为7.5%(用于分析肌球蛋白重链的磷酸化水平)。设置初始电压为70 V,当溴酚蓝进入分离胶后,将电压恒定在110 V,继续电泳直至溴酚蓝到达离凝胶底部0.5 cm处。随后进行Pro-Q染色和Ruby染色,染色流程参考陈立娟等[21]的方法。
使用BIO RAD凝胶成像系统对染色后的凝胶拍照,利用Quantity One 4.6.2软件(Bio-Rad,美国)对肌球蛋白重链条带和肌球蛋白轻链2条带的光密度值进行定量,得到对应的Pro-Q Diamond染色光密度值(P)和SYPRO Ruby染色光密度值(T),该条带的光密度值之比P/T即为该条带蛋白的蛋白质磷酸化水平。
1.2.3 肌动球蛋白解离程度的测定 将游离肌动蛋白样品与稀释3倍的总肌动蛋白样品分别和上样缓冲液等体积混合后在沸水浴中加热5 min,冷却后离心(12 000×g,1 min),取上清液上样,上样量均为6 µL。电泳结束后用半干转膜仪(Bio-Rad,美国)将凝胶中的蛋白转印到聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜上,TBS溶液(0.01 mol·L-1 Tris,0.15 mol·L-1 NaCl,pH 7.5)漂洗(3次,2 min/次)。转印后的 PVDF 膜用封闭液(含0.05% Tween-20、3%牛血清白蛋白的TBS溶液)室温封闭2 h,然后与用封闭液1﹕1 000稀释的肌动蛋白抗体(A4700,Sigma)室温孵育2 h,随后将膜用三羟甲基氨基甲烷缓冲溶液(Tris buffered saline-tween-20,TBST1)(含0.1% Tween-20的TBS溶液)漂洗3次后与二抗(二抗为辣根过氧化酶标记的羊抗鼠IgG,用封闭液1﹕5 000稀释)室温孵育2 h,膜用TBST2溶液(0.05 mol·L-1 Tris,0.15 mol·L-1 NaCl,0.1% Tween-20,pH 7.5)漂洗3次后使用电化学发光(Electrochemiluminescence,ECL)显色剂显色,并使用凝胶成像仪拍照。采用Quantity One软件分析蛋白免疫印迹条带光密度值,用得到的游离肌动蛋白与总肌动蛋白的光密度值之比表示肌动球蛋白的解离程度。
1.2.4 肌动球蛋白ATPase活性的测定 肌动球蛋白ATPase活性的测定按照ATP酶活性测定试剂盒的说明书进行测定。基本步骤如下:(1)制作磷酸盐标准曲线。(2)根据说明书提供的各反应物添加量添加相应试剂开始样品和对照反应,在25℃反应1 h后添加200 μL Reagent到每个孔中25℃下再孵育30 min,终止酶反应,同时生成比色产物,并在620 nm处测定吸光值。(3)计算:根据公式∆A620=(A620)样品-(A620)对照计算出吸光值的变化,然后根据绘制的磷酸盐标准曲线,计算样品中无机磷的含量[Pi]。酶活根据下列公式得出。
酶活性(U·L-1)=([Pi](μmol)×40μL)/(10μL×T)
其中40 μL为反应体积,10 μL为样品体积,T为反应时间,1 U酶活是指在试验条件下每分钟催化生成1 μmol无机磷所需要的酶的量。
1.2.5 肌原纤维蛋白超微结构分析 肌原纤维超微结构的观察测定参考PRATES等[22]的方法并稍作修改。顺着肌纤维方向将待测样品切成大小为5 mm×2 mm×2 mm的细丝,立即放入2.5%的戊二醛固定液(pH 7.2)中进行前固定,固定48 h后用0.1 mol·L-1的磷酸缓冲液(pH 7.4)冲洗。然后在通风橱中用1%四氧化锇进行后固定,静置2—3 h后,再次用磷酸缓冲液冲洗,然后用乙醇进行梯度脱水(30%、50%、60%、70%、80%、90%、100%),之后再利用无水丙酮置换5次,每次放置7—15 min。脱水后的样品用包埋剂包埋,然后放入烘箱聚合(聚合条件:37℃,12 h;40℃,12 h;45℃,12 h;50℃,12 h;60℃,48 h),随后室温冷却(至少2 d)、修块。修块完成后用UC6型超薄切片机进行超薄切片,醋酸铀-柠檬酸铅双染色,最后用H-7500型透射电镜观察、拍照。利用Image-Pro Plus 6.0软件量取肌节长度。
1.2.6 统计分析 所有试验均做5次重复,每个样品做3次平行,所得数据采用SPSS 19.0统计软件进行方差分析,通过最小显著差异法(least significant difference,LSD)和邓肯氏总重比较法(Duncans Multiple-rang test)进行差异显著性分析,并进行相关性分析。
2 结果
2.1 肌球蛋白磷酸化水平随宰后时间的变化
2.1.1 肌球蛋白重链磷酸化水平随宰后时间的变化 对电泳图进行灰度值分析,用磷酸化染色(图1-A)的光密度值与全蛋白染色(图1-B)的光密度值之比代表肌球蛋白重链的磷酸化水平,宰后不同时间点肌球蛋白重链的磷酸化水平如图1-C所示。从图中可以看出,宰后肌肉中肌球蛋白重链的磷酸化水平随时间呈现先下降后上升再下降并趋于稳定的趋势,而且宰后6 h及以后各时间点的磷酸化水平均显著低于0.5 h的初始值。肌球蛋白重链的磷酸化水平变化在宰后48 h后基本趋于稳定,宰后72 h肌球蛋白重链的磷酸化水平与初始值0.5 h相比下降了18.8%。说明宰后肌肉中肌球蛋白重链的去磷酸化作用大于磷酸化作用,所以整体呈现出磷酸化水平降低的趋势。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1宰后不同时间点肌球蛋白重链的磷酸化水平
图中A、B分别表示肌球蛋白重链Pro-Q染色和Ruby染色效果图;C表示宰后不同时间点肌球蛋白重链的磷酸化水平,柱形图上方的不同字母表示不同时间点差异显著(P<0.05)。下同
-->Fig. 1Variation of myosin heavy chain phosphorylation level during postmortem
A, B indicate gel images of phosphoproteins and total proteins of myosin heavy chain by SDS-PAGE,respectively; C indicates variation of myosin heavy chain phosphorylation level during postmortem, different letters on the columns represent significant differences among groups during postmortem (P<0.05). The same as below
-->
2.1.2 肌球蛋白轻链2磷酸化水平随宰后时间的变化 对图2-A、B进行光密度值分析,宰后不同时间点肌球蛋白轻链2的磷酸化水平如图2-C所示,宰后肌肉中肌球蛋白轻链2的磷酸化水平在48 h内显著下降,48—72 h显著上升,但是72 h的肌球蛋白轻链2磷酸化水平仍显著低于0.5 h的初始值。说明宰后肌肉中肌球蛋白轻链2的去磷酸化作用起主导作用,整体呈现出肌球蛋白轻链2磷酸化水平显著降低的趋势。
2.2 肌动球蛋白解离程度随宰后时间的变化
利用免疫印迹测定宰后不同时间肌动球蛋白的解离程度,其结果如图3-A、B所示,对图中免疫印迹条带进行灰度值分析,所得结果如图3-C所示。从图中可以看出宰后肌动球蛋白解离程度呈现出先下降后上升然后趋于稳定的趋势。宰后0.5—6 h,肌动球蛋白的解离程度显著下降,说明此阶段肌肉中的肌球蛋白与肌动蛋白大量结合形成肌动球蛋白,整体呈现出一种结合大于解离的现象。而6—48 h,肌动球蛋白的解离程度则显著上升,肌球蛋白与肌动蛋白之间的横桥断裂,肌动球蛋白不断解离形成游离的肌动蛋白和肌球蛋白,呈现出一种解离大于结合的状态。宰后48—72 h,肌动球蛋白的解离程度无显著差异(P>0.05),此时肌球蛋白和肌动蛋白的结合与解离则处于一种平衡的状态,而且肌动球蛋白的解离程度显著高于初始点0.5 h。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2宰后不同时间点肌球蛋白轻链2的磷酸化水平
图中A、B分别表示肌球蛋白轻链2 Pro-Q染色和Ruby染色效果图;C表示宰后不同时间点肌球蛋白轻链2的磷酸化水平
-->Fig. 2Variation of myosin light chain 2 phosphorylation level during postmortem
A, B indicate gel images of phosphoproteins and total proteins of myosin light chain 2 by SDS-PAGE,respectively; C indicates variation of myosin light chain 2 phosphorylation level during postmortem
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3宰后不同时间点肌动球蛋白的解离程度
图中A、B分别表示宰后不同时间点游离肌动蛋白和总肌动蛋白的免疫印迹图;C表示宰后不同时间点肌动球蛋白的解离程度
-->Fig. 3Variation of actomyosin dissociation degree during postmortem
A, B indicate western blotting of free actin (A) and total actin (B) during postmortem,respectively; C indicates variation of actomyosin dissociation degree during postmortem
-->
2.3 肌动球蛋白ATPase活性随宰后时间的变化
肌动球蛋白ATPase活性代表肌球蛋白和肌动蛋白相互作用力的强弱。宰后不同时间点肌动球蛋白ATPase活性的变化如图4所示,肌动球蛋白ATPase活性随宰后时间呈现先上升后下降的趋势,并且在24 h达到最大值,该点的肌动球蛋白ATPase活性显著高于其他各时间点。宰后0.5—24 h,肌动球蛋白ATPase活性不断增大,说明肌球蛋白与肌动蛋白的相互作用力不断增强;而在24—72 h,肌动球蛋白ATPase活性则不断下降,肌球蛋白与肌动蛋白的相互作用力不断减弱。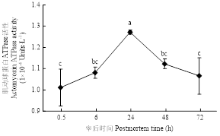 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4宰后不同时间点肌动球蛋白的ATPase活性
不同字母表示不同时间点差异显著(P<0.05)。下同
-->Fig. 4Analysis of actomyosin ATP enzyme activity during postmortem
Different letters significant differences among groups during postmortem (P<0.05). The same as below
-->
2.4 肌节长度随宰后时间的变化
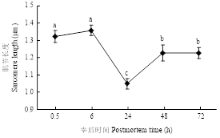
宰后不同时间点肌节样品的透射电镜图如图5所示,宰后72 h的肌节暗带已经开始变得模糊,说明维持肌节的蛋白已经发生了降解。在宰后0.5—6 h,肌节长度并未发生显著的变化,6—24 h,肌节长度显著减小,在24 h肌节明显变短;24—48 h,肌节长度显著增大,肌节舒张,48—72 h则维持这种舒张的状态,肌节长度不再发生显著变化,但是舒张后72 h的肌节长度仍然显著低于0.5 h的初始肌节长度(图6)。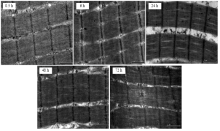 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5宰后不同时间点透射电镜图(30 000×)
-->Fig. 5Transmission electron microscopy photos during postmortem
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6宰后不同时间肌节长度分析
-->Fig. 6Analysis of the sarcomere length of different postmortem times
-->
2.5 相关性分析
将肌球蛋白重链磷酸化水平、肌球蛋白轻链2磷酸化水平、肌动球蛋白解离程度、肌动球蛋白ATPase活性和肌节长度进行相关性分析,肌动球蛋白ATPase活性与肌节长度之间呈显著负相关(r=-0.890,P<0.05),肌球蛋白轻链2磷酸化水平和肌动球蛋白解离程度呈高度的负相关(r=-0.823),肌球蛋白轻链2的磷酸化水平和肌球蛋白重链磷酸化水平、肌动球蛋白ATPase活性、肌节长度均有一定的相关性,其相关系数r分别为0.575、-0.522、0.628(表1)。Table 1
表1
表1宰后肌动球蛋白解离、肌球蛋白磷酸化水平和肌动球蛋白ATPase活性随时间变化的相关性分析
Table 1Correlation analysis of actomyosin dissociation, myosin phosphorylation and actomyosin ATPase activity during postmortem
| 肌动球蛋白解离程度 Actomyosin dissociation | 肌球蛋白轻链2 磷酸化水平 Myosin light chain 2 phosphorylation | 肌球蛋白重链 磷酸化水平 Myosin heavy chain phosphorylation | 肌动球蛋白 ATPase活性 Actomyosin ATPase activity | 肌节长度 Sarcomere length | |
|---|---|---|---|---|---|
| 肌动球蛋白解离程度 Actomyosin dissociation | 1 | -0.823 | -0.141 | 0.201 | 0.517 |
| 肌球蛋白轻链2磷酸化水平 Myosin light chain 2 phosphorylation | 1 | 0.575 | -0.522 | 0.628 | |
| 肌球蛋白重链磷酸化水平 Myosin heavy chain phosphorylation | 1 | 0.041 | -0.062 | ||
| 肌动球蛋白ATPase活性 Actomyosin ATPase activity | 1 | -0.890* | |||
| 肌节长度 Sarcomere length | 1 |
新窗口打开
3 讨论
肉品的宰后成熟是一个复杂的生理生化过程,它受肌肉组织结构、骨架蛋白降解及内源酶等多种因素的调控。GOLL等[8]提出宰后肌肉解僵成熟过程中肌动球蛋白的解离也有助于嫩度的改善。研究发现宰后肌球蛋白和肌动蛋白存在两种不同的结合状态,即高亲和态和低亲和态,而且这两种状态是可以相互转化的[23],在宰后不同阶段处于不同的结合状态,这将会影响宰后肉的成熟以及肉品最终的嫩度[24]。在本研究中也发现了相似的结果,如表1所示,宰后肌动球蛋白ATPase活性与肌节长度显著负相关(r=-0.890,P<0.05),肌动球蛋白解离程度与肌节长度也具有一定的相关性(r=0.517),且均呈现动态变化。0.5—24 h,肌动球蛋白ATPase活性显著增加,肌动球蛋白解离程度先显著下降随后又显著上升,肌节长度显著下降,肌球蛋白与肌动蛋白相互作用力增大,两者由低亲和态转为高亲和态,同时肌球蛋白与肌动蛋白相互作用的横桥的数量也发生显著的变化,最终导致肌节收缩。这是由于在宰后成熟过程中,动物肌肉组织中ATP的不断消耗和糖原无氧酵解导致pH的下降,最终导致钙泵的功能丧失[25],大量的Ga2+从肌浆网释放到肌浆中,作用于肌钙蛋白C,使肌细丝的构象发生变化,暴露出肌动蛋白上与肌球蛋白结合的位点,同时肌动球蛋白ATP酶有规律的水解ATP释放能量[26],促使肌动蛋白与肌球蛋白通过横桥相互结合或解离,导致细丝沿着粗丝发生移动,肌动蛋白与肌球蛋白相互作用力增大,从而致使肌原纤维发生收缩。而在24—72 h,由于蛋白降解、蛋白相互作用等的影响,肌动球蛋白ATPase活性显著降低,肌动球蛋白解离程度显著增加随后保持稳定,肌节长度显著增加,肌球蛋白与肌动蛋白由高亲和态转为低亲和态,诱使肌节舒张,长度增加。
肌球蛋白轻链2的磷酸化修饰受肌球蛋白调节轻链激酶、Rho kinase、蛋白激酶A和蛋白激酶C等多种酶的调控[27]。肌球蛋白轻链2的磷酸化作用可以增加肌动球蛋白强结合横桥的数量[28]。本研究发现,在宰后6—24 h,肌肉中肌球蛋白轻链2磷酸化水平的显著下降,肌动球蛋白的解离程度显著增大,肌动球蛋白ATPase活性显著增加,这说明肌球蛋白轻链2的去磷酸化有可能导致了肌球蛋白与肌动蛋白强结合横桥数量的下降,表明在一定的生理条件下,有可能肌球蛋白轻链2的去磷酸化会阻碍肌球蛋白与肌动蛋白的结合。另外,由表1可知,肌动球蛋白解离程度和肌球蛋白轻链2磷酸化水平呈现高度的负相关,说明肌球蛋白轻链2的磷酸化在一定程度上可以抑制肌动球蛋白的解离。ALAMO等[13]和BRITO等[14]的研究表明肌球蛋白轻链2磷酸化会破坏肌肉粗、细丝的相互作用,使肌球蛋白重链头部远离粗丝,促进肌球蛋白单体与活跃的收缩细丝的结合,与本研究结果一致。
4 结论
宰后肌肉中的肌球蛋白轻链2的磷酸化水平和肌球蛋白与肌动蛋白间的相互作用均呈动态变化。在宰后6—24 h,肌球蛋白轻链2的磷酸化水平显著下降,肌动球蛋白解离程度显著增加,肌动球蛋白ATPase活性显著增加,肌节长度显著下降,说明宰后肌球蛋白轻链2磷酸化水平的变化对肌球蛋白与肌动蛋白的相互作用有较大的影响;而且肌节收缩(肌球蛋白与肌动蛋白的相互作用力)与肌动球蛋白的解离(肌球蛋白与肌动蛋白的相互作用量)并不是一个同步的进程。在一定的生理状态下,肌球蛋白轻链2磷酸化修饰负向调控肌动球蛋白解离和肌动球蛋白ATPase活性,最终导致肉品嫩度下降。The authors have declared that no competing interests exist.
