 ,1, 黄彩燕1, 郑晓春1, 刘维华2, 杨奇
,1, 黄彩燕1, 郑晓春1, 刘维华2, 杨奇 ,2, 张德权
,2, 张德权 ,1
,1Changes of Antioxidant Activity and Its Possible Mechanism in Tan Sheep Meat in Different Postmortem Time
HOU ChengLi ,1, HUANG CaiYan1, ZHENG XiaoChun1, LIU WeiHua2, YANG Qi
,1, HUANG CaiYan1, ZHENG XiaoChun1, LIU WeiHua2, YANG Qi ,2, ZHANG DeQuan
,2, ZHANG DeQuan ,1
,1通讯作者:
责任编辑: 赵伶俐
收稿日期:2021-05-17接受日期:2021-08-10
| 基金资助: |
Received:2021-05-17Accepted:2021-08-10
作者简介 About authors
侯成立,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1958KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
侯成立, 黄彩燕, 郑晓春, 刘维华, 杨奇, 张德权. 宰后不同时间滩羊肉抗氧化活性的变化及可能机制. 中国农业科学, 2021, 54(23): 5110-5124 doi:10.3864/j.issn.0578-1752.2021.23.015
HOU ChengLi, HUANG CaiYan, ZHENG XiaoChun, LIU WeiHua, YANG Qi, ZHANG DeQuan.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】羊肉是三大畜肉之一,是优质的蛋白质食品,营养价值高,可提供人体必需的氨基酸、脂肪酸、矿物质和维生素等。盐池滩羊是我国优良特色畜种、中国地理标志产品,盐池滩羊肉肉质细嫩、无膻味、脂肪分布均匀、风味独特,深受广大消费者喜爱,是我国高端羊肉的代表品牌。近年来,随着人们生活水平的提高,消费者越来越多地关注肉品的新鲜度、安全性和功能性,对高品质健康肉的需求越来越大[1,2]。肉的抗氧化能力与肉品质密切相关,研究宰后不同时间羊肉抗氧化活性变化对生鲜羊肉的品质调控具有重要意义。【前人研究进展】动物宰后会经历僵直、解僵成熟、腐败3个过程,宰后不同贮藏时间对羊肉品质有重要影响[3]。僵直前羊肉保水性高、营养物质流失少,加工特性优于解僵后的羊肉[4,5];僵直前和解僵初期煮制的羊肉风味物质含量丰富,而解僵后烤制的羊肉风味物质含量相对丰富[6]。关于宰后僵直和解僵成熟过程对肉品质的影响在国内外已开展了大量研究,而对僵直前生鲜肉的品质研究则较少,从而成为近年来的热点。动物屠宰后,肌肉内仍进行着各种氧化反应,并且氧化反应的程度与肉品质密切相关[7,8]。研究表明,生鲜肉加工与贮藏过程中,蛋白质的氧化是导致肉品品质下降的主要原因,如蛋白质氧化能够抑制μ-钙蛋白酶的活性从而影响生鲜肉嫩度[9]。宰后肌肉的抗氧化活性与饲养过程中的饲料组成、动物品种、年龄、分割部位、贮藏时间等外部因素有关,同时生鲜肉的抗氧化活性与游离氨基酸的组成与含量密切相关[10,11,12,13,14,15]。【本研究切入点】现有研究更多地关注解僵成熟生鲜肉在贮藏过程中的氧化反应变化,关于宰后早期羊肉抗氧化活性的变化未见报道。【拟解决的关键问题】本试验以滩羊为研究对象,在宰后0.5、3、6、12和48 h取背最长肌,探究宰后不同时间滩羊肉抗氧化活性的变化,并从游离氨基酸、蛋白质组角度阐释抗氧化活性变化的原因,为开发高品质羊肉提供数据支持。1 材料与方法
样品采集试验于2018年12月在宁夏盐池滩羊产业发展集团有限公司进行;样品测定试验于2019— 2020年在中国农业科学院农产品加工研究所肉品实验室和农业农村部农产品加工重点实验室进行。1.1 材料与仪器
1.1.1 样品采集 选取同一养殖场的6月龄健康舍饲未去势公滩羊6只,饲喂大北农集团肉羊育肥期配合饲料。按伊斯兰屠宰方式屠宰,胴体重为(18.30± 1.41)kg,宰后立即推入0—4℃冷却间冷却,分别在宰后0.5、3、6、12和48 h取单侧背最长肌的部分肌肉样品(约100 g),每个时间点分别各选择3只滩羊取左侧背最长肌、3只滩羊取右侧背最长肌样品,剔除表面脂肪和筋膜,将肌肉样品分为两份,一份5 g左右,经液氮冷冻后干冰保存,冷链运输至实验室,-80℃贮存,用于蛋白质组学分析;剩余95 g左右样品,经液氮冷冻后,用干冰保存,并用冷链运输至实验室,-20℃贮存备用,用于游离氨基酸、抗氧化性能测定。1.1.2 主要仪器与试剂 LGJ-25冷冻干燥机,北京四环科学仪器厂;超低温冰箱,美国Thermo公司;ML204/02电子天平,上海梅特勒-托利多有限公司;FCR1000-UF-E超纯水机,青岛富勒姆科技有限公司;SpectraMax 190全波长酶标仪,美国Molecular Devices公司;L-8900全自动氨基酸分析仪,日本日立公司;HITACHI高速冷冻离心机,日立(中国)有限公司;TissueLyser LT研磨仪,德国QIAGEN公司;SorvallTM LegendTM Micro 17微量离心机,美国Thermo公司;Ultra Turrax Disperser S25匀浆仪,德国IKA集团;SC210A真空干燥仪,美国Thermo公司;RIGOL L-3000高效液相色谱,北京普源精电科技有限公司;Orbitrap Q-Exactive HF质谱仪,美国Thermo公司。
氧自由基吸收能力(oxygen-radical absorbance capacity,ORAC)抗氧化试剂盒(AOX-2),Zenbio公司;总抗氧化能力检测试剂盒(2, 2-联氮基双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2, 2-azinobis-(3- ethylbenzothiazoline-6-sulphonate),ABTS快速法),上海碧云天生物技术有限公司。
1.2 试验方法
1.2.1 抗氧化活性的测定 采用QUENCHER方法对抗氧化活性进行测定[13]。1.2.1.1 样品制备 参考OH等[16]方法制备样品,称取10 g滩羊背最长肌样品,切碎,采用冷冻干燥机进行冻干(冷阱温度-60℃,物料温度-40℃,真空度1 Pa),冻干时间为27 h;将冻干后的样品采用研钵研磨,并与纤维素以1﹕1(w/w)的比例混合,稀释后采用50目筛过筛,用于抗氧化能力的测定。
1.2.1.2 铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)测定 参考BENZIE和STRAIN[17]的方法,分别配制300 mmol∙L-1醋酸钠缓冲液(pH 3.6)、10 mmol∙L-1 2,4,6-三吡啶-咪嗪(TPTZ)溶液与40 mmol∙L-1盐酸的混合液、20 mmol∙L-1氯化铁溶液,并以10﹕1﹕1(v/v/v)的比例混合制备FRAP工作液,在37℃孵育30 min后使用。将10 mg肉粉-纤维素(1﹕1)样品转移到15 mL离心管中,加入10 mL FRAP工作液开始反应,避光涡旋30 s使试管充分混合,于室温避光条件下在轨道摇床上以200 r/min的速度摇晃混合物,以促进样品颗粒和FRAP溶液之间的充分反应,将自由基溶液引入肉样品120 min后,699×g离心2 min,取200 μL上清液转移到96孔板中,并在595 nm处测量吸光度值。FRAP活性表示为每千克干重肉的Trolox毫摩尔当量(mmol Trolox Eq./kg干肉)。
1.2.1.3 ABTS自由基清除能力测定 采用总抗氧化能力检测试剂盒(ABTS法)进行检测,按照试剂盒操作说明进行前处理,称取10 mg肉粉-纤维素(1﹕1)样品转移到15 mL离心管中,加入10 mL冰冷的磷酸缓冲盐溶液进行匀浆,4℃下12 000×g离心5 min,取上清液用于后续测定。取20 μL过氧化物酶工作液加入到96孔板中,加入10 μL待测样品上清液后,加入170 μL ABTS工作液,轻轻混匀,室温孵育6 min,并在414 nm处测定吸光度值。ABTS自由基清除能力表示为每千克干重肉的Trolox毫摩尔当量(mmol Trolox Eq./kg干肉)。
1.2.1.4 2,2-二苯代苦味酰基苯肼(2,2-diphenyl- 1-picrylhydrazyl,DPPH)自由基清除能力测定 参考OH等[16]方法进行测定,称取40 mg DPPH溶解于100 mL乙醇中制备DPPH储备溶液A,然后用100 mL去离子水稀释DPPH储备溶液A,获得水-乙醇(50﹕50,v/v)混合物的DPPH储备溶液B,将200 mL储备溶液A与800 mL储备溶液B混合得到DPPH工作溶液。称取10 mg肉粉-纤维素(1﹕1)样品转移到15 mL的离心管中,添加10 mL的DPPH工作溶液开始反应,在黑暗中涡旋30 s使试管充分混合,于室温避光条件下在轨道摇床上以200 r/min的速度摇晃混合物,以促进肉样品颗粒和DPPH溶液之间的反应,将自由基溶液引入肉样品30 min后,699×g离心2 min。取200 μL上清液转移到96孔板中,并在540 nm处测量吸光度值。DPPH自由基清除能力表示为每千克干重肉的Trolox毫摩尔当量(mmol Trolox Eq./kg干肉)。
1.2.1.5 氧自由基吸收能力(ORAC)测定 采用ORAC荧光法检测试剂盒进行测定,将10 mg肉粉-纤维素(1﹕1)样品加入到15 mL离心管中,添加10 mL冰冷的工作液,避光涡旋30 s使其充分混合待用;按照试剂盒操作说明进行测定,将96孔板37℃预热,加入150 μL荧光素溶液到96孔板中,随后加入25 μL Trolox标品和待测样品,37℃孵育10 min;随后加入25 μL 2, 2'-偶氮二(2-甲基丙基咪)二盐酸盐工作液,在520 nm处测量吸光度值。ORAC值表示为每千克干重肉的Trolox毫摩尔当量(mmol Trolox Eq./kg干肉)。
1.2.1.6 N, N-二甲基-对苯二胺(N, N-dimethyl-p- phenylendiamine,DMPD)总抗氧化能力测定 参考FOGLIANO等[18]方法进行测定,将0.05 mol∙L-1氯化铁、100 mmol∙L-1 DMPD的水溶液和100 mmol∙L-1醋酸缓冲液按2﹕10﹕1000(v/v/v)的比例混合(pH 5.25),制备DMPD工作液。将10 mg肉粉-纤维素(1﹕1)样品加入到15 mL离心管中,添加10 mL DMPD工作溶液开始反应,避光涡旋30 s使试管充分混合,于室温避光条件下在轨道摇床上以200 r/min的速度摇晃混合物,以促进肉样颗粒和FRAP溶液之间的充分反应,将自由基溶液引入肉样品60 min后,699×g离心2 min,取上清液(200 μL)转移到96孔板中,并在505 nm处测定吸光度值。FRAP活性表示为每千克干重肉的Trolox毫摩尔当量(mmol Trolox Eq./kg干肉)。
1.2.2 游离氨基酸测定 参考ZOU等[19]方法,稍作修改。称取3 g左右绞碎的鲜肉样品,加入20 mL 5-磺基水杨酸(3 g/100 mL)均质(6 000 r/min,2×20 s),4℃下10 000×g离心15 min,取上清液定容至25 mL。称取2 mL正己烷于上清液中,混匀振荡(60 s),10 000×g离心10 min后取下层溶液,最后通过0.22 μm水相滤膜过滤后,采用氨基酸自动分析仪对游离氨基酸含量进行测定,结果以mg/100 g鲜肉表示。
1.2.3 蛋白质组学分析 根据抗氧化能力和游离氨基酸结果,选择宰后0.5、6和48 h的滩羊肉进行蛋白质组学分析,具体参考邹波等[20]的方法,对裂解液配方浓度和离心力大小作适当修改。
1.2.3.1 总蛋白提取 取-80℃保存的滩羊肉样品在液氮中研磨成粉,按照1﹕10比例(W/V)加入裂解液(7 mol∙L-1尿素、2 mol∙L-1硫脲、0.1% 3-(3-胆固醇氨丙基)二甲基氨基-1-丙磺酸、1%蛋白酶抑制剂),涡旋混匀,采用组织研磨仪磨成匀浆,冰上静置30 min;16 200×g条件下,4℃离心15 min,取上清液。采用Bradford法测定蛋白浓度,采用SDS-PAGE法对蛋白样品质量进行评测。
1.2.3.2 总蛋白酶解 取蛋白质量为25 μg的上清液,加入到10 kD超滤管(Milipore)中,按照40﹕1(V/V)加入1 mol∙L-1二硫苏糖醇溶液(终浓度为25 mmol∙L-1),涡旋混匀,37℃水浴1 h;随后,按照20﹕1(V/V)加入1 mol∙L-1碘乙酰胺溶液(终浓度为50 mmol∙L-1),涡旋混匀,避光室温放置30 min;随后,加入300 μL 20 mmol∙L-1的四乙基溴化铵,13 800×g离心10 min,收集底部溶液,重复操作3次;随后,加入2%的胰蛋白酶(Promege),37℃消化12 h;最后,加入四乙基溴化铵,13 800×g离心10 min,收集管底部溶液,重复3次。
1.2.3.3 固相萃取 采用ZipTip C18固相萃取柱对酶切的多肽溶液进行萃取,采用10 μL 100%乙腈对萃取柱进行活化,采用10 μL 2%乙腈-0.1%甲酸溶液平衡萃取柱。上样后采用10 μL 2%乙腈-0.1%甲酸溶液进行清洗脱盐(重复5次),采用50%乙腈-0.1%甲酸溶液进行洗脱,收集洗脱液真空抽干后-80℃保存备用。
1.2.3.4 LC-MS/MS分析 将多肽组分重溶于10 μL 0.1%甲酸溶液中,经过EASY-nLC液相,低pH反相C18毛细管色谱柱(150 μm×150 mm,1.9 μm)分离,A相为0.1%甲酸,B相为80%乙腈和0.1%甲酸,线性洗脱,流动相B从12%到100%,总洗脱时间为120 min,流速为0.6 μL∙min-1。
采用Orbitrap Q-Exactive HF质谱仪分析鉴定多肽混合物,喷雾电压2 200 V,离子源温度320℃,选择高灵敏度模式,每个全扫描为高速信号依赖扫描,扫描时间为120 min。一级全扫描分辨率为60 000,扫描范围为300—1 500 m/z,AGC为3e6,最大注射时间为80 ms;每一个一级扫描后筛选前20个离子进入碰撞池打碎,碰撞能量为30%,二级扫描分辨率为15 000,电荷状态筛选(包含+2—+6电荷的前体),动态消除20 s。
1.2.3.5 数据库检索、蛋白质定量、功能分析 所得质谱数据经MaxQuant(version 1.5.3.8)检索匹配和定量分析,使用数据库为:uniprot_proteome_UP000002356_ sheep_23111_20200310.fasta(序列总数:23 111)。采用Perseus(1.5.5.1)软件进行相关性和PCR分析。基于样本技术重复间蛋白定量比值的分布,确定筛选差异蛋白ratio的阈值。选取2组样本间蛋白ratio≤ 1-2SD或ratio≥1+2SD作为筛选差异蛋白ratio的阈值,以P<0.05、差异倍数>1.5或<0.67作为阈值,选取差异蛋白。采用OmicsBox(版本:1.2.4)软件对差异蛋白进行功能注释分析和GO富集分析。
1.3 数据分析
每个处理组6个生物学重复,每个样品测2—3次,取平均值。采用SPSS19.0统计软件进行方差分析,选用Duncan’s法进行多重比较分析,采用Person进行相关性比较;结果表示为平均值±标准差,以P<0.05为差异显著性判断标准,以P<0.01为差异极显著性判断标准。2 结果
2.1 宰后不同时间滩羊肉抗氧化活性
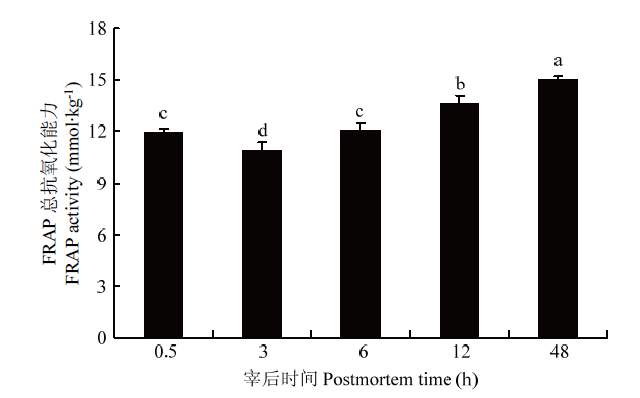
如图1所示,宰后48 h内,滩羊肉中FRAP总抗氧化能力呈先下降后上升的趋势。宰后3 h滩羊肉中FRAP总抗氧化能力最低,且显著低于宰后0.5 h和6 h的水平(P<0.05)。宰后3 h以后,随着宰后时间的延长,滩羊肉中FRAP总抗氧化能力呈上升趋势,宰后6、12和48 h之间均存在显著性差异(P<0.05)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1宰后不同时间滩羊肉中FRAP总抗氧化能力
不同小写字母表示处理间差异显著(P<0.05)。下同
Fig. 1FRAP activity of Tan lamb in different postmortem time
Different lowercase letters indicate significant difference between treatments (P<0.05). The same as below
宰后48 h内,滩羊肉中ABTS自由基清除能力呈先升高后趋于稳定的变化趋势。宰后0.5、3和6 h之间,滩羊肉中ABTS自由基清除能力存在显著性差异(P<0.05);宰后6、12和48 h,滩羊肉ABTS自由基清除能力差异不显著(P>0.05)(图2-A)。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2宰后不同时间滩羊肉中自由基清除能力
Fig. 2Radical scavenging activity of Tan lamb in different postmortem time
宰后48 h内,滩羊肉中DPPH和DMPD自由基清除能力整体均呈现上升的变化趋势。宰后0.5 h和3 h滩羊肉中DPPH和DMPD自由基清除能力差异不显著(P>0.05)。宰后6、12和48 h滩羊肉中DPPH和DMPD自由基清除能力显著高于宰后0.5 h水平(P<0.05)。同时,宰后6、12和48 h之间均存在显著性差异(P<0.05)(图2-B、C)。
滩羊肉中ORAC在宰后48 h内整体呈现上升的变化趋势。宰后0.5 h和3 h滩羊肉中ORAC差异显著(P<0.05),宰后6、12和48 h滩羊肉中ORAC显著增加(P<0.05)(图2-D)。
2.2 宰后不同时间滩羊肉中游离氨基酸含量
如表1所示,滩羊肉中游离氨基酸的总含量为1 085.16—1 100.43 mg/100 g,不同时间点游离氨基酸总含量差异不显著(P>0.05)。滩羊肉中主要的游离氨基酸为肌肽(499.15—555.97 mg/100 g)、鹅肌肽(197.54 —213.93 mg/100 g)、谷氨酸(108.09—120.10 mg/100 g)、牛磺酸(70.26—92.20 mg/100 g)、丙氨酸(49.53—52.07 mg/100 g)和甘氨酸(20.13—21.40 mg/100 g)等,以上氨基酸的含量在不同时间点基本不存在显著性差异(P>0.05)。胱氨酸、亮氨酸、酪氨酸、异亮氨酸、苯丙氨酸、精氨酸的含量在不同时间点存在显著性差异(P<0.05),并且总体呈增加的趋势,宰后48 h滩羊肉中的含量显著高于宰后0.5 h的滩羊肉(P<0.05)。Table 1
表1
表1宰后不同时间滩羊肉中游离氨基酸含量
Table 1
| 氨基酸含量 Amino acid (mg/100 g fresh meat) | 宰后时间Postmortem time (h) | P值 P value | ||||
|---|---|---|---|---|---|---|
| 0.5 | 3 | 6 | 12 | 48 | ||
| 邻磷酸丝氨酸 o-Phospho-serine | 4.16±0.29b | 4.14±0.31b | 4.19±0.64b | 4.45±0.41ab | 4.85±0.65a | 0.08 |
| 牛磺酸 Taurine | 79.10±41.24a | 92.20±32.03a | 80.19±28.93a | 73.62±27.64a | 70.26±36.18a | 0.83 |
| 邻苯二乙醇胺 o-Phsophoethanolamine | 3.25±0.68a | 3.18±0.34a | 2.95±0.39a | 2.80±0.42a | 3.09±0.71a | 0.60 |
| 天冬氨酸 Aspartic acid | 0.76±1.19a | 0.50±1.23a | 0.05±0.13a | 0.00±0.00a | 0.04±0.09a | 0.33 |
| 苏氨酸 Threonine | 4.33±1.53a | 5.03±1.19a | 4.74±1.69a | 5.05±1.33a | 5.22±1.24a | 0.82 |
| 丝氨酸 Serine | 6.63±0.47a | 6.68±0.71a | 6.76±0.63a | 6.92±1.18a | 6.78±0.72a | 0.97 |
| 谷氨酸 Glutamic acid | 120.10±15.06a | 111.63±19.4a | 108.09±22.41a | 111.07±25.38a | 108.38±24.75a | 0.87 |
| 甘氨酸 Glycine | 20.13±3.15a | 21.22±2.50a | 20.69±2.42a | 21.40±1.18a | 20.88±1.92a | 0.90 |
| 丙氨酸 Alanine | 49.53±6.12a | 51.46±4.48a | 51.76±4.34a | 52.07±2.27a | 51.04±2.23a | 0.85 |
| 缬氨酸 Valine | 1.39±0.85a | 0.92±0.44a | 0.97±1.31a | 1.30±0.82a | 1.37±0.28a | 0.77 |
| 蛋氨酸 Methionine | 0.04±0.02a | 0.03±0.01a | 0.04±0.02a | 0.05±0.03a | 0.05±0.05a | 0.84 |
| 胱氨酸 Cystine | 1.04±0.10b | 1.17±0.10ab | 1.14±0.14b | 1.09±0.17b | 1.31±0.16a | 0.02 |
| 亮氨酸 Leucine | 1.81±0.30c | 2.13±0.17bc | 2.20±0.13b | 2.27±0.19b | 2.66±0.46a | 0.00 |
| 酪氨酸 Tyrosine | 4.97±0.67c | 5.78±0.75bc | 6.17±0.66b | 6.42±0.72b | 7.55±1.05a | 0.00 |
| 异亮氨酸 Isoleucine | 1.99±0.29b | 2.40±0.43ab | 2.43±0.37ab | 2.47±0.31ab | 2.79±0.53a | 0.03 |
| 苯丙氨酸 Phenylalanine | 2.00±0.40c | 2.33±0.31bc | 2.41±0.27bc | 2.49±0.32ab | 2.89±0.43a | 0.00 |
| γ-氨基丁酸 γ-Amino-n-butyric acid | 0.90±0.16a | 0.85±0.17a | 0.88±0.14a | 0.86±0.10a | 0.80±0.07a | 0.78 |
| 氨 Ammonia | 18.83±4.17a | 20.57±2.66a | 20.99±2.15a | 21.08±1.71a | 21.75±1.94a | 0.42 |
| 鸟氨酸 Ornithine | 1.70±0.53a | 1.38±0.34bc | 1.27±0.34bc | 1.10±0.12b | 1.49±0.42bc | 0.10 |
| 赖氨酸 Lysine | 2.56±0.91b | 3.12±0.58ab | 3.21±0.66ab | 3.31±0.57ab | 3.79±0.89a | 0.10 |
| 组氨酸 Histidine | 2.57±0.36a | 2.80±0.73a | 2.84±0.92a | 3.14±0.69a | 3.32±0.70a | 0.40 |
| 鹅肌肽 Anserine | 197.54±25.69a | 200.95±24.56a | 208.89±18.77a | 213.93±18.28a | 202.07±28.81a | 0.76 |
| 肌肽 Carnosine | 499.15±27.17a | 530.58±65.12a | 533.56±85.88a | 555.97±34.04a | 528.04±65.02a | 0.60 |
| 精氨酸 Arginine | 6.03±1.02c | 7.03±0.81bc | 7.53±1.41ab | 7.13±1.05ab | 8.51±0.63a | 0.01 |
| 脯氨酸 Proline | 5.63±0.89ab | 4.88±1.62b | 5.29±1.07ab | 5.20±0.62ab | 6.32±0.89a | 0.15 |
| 合计 Total | 1086.05±62.03a | 1100.05±78.03a | 1081.83±70.54a | 1100.43±15.42a | 1085.16±57.00a | 0.97 |
新窗口打开|下载CSV
与FRAP显著相关的游离氨基酸有7个,均呈现显著正相关关系,包括邻磷酸丝氨酸(r=0.489,P<0.01)、亮氨酸(r=0.566,P<0.01)、酪氨酸(r=0.596,P<0.01)、异亮氨酸(r=0.374,P<0.05)、苯丙氨酸(r=0.499,P<0.01)、赖氨酸(r=0.375,P<0.05)和精氨酸(r=0.376,P<0.05)。其中,亮氨酸、酪氨酸、苯丙氨酸、精氨酸与FRAP、ABTS、DPPH、ORAC、DMPD均呈极显著正相关关系(P<0.01)(表2)。
Table 2
表2
表2滩羊肉中游离氨基酸含量与抗氧化活性的相关性
Table 2
| 氨基酸名称 Amino acid name | 相关系数 Correlation coefficients | ||||
|---|---|---|---|---|---|
| FRAP | ABTS | DPPH | ORAC | DMPD | |
| 邻磷酸丝氨酸 o-Phospho-serine | 0.480** | 0.208 | 0.420* | 0.417* | 0.417* |
| 牛磺酸 Taurine | -0.226 | -0.091 | -0.188 | -0.227 | -0.235 |
| 邻苯二乙醇胺 o-Phsophoethanolamine | -0.106 | -0.236 | -0.222 | -0.132 | -0.181 |
| 天冬氨酸 Aspartic acid | -0.252 | -0.393* | -0.378* | -0.246 | -0.268 |
| 苏氨酸 Threonine | 0.128 | 0.213 | 0.135 | 0.192 | 0.241 |
| 丝氨酸 Serine | 0.114 | 0.175 | 0.120 | 0.143 | 0.137 |
| 谷氨酸 Glutamic acid | -0.034 | -0.129 | -0.162 | -0.117 | -0.110 |
| 甘氨酸 Glycine | 0.063 | 0.083 | 0.062 | -0.040 | 0.086 |
| 丙氨酸 Alanine | 0.077 | 0.182 | 0.113 | 0.076 | 0.098 |
| 缬氨酸 Valine | 0.168 | -0.109 | 0.111 | 0.208 | 0.082 |
| 蛋氨酸 Methionine | 0.270 | -0.022 | 0.168 | 0.247 | 0.080 |
| 胱氨酸 Cystine | 0.313 | 0.227 | 0.296 | 0.226 | 0.312 |
| 亮氨酸 Leucine | 0.566** | 0.487** | 0.597** | 0.471** | 0.629** |
| 酪氨酸 Tyrosine | 0.596** | 0.493** | 0.656** | 0.532** | 0.679** |
| 异亮氨酸 Isoleucine | 0.374* | 0.391* | 0.456* | 0.324 | 0.425* |
| 苯丙氨酸 Phenylalanine | 0.499** | 0.405* | 0.545** | 0.445* | 0.569** |
| γ-氨基丁酸 γ-Amino-n-butyric acid | -0.234 | -0.171 | -0.144 | -0.193 | -0.153 |
| 氨 Ammonia | 0.235 | 0.371* | 0.289 | 0.230 | 0.258 |
| 鸟氨酸 Ornithine | -0.010 | -0.402* | -0.274 | -0.117 | -0.091 |
| 赖氨酸 Lysine | 0.375* | 0.265 | 0.410* | 0.271 | 0.391* |
| 组氨酸 Histidine | 0.333 | 0.252 | 0.337 | 0.300 | 0.372* |
| 鹅肌肽 Anserine | 0.075 | 0.269 | 0.157 | 0.073 | 0.095 |
| 肌肽 Carnosine | 0.040 | 0.370* | 0.187 | 0.110 | 0.170 |
| 精氨酸 Arginine | 0.376* | 0.486** | 0.493** | 0.384* | 0.536** |
| 脯氨酸 Proline | 0.324 | -0.078 | 0.212 | 0.285 | 0.370* |
| 合计 Total | -0.089 | -0.014 | -0.016 | -0.116 | -0.078 |
新窗口打开|下载CSV
2.3 宰后不同时间滩羊肉蛋白质组
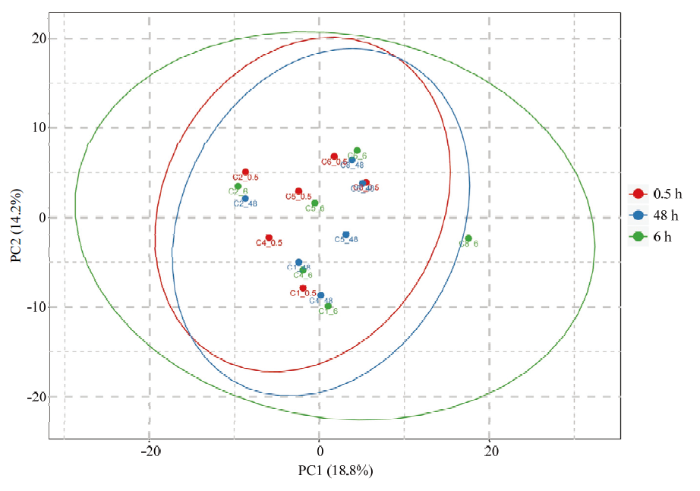
根据宰后不同时间滩羊肉抗氧化活性结果,选择宰后0.5、6和48 h的滩羊肉进行蛋白组学分析,总共鉴定出1 030个蛋白(其中787个为共定量蛋白),共有971个蛋白在数据库中有其对应的GO条目。通过对滩羊肉蛋白质组进行主成分分析(图3),3个处理组不能完全分开,表明宰后3个时间点的滩羊肉蛋白质组差异有限。以P<0.05、差异倍数>1.5或<0.67作为阈值,筛选出宰后不同时间的滩羊肉中存在差异蛋白20个,如图4所示,随着宰后时间的延长,上调的蛋白有伴肌动蛋白(W5PFV9)、糖原蛋白1(W5P5C5)、H15结构域蛋白(W5NS65)、肽基脯氨酰异构酶(W5PHT7)、电压门控钙离子通道辅助亚基α2δ-1(W5Q466)、脯氨酸/精氨酸丰富端亮氨酸丰富重复蛋白(W5NUA0)、泛素羧基末端水解酶(W5Q922)、蛋白激酶结构域蛋白(W5QG38)、苯丙氨酰-tRNA合成酶β(W5QGI4)、H1组蛋白家族成员0(W5QGM7);下调的蛋白有钙蛋白酶抑制蛋白(C3V6M4)、辅酶Q8A(W5NTS5)、亲联蛋白1(W5P8Z2)、蛋白酶体26S亚基ATP合酶(W5P9K6)、亮氨酸拉链和CTNNBIP1结构域(W5PA76)、载脂蛋白B mRNA编辑酶催化亚基2(W5NRQ5)、真核细胞翻译起始因子4H(W5PQJ1)、胞膜窖相关蛋白4(W5PCH1)以及2个未知蛋白(W5PID4、W5PP64)。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3宰后不同时间滩羊肉整体差异分析
Fig. 3Overall difference analysis among the Tan lamb in different postmortem time
图4
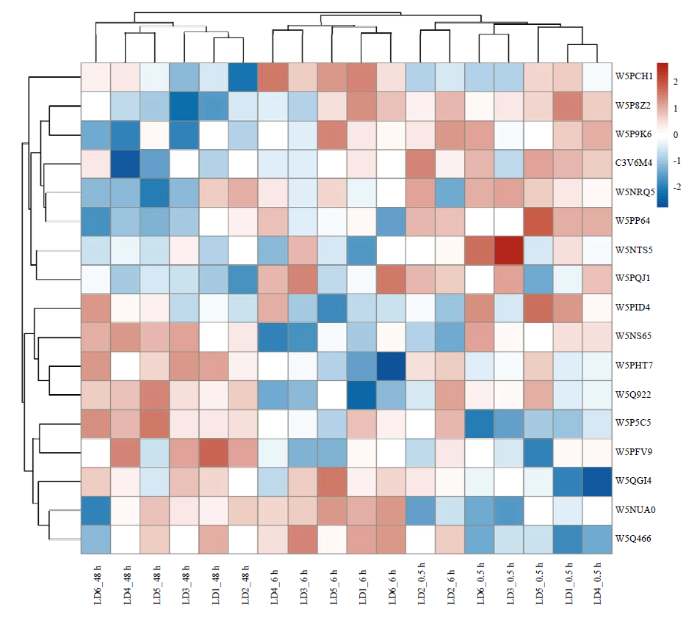 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4宰后不同时间滩羊肉中差异蛋白层次聚类热图
图中不同列代表不同的样品(LD代表背最长肌,数字代表宰后时间),不同行代表不同的蛋白;颜色代表蛋白在样品中的表达量(深红色代表高强度,深蓝色代表低强度,白色代表中强度)
Fig. 4Hierarchical clustering and heatmap of differentially abundant proteins in Tan lamb in different postmortem time
Different columns represent different samples (LD represents the longissimus dorsi and the number represents postmortem time), and different rows represent different proteins. The color represents the relative abundance of the proteins (Deeper red represents higher intensity, deeper blue represents lower intensity, and white represents middle intensity)
对宰后不同时间滩羊肉中的差异蛋白进行GO组分富集分析(图5),这些蛋白主要参与生物学进程、细胞组分和分子功能。其中,参与生物学过程的蛋白主要涉及核小体的组织、组装等;在细胞组分中,富集的功能包括核小体、DNA包装复合体、蛋白质-DNA复合体等;在分子功能中,蛋白质主要参与电压门控性钙通道活性、葡萄糖苷转移酶活性、胞苷脱氨酶活性等过程。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5宰后不同时间滩羊肉中差异蛋白GO富集分析图
纵坐标为GO条目,横坐标表示差异蛋白在对应的功能条目中的富集情况,-LOG 10 P-Value的值越大,差异蛋白和该功能越相关
Fig. 5GO enrichment analysis diagram of differentially abundant proteins in Tan lamb in different postmortem time
The ordinate is the GO entry, and the abscissa indicates the enrichment of the differential protein in the corresponding function entry. The larger the value of -LOG 10 P-Value, the more relevant the differential protein and the function
3 讨论
3.1 宰后不同时间的滩羊肉抗氧化活性变化
由于肉品是复杂体系,难以用单一的方法确定其抗氧化活性。本研究采用FRAP总抗氧化能力、ORAC、DPPH、DMPD、ABTS自由基清除能力等5种方法评价宰后不同时间滩羊肉的抗氧化活性,其中,DPPH、ABTS、FRAP三种抗氧化均属于单电子转移(ET)机制,是体外评价活性物质抗氧化能力的常见方法,操作简单[21,22,23]。ORAC是指氧化自由基吸收能力,是国际上衡量抗氧化能力的通用指标[24];DMPD是一种有机自由基前提物,在酸性条件下可被Fe3+、H2O2等氧化形成有色自由基,被用来测定水溶性样品的抗氧化能力[21]。动物屠宰后,血液循环停止,肌细胞中的氧化-还原平衡被打破,由于缺乏能量的持续供给,肌细胞启动凋亡程序,发生细胞内氧化损伤。正常活体内,机体内的抗氧化防御体系主要由超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等抗氧化酶保护体系和由维生素C、维生素E、胡萝卜素等物质组成的非酶保护体系共同构成[25]。宰后肌肉中的抗氧化物质含量和活性会随着宰后时间的延长而逐渐消耗,直至无法有效降低活性氧自由基对肌肉的损耗,从而影响肉品品质变化,樊路杰等[7]研究发现,宰后肌肉氧化反应的程度与肉色、保水性、货架期长短密切相关。之前研究多数集中在宰后贮藏过程中蛋白质、脂肪氧化对肉品质的影响,而对宰后早期(48 h内)肌肉中抗氧化能力的研究较少。本研究中,随着宰后贮藏时间延长(0—48 h),滩羊肉中FRAP、DMPD、ORAC、DPPH总抗氧化能力总体呈上升趋势。宰后48 h内,肌肉经历着僵直、解僵成熟过程,肌细胞内环境发生巨大变化,肌细胞启动凋亡程序,能量代谢酶、细胞凋亡酶、钙激活酶等发挥作用,肌细胞内进行着复杂的代谢活动,尽可能维持细胞的平衡状态。本研究证实宰后早期48 h内滩羊肉具有较强的自由基清除能力。
宰后不同时间滩羊肉20个差异蛋白中,与FRAP显著相关的差异蛋白有12个,其中与钙蛋白酶抑制蛋白、真核细胞翻译起始因子4H、亮氨酸拉链和CTNNBIP1结构域、未知蛋白2等4个蛋白呈显著负相关关系(P<0.05),与亲联蛋白1和蛋白酶体26S亚基ATP合酶呈极显著负相关关系(P<0.01);与H15结构域蛋白、肽基脯氨酰异构酶呈显著正相关关系(P<0.05),与糖原蛋白1、伴肌动蛋白、蛋白激酶结构域蛋白、H1组蛋白家族成员0等4个蛋白呈极显著正相关关系(P<0.01)。钙蛋白酶抑制蛋白和未知蛋白2与FRAP、ABTS、DPPH、ORAC、DMPD均呈现显著负相关关系(P<0.05),其中钙蛋白酶抑制蛋白与DPPH呈极显著负相关关系(P<0.01),未知蛋白2与ABTS、DPPH、ORAC、DMPD呈极显著负相关关系(P<0.01)。而糖原蛋白1和蛋白激酶结构域蛋白与FRAP、ABTS、DPPH、ORAC、DMPD均呈显著正相关关系(P<0.05)。
3.2 宰后不同时间滩羊肉中游离氨基酸变化
本研究中,肌肽、鹅肌肽、谷氨酸、牛磺酸、丙氨酸和甘氨酸是滩羊肉中主要的游离氨基酸,与OH等[16]在Hanwoo牛肉上的研究结果一致。OH等[16]研究发现,肌肽是Hanwoo牛10个部位中最丰富的游离氨基酸,其次为鹅肌肽、谷氨酸、牛磺酸和丙氨酸。肌肽又称β-丙氨酰-L-组氨酸,是天然存在于肌肉中的水溶性二肽,具有清除自由基、螯合转运金属离子、淬灭单线态氧等抗氧化性质[26,27];鹅肌肽又称β-丙氨酰-1-甲基-L-组氨酸,具有水溶性和显著的抗氧化、抗衰老、降尿酸等功能[28]。牛磺酸又称2-氨基乙磺酸,是机体内含量最丰富的游离氨基酸,是人体健康必不可少的一种营养素,具有多种生理功能,是婴幼儿生长发育的必需氨基酸,可促进大脑生长发育,有助于预防心血管疾病、高血压、糖尿病等[29]。本研究中,滩羊背最长肌中肌肽、牛磺酸的含量高于德克赛尔杂交羔羊背最长肌中肌肽(458 mg/100 g)和牛磺酸(57.3 mg/100 g)的含量[30]以及Hanwoo牛肋脊部肉中的含量[16]。HOU等[31]和TRIKI等[32]研究发现,谷氨酰胺、丙氨酸、甘氨酸是羊肉的主要游离氨基酸,而牛肉中主要的游离氨基酸是天冬氨酸、谷氨酰胺和甘氨酸[33]。肌肉中游离氨基酸的含量受品种、部位、贮藏时间等因素的影响[16,32,34-35];另外,由于测定方法的差异,部分研究没有测定牛磺酸、肌肽、鹅肌肽等游离氨基酸含量。Table 3
表3
表3滩羊肉中差异蛋白丰度与抗氧化活性的相关性
Table 3
| 登记号 Accession | 蛋白名称 Protein name | 相关系数 Correlation coefficient | ||||
|---|---|---|---|---|---|---|
| FRAP | ABTS | DPPH | ORAC | DMPD | ||
| C3V6M4 | 钙蛋白酶抑制蛋白 Calpastatin | -0.556* | -0.587* | -0.638** | -0.573* | -0.589* |
| W5NRQ5 | 载脂蛋白B mRNA编辑酶催化亚基2 Apolipoprotein B mRNA editing enzyme catalytic subunit 2 | -0.432 | -0.544* | -0.584* | -0.409 | -0.599** |
| W5NS65 | H15结构域蛋白 H15 domain-containing protein | 0.471* | -0.155 | 0.142 | 0.396 | 0.375 |
| W5NTS5 | 辅酶Q8A Coenzyme Q8A | -0.223 | -0.372 | -0.448 | -0.289 | -0.359 |
| W5NUA0 | 脯氨酸/精氨酸丰富端亮氨酸丰富重复蛋白 Proline and arginine rich end leucine rich repeat protein | 0.052 | 0.541* | 0.422 | 0.126 | 0.169 |
| W5P5C5 | 糖原蛋白1 Glycogenin 1 | 0.642** | 0.655** | 0.800** | 0.637** | 0.818** |
| W5P8Z2 | 亲联蛋白1 Junctophilin 1 | -0.786** | -0.467 | -0.632** | -0.817** | -0.630** |
| W5P9K6 | 蛋白酶体26S亚基ATP合酶 Proteasome 26S subunit, ATPase 3 | -0.738** | -0.384 | -0.558* | -0.722** | -0.651** |
| W5PA76 | 亮氨酸拉链和CTNNBIP1结构域 Leucine zipper and CTNNBIP1 domain containing | -0.465* | -0.296 | -0.527 | -0.487* | -0.572* |
| W5PCH1 | 胞膜窖相关蛋白4 Caveolae associated protein 4 | -0.442 | 0.168 | -0.100 | -0.333 | -0.305 |
| W5PFV9 | 伴肌动蛋白 Nebulin | 0.627** | 0.253 | 0.539* | 0.587* | 0.596** |
| W5PHT7 | 肽基脯氨酰异构酶 Peptidylprolyl isomerase | 0.562* | -0.027 | 0.256 | 0.508* | 0.416 |
| W5PID4 | 未知蛋白1 Uncharacterized protein 1 | 0.025 | -0.502* | -0.319 | -0.056 | -0.151 |
| W5PP64 | 未知蛋白2 Uncharacterized protein 2 | -0.557* | -0.674** | -0.674** | -0.627** | -0.673** |
| W5PQJ1 | 真核细胞翻译起始因子4H Eukaryotic translation initiation factor 4H | -0.521* | -0.056 | -0.376 | -0.505* | -0.443 |
| W5Q466 | 电压门控钙离子通道辅助亚基α2δ-1 Calcium voltage-gated channel auxiliary subunit alpha 2 delta 1 | 0.183 | 0.742** | 0.555* | 0.284 | 0.334 |
| W5Q922 | 泛素羧基末端水解酶 Ubiquitin carboxyl-terminal hydrolase | 0.447 | -0.040 | 0.230 | 0.403 | 0.465 |
| W5QG38 | 蛋白激酶结构域蛋白 Protein kinase domain-containing protein | 0.611** | 0.489* | 0.584* | 0.607** | 0.539* |
| W5QGI4 | 苯丙氨酰-tRNA合成酶β Phenylalanyl-tRNA synthetase subunit beta | 0.261 | 0.634** | 0.499* | 0.456 | 0.406 |
| W5QGM7 | H1组蛋白家族成员0 H1 histone family member 0 | 0.716** | 0.058 | 0.454 | 0.574* | 0.626** |
新窗口打开|下载CSV
本研究表明,宰后滩羊肉中胱氨酸、亮氨酸、酪氨酸、异亮氨酸、苯丙氨酸、精氨酸的含量随着时间的延长,含量呈现增加趋势,这与之前研究结果一致[34,35];宰后48 h内,滩羊肉中游离氨基酸的总量没有发生显著变化,表明本研究中滩羊肉中蛋白质没有发生大量水解,与之前的研究结果一致[36]。生鲜肉的抗氧化活性受到诸多因素的影响,如维生素、多酚、脂肪酸、氨基酸、酶等[8,13,34]。WU等[37]研究表明,马鲛鱼肉在贮藏过程中,游离氨基酸和肽的变化与抗氧化活性显著相关。另有研究表明,不稳定的氨基酸侧链,如半胱氨酸、蛋氨酸、色氨酸、酪氨酸、组氨酸和苯丙氨酸,在含有低能量自由基的体系中可作为抗氧化剂[38]。本研究中,胱氨酸、酪氨酸、苯丙氨酸、精氨酸的含量呈现升高趋势,并且亮氨酸、酪氨酸、苯丙氨酸、精氨酸与FRAP、ABTS、DPPH、ORAC、DMPD均呈显著正相关关系,部分结果与PÉREZ等[39]在蜂蜜上的研究结果一致。因此,推测宰后不同贮藏时间滩羊肉抗氧化能力的变化与氨基酸含量有关。本研究关于DPPH自由基清除能力的结果与FU等[40]和LIU等[41]在宰后成熟过程中牛肉和鸭肉上的研究结果一致,DPPH自由基清除能力与宰后成熟过程中生物活性肽的释放和游离氨基酸含量的变化有关。
3.3 宰后不同时间滩羊肉蛋白质质组变化
本研究筛选出宰后不同时间滩羊肉的差异蛋白20个,差异蛋白的数量与师希雄等[42]在牦牛肉上的研究结果相当,其鉴定出牦牛肉成熟前后18个差异表达蛋白,其中14个蛋白质在成熟过程中表达量下降,包括代谢酶、结构蛋白以及应激蛋白。本研究中,随着宰后时间的延长,蛋白表达量上升的蛋白有伴肌动蛋白、肽基脯氨酰异构酶、电压门控钙离子通道辅助亚基α2δ-1、脯氨酸/精氨酸丰富端亮氨酸丰富重复蛋白、泛素羧基末端水解酶、蛋白激酶结构域蛋白、苯丙氨酰-tRNA合成酶β等。伴肌动蛋白存在于肌节的I带中,连接细肌丝与Z区,并将肌动蛋白单体连接在一起,通常在宰后1 d后开始降解[43]。泛素羧基末端水解酶,是泛素-蛋白酶体系统中的重要成员,具有去泛素化的作用[44];苯丙氨酰-tRNA合成酶β在蛋白质生物合成中具有重要作用,其在氧化应激下可逆性失活[10];肽基脯氨酰异构酶通过加速脯氨酸肽键的顺反异构化调节蛋白质功能[45];电压门控钙离子通道辅助亚基α2δ-1对电压门控钙通道具有重要的调节作用,参与维持细胞内钙稳态[46]。本研究鉴定出的其他差异蛋白通过功能预测表明参与细胞生物学过程、分子功能等。钙蛋白酶抑制蛋白是一种内源性、需Ca2+的钙蛋白酶抑制蛋白,通过抑制μ-钙蛋白酶活性影响宰后肌肉嫩化进程[47,48]。宰后肌肉中钙蛋白酶抑制蛋白的含量逐渐减少,其被降解和失活的速度与肌肉中蛋白质的水解和肉嫩度有关,通过与μ-钙蛋白酶之间的相互作用共同参与调控宰后肌肉的嫩度[49]。本研究中,随着宰后时间的延长,滩羊肉中钙蛋白酶抑制蛋白的表达量下降,与前人研究一致。亲联蛋白1是一种位于骨骼肌三联管处的蛋白,连接横管和肌浆网,对维持三联管稳定发挥重要作用。缺失亲联蛋白1可导致肌浆网崩解[50],本研究中,随着宰后时间的延长,滩羊肉中亲联蛋白1的表达量下降,表明宰后肌肉僵直、解僵过程中,肌细胞结构受到破坏,解离后的亲联蛋白1容易被肌浆中的蛋白质水解酶降解,导致表达量下降。辅酶Q也叫泛醌(Ubiquinone),是一类脂溶性醌类化合物,具有很强的抗氧化能力[51]。胞膜窖(Caveolae)是细胞膜内陷形成的一种特殊的脂筏结构,并在调节细胞信号转导中发挥重要作用[52]。26S蛋白酶体是细胞中负责蛋白质降解的主要分子机器,参与生物体的大多数生命活动[53],而ATP合酶是生物体能量转换的核心酶[54]。真核细胞翻译起始因子、亮氨酸拉链和CTNNBIP1结构域、载脂蛋白B mRNA编辑酶催化亚基2等在肌肉代谢中发挥着重要作用[55,56]。
本研究中,钙蛋白酶抑制蛋白和未知蛋白2与FRAP、ABTS、DPPH、ORAC、DMPD均呈显著负相关关系,而糖原蛋白1和蛋白激酶结构域蛋白与FRAP、ABTS、DPPH、ORAC、DMPD均呈显著正相关关系。王磊[57]研究表明,抗氧化蛋白、分子伴侣蛋白和一些酶类参与调节宰后机体细胞内的氧化应激和氧化还原调节等过程,从而间接导致其肉色的差异。这表明,钙蛋白酶抑制蛋白、未知蛋白2、糖原蛋白1和蛋白激酶结构域蛋白可作为表征宰后肌肉抗氧化活性的潜在标志物。综上,宰后初期肌肉中进行着复杂的代谢活动,代谢酶、伴侣蛋白、应激蛋白等参与宰后早期肌肉氧化还原调节过程,下一步将从分子代谢通路角度阐释宰后初期肌肉抗氧化活性变化的机制。
4 结论
宰后48 h内,滩羊肉总抗氧化能力总体呈现上升趋势,并且抗氧化能力的升高与宰后肌肉中亮氨酸、酪氨酸、苯丙氨酸、精氨酸等游离氨基酸的释放有关;宰后初期,肌肉中钙蛋白酶抑制蛋白、未知蛋白2等蛋白表达量的下降和糖原蛋白1、蛋白激酶结构域蛋白等蛋白表达量的上升与宰后滩羊肉抗氧化能力的变化显著相关。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.meatsci.2020.108220URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1016/j.meatsci.2011.07.014URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.bbagen.2018.04.023URL [本文引用: 2]
DOI:10.1016/j.meatsci.2007.12.006URL [本文引用: 1]
DOI:10.1016/j.meatsci.2012.11.009URL [本文引用: 1]
DOI:10.1016/j.meatsci.2011.05.027URL [本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.meatsci.2016.04.016URL [本文引用: 6]
DOI:10.1006/abio.1996.0292URL [本文引用: 1]
DOI:10.1021/jf980496sURL [本文引用: 1]
DOI:10.1016/j.ultsonch.2018.04.005URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1177/1082013202008003770URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.3390/antiox8120592URL [本文引用: 1]
DOI:10.1016/j.jfca.2006.01.003URL [本文引用: 1]
DOI:10.1080/10408399409527669URL [本文引用: 1]
DOI:10.3382/ps.2013-03441URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1073/pnas.85.9.3175URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0309-1740(03)00181-5URL [本文引用: 1]
[本文引用: 1]
DOI:10.3390/foods7090132URL [本文引用: 2]
DOI:10.1016/j.jfca.2014.12.011URL [本文引用: 1]
DOI:10.1016/S0309-1740(96)00088-5URL [本文引用: 3]
DOI:10.1016/S0309-1740(00)00152-2URL [本文引用: 2]
[本文引用: 1]
DOI:10.1016/S0963-9969(03)00104-2URL [本文引用: 1]
DOI:10.1080/10408390701425615URL [本文引用: 1]
DOI:10.1021/jf062055bURL [本文引用: 1]
DOI:10.1016/j.meatsci.2016.09.015URL [本文引用: 1]
DOI:10.1016/j.foodchem.2017.05.094URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.cca.2010.07.035URL [本文引用: 1]
DOI:10.1002/bies.v42.7URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3389/fgene.2018.00056URL [本文引用: 1]
DOI:10.1016/j.foodchem.2016.09.048URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1113/jphysiol.2012.243279URL [本文引用: 1]
DOI:10.1007/s13205-018-1271-6URL [本文引用: 1]
DOI:10.1146/cellbio.2018.34.issue-1URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/35089509URL [本文引用: 1]
[本文引用: 1]
DOI:10.1074/jbc.273.13.7579URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
