 ,1, 邵美琪2, 刘畅3, 郭庆港1, 王培培1, 陈秀叶1, 苏振贺1, 马平
,1, 邵美琪2, 刘畅3, 郭庆港1, 王培培1, 陈秀叶1, 苏振贺1, 马平 ,1
,1Identification of the Antifungal Active Compounds from Bacillus amyloliquefaciens Strain HMB33604 and Its Control Efficacy Against Potato Black Scurf
LI YangFan ,1, SHAO MeiQi2, LIU CHANG3, GUO QingGang1, WANG PeiPei1, CHEN XiuYe1, SU ZhenHe1, MA Ping
,1, SHAO MeiQi2, LIU CHANG3, GUO QingGang1, WANG PeiPei1, CHEN XiuYe1, SU ZhenHe1, MA Ping ,1
,1通讯作者:
责任编辑: 岳梅
收稿日期:2020-08-27接受日期:2020-10-15网络出版日期:2021-06-16
| 基金资助: |
Received:2020-08-27Accepted:2020-10-15Online:2021-06-16
作者简介 About authors
李扬凡,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1948KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李扬凡, 邵美琪, 刘畅, 郭庆港, 王培培, 陈秀叶, 苏振贺, 马平. 解淀粉芽孢杆菌HMB33604的抑菌物质及对马铃薯黑痣病的防治效果[J]. 中国农业科学, 2021, 54(12): 2559-2569 doi:10.3864/j.issn.0578-1752.2021.12.007
LI YangFan, SHAO MeiQi, LIU CHANG, GUO QingGang, WANG PeiPei, CHEN XiuYe, SU ZhenHe, MA Ping.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】随着马铃薯主粮化战略的提出,马铃薯在我国的种植面积逐年扩大。由立枯丝核菌(Rhizoctonia solani)引起的马铃薯黑痣病是马铃薯产区普遍发生的主要土传真菌病害[1],由于马铃薯抗黑痣病品种较少、轮作倒茬在一些区域实施困难,造成土壤中黑痣病菌逐年积累,导致马铃薯黑痣病的发生逐年加重,发病严重地块的发病率甚至可高达70%—80%[2],严重影响了马铃薯产业的健康发展。长期以来,化学杀菌剂在防治马铃薯黑痣病中发挥主要作用。使用甲基立枯磷拌种或嘧菌酯沟施和拌种可以显著降低马铃薯黑痣病的发生[3-4]。然而化学农药的大量不合理施用也带来农药残留、水土污染等一系列问题。因此,有必要寻求其他安全有效的防治措施。【前人研究进展】活体微生物杀菌剂是防治作物土传病害行之有效且对环境安全的措施之一,目前已经开发出多个防治作物土传病害的微生物杀菌剂。国内外针对马铃薯黑痣病开展了生防菌的筛选工作,IKEDA等[5]研究发现,利用104—105孢子/mL的寡雄腐霉(Pythium oligandrum)卵孢子处理薯块,可以显著降低马铃薯黑痣病的发生。寡雄腐霉通过定殖于马铃薯根际,降低根际黑痣病菌的数量,从而发挥生防效果;BEAGLE-RISTAINO等[6]发现绿色木霉(Trichoderma viride)T-1-R9孢子处理土壤可以抑制黑痣病菌菌核的萌发,降低土壤中丝核菌的数量,从而有效抑制马铃薯黑痣病的发生。枯草芽孢杆菌(Bacillus subtilis)及其近缘种由于能形成耐逆、抗热的芽孢而利于产品的创制和保存,因此成为研发微生物杀菌剂的重要资源;HUSSAIN等[7]筛选获得一株抑制黑痣病菌生长、有效防治马铃薯黑痣病的生防细菌——枯草芽孢杆菌HussainT-AMU菌株,证明该菌株主要通过产生脂肽类抗生素发挥防治黑痣病的作用,但该研究未明确脂肽类抗生素中具有抑菌活性的组分;马龙等[8]研究发现枯草芽孢杆菌QHZ-M1菌株对马铃薯黑痣病菌具有较强的抑菌活性;KHEDHER等[9]研究发现枯草芽孢杆菌V26菌株可以产生几丁质酶和蛋白酶抑制马铃薯黑痣病菌的生长。【本研究切入点】明确生防细菌主要抑菌活性物质有助于细菌发酵工艺的优化,但目前关于枯草芽孢杆菌产生的脂肽类抗生素对马铃薯黑痣病菌的拮抗活性和作用机制未见报道。【拟解决的关键问题】通过生理生化和基因序列比对方法对生防细菌进行鉴定,通过液相色谱和质谱技术明确生防细菌产生的主要抑菌活性物质,通过real-time PCR技术分析解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HMB33604菌株对马铃薯根际黑痣病菌数量的影响。明确生防细菌防治马铃薯黑痣病的作用机制,为生防细菌的定向发酵以及施用方式提供依据。1 材料与方法
试验于2017年12月至2020年3月在河北省农林科学院植物保护研究所完成。1.1 试验材料
供试马铃薯品种为荷兰15号,该品种对黑痣病表现感病。马铃薯黑痣病菌(Rhizoctonia solani AG-3)和供试土壤细菌由河北省农林科学院植物保护研究所植物病害生物防治实验室分离保存。PDA(potato dextrose agar)培养基:用于真菌的培养,1 L水中加入200 g新鲜马铃薯,煮沸30 min,双层纱布过滤除去马铃薯残渣。过滤液中加入葡萄糖20 g,琼脂12 g,用水补足至1 L后121℃高压灭菌30 min。LB液体培养基:用于细菌的培养,1 L水中含有胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,pH 7.0,121℃高压灭菌30 min。LB固体培养基:用于细菌的培养,1 L水中含有胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂12 g,pH 7.0,121℃高压灭菌30 min。BUG培养基:用于细菌Biolog分析时细菌的培养,称取57 g的BUG 放入1 L蒸馏水中,121℃高压灭菌15 min。IF-A接种液:购自Biolog公司,用于细菌菌种Biolog的鉴定。
1.2 马铃薯黑痣病菌拮抗菌的筛选
通过平皿对峙法筛选对马铃薯黑痣病菌拮抗活性较强的拮抗细菌。将马铃薯黑痣病菌接种于PDA培养基上,25℃恒温培养至菌落长满整个培养皿。在菌落边缘用打孔器打取直径6 mm的菌块,接种在直径9 cm培养皿中PDA培养基中央。距离病原菌菌落边缘2 cm的位置对称点接供试细菌菌株,每个培养皿接4个细菌菌株,以只接种病原菌的PDA培养基为对照,27℃黑暗培养4 d,测量细菌抑菌带宽度,根据抑菌带宽度筛选拮抗活性较强的拮抗细菌。1.3 马铃薯黑痣病生防菌的筛选
在温室条件下采用盆栽接种试验方法筛选马铃薯黑痣病的生防菌。拮抗菌株发酵液的制备:将拮抗菌株接种于5 mL LB液体培养基中,37℃、180 r/min振荡培养12 h后,按接种量1%转接于100 mL LB液体培养基中,37℃、180 r/min振荡培养48 h,得到发酵液。利用梯度稀释法测定发酵液中的菌体浓度(cfu/mL)。
拮抗菌株盆栽防治效果测定:用打孔器打取直径6 mm的马铃薯黑痣病菌菌块,接种在直径9 cm的PDA培养基中央,25℃培养7 d后,用匀浆机充分打碎培养物后与干土混匀(1 皿病原菌﹕1.3 kg干土)制成菌土,其中干土为灭菌土与灭菌草炭按照1﹕1(v/v)混匀而成。将带有两个芽眼的薯块在供试拮抗菌株发酵液中浸泡1 h,然后种植于装有1.3 kg菌土的花盆(150 mm×170 mm)中,每个处理种植10块种薯,以无菌LB液体培养基处理薯块作为空白对照,以250 g·L-1嘧菌酯悬浮剂100倍稀释液浸泡薯块为阳性对照,每个处理3次重复。将种植马铃薯的花盆置于20℃、相对湿度55%、CO2浓度为982.35 mg·m-3的人工气候室中培养(光照﹕黑暗=16 h﹕8 h),25 d后调查马铃薯发病情况,并计算病情指数和防治效果。
马铃薯苗期黑痣病的分级标准:根据病斑的横向平均长度总和占地下茎周长的比例衡量发病严重度[10]。分级标准:0级:植株没有病斑;1级:严重度为1%—25%;2级:严重度为26%—50%;3级:严重度为51%—75%;4级:严重度为76%—100%。病情指数=∑(各级病株数×各级代表值)/(调查总株数×最高级代表值)×100;防治效果(%)=[(对照病情指数-处理病情指数)/对照病情指数]×100。
1.4 生防细菌的分类鉴定
生防细菌的Biolog微生物系统鉴定参照Biolog微生物鉴定的厂家说明。生防细菌的分子鉴定采用改良的CTAB法提取HMB33604菌株基因组DNA[11]。首先扩增16S rDNA基因[12](27F:5′-AGAGTTTGAT CCTGGCTCAG-3′,1492R:5′-CTACGGCTACCTTGT TACGA-3′)部分序列,通过序列比对初步确定细菌属级水平的分类地位,然后通过对HMB33604菌株全基因组序列进行分析,获得看家基因gyrA(GenBank No:MW030640)、gyrB(GenBank No:MW030641)、rpoB(GenBank No:MW030639)和rpoC(GenBank No:MW030638)基因序列。利用CLUSTAL X(2.0)分别对gyrA、gyrB、rpoB、rpoC进行Alignment,将比对后的序列用EditPlus Text Editor v3.70(290)进行拼接,最后利用MEGA 5.05软件通过邻接法(neighbor-joining,NJ)进行1 000次相似度重复计算构建系统发育树[13],根据聚类结果对HMB33604菌株进行分子鉴定。1.5 生防细菌发酵产物的防病效果测定
将供试生防菌株接种于5 mL液体LB培养基中,30℃、180 r/min振荡培养24 h,按接种量2%转接于100 mL优化后的发酵培养基中(数据未发表),振荡培养48 h后得到生防菌发酵液,菌体的发酵浓度为1×109 cfu/mL。发酵液8 000 r/min离心20 min,收集上清并用细菌过滤器(0.22 μm,Biosharp)过滤除菌,过滤液即为无菌体上清液;发酵液8 000 r/min 离心20 min,弃上清,用灭菌水重新悬浮菌体至原有体积即为生防菌菌体悬浮液(1×109 cfu/mL)。将带有芽眼的马铃薯薯块分别在生防菌发酵液、上清液和菌体悬浮液中浸泡1 h,以无菌优化发酵培养基浸泡马铃薯为空白对照,每个处理种植10块种薯,每个处理设置3次重复。马铃薯生长条件同方法1.3,并计算病情指数和防治效果。
1.6 生防细菌抑菌物质的分离鉴定
利用盐酸沉淀、甲醇溶解方法提取生防菌株脂肽类物质[14]。将HMB33604菌株接种于LB液体培养基中,30℃、180 r/min培养12 h。按1%接种量接入100 mL Landy培养基[11]中,30℃、180 r/min培养48 h。培养液于4℃、8 000 r/min离心20 min,收集上清,并用6 mol·L-1的HCl调节pH为2.0,4℃静置过夜。次日于4℃、8 000 r/min离心20 min,收集沉淀。沉淀物经自然风干后,用15 mL甲醇溶解,经0.22 μm细菌过滤器过滤后于4℃保存。采用高效液相色谱(HPLC)对HMB33604菌株脂肽提取物中的活性物质进行分离和纯化。色谱柱型号为SOURCE 25RPC ST 4.6/100。流动相A液包含650 μL三氟乙酸、20 mL乙腈和980 mL超纯水。流动相B液包含500 μL三氟乙酸、800 mL乙腈和200 mL超纯水。检测波长为215 nm,流速为1 mL·min-1。梯度洗脱过程为54 min内流动相A由100%到0%。手动收集HPLC的各组分,在超净工作台中吹干后,用8 mL甲醇使其溶解,经0.22 μm细菌过滤器过滤后于4℃保存备用。
采用UPLC-Triple TOF-MS/MS(AB Triple TOF TM 5600 system-MS/MS and SHIMADZU LC-30 AD)测定活性成分的分子量,根据测得的分子量对活性物质进行鉴定。分离色谱柱型号为C18色谱柱(Agilent,100 mm×2.1 mm,1.8 μm)。色谱分离条件:柱温40℃,流速0.3 mL·min-1,进样量4 μL。质谱条件:采用电喷雾离子化(ESI+)源;雾电压(IS)5 kV;喷雾气(GS1)50 psi;辅助加热气(GS2)50 psi;辅助加热气温度350℃;TOF MS扫描质合比范围:m/z 200-400;采集模式:飞行时间全扫描质谱和二级质谱(TOF MS IDAMS-MS)模式;TOF MS触发二级扫描范围:m/z 50-4000;去簇电压(DP)100 V;MS-MS碰撞能量(CE)Rolling collision energy。
用牛津杯法测定菌株脂肽提取物中不同组分对马铃薯黑痣病菌的抑菌活性。将直径6 mm的黑痣病菌菌块接种在直径为9 cm培养皿中PDA培养基中央,距离真菌2 cm的位置放置牛津杯,每个牛津杯分别加入100 μL脂肽提取物的不同组分,以甲醇作为对照,25℃培养箱黑暗静置培养10 d,比较HMB33604菌株脂肽提取物中不同组分对马铃薯黑痣病菌的抑菌活性。
1.7 生防菌处理后马铃薯根际黑痣病菌的定量检测
采用CTAB法提取黑痣病菌的基因组DNA,以RsTqF1(5′-AAGAGTTTGGTTGTAGCTGGTCTATTT -3′)和RsTqR1(5′-AATTCCCCAACTGTCTCACA AGTT-3′)[15]为特异性引物扩增马铃薯黑痣病菌AG-3菌株中98 bp的ITS序列,扩增产物连接到pMD-19T载体上并在大肠杆菌DH5α中进行扩繁。对含有PCR扩增片段的T载体进行10倍系列稀释,然后进行real-time PCR扩增,以质粒DNA量(copies)的对数值为横坐标,对应的Ct值为纵坐标,绘制标准曲线。Real-time PCR扩增采用20 μL体系:2×TransStart? Top Green SuperMix(+DyeⅡ)10 μL,引物为RSTqF1和RSTqR1各0.4 μL,DNA模板2 μL,超纯水7.2 μL。扩增程序:94℃预变性30 s;94℃变性5 s,60℃退火15 s,72℃延伸10 s,40个循环。将调查病级后的马铃薯植株从花盆中拔出,用力抖落根上附着的土,用毛刷刷下来剩余的土即为马铃薯根际土。利用土壤基因组DNA提取试剂盒(天根生化科技(北京)有限公司)提取生防菌发酵液、上清液和菌体悬浮液处理马铃薯根际土壤总DNA,进行real-time PCR反应。根据构建的标准曲线比较不同处理根际马铃薯黑痣病菌的群体密度(copies/g土壤)。
1.8 数据分析
采用IBM SPSS Statistics Version 20进行单因素方差分析,并且使用Duncan法进行显著性检验(P<0.05)。2 结果
2.1 马铃薯黑痣病生防细菌的筛选
通过平板对峙法对笔者实验室保存的2 106株土壤细菌进行抑菌活性测定,筛选得到61株对马铃薯黑痣病菌抑菌能力较强的拮抗菌株,抑菌带在6—16 mm,抑菌率均>70%(结果未列出)。在温室条件下对61株抑菌活性较强的拮抗细菌进行马铃薯黑痣病的防治效果评价,获得3株对马铃薯黑痣病具有较强防病效果的细菌(表1),其中HMB33604菌株对马铃薯黑痣病的防治作用最强,达到52.9%。其次是HMB28363和HMB32830菌株,防治效果分别为45.9%和44.1%。因此,后续对HMB33604菌株开展进一步研究。Table 1
表1
表1拮抗菌株对马铃薯黑痣病的防治效果
Table 1
| 序号 Serial number | 菌株 Strain | 采集信息 Sampling information | 病情指数 Disease index | 防治效果 Control efficacy (%) |
|---|---|---|---|---|
| 1 | 对照 CK | 80.6±9.1a | - | |
| 2 | 嘧菌酯Azoxystrobin (250 g·L-1) 100倍稀释液100× diluent | 11.5±2.6c | 85.7 | |
| 3 | HMB33604 | 河北围场马铃薯根际土壤 Potato rhizosphere soil in Hebei paddock | 37.9±4.3b | 52.9 |
| 4 | HMB28363 | 西藏墨竹工卡山区土壤 Mountain soil of Mozhu Gongka, Tibet | 43.5±2.2b | 45.9 |
| 5 | HMB32830 | 河北邯郸小麦根际土壤 Rhizosphere soil of wheat in Handan, Hebei | 44.9±8.1b | 44.1 |
新窗口打开|下载CSV
2.2 HMB33604菌株的鉴定
通过Biolog微生物鉴定系统对HMB33604菌株进行鉴定,结果表明HMB33604菌株与莫海威芽孢杆菌(Bacillus mojavensis)相似度最高,达到0.697。扩增HMB33604菌株的16S rDNA基因序列,扩增产物经测序后通过BLAST序列比对,HMB33604菌株的16S rDNA基因序列与枯草芽孢杆菌、解淀粉芽孢杆菌以及莫海威芽孢杆菌的16S rDNA基因序列同源性均为100%,表明HMB33604菌株属于芽孢杆菌属细菌(图1)。进一步扩增HMB33604菌株的gyrA、gyrB、rpoB和rpoC基因序列,通过多基因序列比对并构建系统发育树,结果表明,HMB33604菌株与解淀粉芽孢杆菌 NBRC 15535T菌株聚类到一个分支(图2)。上述结果证实,HMB33604菌株为解淀粉芽孢杆菌。
图1
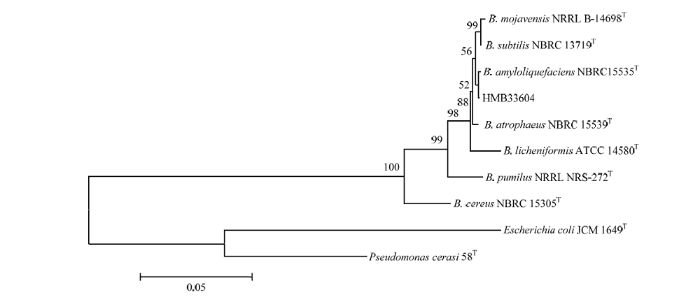 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1基于16S rDNA基因序列构建HMB33604菌株系统发育树
Fig. 1Phylogenetic tree for strain HMB33604 based on 16S rDNA gene sequence
图2
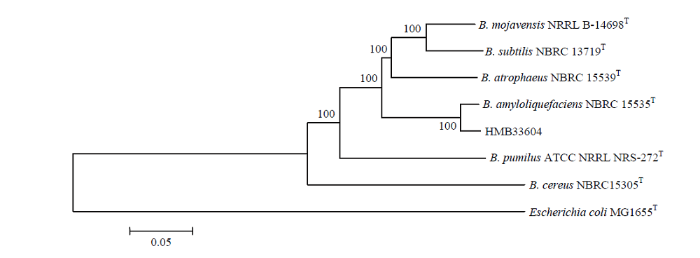 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2基于gyrA、gyrB、rpoB和rpoC基因序列构建HMB33604菌株系统发育树
Fig. 2Phylogenetic tree for strain HMB33604 based on gyrA, gyrB, rpoB, rpoC gene sequences
2.3 HMB33604菌株发酵产物对马铃薯黑痣病的防治效果
在温室条件下测定了HMB33604菌株发酵液(1×109 cfu/mL)、上清液和菌体悬浮液(1×109 cfu/mL)对马铃薯黑痣病的防治效果。结果显示菌株发酵液和上清液对马铃薯黑痣病的防治效果分别为52.2%和66.4%,而菌体悬浮液对马铃薯黑痣病的防治效果仅为16.9%(表2),表明菌株HMB33604产生的抑菌物质在防治马铃薯黑痣病中发挥主要作用。Table 2
表2
表2HMB33604菌株发酵液、上清液和菌体悬浮液对马铃薯黑痣病的防治效果
Table 2
| 处理 Treatment | 病情指数 Disease index | 防治效果 Control efficacy (%) |
|---|---|---|
| 对照Control | 54.0±16.6a | - |
| 发酵液Fermentation broth | 25.8±5.7b | 52.2 |
| 上清液Supernatant | 18.2±6.4b | 66.4 |
| 菌体悬浮液Bacterial suspension | 44.8±1.7a | 16.9 |
新窗口打开|下载CSV
2.4 HMB33604菌株抑菌物质的分离鉴定
通过平板对峙法测定HMB33604菌株脂肽粗提物对马铃薯黑痣病菌的抑菌活性。结果显示,脂肽粗提物对马铃薯黑痣病菌具有较强的抑菌活性(结果未列出)。将HMB33604菌株的脂肽粗提物进行HPLC分析,结果显示,该菌株脂肽粗提物存在3个组分,即LPⅠ、LPⅡ、LPⅢ(图3)。将上述3个组分进行UPLC-Triple TOF-MS分析,获得组分LPⅠ的[M+H]+ 分别为1 043.55、1 057.56、1 071.58和1 085.59,其中每个分子量相差14 Da,且与脂肪酸链长度-CH2相等,分别为伊枯草菌素A(C14—C17)的分子量[16,17,18];组分LPⅡ的[M+2H]2+分别为718.39、725.40、732.40、739.41、746.42和753.43的两类信号,分别为泛革素A(C14—C18)和泛革素B(C14—C17)的分子量[16,17,18];组分LPⅢ的[M+H]+分别为994.64、1 008.65、1 022.67、1 036.68和1 050.70,为表面活性素(C12—C16)的分子量[14,16,19-20](图4)。图3
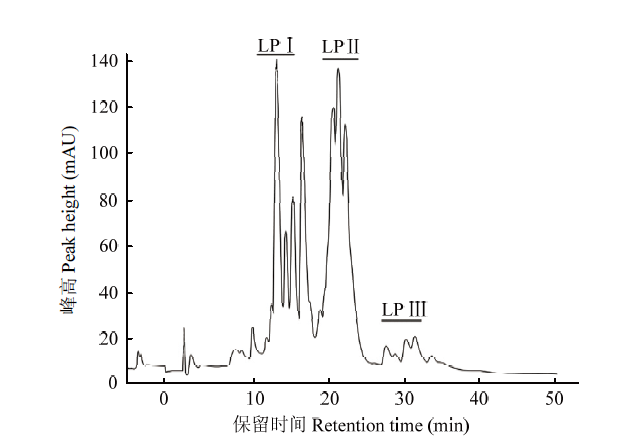 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3HMB33604菌株脂肽类物质的HPLC分析
Fig. 3HPLC analysis of the lipopeptide extracted from strain HMB33604
图4
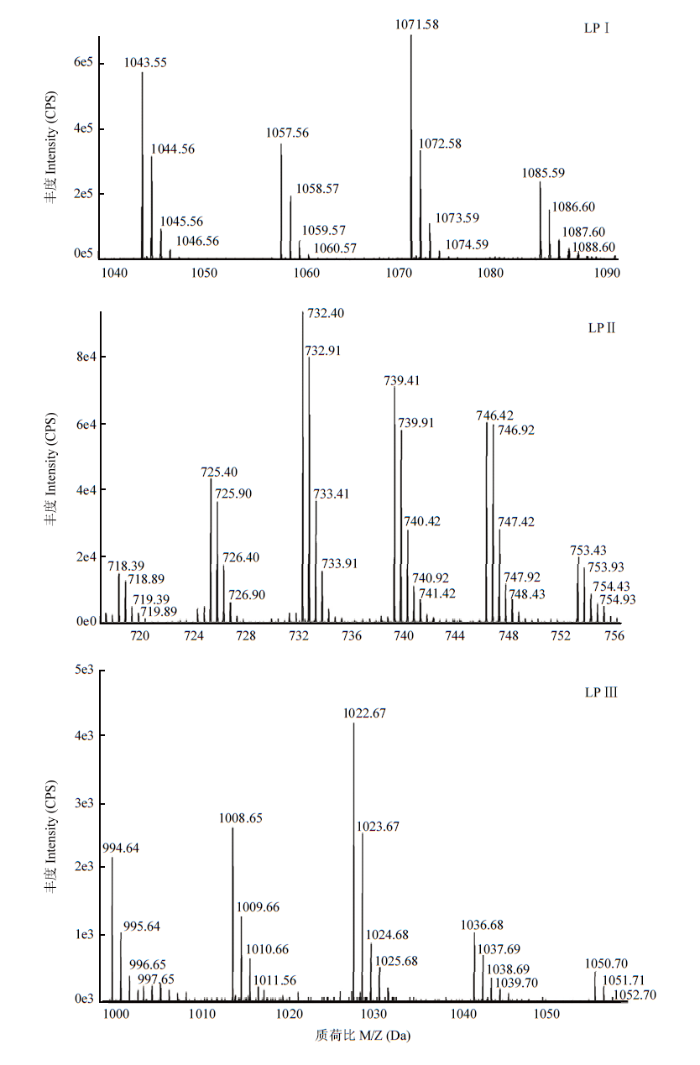 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4HMB33604菌株3种脂肽类物质的UPLC-Triple TOF-MS/MS分析
Fig. 4UPLC-Triple TOF-MS analysis of the three purified compounds in the lipopeptide of strain HMB33604
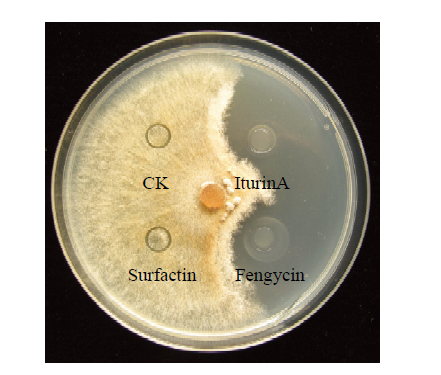
以甲醇作为对照,采用牛津杯法测定HMB33604菌株脂肽提取物中的3个组分对马铃薯黑痣病菌的抑菌活性。结果表明HMB33604菌株脂肽提取物中组分LPⅠ和LPⅡ表现较强的抑菌活性,证明伊枯草菌素A和泛革素是HMB33604菌株产生的主要抑菌活性物质(图5)。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5表面活性素、泛革素和伊枯草菌素对马铃薯黑痣病菌的抑制作用
Fig. 5Inhibitory effect of surfactin, fengycin and iturinA on the growth of R. solani
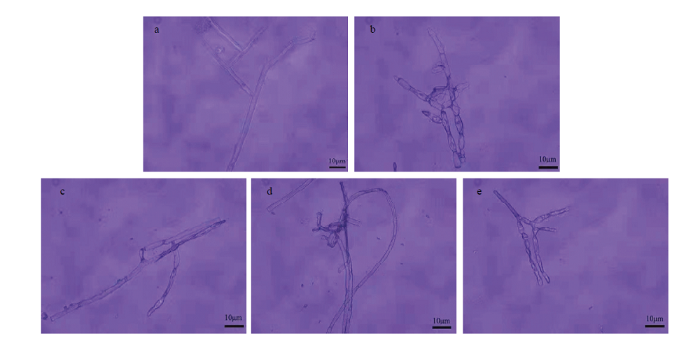
显微观察脂肽提取物中抑菌活性组分对马铃薯黑痣病菌菌丝的影响,结果显示,菌丝经脂肽类抗生素泛革素处理后菌丝分支增多,菌丝细胞壁消解、菌丝断裂。菌丝经脂肽类抗生素伊枯草菌素A处理后菌丝出现缠绕变形和菌丝局部膨大成球的现象(图6)。
2.5 HMB33604菌株对马铃薯根际土中马铃薯黑痣病菌数量的影响
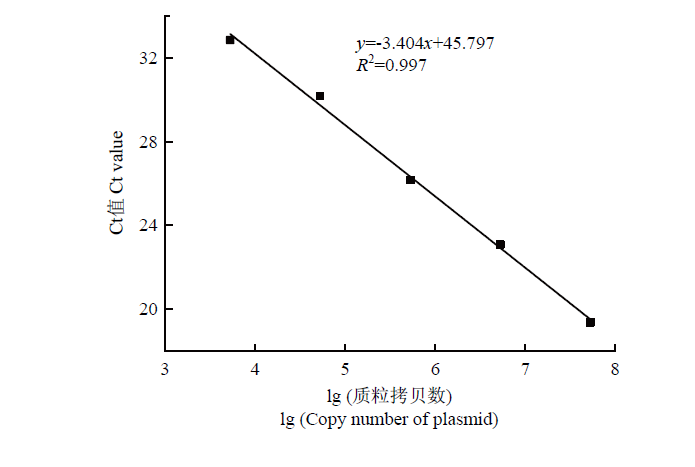
利用质粒浓度为1×103—1×107 copies/μL 5个浓度的质粒标准品进行real-time PCR扩增反应,得出每个反应体系中DNA量(copies)的对数值(x)与对应的Ct(y)值呈线性关系,即标准曲线方程为y=-3.404x+45.797,相关系数为0.997,扩增效率为96%(图7)。表明该引物特异性良好,适用于土壤中马铃薯黑痣病菌的定量检测。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7Real-time PCR标准曲线的构建
Fig. 7Standard curve for real-time PCR
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6HMB33604菌株脂肽提取物泛革素和伊枯草菌素A对马铃薯黑痣病菌菌丝形态的影响
a:未经处理的菌丝生长正常Untreated control;b:泛革素处理后菌丝分支增多Increased mycelial branching with fengycin;c:泛革素处理后菌丝细胞壁消解、菌丝断裂Cell wall disintegrated, protoplasm leaked out with fengycin;d:伊枯草菌素处理后菌丝缠绕变形Mycelium winding deformation with iturinA;e:伊枯草菌素处理后菌丝局部膨大成球Developed swelling at hyphal tips with iturinA
Fig. 6Effects of fengycin and iturinA from strain HMB33604 on the hypha of R. solani
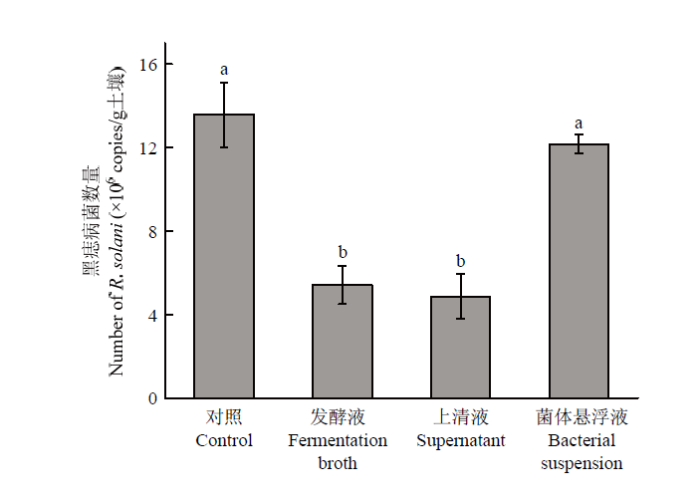
分别提取HMB33604菌株发酵液、上清液和菌体悬浮液处理的马铃薯根际土壤DNA进行real-time PCR扩增,扩增结果依据构建的标准曲线进行计算,即获得不同处理马铃薯根际的黑痣病菌数量。结果表明,与对照土壤中黑痣病菌的数量(13.6×106 copies/g土壤)相比,HMB33604菌株发酵液和上清液处理可显著降低马铃薯根际土壤中黑痣病菌的数量,分别降低60.3%(5.4×106 copies/g土壤)和64.0%(4.9×106 copies/g土壤);而菌体悬浮液处理的马铃薯根际土壤中黑痣病菌的数量仅降低10.3%,与对照相比无显著差异(图8)。
图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8马铃薯根际土壤中马铃薯黑痣病菌的数量
Fig. 8Number of R. solani in the potato rhizosphere soil
3 讨论
本研究通过平板对峙以及温室盆栽试验,获得一株有效防治马铃薯黑痣病的生防细菌,通过生理生化以及基因序列比对,该菌株被鉴定为解淀粉芽孢杆菌。解淀粉芽孢杆菌是枯草芽孢杆菌的近缘种,而枯草芽孢杆菌类细菌是研发微生物杀菌剂的重要资源。国内外针对马铃薯黑痣病开展了生防细菌的筛选工作,发现一些枯草芽孢杆菌类细菌可有效抑制黑痣病菌生长,降低马铃薯黑痣病的危害。这些枯草芽孢杆菌类细菌主要通过分泌表面活性素、几丁质酶和葡聚糖酶等抑菌活性物质而发挥生防作用[7,8,9]。除了产生抑菌活性物质外,枯草芽孢杆菌类细菌还可以通过竞争作用(与病原菌竞争营养位点与空间位点,减少病原菌侵入)和诱导抗性(诱导植物产生系统抗性)等降低土传病害的发生。对于以竞争作用为主的生防菌,其根际定殖能力和根际的群体数量决定其生防效果,因此,通过施入一定浓度的菌体悬浮液即可达到理想的防治效果。枯草芽孢杆菌K-106的菌体悬浮液对离体叶片上的油菜菌核病具有较好的防治效果,而发酵上清液则没有明显的防治效果,因此,认为竞争作用是菌株K-106防治油菜菌核病的主要作用机制[21]。有些生防菌通过产生抑菌活性物质达到防治植物病害的目的,对于这种生防菌,发酵液或发酵上清液中抑菌物质的浓度和活性决定了其生防效果。赵新贝等研究发现解淀粉芽孢杆菌TD-7菌株发酵液和发酵滤液对番茄灰霉病具有较好的防治效果,而菌体悬浮液则没有明显的防治效果[22]。因此,认为该菌株产生的抑菌物质在病害防治中发挥重要作用。本研究中,解淀粉芽孢杆菌HMB33604菌株发酵液和上清液对马铃薯黑痣病的防治效果分别为52.2%和66.4%,而菌体悬浮液对马铃薯黑痣病的防治效果仅为16.9%,推测HMB33604菌株主要通过分泌抑菌活性物质来防治马铃薯黑痣病。进一步通过real-time PCR方法分析了HMB33604发酵液、上清液以及菌体悬浮液对马铃薯根际病原菌数量的影响。结果发现,该菌株发酵液和上清液可显著降低马铃薯根际土壤中黑痣病菌的数量,而菌体悬浮液处理的黑痣病菌的数量与对照无显著差异。推测可能是HMB33604菌株发酵液和上清液中的抑菌物质显著降低了马铃薯根际土壤中的黑痣病菌数量,从而减轻马铃薯黑痣病的发生。芽孢杆菌可以产生多种抑菌活性物质,其中报道和研究最多的为脂肽类抗生素伊枯草菌素、表面活性素和泛革素[23]。研究表明,泛革素作用于病原菌菌丝细胞壁的类脂层,造成病菌菌丝染色质浓缩、DNA链断裂,破坏细胞膜透性和结构[24],从而抑制病原菌的生长[25];伊枯草菌素与靶细胞质膜相互作用形成离子传导孔,造成病菌菌丝原生质泄露[24],抑制植物病原真菌的生长[26]。表面活性素本身没有抑制病原真菌的活性,但可以增加泛革素[27]和伊枯草菌素[28]的抑菌活性。本试验从HMB33604菌株发酵液中分离纯化到3类活性组分LPⅠ、LPⅡ和LPⅢ,经质谱分析后发现组分LPⅠ、LPⅡ和LPⅢ分别为伊枯草菌素A、泛革素和表面活性素,并通过牛津杯法测定3个组分对马铃薯黑痣病菌的抑菌活性,发现菌株产生的伊枯草菌素A和泛革素显著抑制马铃薯黑痣病菌菌丝生长,导致菌丝缠绕变形、分支增多、菌丝局部膨大成球、细胞壁消解、断裂,造成细胞质外漏。枯草芽孢杆菌类细菌可以产生10多种抑菌活性物质,其基因组中约8%的基因序列与抑菌物质的合成有关[29]。本研究通过盐酸沉淀的方法提取脂肽类抗生素,但有些抑菌活性物质不属于脂肽类抗生素,采用此方法不能将全部抑菌物质提取出来;另外,有些抑菌物质只有在特定培养条件下才大量产生,因此,对于HMB33604菌株是否能够产生其他抑菌物质有待进一步研究。
4 结论
从2 106株土壤细菌中筛选获得可稳定、有效防治马铃薯黑痣病的解淀粉芽孢杆菌HMB33604菌株,该菌株主要产生3种脂肽类抗生素(伊枯草菌素、泛革素和表面活性素),其中,伊枯草菌素和泛革素是其产生的主要抑菌活性物质,可导致马铃薯黑痣病菌菌丝畸形、断裂等。HMB33604菌株发酵液和上清液显著降低马铃薯根际土中黑痣病菌的数量,说明该菌株通过产生抑菌物质降低黑痣病菌的数量,从而在马铃薯黑痣病有效防治中发挥重要作用。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.biocontrol.2011.10.016URL [本文引用: 1]
DOI:10.1094/Phyto-75-560URL [本文引用: 1]
DOI:10.1016/j.bcab.2019.101443URL [本文引用: 2]
[本文引用: 2]
[本文引用: 2]
DOI:10.1016/j.crvi.2015.09.005URL [本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1099/ijsem.0.003775URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
DOI:10.3390/plants9111438URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s12275-014-3605-3URL [本文引用: 2]
DOI:10.7164/antibiotics.39.888URL [本文引用: 1]
DOI:10.1016/0300-483X(94)90159-7URL [本文引用: 1]
DOI:10.1111/emi.2007.9.issue-4URL [本文引用: 1]
DOI:10.1016/0300-9084(92)90002-VURL [本文引用: 1]
DOI:10.1007/s10529-011-0617-5URL [本文引用: 1]
