 ,1, 赵旭东2, 姜义平1, 赵静1, 肖留斌
,1, 赵旭东2, 姜义平1, 赵静1, 肖留斌 ,1, 郝德君
,1, 郝德君 ,2
,2Cloning, Preparation of Antibody and Response Induced by 20-Hydroxyecdysone of Target of Rapamycin in Apolygus lucorum
TAN YongAn ,1, ZHAO XuDong2, JIANG YiPing1, ZHAO Jing1, XIAO LiuBin
,1, ZHAO XuDong2, JIANG YiPing1, ZHAO Jing1, XIAO LiuBin ,1, HAO DeJun
,1, HAO DeJun ,2
,2通讯作者:
责任编辑: 岳梅
收稿日期:2020-07-31接受日期:2020-09-7网络出版日期:2021-05-16
| 基金资助: |
Received:2020-07-31Accepted:2020-09-7Online:2021-05-16
作者简介 About authors
谭永安,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1775KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
谭永安, 赵旭东, 姜义平, 赵静, 肖留斌, 郝德君. 绿盲蝽雷帕霉素靶蛋白的克隆、抗体制备及在蜕皮激素诱导下的应答[J]. 中国农业科学, 2021, 54(10): 2118-2131 doi:10.3864/j.issn.0578-1752.2021.10.008
TAN YongAn, ZHAO XuDong, JIANG YiPing, ZHAO Jing, XIAO LiuBin, HAO DeJun.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】绿盲蝽(Apolygus lucorum)属半翅目(Hemiptera)盲蝽科(Miridae),寄主范围广泛,可危害棉花等多种经济作物[1,2]。20世纪90年代末以来,由于Bt棉的大面积推广种植和农业产业结构的调整,绿盲蝽种群数量急剧上升,已成为棉田主要害虫,并迅速波及枣树、葡萄、樱桃、桃等多种果树,严重影响其产量及品质。生产上对化学农药的长期依赖势必会导致绿盲蝽的抗药性日渐增强,从而造成防治效果下降[3,4]。因此,目前绿盲蝽防控面临严峻挑战,亟需开拓基于新靶标的有效防控技术。【前人研究进展】雷帕霉素靶蛋白 (target of rapamycin,TOR)是一种丝氨酸/苏氨酸激酶,在细胞代谢、生长及增殖方面至关重要[5,6]。TOR可分为TOR复合物1(TOR complex 1,TORC1)和TOR复合物2(TOR complex 2,TORC2)。TORC1是TOR与RapTOR(regulatory associated protein of mTOR)及mLST8(mammalian lethal with Sec13 protein 8)形成的一个对雷帕霉素敏感的复合物,可调控细胞内蛋白质翻译、细胞凋亡及细胞周期等关键生理过程[7,8]。TORC2是由RicTOR(rapamycin insensitive cornpanion of mTOR)、Sinl(也称为Mip1)与mLST8、mTOR共同形成的对雷帕霉素不敏感的复合物,通过调控蛋白激酶B(protein kinase B,PKB)和蛋白激酶C(protein kinase C,PKC)的活化,主要参与细胞极性、空间及骨架结构的形成[9]。在昆虫中,TOR可通过直接耦合前胸腺中的营养感应,从而在蜕皮激素(20E)生成及蜕皮过程中发挥重要作用[10,11]。研究表明,抑制TOR的表达可造成幼虫发育历期延长,同时与蜕皮激素合成相关基因的表达量下调,表明昆虫在生长发育以及蜕皮变态时需要TOR的参与;此外,在幼虫营养缺乏的条件下,TOR信号的激活会诱导蜕皮激素的生成,使幼虫完成正常蜕皮及变态行为[12]。TOR信号也可受蜕皮激素的调控[13,14]。对黑腹果蝇(Drosophila melanogaster)的研究发现,当幼虫摄入营养时,蜕皮激素抑制TOR信号介导调控胰岛素样肽(ILP)生成胰岛素分泌细胞来调控果蝇的生长发育[15,16]。【本研究切入点】目前对于TOR的研究多集中在植物、哺乳动物及一些模式昆虫上[17,18,19],对绿盲蝽AlTOR的相关研究尚未见报道。【拟解决的关键问题】采用RACE技术从绿盲蝽中扩增AlTOR全长,运用生物信息学方法对该基因进行结构分析和同源进化分析,并利用qRT-PCR阐明其时空表达动态及20E对其表达的影响,同时将其在原核细胞中进行高效表达,筛选最佳表达条件,以获得纯化蛋白,最后制备特异性的抗体,为在蛋白水平进一步研究该基因的功能打下基础。1 材料与方法
试验于2018年9月至2019年12月在江苏省农业科学院植物保护研究所完成。1.1 供试昆虫
绿盲蝽于2018年采自江苏沿海棉区的大丰市蚕豆田(33.11°N,120.25°E),室内用新鲜四季豆(Phaseolus vulgaris)续代饲养,饲养条件为温度(27±0.5)℃,相对湿度(70±5)%,光周期14L:10D。1.2 主要试剂及仪器
RNA提取试剂盒(Promega),M-MLV反转录试剂盒(Promega),BD SMARTTM RACE cDNA Amplification Kit(宝生物工程(大连)有限公司),pCzn1表达载体、PFU DNA聚合酶(南京钟鼎生物技术有限公司),TOP10菌株(天根生化科技有限公司),大肠杆菌(Escherichia coli)Arctic Express(DE3)(Agilent);卡那霉素、咪唑、尿素(上海生工生物工程有限公司);限制性内切酶(TaKaRa),Protein Marker(Thermo),IPTG、Acr、Bis、Tris(Sigma),SDS(Amresco),TEMED(BIO-RAD),高糖、Tyrptone、Yeast Extract(OXOID),Agarose(上海赛百盛基因技术有限公司);其他试剂均为国产分析纯。Ni2+ IDA亲和层析胶(Novagen),HexIOS分光光度计、Allegra 21R台式高速冷冻离心机(Beckman),台式高速离心机(Sorval),Biologic LP层析系统、Mini Protean II垂直平板电泳系统、水平电泳系统(BIO-RAD),PTC-200基因扩增仪(MJ Research),20E、U73211(Sigma)。1.3 AlTOR全长基因的克隆
基于实验室构建的绿盲蝽转录组数据及已报道昆虫TOR进行BLAST搜索,筛选绿盲蝽转录组中可能的TOR基因片段序列,从而进行克隆验证。根据获得的序列设计特异性引物(表1),进行AlTOR 5′和3′端序列的克隆。取绿盲蝽3龄若虫20头,Trizol法提取总RNA后合成cDNA第1链,根据设计的特异性上游引物和下游引物,进行AlTOR 5′和3′端序列的克隆。5′端序列的克隆采用巢式PCR,第一轮反应体系:10×PCR缓冲液5.0 μL、25 mmol·L-1 MgCl2 3.0 μL、10 mmol·L-1 dNTP Mix 1.0 μL、10 μmol·L-1 5′-AlTOR-1 2.0 μL、10 μmol·L-1通用引物Abridged Anchor Primer 2.0 μL、cDNA 5.0 μL、Taq DNA聚合酶0.5 U,超纯水补足至50.0 μL;第二轮反应体系:10×PCR缓冲液5.0 μL、25 mmol·L-1 MgCl2 3.0 μL、10 mmol·L-1 dNTP Mix 1.0 μL、10 μmol·L-1 5′-AlTOR-2 1.0 μL、10 μmol·L-1通用引物Abridged Universal Amplification Primer 1.0 μL、第一轮PCR产物5.0 μL、Taq DNA聚合酶0.5 U,超纯水补足至50.0 μL;PCR反应条件:预变性94℃ 2 min,94℃ 30 s,55℃ 30 s,72℃ 1 min,循环35次,72℃延伸7 min。3′端序列的克隆也采用巢式PCR,第一轮反应体系:PCR-Grade Water 34.5 μL,10×Advantage 2 PCR Buffer 5.0 μL,10 mmol·L-1 dNTP Mix 1.0 μL,50×Advantage 2 Polymerase Mix 1.0 μL,cDNA 2.5 μL,10 μmol·L-1 3′-AlTOR-1 1.0 μL,10×UPM 5.0 μL,超纯水补足至50.0 μL;第二轮反应体系:PCR-Grade Water 34.5 μL,10×Advantage 2 PCR Buffer 5.0 μL,10 mmol·L-1 dNTP Mix 1.0 μL,50×Advantage 2 Polymerase Mix 1.0 μL,第一轮PCR产物2.5 μL,10 μmol·L-1 3′-AlTOR-2 1.0 μL,10×UPM 5.0 μL,超纯水补足至50.0 μL;PCR反应条件:预变性94℃ 2 min,94℃ 30 s,68℃ 30 s,72℃ 1 min,循环30次,72℃延伸7 min。将获得的5′和3′端及保守区域进行拼接和测序(上海生工生物工程有限公司),最终获得AlTOR全长。最后根据测序结果,设计全长基因克隆引物(AlTOR-F和AlTOR-R),进行AlTOR全长基因的克隆。Table 1
表1
表1本研究所用的引物
Table 1
| 引物名称/目的 Primer name/Purpose | 序列 Primer sequence (5′ to 3′) |
|---|---|
| 克隆Cloning | |
| 5′-AlTOR-1 | AACGACTGGGCAAGAA |
| 5′-AlTOR-2 | CAAGACGTTTGGGTAGCA |
| 3′-AlTOR-1 | AGAGACTCAGTCGCTCACTATCAAGA |
| 3′-AlTOR-2 | CATTGAGACCACACCCCAGACACA |
| AlTOR-F | ATGGTGGAAAAATATGCTCG |
| AlTOR-R | GCTAGCCAGTATACAACG |
| 表达谱分析qRT-PCR | |
| RT-AlTOR-F | GGGGTCGTCAACTGGCAGAA |
| RT-AlTOR-R | CCTCCTTCTTCTTGGGTGCGA |
| Al-β-Actin-F | ACCTGTACGCCAACACCGT |
| Al-β-Actin-R | TGGAGAGAGAGGCGAGGAT |
新窗口打开|下载CSV
1.4 AlTOR时空表达定量检测
收集绿盲蝽不同日龄若虫及羽化7 d后雌成虫的不同组织(头、胸、翅、足、中肠、卵巢和脂肪体)。其中不同日龄样本每个处理15头,不同组织样本每个处理10头雌成虫,并设计3个生物学重复,每个生物学重复设置3个技术重复。液氮处理样品后-80℃冰箱保存备用。Trizol法提取总RNA,Prime ScriptTM RT Master Mix反转录合成cDNA,-20℃保存。qRT-PCR试验步骤按照SYBR Premix Ex Taq Kit说明书上进行。所用的AlTOR引物参见表1,并以绿盲蝽持家基因β-actin为内标对照基因[20](GenBank登录号:JN616391)。扩增体系:UltraSYBR Mix 12.5 μL,上下游引物各0.5 μL,cDNA模板2 μL,ddH2O 9.5 μL;扩增条件:95℃预变性5 min,然后95℃ 10 s,60℃ 20 s,72℃ 20 s,循环40次。1.5 20E处理绿盲蝽若虫
分别用20E(2 μmol·L-1)、U73122(20E抑制剂[21],50 μmol·L-1)、20E+U73122处理、乙醇(CK)浸泡切除两端的四季豆1 min,晾干后饲喂初孵1龄若虫。每处理绿盲蝽400头,重复4次。按1.4方法收集绿盲蝽不同发育阶段和不同组织样本后,分析不同处理AlTOR表达量。1.6 AlTOR序列分析与进化树分析
AlTOR核苷酸序列分析使用Expasy在线程序(1.7 AlTOR在大肠杆菌中的表达
使用DNASTAR-Protean软件分析AlTOR蛋白Antigenic index,选取抗原性较好的区域(72—381,蛋白质理论分子量为35.83 kD)作为免疫原区域,使用原核表达获得抗原蛋白。基于PAS(PCR-based accurate synthesis)的方法,在引物的两端各设计保护性碱基合成基因6731-2S,将其连入pCzn1重组质粒用限制性内切酶EcoR I及Xho I双酶切后进行连接。酶切体系:两种限制性内切酶各0.25 μL,10×Buffer缓冲液1.0 μL,带有合适酶切位点的基因片段3 μL,用ddH2O补足至10 μL,37℃水浴3 h。连接体系:酶切回收后的载体5.0 μL,基因片段10.0 μL,T4 DNA连接酶1.0 μL,10×Buffer缓冲液2.0 μL,用ddH2O补足至20 μL,16℃反应12—16 h。连接产物转化大肠杆菌TOP10后采用PCR筛选阳性克隆。将鉴定正确的重组质粒pCzn1-AlTOR转化到大肠杆菌Arctic Express感受态细胞,具体方法:将质粒1 μL加入100 μL感受态细菌中,置冰上20 min;42℃热激90 s,迅速置冰中5 min,加入600 μL LB培养液;37℃,220 r/min振摇1 h,离心后全部涂布于含50 μg·mL-1 Amp的LB平板,37℃倒置培养过夜。挑取转化平板上的多克隆接种于含50 μg·mL-1 Amp的3 mL LB培养液的试管中,37℃ 220 r/min振摇过夜。次日按1:100接种于50 μg·mL-1 Amp的30 mL LB培养液中,37℃ 220 r/min 振摇至菌体OD600为0.6—0.8。取出1 mL培养物,10 000 r/min室温离心2 min,弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀。向剩余的培养物中加入IPTG至终浓度为0.5 mmol·L-1,20℃ 220 r/min振摇过夜,诱导融合蛋白表达。取出1 mL培养物,10 000 r/min室温离心2 min,弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀。剩余培养物4 000 r/min,离心10 min,弃上清,用PBS重悬菌体沉淀;重悬液进行超声波破碎后,分别取上清液与沉淀液加入上样缓冲液重悬。12% SDS-PAGE检测分析,考马斯亮蓝染色显带。
1.8 包涵体蛋白的变性和复性
先将菌体沉淀重悬于20 mL裂解液(20 mmol·L-1 Tris-HCl containing 1 mmol·L-1 PMSF,pH 8.0)中,超声破碎(功率400 W,工作4 s,间歇8 s,共20 min),收集沉淀。使用包涵体洗涤液(20 mmol·L-1 Tris,1 mmol·L-1 EDTA,2 mol·L-1尿素,1 mol·L-1 NaCl,1% Triton X-100,pH 8.0)洗涤包涵体3次。再使用溶解缓冲液(20 mmol·L-1 Tris,5 mmol·L-1 DTT,8 mol·L-1尿素,pH 8.0),溶解包涵体,4℃过夜。室温,10 000 r/min离心15 min,将上述溶液滴加缓冲液(20 mmol·L-1 Tris-HCl,0.15 mol·L-1 NaCl,pH 8.0),逐步成倍梯度稀释缓慢搅拌,将蛋白溶液装入透析袋于上述缓冲液中透析过夜。1.9 融合蛋白的Ni柱亲和纯化
利用低压层析系统,包涵体溶液以0.5 mL·min-1流速上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA -Sepharose CL-6B亲和层析柱,Ni-IDA Binding-Buffer以0.5 mL·min-1流速冲洗,至流出液OD280值到达基线,再用Ni-IDA Washing-Buffer(20 mmol·L-1 Tris-HCl,20 mmol·L-1咪唑,0.15 mol·L-1 NaCl,pH 8.0) 以1 mL·min-1流速冲洗,至流出液OD280值到达基线;用Ni-IDA Elution-Buffer(20 mmol·L-1 Tris-HCl,250 mmol·L-1咪唑,0.15 mol·L-1 NaCl,pH 8.0)以1 mL·min-1流速洗脱目的蛋白,收集流出液;上述收集的蛋白溶液加入透析袋中,使用Ni-IDA Elution-Buffer进行透析过夜;12% SDS-PAGE分析后利用BSA蛋白定量试剂盒测定蛋白浓度。1.10 AlTOR多克隆抗体的制备
取纯化的AlTOR重组蛋白免疫新西兰白兔 (江苏省农业科学院兽医研究所提供)。皮下注射,每次免疫量为400 μg,2—3周免疫一次,共免疫4次。第4次免疫后在大白兔颈动脉采血,8 000 r/min离心8 min所得上清制备抗血清并准备纯化抗体。TOR蛋白与琼脂糖介质偶联制备成抗原亲和纯化层析柱,将PBS与所得抗血清等量混合后缓慢上样,待抗体抗原结合后用甘氨酸洗脱缓冲液洗脱得到所需纯化抗体,并在PBS缓冲液 (pH 7.4)中进行透析过夜(4℃),隔日进行效价测定,BCA浓度测定试剂盒对所得抗体进行浓度测定。1.11 效价测定
间接ELISA法对抗体进行效价测定。以纯化的AlTOR重组蛋白(5 g·mL-1)包被ELISA板,每孔加入100 mL,4℃过夜。用PBST(0.2 g KCl,0.2 g KH2PO4,2.9 g NaHPO4·12H2O,8 g NaC1,0.05% Tween-20,pH 7.4)洗涤3次,加入PBST封闭液(含5%牛血清白蛋白)于37℃封闭2 h。取出酶标板,弃去内液,用PBST洗板3次,加入用PBST连续倍比稀释的AlTOR多克隆抗体和阴性血清每孔100 μL,37℃恒温箱1 h。同上洗涤后,加入100 μL的用PBST以1:5 000稀释的二抗HRP-IgG,37℃放置1 h。用PBST洗板3次,每次5 min,最后加100 μL TMB底物液显色,37℃显色15 min,待终止反应后,酶标仪测定A450值。1.12 AlTOR多克隆抗体的鉴定
检测多克隆抗体的特异性Western blot测定按照SONG等[22]的方法进行并稍作修改。将原核表达的AlTOR重组蛋白及3龄绿盲蝽若虫总蛋白进行SDS-PAGE分析。转印PVDF膜后封闭,一抗为上述制备的蛋白抗体,二抗为辣根过氧化物酶标记的兔抗鼠HRP。1.13 数据分析
不同处理的AlTOR相对表达量变化以2-ΔΔCt[23]计算。差异显著性采用统计软件SAS 8.0中的Duncan氏新复极差法进行分析。2 结果
2.1 AlTOR的克隆及序列分析
利用绿盲蝽转录组筛选AlTOR基因序列,再利用RACE方法,分别进行5′和3′末端的扩增,获得了AlTOR的全长序列(图1)。序列分析结果表明,AlTOR全长1 652 bp,包括一个208 bp的5′非翻译区以及136 bp的3′端非翻译区。AlTOR开放阅读框含有1 308 bp的核苷酸,编码435个氨基酸,理论等电点预测为7.16。结构域分析表明,AlTOR基因翻译后的氨基酸序列具有典型的TOR特征,含有N-末端的SIN1结构域(288 bp)、高度保守的CRIM结构域(390 bp)及脂质与膜结合相关C-末端的PH域(363 bp)(图2)。图1
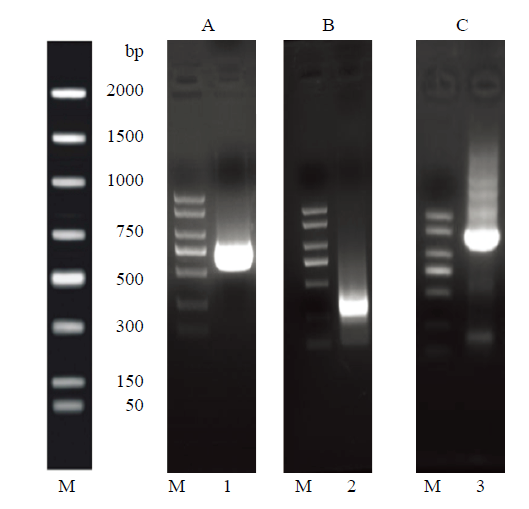 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1AlTOR的5′、3′端及全长序列PCR产物
A:5′端5′ end;B:3′端3′ end;C:全长Full sequence。M:DL2000;1:5′端第二轮PCR产物The second round of 5′ PCR product;2:3′端第二轮PCR产物The second round of 3′ PCR product;3:全长PCR产物Full sequence of PCR product
Fig. 1PCR products of 5′, 3′ end and full sequences from AlTOR
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2AlTOR核苷酸序列及推导的氨基酸序列
黄色阴影代表AlTOR N-末端的SIN1结构域;灰色阴影代表高度保守的CRIM结构域;红色阴影代表脂质与膜结合相关C-末端的PH域
Fig. 2Nucleotide and deduced amino acid sequences of AlTOR
Yellow shaded amino acids represent SIN1 domain of N-terminus, grey shaded amino acids represent highly conserved CRIM domain, and red shaded amino acids represent PH domain of the C-terminus associated with lipid-membrane binding
2.2 多重联比及进化树分析
多重联比结果如图3所示,TOR在半翅目昆虫中较为保守,尤其是CRIM结构域,AlTOR的氨基酸序列与半翅目臭虫科温带臭虫(Cimex lectularius)以及蝽科茶翅蝽(Halyomorpha halys)的TOR氨基酸序列一致性相对较高,分别为55.78%和54.38%,与其他昆虫的TOR基因序列一致性较低,如膜翅目的造纸胡蜂(Polistes dominula)(38.70%)及芜菁叶蜂(Athalia rosae)(39.33%)。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3AlTOR与其他半翅目昆虫TOR氨基酸序列多重比对
TOR来源物种及GenBank登录号Origin species of TORs and their GenBank accession numbers:温带臭虫Cimex lectularius (XP_014251577);茶翅蝽Halyomorpha halys (XP_014272645);麦双尾蚜Diuraphis noxia (XP_015365434);棉蚜Aphis gossypii (XP_027843790)。红色方框为AlTOR N-末端的SIN1结构域;蓝色方框为高度保守的CRIM结构域;黄色方框为脂质与膜结合相关C-末端的PH域Red boxes represent SIN1 domain of N-terminus, blue boxes represent highly conserved CRIM domain, and yellow boxes represent PH domain of the C-terminus associated with lipid-membrane binding
Fig. 3Amino acid sequence alignment of AlTOR and other Hemiptera insects
利用MEGA 6.0软件NJ法构建了包括绿盲蝽在内的5个目20种昆虫TOR的系统进化树(图4)。结果显示,TOR作为高度保守的蛋白,在种间同源性较高;外聚群中,膜翅目、鳞翅目、蜚蠊目、缨翅目中聚类更为接近,属于同一类分支。半翅目中,绿盲蝽与温带臭虫、茶翅蝽同源性较高,亲缘关系较为接近;与蚜虫位于不同分支,同源性远低于同为半翅目的温带臭虫和茶翅蝽。
图4
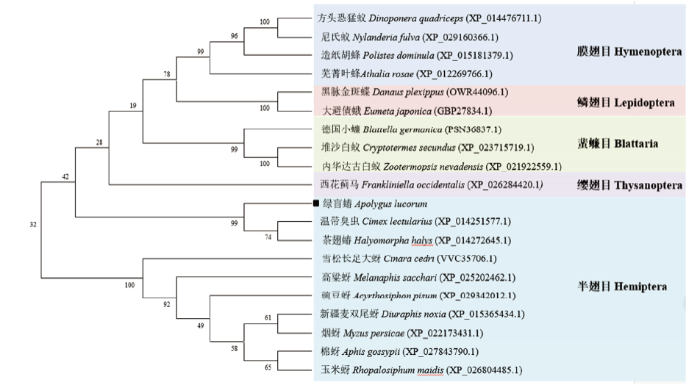 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4AlTROR与其他已知昆虫TOR氨基酸序列的系统进化树
采用Bootstrap方法分析,每个分支进行1 000次验证,数值代表Bootstrap估算值
Fig. 4Phylogenetic tree based on amino acid sequence of AlTOR and other insects
Using the Bootstrap method for analysis, 1 000 bootstrap replicates and values representing the Bootstrap estimate
2.3 AlTOR在绿盲蝽不同发育阶段及组织中的表达
AlTOR在绿盲蝽1—16日龄虫体中均有表达,表达量呈现波动式下降趋势,其中在初孵若虫(1日龄)表达量最高,8日龄若虫表达量最低,此外,AlTOR在绿盲蝽各龄期蜕皮时表达量显著升高(图5)。AlTOR在绿盲蝽雌成虫各组织中均有表达,其中在卵巢、中肠和脂肪体中高表达,而在头、胸、足中表达量较低,AlTOR的表达具有组织特异性(图6)。图5
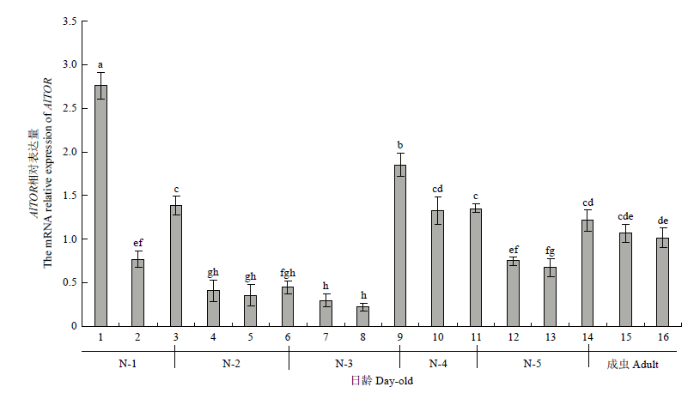 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5AlTOR在绿盲蝽不同发育阶段的表达
图中数据为平均数±标准误,柱上不同字母表示差异显著(P<0.05)。下同
Fig. 5Relative expression levels of AlTOR at different stages of A. lucorum
Date in the figure are means±SE, and different letters above bars indicate significant difference (P<0.05). The same as below
图6
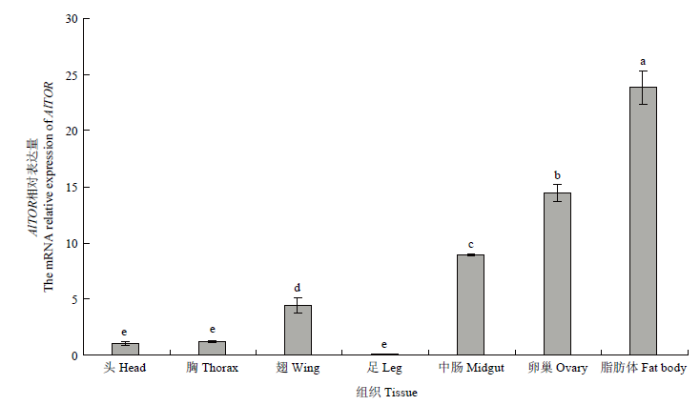 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6AlTOR在绿盲蝽雌成虫不同组织中的表达
Fig. 6Relative expression levels of AlTOR in different tissues of A. lucorum female adult
2.4 不同处理对AlTOR相对表达量的影响
与CK(乙醇)相比,当绿盲蝽分别发育至1龄蜕皮及2龄蜕皮时(4 d和6 d),20E显著上调AlTOR的表达;U73122处理后,AlTOR的表达呈现先上升后下降的趋势;此外,20E+U73122混合处理后,AlTOR的表达总体变化不大(图7)。与CK(乙醇)相比,20E处理绿盲蝽雌成虫后,各组织中AlTOR表达均显著上调,其中头、翅、卵巢和脂肪体中基因表达量分别显著提高了200.00%、118.89%、20.53%和60.82%;而当U73122处理后,绿盲蝽雌成虫的头、翅和足中AlTOR显著上调,中肠、卵巢和脂肪体中AlTOR表达量则下调(图8)。图7
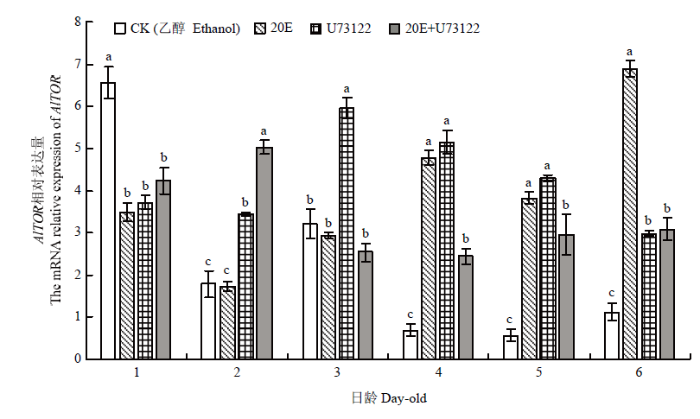 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7不同处理下各日龄绿盲蝽AlTOR的表达
Fig. 7Relative expression levels of AlTOR at different stages of A. lucorum under different treatments
图8
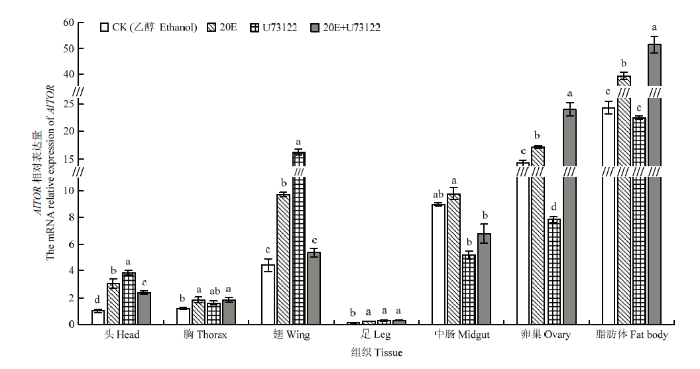 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8不同处理下绿盲蝽雌成虫各组织AlTOR的表达
Fig. 8Relative expression levels of AlTOR in different tissues of A. lucorum female adult under different treatments
2.5 重组蛋白AlTOR的表达、复性及纯化
重组质粒命名为pCzn1-AlTOR。随后将其转化至大肠杆菌Arctic Express(DE3)表达菌株中,经0.5 mmol·L-1 IPTG 20℃诱导12 h后,12% SDS-PAGE检测分析发现,pCzn1-AlTOR重组质粒表达一个约36 kD的蛋白(图9-A)。而不经IPTG诱导的重组质粒无此蛋白表达,说明AlTOR可在大肠杆菌细胞中诱导表达。但诱导表达的pCzn1-AlTOR表达蛋白均分布在沉淀体中,上清液中几乎没有,说明pCzn1- AlTOR表达蛋白主要以包涵体形式存在。包涵体经体外溶解、复性后,利用SDS-PAGE电泳分析pCzn1- AlTOR表达蛋白的纯化情况。用含20 mmol·L-1咪唑的缓冲液洗脱包涵体,进一步复性和纯化后在36 kD附近仅出现一条明显的特异性条带未见其他条带,说明已得到纯化的靶蛋白(图9-B)。采用蛋白定量试剂盒测定该蛋白的浓度为0.2 mg·mL-1,SDS-PAGE电泳检测该抗体的纯度达到85%以上,并最终获得了5.46 mg抗体,可以进行后续多克隆抗体制备工作。图9
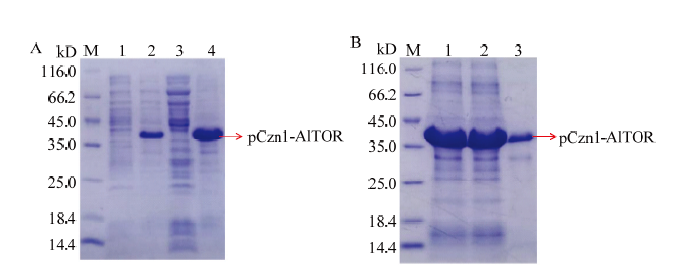 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9原核表达质粒pCzn1-AlTOR诱导表达蛋白的SDS-PAGE分析(A)和pCzn1-AlTOR表达蛋白纯化的SDS-PAGE分析(B)
M:蛋白分子量标准物Protein molecular weight marker。A:1:未经IPTG诱导的pCzn1-AlTOR表达蛋白pCzn1-AlTOR expressed protein without induced by IPTG;2:IPTG诱导的pCzn1-AlTOR表达蛋白pCzn1-AlTOR expressed protein induced by IPTG;3:重组质粒pCzn1-AlTOR表达蛋白上清Supernatant of pCzn1-AlTOR expressed protein induced by IPTG;4:重组质粒pCzn1-AlTOR表达蛋白沉淀Precipitate of pCzn1-AlTOR expressed protein induced by IPTG。B:1:未纯化的包涵体Unpurified inclusion body;2:未与Ni柱结合的杂蛋白Uncombined heterozygous protein with Ni NTA column;3:与Ni柱结合的目的蛋白Combined target protein with Ni NTA column
Fig. 9Expression SDS-PAGE analysis induced by IPTG (A) of pCzn1-AlTOR and SDS-PAGE of purified pCzn1-AlTOR fusion protein (B)
2.6 AlTOR蛋白多克隆抗体的特异性鉴定
新西兰白兔经3次免疫后,用间接ELISA法检测多克隆抗体的效价。AlTOR多克隆抗体和阴性血清(免疫前健康兔血清)按500×20—500×210连续倍比稀释。结果表明当AlTOR抗体稀释5 120倍时,OD阳性/ OD阴性>2.0,其终效价可达1:512 000。用制备的多克隆抗体分别检测原核表达的AlTOR重组蛋白及刚蜕皮的绿盲蝽3龄若虫,Western blot分析表明,所制备的多克隆抗体不仅能与绿盲蝽总蛋白结合,还可特异性与AlTOR重组蛋白反应(图10),且条带大小与预测的蛋白质大小一致,说明制备的AlTOR多克隆抗体准确、有效。图10
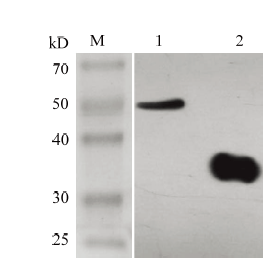 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10AlTOR多克隆抗体的Western blot 特异性分析
M:蛋白分子量标准物 Protein molecular weight marker;1:3龄若虫 3rd instar nymph;2:重组蛋白pCzn1-AlTOR Recombinant protein pCzn1- AlTOR
Fig. 10Western blot analysis of antibody against the expressed AlTOR protein
3 讨论
TOR是一类进化上保守的丝氨酸/苏氨酸(Ser/ Thr)蛋白激酶,是真核细胞响应环境信号调控生长和代谢的关键因子[6]。自TOR蛋白在酵母细胞发现后,在其他真菌、昆虫、植物以及哺乳动物中也相继被发现。TOR信号通路高度保守,对有机体自身生长和发展至关重要[24]。研究发现,植物、蠕虫、果蝇以及哺乳动物细胞中有一个TOR编码基因,而酿酒酵母中存在两个TOR编码基因[25]。TOR在细胞生长的营养调控中能通过激活下游信号通路,介导4E-BP1、S6K、eEF2等一系列翻译调节因子的磷酸化作用传递外界营养状况、生长因子等生长刺激信号,从而调节细胞内核糖体的发生及蛋白质的合成,进而综合调控细胞的生长与增殖[24]。另外,TOR还可参与调节真核细胞中mRNA和蛋白质的稳定性、细胞大小等与细胞生长密切相关的生理过程[26,27,28]。本研究通过筛选绿盲蝽转录组数据,RACE法获得了AlTOR的全长基因序列。序列分析结果表明,AlTOR的开放阅读框含有1 308 bp的核苷酸,编码435个氨基酸。多序列比对结果显示与其他半翅目昆虫TOR的氨基酸序列一致性在40%—60%,含有TOR作用靶标相关的SIN1结构域、CRIM结构域以及PH结构域。SIN1结构域是哺乳动物mSIN1的同源物,也是TOR作用的靶标之一,在信号转导过程中起着重要的作用。CRIM结构域位于TOR蛋白的中间位置,对TOR识别底物有着重要作用;另外CRIM结构域不论是在酵母细胞还是哺乳动物体内都高度保守。PH结构域同样也十分保守,其主要与脂质与膜结合相关[28]。进化树结果显示半翅目、膜翅目、鳞翅目等昆虫的TOR较为分化,位于不同的分支上。分化的原因可能这些目昆虫种类繁多、变态类型及由于不同的自然选择压造成的,如膜翅目、鳞翅目类昆虫是完全变态类昆虫,而半翅目昆虫属于不完全变态类昆虫。
TOR是昆虫体内营养信号的中心,通过氨基酸(AA)作为其调节因子,对外界摄入营养进行感知。AA/TOR途径广泛存在于真核细胞中,如酵母细胞。研究表明,除了调控葡萄糖的合成,TOR还可以通过氨基酸控制类胰岛素样肽的合成以及分泌。在果蝇成虫中,胰岛素样肽的分泌是由脂肪体产生的未配对细胞因子2(cytokine unpaired 2)远程调控从而响应营养信号[15,29]。由此可见,由TOR发出的氨基酸信号代表着营养信号的第一阶段,特别是对于需要蛋白质来启动产卵的昆虫而言[30]。此外,TOR信号还参与雌性昆虫生殖产卵,其作为营养信号的中心为雌虫生殖以及产卵提供充足的能量供给[12]。本研究发现,AlTOR在1—16日龄绿盲蝽中均有表达,表达量呈现波动式下降趋势,以初孵若虫(1日龄)中表达量最高;此外AlTOR在绿盲蝽雌成虫各组织中均有表达,其中卵巢、中肠及脂肪体中高表达,表明AlTOR的表达存在组织和时空特异性。研究表明,雌性昆虫的生殖需营养及能量资源的投入,在大多数昆虫中,营养的摄取是启动卵发育的关键触发因素。而AA/TOR途径和胰岛素途径作为营养传感器,在昆虫繁殖中起着至关重要的作用,影响生殖组织形成并调控JH和20E的生物合成[31,32,33]。TOR可刺激卵黄原蛋白在脂肪体的合成并激活卵发育;相反地,TOR途径的失活会导致繁殖受到抑制。在埃及伊蚊(Aedes aegypti)以及褐飞虱(Nilaparvata lugens)中,通过雷帕霉素抑制TOR蛋白质的合成以及RNAi介导的TOR基因沉默都会抑制卵黄原蛋白的表达,从而导致生殖力的降低[34,35]。在本研究中,AlTOR在若虫蜕皮期以及成虫羽化期表达水平显著提高,暗示TOR可能参与绿盲蝽若虫蜕皮以及羽化的变态行为;且AlTOR在卵巢、中肠及脂肪体中高表达暗示TOR可能参与绿盲蝽的生殖活动,这也是后续需要进行的研究工作。TOR可在蜕皮激素生成以及昆虫蜕皮过程中发挥重要作用。同时,蜕皮激素也会抑制TOR信号,在果蝇中,蜕皮激素会抑制幼虫进食时脂肪体内的TOR信号,进而产生未知信号,调节胰岛素生成细胞中胰岛素样肽的产生,从而控制果蝇全身性生长[32]。对家蚕的研究发现,蜕皮激素会在成虫的不同发育阶段在同一组织促进或抑制TOR信号从而调控成虫的生长发育[36]。在本研究中,绿盲蝽若虫随着龄期的增加,20E会显著上调AlTOR的表达,卵巢和脂肪体中AlTOR的表达也会由于20E的刺激而显著提高,表明AlTOR可能受20E调控,尤其是在“能量中心”脂肪体以及“生殖中心”卵巢中。细胞膜上的磷脂酶C是参与20E信号转导的关键酶,磷脂酶C可水解磷酯酰肌醇二磷酸成为第二信使IP3和DAG传递激素,神经递质和生长因子等信号行使其功能[37]。GU等研究表明,TOR信号参与家蚕前胸腺中促前胸腺激素诱导的20E合成,且磷脂酶C参与这个过程,当使用U73122抑制磷脂酶C时,会导致20E的合成受阻[38,39]。在本研究中,20E抑制剂U73211处理后,AlTOR在中肠和脂肪体中表达量显著下降,而20E处理后,AlTOR在中肠和脂肪体中表达量显著上调,暗示磷脂酶C可能参与20E对AlTOR的调控。
可溶性蛋白质的异源表达已经有较多的表达系统可用,目前很多可溶性蛋白以融合蛋白的形式得到成功表达[40,41]。本研究成功构建了pCzn1-AlTOR原核表达载体,并发现在20℃ 0.5 mmol·L-1 IPTG诱导12 h的条件下可大量表达AlTOR蛋白,之后通过变性、复性、蛋白纯化获得了纯化的靶蛋白。通过免疫新西兰白兔4次之后,采血检测,ELISA方法确定抗血清针对TOR蛋白的效价,通过ELISA检测效价得出,TOR抗体效价在512 000左右,纯度在85%以上,获得纯化的抗体为5.46 mg。Western blot分析结果也表明该多克隆抗体可同时与绿盲蝽总蛋白及AlTOR重组蛋白特异性结合,为进一步在蛋白层面研究TOR的功能打下了良好基础。
4 结论
AlTOR在绿盲蝽体内的表达谱显示出发育阶段特异性和组织特异性;20E及其抑制剂诱导后,AlTOR呈现出相反的应答反应;本研究获得的AlTOR重组蛋白的多克隆抗体具有高特异性。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1126/science.1187881URL [本文引用: 1]
DOI:10.1002/(ISSN)1526-4998URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/nature11153URL [本文引用: 1]
DOI:10.1074/jbc.M209374200URL [本文引用: 1]
DOI:10.1016/j.biocel.2006.02.013URL [本文引用: 2]
DOI:10.1042/BST0370223URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1074/jbc.M110.141168URL [本文引用: 1]
DOI:10.1016/j.peptides.2018.02.001URL [本文引用: 1]
DOI:10.1016/j.jinsphys.2019.103902URL [本文引用: 1]
DOI:10.1016/j.devcel.2008.08.003URL [本文引用: 2]
DOI:10.1016/j.devcel.2009.10.008URL [本文引用: 1]
DOI:10.1016/j.devcel.2010.05.007URL [本文引用: 1]
DOI:10.1016/S0092-8674(03)00713-XURL [本文引用: 2]
DOI:10.1126/science.1119432URL [本文引用: 1]
[本文引用: 1]
DOI:10.1074/jbc.M501116200URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1002/ps.4203URL [本文引用: 1]
DOI:10.1074/jbc.M110.191783URL [本文引用: 1]
DOI:10.1253/circj.CJ-11-0870URL [本文引用: 1]
DOI:10.1006/meth.2001.1262URL [本文引用: 1]
DOI:10.1016/j.mad.2017.03.005URL [本文引用: 2]
DOI:10.1091/mbc.e15-08-0594URL [本文引用: 1]
[本文引用: 1]
DOI:10.1534/genetics.111.133363URL [本文引用: 1]
DOI:10.4161/cc.10.7.15063URL [本文引用: 2]
DOI:10.1016/j.cell.2012.08.019URL [本文引用: 1]
DOI:10.1016/j.bbrc.2017.01.031URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.cois.2015.08.003URL [本文引用: 2]
[本文引用: 1]
.
DOI:10.1016/j.jinsphys.2012.01.005URL [本文引用: 1]
DOI:10.3390/ijms17040438URL [本文引用: 1]
[本文引用: 1]
DOI:10.1146/annurev-physiol-030212-183750URL [本文引用: 1]
DOI:10.1016/j.ygcen.2019.01.009URL [本文引用: 1]
DOI:10.1016/j.jinsphys.2016.10.007URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
