 ,1
,1Effects of High-Temperature at Filling Stage on Grain Storage Protein Accumulation and Its Biosynthesis Metabolism for Rice Plants Under Different Nitrogen Application Levels
HAN ZhanYu1, WU ChunYan2, XU YanQiu1, HUANG FuDeng2, XIONG YiQin1, GUAN XianYue1, ZHOU LuJian1, PAN Gang1, CHENG FangMin ,1
,1通讯作者:
责任编辑: 杨鑫浩
收稿日期:2020-08-11接受日期:2020-09-27网络出版日期:2021-04-01
| 基金资助: |
Received:2020-08-11Accepted:2020-09-27Online:2021-04-01
作者简介 About authors
韩展誉,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1340KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
韩展誉, 吴春艳, 许艳秋, 黄福灯, 熊义勤, 管弦悦, 周庐建, 潘刚, 程方民. 不同施氮水平下灌浆期高温对水稻贮藏蛋白积累及其合成代谢影响[J]. 中国农业科学, 2021, 54(7): 1439-1454 doi:10.3864/j.issn.0578-1752.2021.07.010
HAN ZhanYu, WU ChunYan, XU YanQiu, HUANG FuDeng, XIONG YiQin, GUAN XianYue, ZHOU LuJian, PAN Gang, CHENG FangMin.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】氮素营养是影响水稻籽粒产量与稻米品质的重要生态因子之一[1,2]。合理施用氮肥不仅是实现水稻高产的有效措施,而且有利于稻米品质改良和提高稻田氮肥利用率[3,4]。在优质米生产上,氮素穗(粒)肥施用量偏多通常引起稻米蛋白质含量过高、米饭色泽和口感变差、贮藏品质降低,但氮素穗(粒)肥不足,往往又引起水稻生育后期功能叶片的提早衰老和光合同化物生产能力迅速下降,导致垩白米率增加、整精米率降低,同样不利于稻米优质 [1,3-4]。此外,氮素穗(粒)肥对水稻产量及稻米品质的影响及其程度还与水稻生育后期的气候条件有关[5,6,7,8,9,10]。已有研究表明,灌浆结实期高温胁迫可引起水稻、小麦等作物籽粒中的淀粉合成受阻,适度施氮能部分恢复高温胁迫对碳代谢相关酶的损伤,从而减轻高温对作物籽粒灌浆和产量形成的危害[11,12,13]。鉴于灌浆结实期温度和氮肥施用均与稻米品质存在密切联系,探明灌浆结实期温度与氮肥两个因素耦合对稻米品质的影响效应及其生理机制,对于现阶段我国稻米品质改良工作具有重要理论意义。【前人研究进展】稻米的化学组分是淀粉和蛋白质[14]。在水稻籽粒灌浆过程中,淀粉合成代谢主要发生水稻胚乳的淀粉体,而贮藏蛋白主要积累于蛋白体Ⅱ(PB-Ⅱ)和蛋白体I(PB-I)[15]。稻米蛋白质主要是由谷蛋白和醇溶蛋白组成,两者分别占稻米贮藏蛋白总量的75%—80%和8%—10%[14,16]。近年来,国内外对水稻籽粒淀粉合成与贮藏蛋白积累的代谢途径及其关键调控基因(关键酶)已取得一定深度认识。现已基本明确,谷蛋白是由37—39 kD 的酸性亚基和 20—22 kD 的碱性亚基构成并通过二硫键结合在一起贮藏于PB-Ⅱ,而醇溶蛋白是由13 kD等亚基组成,其多肽被合成后直接在内质网腔内组装成 PB-Ⅰ[17,18]。水稻不存在直接编码22 kD 和37 kD 多肽的基因[14,18],谷蛋白57 kD前体和13 kD醇溶蛋白均是由多基因编码并受其转录水平的调控[16,19]。在灌浆温度与氮素穗肥对稻米品质影响的生理机制研究方面,目前国内外主要侧重于对不同温度处理下,水稻胚乳淀粉合成代谢途径的几个关键酶及有关功能基因与稻米淀粉组分及其链长分布结构等特征之间的关系分析[5, 19-20],而对于灌浆温度与氮素穗肥对稻米贮藏蛋白含量组分影响的耦合效应,以及不同氮素水平下灌浆温度对水稻籽粒贮藏蛋白合成积累过程影响的调控机制,已有文献报道却缺乏较深入探讨。【本研究切入点】前人对作物籽粒灌浆过程的淀粉合成与贮藏蛋白积累及其环境调控机理问题研究,主要局限于灌浆温度或氮肥对稻米品质影响的单因素影响效应与籽粒淀粉合成及贮藏蛋白积累间的关系分析[1,5-6],而对于不同施氮水平下,灌浆期高温对水稻贮藏蛋白合成积累代谢过程的影响及其与稻米蛋白质含量及亚基组分间的相互联系[10],迄今尚不明确。【拟解决的关键问题】本文以生育期相近的2个主栽常规晚粳品种(秀水134和秀水09)为材料,采用盆栽土培试验和人工气候箱控温处理相结合的方法,并通过籽粒灌浆过程中的动态取样,探析了不同氮肥水平下,灌浆期高温对稻米蛋白含量及组分的影响效应及其与籽粒贮藏蛋白合成代谢间的关系,旨在揭示氮素穗肥对水稻高温灌浆过程贮藏蛋白积累过程影响及其生理代谢机制,为水稻优质高效生产的氮肥合理施用与相关栽培管理技术提供理论参考。1 材料与方法
1.1 供试品种与试验处理
试验于2019年在浙江大学农业试验站(紫金港西区)进行。供试水稻材料为秀水134和秀水09(常规晚粳稻品种)。氮肥处理在水稻穗分化期开始实施,设低氮(LN)和高氮(HN)2个水平;温度处理在水稻灌浆结实期进行,设常温(日均温度23℃)和高温(日均温度30℃)2个温度水平。5月20日播种,大田湿润育秧,6月20日移栽至盆钵,盆钵为正方形白色桶,直径25 cm、高30 cm,内装过筛土约15 kg。盆钵土壤于2018年取自浙江农业科学院海宁试验基地氮肥长期定位试验田的不施氮区和施氮区。其中,不施氮区土壤含有机质2.34 g·kg-1、全氮0.13 g·kg-1、速效氮96.35 mg·kg-1、全磷0.17 g·kg-1、速效磷120.41 mg·kg-1、全钾1.45 g·kg-1、速效钾110.26 mg·kg-1;施氮区土壤含有机质2.55 g·kg-1、全氮0.19 g·kg-1、速效氮149.16 mg·kg-1、全磷0.15 g·kg-1、速效磷115.37 mg·kg-1、全钾1.53 g·kg-1、速效钾131.06 mg·kg-1。土壤经自然风干、充分浸泡和充分混匀后,分别装入不同盆钵(不施氮与施氮区的土壤各装32盆,共64盆)。移栽前每盆施2 g尿素和0.5 g KH2PO4做基肥,秧苗移栽前预先淹水2周,每桶栽插4穴,每穴单苗插秧。在水稻生长至穗分化期(叶龄余数为1.5左右时)施氮肥处理。其中,低氮处理水平(LN)是在装有不施氮区稻田土壤的各盆钵之中,每盆施0.5 g尿素,约合尿素20 kg·hm-2,高氮处理水平(HN)是在装有施氮区稻田土壤的各盆钵之中,每盆施2.0 g尿素,约合尿素80 kg·hm-2。每个品种、每氮处理水平各16盆,盆钵水稻放置于大型智能温室(28℃白天/22℃夜间)生长,温室内自然光照,每3 d左右浇一次水,及时防控病虫。待盆钵水稻在大型智能温室生长发育至齐穗期,选同日开花且发育良好的单穗挂牌,并将同一品种每个氮肥处理的盆钵进一步分成2组(每组8盆),在挂牌标记稻穗开花后的第4天,分别将其盆钵移入2台步入式CONVIRON人工气候箱实施不同温度处理,之后按一定的时间间隔(抽穗开花后的第7天、第14天、第21天、第28天和第35天)进行动态取样,每次4—5个标记稻穗,直至成熟。2台CONVIRON人工气候箱的温度处理设计分别为常温(NT,日平均温度23℃,日最高温度和最低温度分别为26℃和20℃)和高温(HT,日平均温度30℃,日最高温度和最低温度分别为34℃和26℃)。温度日变化模拟自然气候特征,每日14:00为最高温、5:00为最低温,其间温度以1℃为间隔呈线性增加[10]。2台气候箱中的其他气候因子均保持完全一致。其中,光照时间为6:00—19:00,光照强度为120—150 J·m-2·s-1,相对湿度为75%—80%,风速0.5 m·s-1[10]。
1.2 籽粒粗蛋白含量测定
用凯氏定氮法测定籽粒总蛋白含量,参照LUTHE[21]方法进行。分别取14、21、28、35 d部分样品于60℃烘干至恒重,去壳、磨粉和过筛(0.25 mm)后,称取糙米粉200 mg,倒入硝煮管后加入3 g硫酸钾﹕硫酸铜粉末(10﹕1,w/w),再加入8 mL浓硫酸,在硝煮仪(Tecator Digestor Auto,Foss)上360℃硝煮150 min,样品冷却后注入凯氏定氮仪,运行蒸馏以及滴定过程,计算总氮含量,总蛋白含量等于总氮含量×5.95。以上指标每样品重复 3 次。1.3 4种蛋白组分的提取与测定
参照LIU等[22]方法对0.5 g糙米米粉中的4种蛋白组分进行分步提取。提取顺序如下:(1)清蛋白:去离子水;(2)球蛋白:2%氯化钠;(3)醇溶蛋白:55%(v/v)正丙醇;(4)谷蛋白:0.24% 五水合硫酸铜,1.68% KOH,0.5%酒石酸钾钠和 50%(v/v)异丙醇。每次提取液用量为25 mL,室温下持续振荡2 h,其后4 000×g离心10 min,重复提取3次。之后,采用Bradford法测定醇溶蛋白含量,以牛血清蛋白为对照[10];采用双缩脲法测定谷蛋白含量,仍以牛血清蛋白为对照,用凯式法加以标定[10]。1.4 谷蛋白和醇溶蛋白亚基组成的SDS-PAGE分析
参照YAMAGATA等[23]方法,对稻米贮藏蛋白的亚基组成进行SDS-PAGE分析。准确称取30 mg糙米粉于2 mL离心管中,加入1 mL的SDS-urea提取液(4%SDS、5%硫基乙醇、20%甘油和8 mol·L-1尿素,pH 6.8),室温下过夜,混合液在20℃ 15 000×g离心20 min,上清液用于点样。采用分离胶浓度为15%,浓缩胶浓度均为5%。电极缓冲液为Tris-HCl体系,含0.1% SDS。室温下恒流30—40 mA(起始15—20 mA)电泳2—3 h至溴酚蓝泳动到胶板下缘停止,取出凝胶板进行冲洗、固定、染色、脱色,最后将凝胶在Bio-Rad GS-800扫描仪扫描,并用ImageJ对染色凝胶中各蛋白亚基条带的相对光密度进行估算。1.5 粗酶液的提取和酶生理活性测定
以-80℃冰箱保存的不同灌浆时期的籽粒样品为材料,选取稻穗中上部籽粒25粒,去壳称重后,加5 mL 100 mmol·L-1 的Tricine-NaOH缓冲液(pH=7.5,含8 mmol·L-1 MgCl2,2 mmol·L-1 EDTA,50 mmol·L-1 2-Mercaptoethanol),冰浴研磨成匀浆,在4℃下10 000×g离心20 min,上清液即为用于籽粒碳氮代谢若干关键酶的活性测定。其中,谷氨酰胺合酶(Glutamine synthetase,GS)、谷草转氨酶(Glutamic-oxaloacetic transaminase,GOT)和谷丙转氨酶(Glutamic-pyruvic transaminase,GPT)的生理活性测定参照CAO等[24]的方法;谷氨酸脱氢酶(Glutamate dehydrogenase,GDH)的生理活性测定参照LEA等[25]的方法。以上酶活生理指标,每样品重复3次。1.6 基因表达的荧光定量PCR检测
取不同灌浆时期的籽粒样品,去壳后在液氮中研磨成粉末,利用TransZol法提取水稻籽粒总RNA,并采用DNaseI(Fermentas)对总 RNA 进行消化处理,以消除基因组 DNA 的污染。用琼脂糖凝胶电泳和微量分光光度计(NanoDrop 2000)扫描检测提取的RNA的完整性和浓度。cDNA的反转录采用TaKaRa 公司的 PrimeScriptTMRT reagent Kit with gDNA Eraser(PerfectReal Time)试剂盒,反转录得到的cDNA用于实时荧光定量分析。利用Primer Premier 5.0软件设计有关基因的荧光定量PCR特异扩增引物(表1),并以 1 μg 总 RNA 反转录得到的第一链 CDNA 为模板,采用20 μL反应体系用SYBR® Green Real-time PCR Master Mix 试剂盒(Toyobo公司)进行荧光定量PCR检测,利用BioRad CFX96荧光定量PCR仪完成扩增过程,使用 ACTIN-1作为内参基因来计算目标基因的相对表达水平。计算方法采用参照基因的△CT 法[19],每样品重复3次。
Table 1
表1
表1荧光定量PCR引物序列
Table 1
| 基因 Gene name | 登录号 Accession No. | 上游引物 Forward primer (5′-3′) | 下游引物 Reverse primer (5′-3′) |
|---|---|---|---|
| GluA1 | KC202291 | AAGACAGTGTTCAACGGCGA | TTGGGAGAGCACGGAAGATG |
| GluA2 | KC202292 | ATGATGGTGAAGTGCCGGTT | CTCCTCAACTTCACGCCTGT |
| GluA3 | KC202293 | ACAACCCAAACCTCGCAGAT | CGGGCACGACCTTGAGTAAT |
| GluB1 | X54314 | GCGTATCGCATCTCAAGGGA | GGTCTCGCTTTCGGACTCAT |
| GluB4 | AK242284 | GTCAATTGCTGATCATTCCA | CTGCAAGGTGGCTCACCA |
| GluB5 | AY196923 | GAGCGTGAAGGATGCCAAT | GGTAAGGCGCGGAATACTGA |
| Pro13 | X14392 | AGACTCAAGCTCAAGCCCA | CACCAACAGTGGCAATGCTC |
| Pro14 | D11385 | GCAATATCAGGTGCAGTCG | ACTGCTGCCTTACGAACTCA |
| Pro17 | AB016505 | GGTGAGTTCGTAAGGCAGCA | GTGCGATCATCCTGAGCTGT |
| Actin-1 | X16280 | CAGCACATTCCAGCAGATGT | TAGGCCGGTTGAAAACTTTG |
新窗口打开|下载CSV
1.7 考种与计产
水稻成熟后对各处理盆钵中在灌浆结实期尚未进行动态取样的其余稻株收获考种,考查他们的单株有效穗数、每穗总(实)粒数、千粒重和结实率,然后将单株有效穗数(每盆栽4株)换算成每盆有效穗数,并计算每盆的理论产量。2 结果
2.1 不同施氮水平下灌浆期高温对稻米贮藏蛋白含量与蛋白亚基组分及其积累动态的影响
氮素穗肥和灌浆期高温均会引起稻米粗蛋白含量的上升,但灌浆期高温对稻米谷蛋白/醇溶蛋白比值的影响大于氮素处理,以HN-HT(高氮-高温)处理的粗蛋白含量最高,LN-NT(低氮-常温)处理的粗蛋白含量最低,供试2个品种的差异表现基本一致,但在LN-HT(低氮-高温)和HN-NT(高氮-常温)这2个处理的粗蛋白含量差异上略有不同(表2)。其中,秀水09的粗蛋白含量在LN-HT和HN-NT处理之间的差异未达到显著水平,而秀水134在HN-NT处理下的粗蛋白含量显著高于LN-HT处理,说明氮素穗肥对秀水134稻米粗蛋白含量的影响效应要比高温处理效应更明显。此外,在不同氮素穗肥水平下,灌浆期高温均会引起糙米率、整精米率和直链淀粉含量显著下降,稻米垩白度显著上升。与此同时,千粒重和结实率在高温处理(LN-HT和HN-HT)下呈下降趋势,每盆产量也显著降低,但HN-HT处理的千粒重和结实率略高于LN-HT处理,而HN-HT与LN-NT处理间的每盆产量差异不明显。其中,HN-HT处理的每盆穗数高于LN-NT处理,但前者的每穗实粒数和结实率却显著低于后者,两者在产量构成上存在明显差异。Table 2
表2
表2不同温度氮肥处理组合下稻米蛋白含量、谷/醇比、直链淀粉含量和千粒重等指标的差异
Table 2
| 品种 Cultivar | 处理Treatment | 每盆穗数 Panicle number per pot | 每穗实 粒数 Spikelets per panicle | 千粒重 1000-grain weight (g) | 结实率 Seed setting rate (%) | 每盆产量 Yield each pot (g/pot) | 糙米率 Brown grain rate (%) | 整精米率 Head milled grain rate (%) | 垩白度 Grain chalky degree (%) | 直链淀粉含量 Amylose content (%) | 粗蛋白 含量 Protein content (%) | 谷/醇比 Glutelin/ Prolamin |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 秀水134 Xioushui134 | LN-NT | 15.8b | 126.4b | 21.54bc | 82.89a | 43.20b | 74.19a | 51.41b | 7.71d | 15.95a | 9.04d | 7.27c |
| LN-HT | 15.3b | 99.6d | 21.48c | 65.80c | 32.73c | 64.77b | 48.29c | 62.86a | 13.41b | 9.97c | 8.39a | |
| HN-NT | 18.7a | 136.4a | 22.37a | 83.18a | 57.06a | 73.36a | 56.62a | 15.17c | 16.03a | 10.24b | 7.36c | |
| HN-HT | 18.2a | 109.3c | 21.61b | 69.64b | 42.98b | 65.32b | 49.83bc | 55.09b | 12.86c | 10.73a | 8.18b | |
| 秀水09 Xioushui09 | LN-NT | 16.9b | 126.8b | 21.69b | 85.48a | 46.48b | 75.20b | 51.33b | 6.86c | 16.56a | 8.86c | 7.32c |
| LN-HT | 16.5b | 102.6d | 20.15c | 67.71d | 34.11c | 59.46d | 42.07d | 48.63a | 13.64b | 10.01b | 8.26a | |
| HN-NT | 19.4a | 139.3a | 23.49a | 82.31b | 63.48a | 77.86a | 60.91a | 9.45c | 16.62a | 9.97b | 6.80d | |
| HN-HT | 19.1a | 110.8c | 21.54b | 70.44c | 45.58b | 66.17c | 45.59c | 24.77b | 13.81b | 11.06a | 7.78b |
新窗口打开|下载CSV
利用水稻籽粒灌浆过程中的动态取样,对不同处理单位籽粒中的总蛋白绝对含量及其谷蛋白与醇溶蛋白组分的测定结果表明(图1),单位籽粒中的总蛋白、谷蛋白和醇溶蛋白含量随籽粒灌浆过程均呈逐渐上升趋势,且2个高氮处理(HN-NT和HN-HT)单位籽粒中的总蛋白、谷蛋白和醇溶蛋白含量分别高于其在相同温度条件下的低氮处理(LN-NT和LN-HT),但高氮处理下的谷/醇比相对较低,这说明增施氮素可引起单位籽粒中的总蛋白、谷蛋白和醇溶蛋白积累量上升,并导致稻米谷蛋白/醇溶蛋白比值略有下降。不难发现,在籽粒灌浆21 d或28 d后,2个高温处理(LN-HT和HN-HT处理)单位籽粒中的总蛋白、谷蛋白和醇溶蛋白含量在不同程度上均低于相应的常温处理(LN-NT和HN-NT)。其中,醇溶蛋白在2个高温处理下的下降幅度相对较大,以HN-NT处理的醇溶蛋白含量最高,LN-HT处理的醇溶蛋白最低,供试2个品种表现基本一致,但差异幅度略有不同。由此可见,灌浆期高温虽然会引起水稻籽粒贮藏蛋白相对含量的显著提高,但单位籽粒贮藏蛋白积累的绝对量却在不同程度上有所下降;而高温处理引起的醇溶蛋白含量下降和谷蛋白/醇溶蛋白比值上升,是不同施氮水平下灌浆期高温对水稻籽粒贮藏蛋白组分影响的一个共同特征。
图1
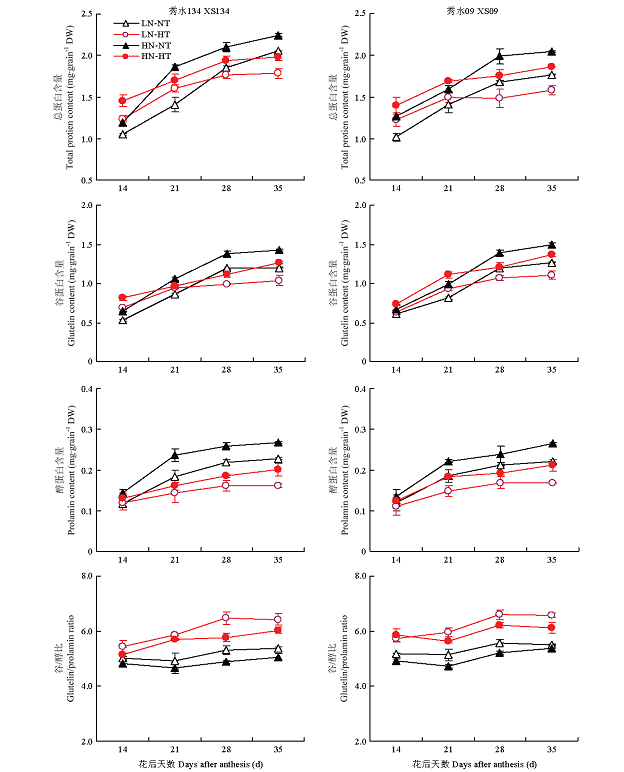 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1单位籽粒总蛋白、谷蛋白和醇溶蛋白和谷/醇比在水稻灌浆过程中的动态变化及其温氮处理效应
LN-NT、LN-HT、HN-NT和HN-HT分别表示低氮-常温、低氮-高温、高氮-常温和高氮-高温处理组合。下同
Fig. 1Differences in total protein content, glutelin, prolamin, glutelin/prolamin per kernel among different temperature-nitrogen treatments and their temporal pattern during grain filling period
LN-NT, LN-HT, HN-NT and HN-HT indicate low nitrogen-normal temperature, low nitrogen-high temperature, high nitrogen-normal temperature, high nitrogen-high temperature, respectively. The same as below
不同处理下籽粒贮藏蛋白各主要亚基组分差异及其积累动态变化的SDS-PAGE检测结果表明(图2),水稻籽粒贮藏蛋白主要由57 kD、37—39 kD、22—23 kD 的3个谷蛋白亚基和13 kD的醇溶蛋白亚基组成,且在不同氮素水平和温度处理下,这4条主要蛋白条带均随水稻籽粒灌浆天数的推移呈上升趋势(图2-A、B)。不同处理组合间相比,LN-HT处理相同时期13 kD醇溶蛋白亚基的条带亮度与LN-NT处理相比明显变淡,HN-HT处理的13 kD醇溶蛋白亚基的条带亮度也不如HN-NT处理明亮(图2-A、B),这说明增施氮肥虽引起13 kD醇溶蛋白亚基含量的明显提升,但高温处理抑制水稻籽粒灌浆过程中13 kD醇溶蛋白亚基的合成积累。就3个谷蛋白亚基(57 kD、37—39 kD、22—23 kD)条带而言,灌浆结实期温度对37 kD 谷蛋白亚基和22 kD 谷蛋白亚基在条带亮度的影响远没有氮素处理的效应明显,在常温(NT)和高温(HT)下,增施氮肥(HN)均会引起灌浆籽粒中37 kD 谷蛋白和22 kD 谷蛋白亚基条带的亮度增强,且37 kD 谷蛋白亚基与22 kD 谷蛋白亚基的条带亮度几乎呈同步增强趋势(图2-A、B)。上述现象说明,高温处理降低了13 kD醇溶蛋白亚基在灌浆籽粒中的合成积累量,而增施氮素穗肥可引起灌浆籽粒中37 kD 谷蛋白酸性亚基和22 kD 谷蛋白碱性亚基含量的明显提升,但谷蛋白中的37 kD 亚基与22 kD亚基比例相对稳定,受高温和氮素穗肥的影响均较小。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同温氮处理组合下籽粒灌浆过程贮藏蛋白亚基组分动态变化的SDS-PAGE检测
Fig. 2SDS-PAGE analysis of grain storage protein per kernel among different temperature-nitrogen treatments and their temporal pattern during grain filling period
A和B分别表示秀水134和秀水09 A and B indicate XS134, XS09, respectively
2.2 不同施氮水平下灌浆期高温对水稻籽粒贮藏蛋白合成途径相关基因表达的影响
由图3可见,在正常温度(NT)条件下,编码13 kD醇溶蛋白合成的3个同工型基因(Pro13、Pro14和Pro17)在水稻灌浆籽粒中的相对表达量大致呈先升高、后降低的变化趋势(图3-A—F),但增施氮肥(HN-NT)可引起Pro13、Pro14和Pro17转录表达量的峰值延迟,尤其是这3个同工型基因(Pro13、Pro14和Pro17)在开花后28 d的转录表达水平明显高于相同温度的低氮处理(LN-NT),说明Pro13、Pro14和Pro17在籽粒灌浆中后期(开花后28 d左右)的上调表达,可能是增施氮肥导致水稻籽粒醇溶蛋白含量提升的一个重要原因。与此同时,编码13 kD醇溶蛋白合成的3个同工型基因(Pro13、Pro14和Pro17)在2个高温处理(LN-HT和HN-HT)的转录表达水平显著低于2个常温处理(LN-NT和HN-NT),且在籽粒灌浆各个时期的差异趋势基本一致(图3-A—F),这说明高温处理显著抑制Pro13、Pro14和Pro17在水稻籽粒灌浆过程中的转录表达水平(图3-A—F)。此外,在高温胁迫下增施氮肥可在一定程度上引起醇溶蛋白各同工型基因(Pro13、Pro14、Pro17)表达量的提升,但增施氮肥对有关基因表达量变化的影响程度远不及高温胁迫处理明显(图3-A—F)。因此高温处理引起单位水稻籽粒醇溶蛋白积累量下降和稻米谷蛋白/醇溶蛋白比值上升的原因,在很大程度上是由于编码水稻13kD醇溶蛋白合成基因(Pro13、Pro14和Pro17)在高温处理下的下调表达所致。编码谷蛋白前体合成的多个主要功能基因(GluA1、GluA2、GluA3、GluB1、GluB4和 GluB5)在不同处理下的转录表达相对较复杂(图3)。总体而言,在常温条件下,多数基因(包括GluA1、GluA2、GluB1、GluB4和 GluB5)在籽粒灌浆前期的转录表达量相对较低,至14—28 d左右时达到其表达量的峰值,在籽粒灌浆后期的表达量下降。增施氮肥(HN)可引起编码谷蛋白前体合成的多数功能基因(GluA1、GluA2、GluA3、GluB1、GluB4和 GluB5)在籽粒灌浆中后期的表达量上调,但对有关基因在籽粒灌浆前期表达量的影响趋势并不一致,供试2个品种的表现也略有差异;在相同氮水平下,灌浆期高温(HT)可引起谷蛋白前体合成相关基因(包括GluA1、GluA2、GluA3、GluB1、GluB4和GluB5)在灌浆前期表达量的上调,但同时可引起有关基因在籽粒灌浆中后期的表达量出现迅速下降。其中,HN-HT(高氮-高温)处理的多数功能基因(GluA1、GluA3、GluB1、GluB4和 GluB5)在籽粒灌浆中后期的表达量大于LN-HT(低氮-高温)处理,说明增施氮肥对谷蛋白合成前体相关基因在籽粒灌浆中后期的迅速下调表达具有延缓效应。
2.3 不同施氮水平下灌浆期高温对籽粒氮代谢关键酶活性影响及其动态变化
谷氨酰胺合成酶(GS)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)和谷氨酸脱氢酶(GDH)是植物氮代谢途径的几个关键酶,其产物可为籽粒贮藏蛋白合成代谢提供各种氨基酸供体[26,27]。由图4可见,HN-NT处理单位籽粒中的GS、GOT和GPT活性在籽粒灌浆前期略低于HN-HT处理,但在籽粒灌浆的中后期(开花21 d后),前者的GS、GOT和GPT活性却显著高于后者(图 4-A—F)。在高氮水平下,高温胁迫对籽粒GS、GOT和GPT活性的影响表现出灌浆前期增高、后期降低的基本趋势(图 4-A—F)。此外,增施氮肥对籽粒GS、GOT、GPT和GDH活性的影响程度也与灌浆温度有关。在常温处理下,增施氮肥可显著提高灌浆籽粒中的GS、GOT和GPT活性,并引起灌浆籽粒中的GDH活性显著降低,但在高温处理下,增施氮肥对籽粒GS、GOT和GDH活性的影响幅度相对较小(图4-A—H)。即2个常温处理(HN-NT与LN-NT)间的GS、GOT和GDH活性差异大于2个高温处理(HN-HT与LN-HT),说明高温胁迫会在一定程度抵消氮肥对水稻籽粒氮代谢的影响效应。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同温氮处理组合下编码醇溶蛋白和谷蛋白合成各功能基因在籽粒灌浆过程中的转录表达变化
Fig. 3Differences in transcriptional expression of various genes that encoded prolamin protein and pro-glutelin biosynthesis in rice kernels as well as their temporal pattern during grain filling period among different temperature-nitrogen treatments
图4
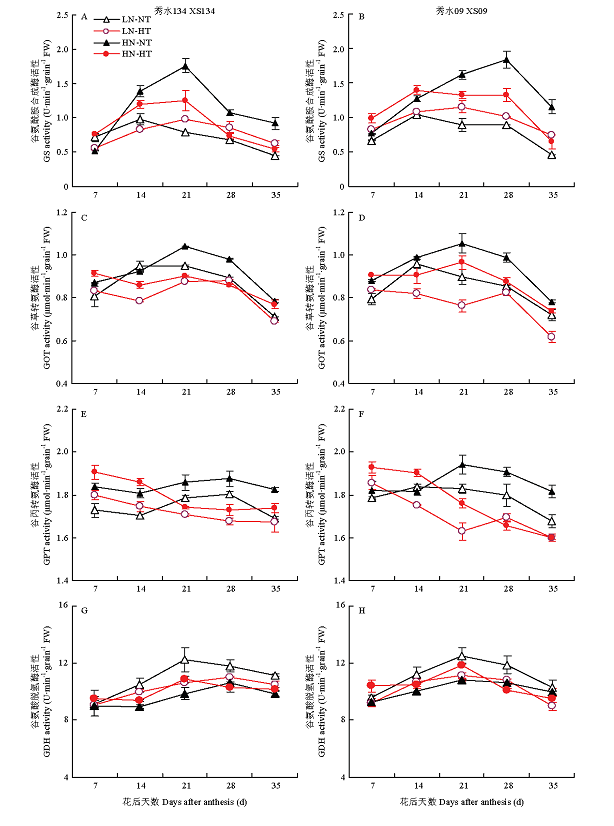 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4不同温氮处理下籽粒氮代谢若干关键酶的活性差异及其在籽粒灌浆过程中的动态变化
Fig. 4Differences in the activities of various key enzymes related to grain N metabolism among different temperature-nitrogen treatments and their temporal patterns during grain filling period
3 讨论
蛋白质是水稻籽粒中仅次于淀粉的第二大贮藏物质,受栽培环境、肥水管理等因素的影响较大[1,5,11,15]。大量研究表明,增施氮肥或前氮后移可引起稻米贮藏蛋白含量较明显增加,并对部分水稻品种的外观品质和米饭食味产生不利影响[3, 9-10, 28]。FITZGERALD等[1] 认为,施氮量对稻米蛋白含量和米饭食味等品质指标的影响程度因品种类型而异。在一定施用量范围内,氮肥施用量过高对粳稻品种的米饭食味、垩白米率和蛋白质含量等品质指标的影响程度大于籼稻品种[1,10, 29-30]。胡群等[28]报道,在机插栽培方式下,提高穗肥的比例会引起稻米蛋白含量增加与食味品质下降,垩白米率和垩白度显著增加,但适当增加穗肥的比例能够有效地改善稻米的加工品质[29]。段骅等[6]发现,在高温胁迫下适当增施氮肥可提高水稻的结实率和千粒重,减轻结实期高温对籽粒灌浆及产量形成的危害程度;另据DOU等[9, 31]报道,在大田增温条件下,适当增加氮肥施用量能降低稻米直链淀粉含量,并缓解高温对稻米加工品质和外观品质的不利影响[9, 31-32]。本研究结果中,增施氮素穗肥所引起稻米贮藏蛋白的增加,不仅表现在蛋白质占籽粒干重的相对含量上,而且表现在单位籽粒的贮藏蛋白积累的绝对量上,但氮肥施用量对稻米直链淀粉含量的影响程度相对较小,远不及灌浆温度对稻米直链淀粉含量和谷蛋白/醇溶蛋白比值的影响明显。此外,HN-HT(高氮-高温)处理的稻米垩白度显著高于相同品种在不同施用氮肥水平下的常温处理(HN-NT和LN-NT),而其对整精米率的影响趋势则相反,前者的整精米率显著低于后者,但与LN-HT(低氮-高温)处理相比,HN-HT(高氮-高温)处理的稻米垩白度显著降低,整精米率有所提高(秀水134未达统计显著水平)。与此同时,HN-HT(高氮-高温)处理的千粒重和结实率均略高于LN-HT(低氮-高温)处理,且在单株(盆)产量指标上,HN-HT处理显著大于LN-HT处理(表1)。这与段骅等[6]的研究结论基本一致,进一步证实氮素穗肥在一定程度上缓解高温胁迫对水稻籽粒灌浆充实与稻米品质影响的不利效应,而氮素穗肥不足可加剧高温胁迫对稻米整精米率和稻米垩白表现的负面影响,但本研究结果中,在相同灌浆温度条件下增施氮肥对稻米贮藏蛋白的谷/醇比和直链淀粉含量影响不大,这与DOU等[9, 31]和姚姝等[30]的研究结论有所不同,其原因可能与供试品种的直链淀粉含量高低有关。需要说明的是,本文利用盆栽试验进行HN和LN处理的土壤分别取自大田氮肥长期定位试验田的不施氮区和施氮区,两者在基础肥力水平上存在一定差别,这是2个高氮处理(HN-NT和HN-HT)的稻株有效穗数大于2个低氮处理(LN-NT和LN-HT)的重要原因。与LN-NT处理相比,HN-HT处理的有效穗粒数增加,但结实率却显著降低,因而这2个处理(LN-NT和HN-HT)在水稻成熟期的产量水平差别不大,均显著低于HN-NH处理和高于LN-HT处理。在几个重要品质性状(整精米率、垩白度、直链淀粉含量等)上,LN-NT处理的稻米直链淀粉含量和整精米率略高于HN-HT处理,但前者的稻米垩白度大幅度低于后者,在产量水平相近的情况下表现出各自不同的品质生态特点(表2)。灌浆结实期温度是影响稻米蛋白质含量和米饭食味的另一个重要环境生态因素[5,11, 19]。现已基本明确,灌浆结实高温或夜间增温会引起稻米粗蛋白含量提高[7,15]。但对于灌浆结实期高温引起稻米蛋白质含量上升的原因,究竟是由于灌浆结实期高温促进了水稻籽粒蛋白质的合成积累,从而直接引起了单位籽粒中贮藏蛋白绝对含量的增加[33],还是由于高温胁迫下籽粒粗蛋白占籽粒总干重的相对比值增加,从而间接引起了其相对百分含量的上升[10],目前尚存在较大争议。本研究结果中,稻米粗蛋白的相对含量在HN-HT(高氮-高温)处理下最高,HN-NT(高氮-常温)和LN-HT(低氮-高温)处理次之,LN-NT(低氮-常温)处理最低(表2),这说明高温(HT)和高氮(HN)组合对稻米粗蛋白的相对含量影响具有一定“叠加”效应,但从单位籽粒贮藏蛋白的绝对含量看,2个高温处理(HN-HT和LN-HT)在水稻灌浆开始21 d或28 d后的总蛋白、谷蛋白和醇溶蛋白的积累量却明显低于其相同施氮水平的常温处理(HN-NT和LN-NT)(图1),尤其是单位籽粒中的醇溶蛋白绝对量在2个高温处理(HN-HT和LN-HT)下的降低幅度较大(图1-E,F),从而引起稻米谷/醇比在高温处理下的显著下降(图1-G,H)。利用SDS-PAGE对不同温-氮处理下籽粒贮藏蛋白亚基组成进行检测,发现谷蛋白的57 kD前体亚基(pro-glutelin)、37 kD 酸性亚基(α-glutelin)和22 kD 碱性亚基(β-glutelin),以及醇溶蛋白的13 kD 亚基在高氮处理下(HN-HT和HN-NT)含量均明显高于其相同温度下的低氮处理(LN-HT和LN-NT),但相同氮水平下的不同温度处理间相比,2个高温处理(HN-HT和LN-HT)的13 kD亚基的条带亮度却较其相应的常温处理(HN-NT和LN-NT)明显变淡(图2)。进一步对编码水稻13KD醇溶蛋白合成基因(Pro13和Pro14)在籽粒灌浆过程中转录表达变化检测表明,高温胁迫可引起Pro13和Pro14等醇溶蛋白合成相关基因在水稻籽粒灌浆过程中的下调表达(图3-A—F),并在一定程度上降低单位籽粒中的氮代谢相关酶(GS、GOT、GPT)在籽粒灌浆中后期的活性(图4),以及谷蛋白前体合成相关基因(GluA1、GluA2、GluA3、GluB1、GluB4和 GluB5)在籽粒灌浆中后期的表达水平(图3-G—R)。由此可见,高温处理可通过抑制水稻灌浆籽粒中的13 kD醇溶蛋白合成相关基因的表达,从而引起单位籽粒中醇溶蛋白积累量的显著降低,而谷蛋白前体合成相关基因(GluA1、GluA2、GluA3、GluB1、GluB4和 GluB5)在籽粒灌浆中后期的表达量虽然也受高温胁迫所抑制,但下调幅度相对较小,这可能是灌浆结实期高温引起稻米贮藏蛋白的谷/醇比上升和单位籽粒中的贮藏蛋白绝对含量下降的原因。即高温处理导致水稻籽粒蛋白质增加的主要原因,并不是由籽粒氮素物质的转运能力和蛋白质合成能力的增强所引起的,而是蛋白质占籽粒总干重的相对比值增加所致。其中,高温胁迫下水稻籽粒在醇溶蛋白合成能力及其积累量的显著下降,导致了贮藏蛋白的谷/醇比在高温下的明显提升。与之相比,增施氮素穗肥所引起的稻米贮藏蛋白含量增加,不仅表现在蛋白质占籽粒干重的相对含量上,而且表现在单位籽粒的贮藏蛋白积累的绝对量上,其主要原因可能是增施氮素穗肥可促进13 kD醇溶蛋白合成相关基因在籽粒灌浆过程中的上调表达,并对谷蛋白前体合成相关基因(GluA1、GluA2、GluA3、GluB1、GluB4和 GluB5)表达水平在高温胁迫下的迅速下降有一定缓解效应。
高等植物叶片等器官中的无机氮素是以氨基酸、酰胺的形式输送到籽粒,进而在籽粒中合成蛋白质[34]。其中,谷氨酰胺合成酶(GS)能在ATP供能下催化谷氨酸和NH3生成谷氨酰胺,又能通过GS/GOGAT循环催化谷氨酰胺和α-酮戊二酸之间的氨基转移来调节谷氨酸的生成,在无机氮转化为有机氮的这一代谢环节中起关键作用,而其所生成的谷氨酸则在谷草转氨酶(GOT)和谷丙转氨酶(GPT)等催化下转化为其他氨基酸(如天门冬氨酸和丙氨酸等),从而为籽粒蛋白合成代谢提供各种氨基酸供体[34,35]。肖辉海等[36]研究认为,水稻灌浆期籽粒中GS活性的提高是高温处理下籽粒粗蛋白总量增加的一个重要原因,但梁成刚等[37]研究表明,高温处理下水稻籽粒中的GS酶活性有明显下降,并认为籽粒GS不是高温处理对水稻籽粒氮代谢和蛋白合成影响的关键酶。根据本文对上述几个关键酶在籽粒灌浆过程中的动态变化及其在不同温氮处理组合间差异的比较分析,高温胁迫除引起低氮水平下的GS活性明显上升之外,HN-HT(高氮-高温)处理在籽粒灌浆主要时期的GS、GOT、GPT活性均低于HN-NT(高氮-常温)处理。再则,增施氮肥对籽粒GS、GOT、GPT和GDH活性的影响程度也与灌浆温度有关。在常温处理下,增施氮肥可显著提高灌浆籽粒中的GS、GOT和GPT活性,并引起灌浆籽粒中的GDH活性显著降低,但在高温处理下,增施氮肥对籽粒GS、GOT和GDH活性的影响幅度相对较小(图4-A—H)。李双哲[38]研究发现,种植季节和施氮水平对水稻叶片器官的GS和GOT活性存在相互作用,同一水稻品种晚季种植旗叶中的GS和GOT活性高于早季,但前者随施氮水平增加的增幅却低于早季。考虑到“源”器官向“库”器官的氮素转运主要是有机氮形态[34],且作物籽粒中的GS、GOT和GDH活性通常远低于叶片、根系等无机氮的主要同化器官[34,39]。因此,温氮互作对水稻氮代谢关键酶的影响在水稻植株的不同器官存在较明显差别,而在高氮水平下,高温胁迫引起水稻籽粒灌浆过程中GS、GOT、GPT活性的显著降低,说明高温胁迫会在一定程度“抵消”增施氮肥对水稻籽粒氮代谢的增进效应,并对水稻籽粒中氨基酸转运代谢过程产生不利影响,进而影响籽粒贮藏蛋白的合成过程。值得一提的是,氮肥水平和灌浆期高温,不仅对水稻籽粒灌浆过程中的氨基酸转运和贮藏蛋白合成代谢产生影响,而且与籽粒器官中的碳-氮分流、蔗糖卸载和淀粉合成积累过程存在密切联系[13,27,39],因此进一步揭示不同氮素水平下灌浆期高温对水稻贮藏蛋白积累及组分影响与籽粒蔗糖卸载-淀粉合成代谢过程间的相互联系,对于水稻优质与高产相协同的栽培调控机理问题研究具有重要意义。
4 结论
氮素穗肥和灌浆结实期高温均引起稻米蛋白质含量上升,但单位籽粒中的贮藏蛋白绝对量在高温处理下呈下降趋势,以13 kD醇溶蛋白亚基组分受高温影响的下降幅度最大,导致稻米贮藏蛋白的谷/醇比降低,其原因主要是由于编码水稻13 kD醇溶蛋白合成基因Pro13在高温处理下的下调表达所致,且稻米贮藏蛋白在灌浆期高温下的相对含量增加,并不是由其灌浆籽粒中的氮转运代谢和蛋白质合成能力的增强所致;增施氮素穗肥显著增加稻米贮藏蛋白相对含量和单位籽粒蛋白绝对含量,但对贮藏蛋白的谷/醇比影响不大,且谷蛋白组分中的37 kD酸性亚基和22 kD碱性亚基在不同氮处理水平下的相对比例基本保持稳定;氮素穗肥可提高水稻籽粒灌浆中后期谷氨酰胺合成酶(GS)、谷草转氨酶(GOT)和谷丙转氨酶(GPT)酶活性,并引起灌浆籽粒谷氨酸脱氢酶(GDH)活性显著降低,但对高温灌浆籽粒中GS、GOT和GDH活性的影响程度相对较小,因此高温胁迫在一定程度可“抵消”增施氮肥对水稻籽粒氮代谢的增进效应,进而影响水稻籽粒中的贮藏蛋白合成过程。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 6]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 5]
[本文引用: 4]
[本文引用: 4]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 5]
[本文引用: 9]
[本文引用: 9]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 2]
