 ,1, 杜国栋2, 邵静3, 张静茹1, 孙海龙
,1, 杜国栋2, 邵静3, 张静茹1, 孙海龙 ,1
,1Physiological Response of Mitochondrial Function of Strawberry Roots to Exogenous Phenolic Acid
LU XiaoFeng ,1, DU GuoDong2, SHAO Jing3, ZHANG JingRu1, SUN HaiLong
,1, DU GuoDong2, SHAO Jing3, ZHANG JingRu1, SUN HaiLong ,1
,1通讯作者:
责任编辑: 赵伶俐
收稿日期:2020-05-21接受日期:2020-11-26网络出版日期:2021-03-01
| 基金资助: |
Received:2020-05-21Accepted:2020-11-26Online:2021-03-01
作者简介 About authors
鲁晓峰,Tel:13314021850;E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (658KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
鲁晓峰, 杜国栋, 邵静, 张静茹, 孙海龙. 草莓根系线粒体对外源酚酸胁迫的生理响应[J]. 中国农业科学, 2021, 54(5): 1029-1042 doi:10.3864/j.issn.0578-1752.2021.05.014
LU XiaoFeng, DU GuoDong, SHAO Jing, ZHANG JingRu, SUN HaiLong.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】连作障碍是设施草莓生产遇到的严重问题,植物根系作为植物与外界交流的重要媒介,在与外界互作过程中起重要作用[1]。酚酸物质是根系分泌物的主要成分,同时也是造成连作障碍的主要原因之一[2]。因此,探究草莓根系线粒体对酚酸胁迫的生理响应规律,可为进一步研究草莓根系线粒体对连作障碍的适应机制提供理论基础。【前人研究进展】一般认为,土壤和植株两个系统内部的生物和非生物因素都是引起草莓连作障碍的主要原因,而化感自毒作用是导致土壤微环境恶化的主要原因之一[3]。自毒物质可促使细胞膜结构发生改变,造成细胞内物质外渗,阻碍细胞正常生理活动及物质运输[4]。吴凤芝等[5]在探究外源对羟基苯甲酸和苯丙烯酸对黄瓜幼苗生长发育时发现,高浓度酚酸破坏黄瓜根系贮藏组织结构,线粒体功能基本丧失。SINGH等[6]研究也指出,单萜等发生氧化应激反应会引起细胞膜及膜结构的完整性丧失,从而导致细胞死亡破裂。环境释放化感物质会导致植物根系的相对活性及功能发生变化。ABENAVOLI等[7]研究发现,肉桂酸、阿魏酸和香豆酸会影响根系硝酸盐的吸收和膜H+-ATPase的活性。供体植物释放的化感物质可通过影响线粒体电子传递过程、养分吸收、ATP生成和氧化磷酸化过程来抑制细胞呼吸。张国伟等[8]在用羟基苯甲酸和间苯三酚处理棉花根系时发现,MPTP开放,线粒体膜中不饱和脂肪酸氧化,膜流动性降低,打破线粒体内电化学平衡,阻碍氧化还原通道的畅通。平邑甜茶在受到根皮苷胁迫后,线粒体膜的完整性被破坏,影响线粒体的结构和功能,抑制根系呼吸速率,降低根系TCA循环关键酶活性[9]。张鹤[10]在对草莓连作土壤进行分离鉴定时发现,对羟基苯甲酸、香草酸、邻苯二甲酸和丁香酸为主要变化的酚酸类物质,其中丁香酸和邻苯二甲酸作用效果最显著。【本研究切入点】有关外源酚酸对作物根系形态及保护性酶活性的影响已有研究,但有关外源酚酸邻苯二甲酸和丁香酸对草莓根系线粒体膜功能、呼吸代谢、抗氧化酶系统的影响及它们之间的关系还未见详细报道。【拟解决的关键问题】通过外源酚酸浇灌根系的方式,验证和理清自毒酚酸物质对草莓植株根系线粒体功能的影响,为研究草莓连作障碍防控技术提供理论依据。1 材料与方法
1.1 试验材料
本试验于2016年5月至2017年12月进行,供试材料为日本草莓品种‘宝交早生’(Fragaria× ananassa Duch.),取自辽宁省沈阳市沈北新区国邦园艺农场草莓苗木生产基地。外源酚酸物质邻苯二甲酸和丁香酸都为分析纯标准品(Sigma公司,美国),购自苏州科铭生物技术有限公司。1.2 试验处理
参考连作22年的草莓根际土壤中检测出的邻苯二甲酸和丁香酸的实际浓度,配制27.0 μg·g-1邻苯二甲酸(L)、丁香酸(D)及两种酚酸混合溶液(D+L)进行外源处理[10]。用0.3%的乙醇溶液配制浓度为27.0 μg·g-1的邻苯二甲酸和丁香酸溶液,敞口避光放置过夜,使乙醇充分挥发,以溶有0.3%酒精的清水敞口放置过夜作为对照(CK)。以‘宝交早生’为试验材料,取4叶1心的草莓幼苗定植于直径16 cm、高16 cm的塑料盆中,栽培基质为消毒的清洁河沙,质量为1.5 kg,每盆单株小区,重复30次。整个生长周期在基地温室内进行,定期浇灌Hoagland营养液,补充充足的水分及养分,确保植株正常生长。定植30 d后选择长势一致的草莓植株,用浓度为27.0 μg·g-1的丁香酸、邻苯二甲酸溶液及丁香酸+邻苯二甲酸混合液分别浇灌草莓根部,连续5次浇灌,每次间隔1 d,每株用量100 mL,重复3次。为防止酚酸溶液流失,在培养钵下面放置托盘,将外渗的酚酸溶液重新浇回培养钵中。处理10 d后按不同时间段取样,进行相关生理指标的测定。
1.3 测定方法
1.3.1 草莓植株生长量、生物量及形态指标的测定 植株处理20 d时,用卷尺、游标卡尺等测定植株株高、茎粗、叶面积及叶柄长度,每个指标10次重复。另外,每个处理中选取3株长势均一的幼苗,用蒸馏水将植株清洗干净,擦干植株表面水分,用于鲜重的测定。后于105℃杀青20 min,置于烘箱中,80℃烘至恒重,冷却后测定干物质重量。利用根系扫描仪(Epson Perfection V800 photo)扫描并保存完整的植株根系图像,用WinRHIZO根系分析软件对根总长、根系总表面、根系平均直径、根体积、根尖数量进行分析,并进行根系分级。
1.3.2 根系线粒体细胞功能测定 线粒体膜通透性转换孔(MPTP)的测定参照DE MARCHI等[11]方法,单位为△A·g-1。按照BRAIDOT等[12]方法测定线粒体膜电位,以550 nm和630 nm两种波长下单位质量线粒体的吸收值之比计算细胞色素Cyt c/a[13]。
1.3.3 根系活力及活性氧含量的测定 根系活力采用TTC法测定[14],单位为mg·g-1·h-1;质膜H+-ATPase测定参照BLUMWALD等[15]方法,单位为μmol Pi?mg-1 protein·h-1。
H2O2的组织化学定位参照LI等[16]的方法,用二氨基联苯胺(DAB,Amresco)(0.2 mol?L-1的HCl溶解)对H2O2的产生进行定位。取草莓根尖浸入到含1 mg?mL-1 DAB的水溶液,抽真空后培养箱(25℃)黑暗中反应2 h,以使DAB被吸收并与根系内H2O2和过氧化物酶进行反应,在95%的乙醇溶液中煮沸10 min进行固定和脱色,万能显微镜拍照保存。
$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$的组织化学定位参照LI等[16]的方法,取根尖,放入含有1 mg?mL-1 NBT的10 mmol?L-1磷酸缓冲液中(pH 7.8),真空渗透8 min后,在95%的乙醇溶液中煮沸10 min进行固定和脱色,万能显微镜拍照保存。
1.3.4 根系抗氧化系统相关酶活性测定 SOD、POD、CAT、APX活性的测定参照汪晓谦[17]所在实验室建立的体系。
1.3.5 草莓根系线粒体电子传递链、呼吸途径和能量代谢等途径关键酶的研究 根系呼吸代谢途径参照余让才等[18]的方法,采用HANSATECH公司(英国)Oxytherm液相氧电极自动测定系统测定,经过根系浇灌等酚酸处理,测定第1、3、5、7和9天的根系呼吸速率;糖酵解途径(EMP)、三羧酸循环(TCA)和磷酸戊糖途径(PPP)分别用0.5 mol·L-1的NaF、丙二酸和Na3PO4抑制,3种生化途径的反应介质为0.2 mol·L-1磷酸缓冲液(pH 6.8)。己糖激酶(HK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、苹果酸脱氢酶(MDH)、琥珀酸脱氢酶(SDH)、异柠檬酸脱氢酶(IDH)、葡萄糖-6-磷酸脱氢酶(G-6-PDH)及6-磷酸葡萄糖酸脱氢酶(6-PGDH)等活性的测定采用试剂盒(苏州科铭生物有限公司)方法测定。氧化磷酸化相关酶Na+K+-ATPase、Ca2+Mg2+-ATPase活性的测定采用试剂盒(苏州科铭生物有限公司)测定。
1.4 数据处理
所得数据利用DPS 7.05统计软件进行单因素方差分析(ANOVA),Duncan新复极差法检验差异显著性,Sigma plot 10.0软件绘图。2 结果
2.1 不同酚酸处理对草莓幼苗根系形态指标的影响
植物根系是酚酸作用的主要对象,酚酸物质能通过影响植株根系构型,包括根系的形态和表型,阻碍植株对土壤中的水分和养分的吸收,进而影响草莓植株的生长发育。由表1可知,外源酚酸处理草莓根系能显著影响根系各构型参数,表现为D处理>D+L处理>L处理,其中,D处理显著影响草莓根系总根长、总表面积、根系总体积和平均直径,分别比对照减少了5.2%、16.2%、7.2%、10.0%(P<0.05);L处理抑制程度最轻,在处理20 d后测定各指标,分别比对照减少了1.1%、8.8%、2.9%、5.0%。说明外源施入酚酸后,恶化了土壤环境,抑制草莓植株根系的加粗生长。各处理的根尖数、分枝数和交叉数也低于对照,变化趋势与根系各构型参数相似,说明酚酸物质抑制根系的发生和生长,根系对丁香酸的作用更为敏感。两种酚酸混合后,使根系构型各参数整体下降,能一定程度上减缓丁香酸对根系的损伤。Table 1
表1
表1外源酚酸处理对草莓根系根构型参数的影响
Table 1
| 处理 Treatment | 总根长 Length (cm) | 总表面积 Surf. area (cm2) | 根系总体积 Root volume (cm3) | 平均直径 Avg. Diam. (mm) | 根尖数 Tip | 分枝数 Fork | 交叉数 Crossings |
|---|---|---|---|---|---|---|---|
| CK | 2416.26±68.16a | 279.69±10.22a | 2.36±0.12a | 0.40±0.01a | 4244.68±66.82a | 24472.57±866.17a | 5206.71±956.34a |
| D | 2290.69±53.04c | 234.48±7.17c | 2.19±0.09b | 0.36±0.02c | 2567.38±80.38c | 16610.73±2147.65c | 3836.00±514.50b |
| L | 2389.52±85.22ab | 254.98±9.48ab | 2.29±0.04a | 0.38±0.01b | 3160.01±113.42b | 19865.30±585.32b | 4546.40±587.37b |
| D+L | 2318.27±66.14bc | 244.61±10.19bc | 2.26±0.32a | 0.37±0.02bc | 3072.5±342.01b | 18900.83±970.31b | 4366.75±289.16b |
新窗口打开|下载CSV
2.2 不同酚酸处理对草莓幼苗根系活力及离子泵含量的影响
2.2.1 对草莓幼苗根系活力的影响 如图1所示,施加两种外源酚酸及其混合溶液均能导致植株根系活力显著降低,且随着处理时间的延长,根系活力呈现明显的下降趋势。其中,外源施入丁香酸后伤害程度最大,在第9天时活力最低,比对照降低了34.1%(P<0.05),施加邻苯二甲酸和两者混合溶液出现相似的变化趋势,但变化幅度相对较小,分别比对照降低了23.2%和27.6%。由此可知,外源酚酸能够一定程度上降低植株的根系活力,不同类型酚酸作用程度不尽相同。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同酚酸处理对草莓幼苗根系活力的影响
不同小写字母表示同一处理在不同时间段差异显著(P<0.05);不同大写字母表示不同处理在同一时间点差异显著(P<0.05)。下同
Fig. 1Effects of different phenolic acids on root activity of strawberry roots
Different small letters showed significant different among different time periods under the same treatment (P<0.05); Different capital letters showed significant different among treatments under the same time period (P<0.05). The same as below
2.2.2 对草莓幼苗根系质子泵活性的影响 通常情况下,质子泵可通过水解ATP产生能量,调节植株细胞内pH、促进根系吸收养分及同化物运输,是衡量植物受胁迫伤害程度的重要指标。如图2-a所示,在草莓根系受到外界酚酸胁迫时,随着胁迫时间的延长,H+-ATPase活性前期呈现显著下降趋势;在处理第3天时下降幅度最大,处理D、处理L、处理D+L分别比对照下降了38.8%、28.8%、33.7%(P<0.05),后期变化趋于平稳。K+Na+-ATPase活性变化具有相似的变化趋势,活性随着酚酸胁迫时间的延长,呈现出逐步下降的趋势,各处理均在第9天时活性最低,且表现为处理D>处理L>处理D+L(图2-b)。由图2-c可知,与对照相比,外源酚酸处理可显著降低根系Ca2+Mg2+-ATPase活性;处理第1天时各处理之间变化并不明显,但随着处理时间的延长,根系Ca2+Mg2+-ATPase活性降低幅度显著降低,于处理第9天下降幅度最明显,各处理分别比对照降低了44.6%、30.1%和39.4%。由此可知,外源酚酸能显著影响植株根系离子泵活性,阻碍细胞内外各离子的运转能力。
图2
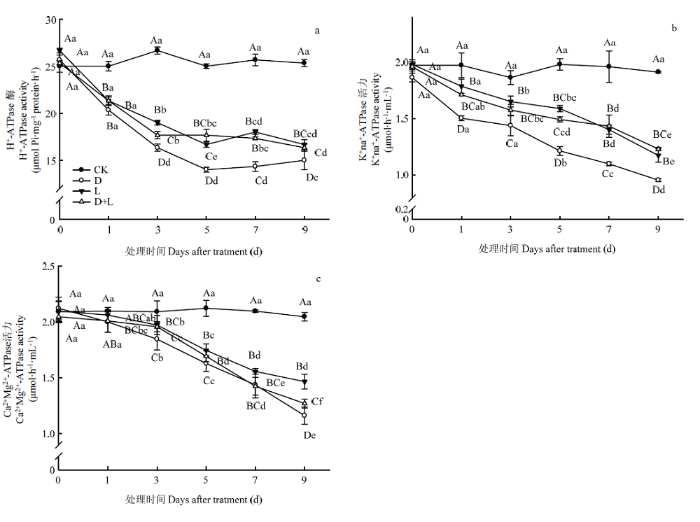 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同酚酸处理对草莓幼苗根系质子泵活性的影响
Fig. 2Effect of different phenolic acids on the activity of proton pump in strawberry roots
2.3 不同酚酸处理对草莓幼苗根系活性氧含量及组织化学定位的影响
2.3.1 对草莓幼苗根系活性氧含量的影响 如图3-a所示,与对照相比,随着处理时间的延长,处理D的草莓根系超氧阴离子自由基($ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$)含量呈逐渐上升趋势,处理第7天时,$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$含量显著上升,达最高值,较CK增长53.3%;L处理第7天时,草莓根系的$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$含量比CK增长31.8%,各处理$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$含量变化趋势相似,但处理D+L的$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$含量始终低于处理D。由图3-b可知,与对照相比,随着胁迫时间的持续,处理D的根系过氧化氢(H2O2)含量呈上升趋势,处理第9天时,H2O2含量达到最高值,较CK增长61.8%;处理L和处理D+L根系H2O2含量变化与处理D相似,但始终低于处理D。说明外源丁香酸处理对植株根系的伤害严重,对ROS产生有较大的影响,而两种溶液混合处理有效缓解丁香酸对草莓根系的伤害。图3
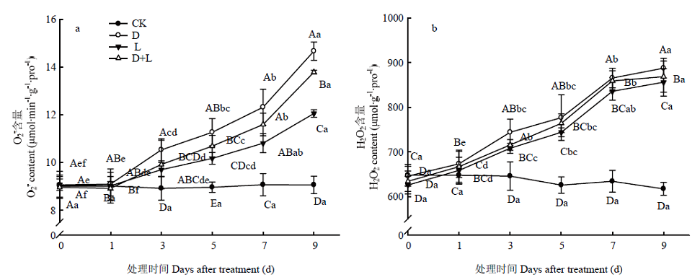 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同酚酸处理对草莓幼苗根系活性氧含量的影响
Fig. 3Effect of different phenolic acids on the content of reactive oxygen species in strawberry roots
2.3.2 对草莓幼苗根系活性氧组织化学定位的影响 如图4所示,在正常培养情况下,活性氧的积累量较低,根系浇灌酚酸处理后,与对照相比,H2O2和$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$染色程度都出现不同程度的加深,表现为D处理>D+L处理>L处理,说明外源酚酸处理对植株根系的伤害严重,对ROS的产生有较大影响,且不同类型酚酸作用程度略有差异,根系对丁香酸处理更敏感。
图4
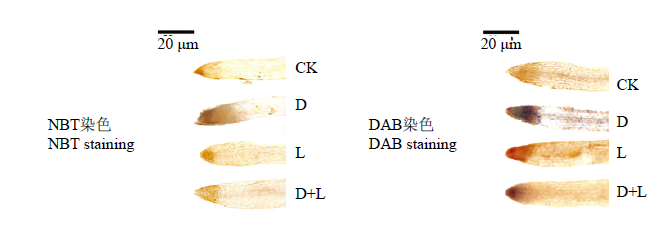 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4不同酚酸处理对草莓幼苗根系活性氧组织化学定位的影响
Fig. 4Effects of different phenolic acids on the histochemical localization of ROS in strawberry roots
2.4 不同酚酸对草莓幼苗根系线粒体功能的影响
第3天时,与对照相比,处理D根系线粒体膜通透性(MPT)显著上升,比CK上升59.1%;处理第9天时,MPT达最高值。处理L和处理D+L的MPT值一直低于处理D(图5-a)。由此可知,外源丁香酸处理影响了线粒体通透性转换孔道的开放程度,对MPT产生抑制作用,且作用效果明显高于邻苯二甲酸,混合溶液处理可一定程度上减缓对MPT的负面影响。图5
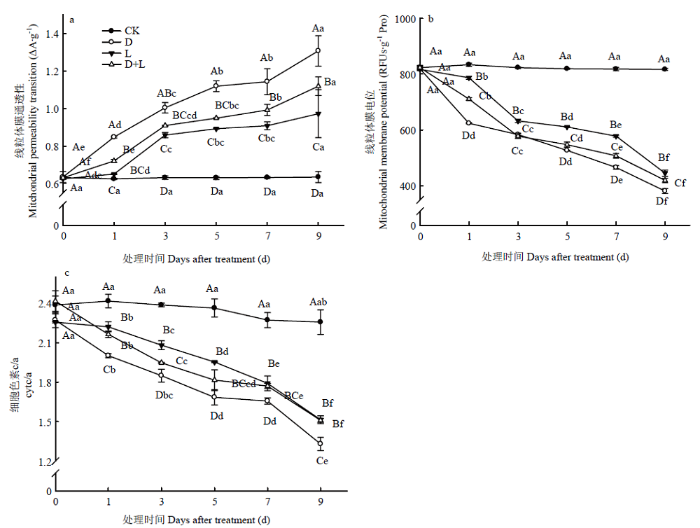 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5不同酚酸处理对草莓幼苗根系线粒体功能的影响
Fig. 5Effects of different phenolic acids on the mitochondrial function of strawberry roots
处理D使根系线粒体膜Δψm呈持续下降的趋势,于处理第1天下降幅度最显著,较CK下降25.2%,并在第9天达到最低值。处理L、处理D+L的Δψm与处理D有相似的变化趋势,但前两者普遍高于后者。说明丁香酸对草莓根系线粒体膜功能的伤害程度高于邻苯二甲酸,混合溶液处理能一定程度缓解丁香酸对草莓植株的伤害(图5-b)。
由图5-c可知,Cyt c/a变化趋势与Δψm相似,与对照相比,各处理均使草莓根系线粒体内膜上细胞色素Cyt c/a含量明显下降,均于处理第9天达最低值,且D+L处理的线粒体Cyt c/a较处理D下降幅度小,但均与对照差异显著。表明外源酚酸导致草莓根系线粒体内膜上的Cyt c不断流失,对线粒体的呼吸电子传递功能产生严重影响,而不同类型酚酸处理作用效果不同。
2.5 不同酚酸处理对草莓幼苗根系呼吸速率及根呼吸途径的影响
2.5.1 对草莓幼苗根系呼吸速率的影响 根系呼吸速率可反映根系呼吸代谢变化。如图6所示,在正常培养情况下,根系呼吸速率可达到1.2 μmol O2·min-1·g-1 FW,外源酚酸处理后,根系总呼吸速率呈现下降趋势,处理D、处理L、处理D+L分别比对照下降22.1%、6.6%和8.2%,说明酚酸处理在一定程度上影响根系呼吸代谢活动,且不同酚酸的作用效果不同。图6
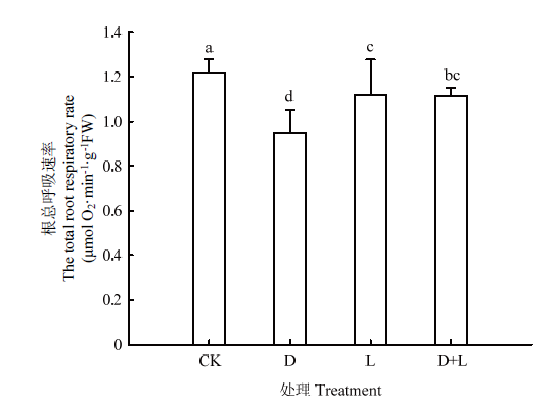 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6不同酚酸处理对草莓幼苗根系呼吸速率的影响
Fig. 6Effects of different phenolic acids on root respiration rate of strawberry roots
2.5.2 对草莓幼苗根呼吸途径的影响 由图7可知,在进行根系浸泡处理后,各代谢途径发生变化,EMP途径所占比例大幅降低,与对照相比,处理D、处理L、处理D+L分别比对照降低了51.4%、34.0%、44.6%;TCA循环也出现一定程度的下降,但各处理变化并不明显,由EMP-TCA逐渐向PPP途径转化,PPP途径分别上升了111.9%、74.5%、21.4%,产能逐渐降低,且胁迫越深,负效应越显著。
图7
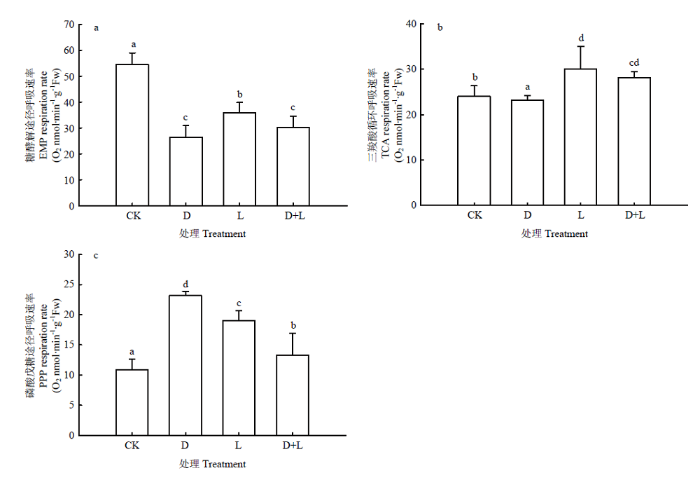 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7不同酚酸处理对草莓幼苗根呼吸途径的影响
Fig. 7Effects of different phenolic acids on root respiration pathway of strawberry roots
2.6 不同酚酸处理对草莓幼苗根系呼吸关键酶活性的影响
2.6.1 对根系呼吸EMP途径关键酶活性的影响 己糖激酶(HK)、磷酸果糖激酶(PFK)和丙酮酸激酶(PK)是糖酵解途径(EMP)调控关键酶。如图8-a所示,与对照相比,处理D和处理D+L的HK活性表现为随着胁迫时间的延长逐渐降低,而处理L在酚酸胁迫下先升高后降低,在处理后第3天,其活性达到最大值,比对照增长了3.3%,然后持续降低,第9天达最低值。由图8-b可知,随着外源酚酸胁迫时间的延长,各处理根系PFK活性均表现为先升高后降低的趋势,均在第5天活性达到最大值,处理D、处理L和处理D+L分别比对照增加了108.4%、117.3%和103.5%,并于第9天降到最低值,其中处理L和处理D+L活性高于对照,而处理L的PHK活性比对照降低20.1%。由图8-c可知,在酚酸胁迫前期,各处理均使根系PK活性呈升高的趋势,然后在第5天显著降低,至第9天为最低值,变化幅度表现为处理D>处理D+L>处理L。图8
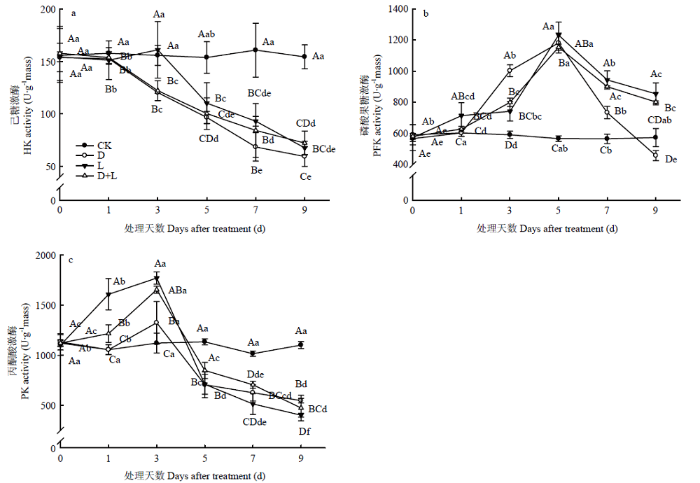 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8不同酚酸处理对草莓幼苗根呼吸EMP途径关键酶活性的影响
Fig. 8Effects of different phenolic acids on respiratory EMP pathway key enzyme activity of strawberry roots
2.6.2 对根系呼吸TCA途径关键酶活性的影响 琥珀酸脱氢酶(SDH)、异柠檬酸脱氢酶(IDH)和苹果酸脱氢酶(MDH)在调控TCA途径中起关键调控作用。如图9-a所示,酚酸处理后,根系琥珀酸脱氢酶(SDH)随处理时间的延长呈缓慢下降趋势,前期变化并不显著,于处理后第7天下降最显著,与对照相比,处理D、处理L和处理D+L分别下降了45.2%、17.4%和27.7%,并于第9天达到最低值,且处理D始终为最低水平。图9-b显示,处理D和处理D+L的异柠檬酸脱氢酶(IDH)活性都表现为先迅速下降,然后变化趋于平稳,再显著下降,且活性始终为处理D+L>处理D;处理L也呈显著下降趋势,但活性始终高于处理D和处理D+L。说明根系TCA途径对丁香酸响应更为敏感,两种溶液混合作用一定程度上减缓丁香酸对植株根系的伤害。由图9-c可以看出,随着胁迫时间的延长,处理D的苹果酸脱氢酶(MDH)活性呈现持续降低的趋势,处理L的MDH活性先升高后降低,处理D+L具有相似的变化趋势,但变化程度低于处理L。
图9
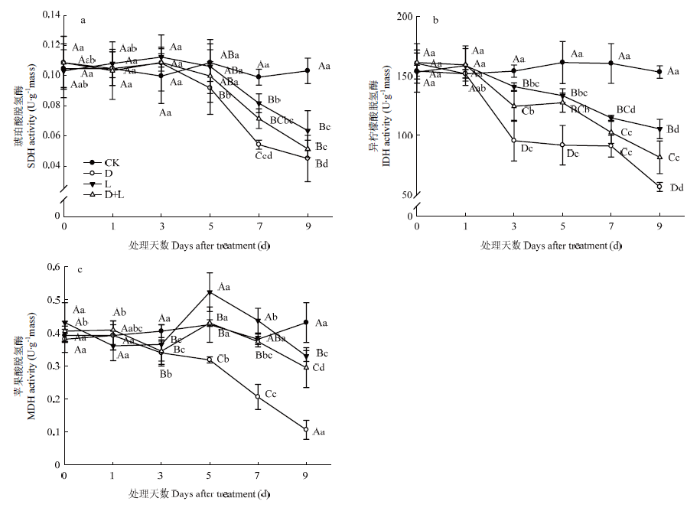 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9不同酚酸处理对草莓幼苗根呼吸TCA途径关键酶活性的影响
Fig. 9Effect of different phenolic acids on respiratory TCA pathway key enzyme activity of strawberry roots
2.6.3 对根系呼吸PPP途径关键酶活性的影响 如图10-a所示,在整个酚酸处理过程中,对照组根系中葡萄糖-6-磷酸脱氢酶(G-6-PDH)变化并不明显,与对照相比,植株在受到外源酚酸胁迫过程中,G-6-PDH具有相似的变化趋势,表现为活性先升高后降低,且处理D<处理D+L<处理L<CK。酚酸胁迫第3天时,处理D的6-磷酸葡萄糖酸脱氢酶(6-PGDH)活性骤增,比对照上升了30.3%,随后迅速降低,于处理第9天达到最低值(图10-b)。处理L和处理D+L的6-PGDH活性随着酚酸胁迫时间的延长呈逐渐下降趋势,第9天活性最低,分别比对照下降了52.3%和60.8%。
图10
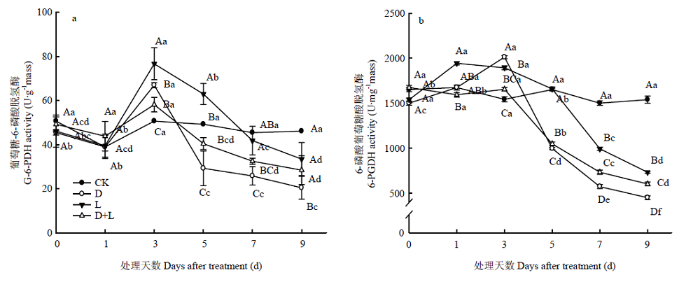 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10不同酚酸处理对草莓幼苗根呼吸PPP途径关键酶活性的影响
Fig. 10Effects of different phenolic acids on respiratory PPP pathway key enzyme activity of strawberry roots
2.7 不同酚酸对草莓幼苗根系抗氧化酶活性的影响
超氧化物歧化酶(SOD)是参与$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$分解的唯一酶类。由图11-a可以看出,与对照相比,随着外源酚酸胁迫处理时间增加,处理D、处理L和处理D+L的草莓根系SOD活性均呈逐渐下降趋势,且处理D的SOD活性一直低于处理L的水平。图11
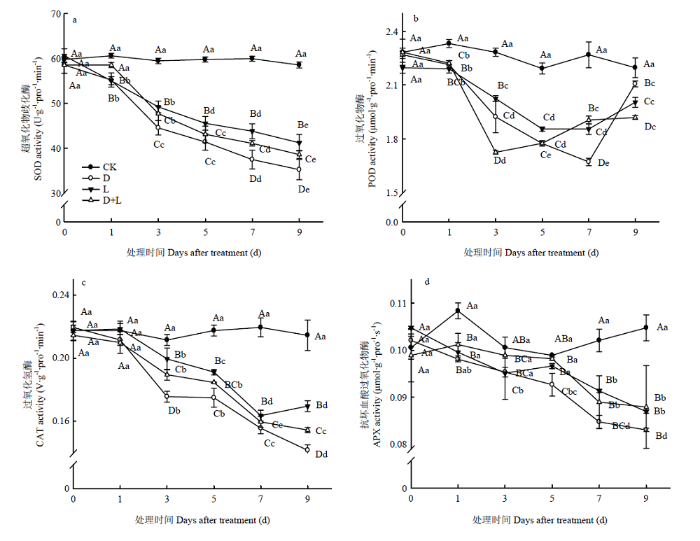 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图11不同酚酸处理对草莓幼苗根抗氧化酶活性的影响
Fig. 11Effects of different phenolic acids on antioxidant enzyme activity of strawberry roots
过氧化物酶(POD)作为胞内酶又可作为胞外酶来参与H2O2的分解,是众多涉及清除ROS类物质的最重要酶类之一。如图11-b可知,随酚酸胁迫处理时间的延长,POD活性呈先降低再升高的趋势,但其酶活性明显低于CK水平。说明外源酚酸对草莓根系产生伤害,引起根系保护性酶POD发生应激反应。
过氧化氢酶(CAT)清除剂也是生物防御体系的关键酶之一。如图11-c所示,随酚酸胁迫程度的加重,处理D的根系CAT活性逐渐降低,于胁迫处理第3天下降最为显著,比对照降低了16.7%,处理第9天的CAT活性达最低值,较CK降低了33.0%;处理L和处理D+L的草莓根系CAT活性呈相似的变化趋势,且处理L的活性始终高于处理D+L,表明两种溶液混合处理后明显缓解丁香酸对植株根系的伤害作用,为根系生理功能的正常发挥奠定条件。
如图11-d所示,前期APX含量变化并不显著,随酚酸胁迫程度的加重,处理D、处理L和处理D+L的根系APX活性整体呈降低趋势,并于第9天的含量达到最低值。
3 讨论
连作将导致草莓植株生长变弱、产量下降、果实品质变差、甚至造成绝收,给草莓产业健康发展带来严重的不良后果,酚酸作为连作障碍的主要因子之一,是目前要解决的一大重要问题。张鹤[10]对草莓连作土壤进行分离鉴定时发现,对羟基苯甲酸、香草酸、邻苯二甲酸和丁香酸为主要变化的酚酸类物质,本研究选取其中具有显著差异的2种酚酸类物质,模拟连作环境,明确草莓植株生长发育、线粒体功能等对自毒酚酸物质的应答机制。线粒体是细胞能量代谢的场所,细胞氧化功能的中心,也是植物细胞的动力中心。根系依赖线粒体呼吸代谢产生的能量,与外界维持物质吸收和交换,是产生ROS的场所,是细胞感受外界信号的原初位点,其内含有的抗氧化酶对机体有一定保护作用[19]。逆境胁迫下线粒体结构会发生显著变化。陆晓民等[20]发现,低氧胁迫下的黄瓜根系线粒体抗氧化酶活性降低,线粒体膜结构受损,本试验也得出,在受到外源酚酸胁迫后,植株根系线粒体膜透性显著增大。过量的ROS会引起线粒体膜氧化损伤,导致线粒体的电子传递受阻,内膜的完整性和呼吸电子传递链受到破坏,进一步破坏线粒体的抗氧化防御体系,使线粒体$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$产生速率加快、H2O2和MDA含量激增、膜脂过氧化加剧[21]。此外,SOLTYS等[22]利用氰氨(CA)处理玉米幼苗,也发现根尖边缘细胞数量减少,原生质体降解,线粒体空泡增加。本研究中,施加外源丁香酸和邻苯二甲酸后,草莓根系线粒体的$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$产生速率显著增加,根系Δψm持续降低,此结果也与前人研究结果相对应。
在植物根系中,线粒体呼吸链电子漏是$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$产生的主要来源,而线粒体膜电位的下降又能导致线粒体呼吸链电子漏的增加[23,24]。施用外源酚酸造成草莓根系线粒体膜电位降低,这可能是导致根系$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$产生的重要原因之一。呼吸电子传递链在植物体呼吸作用及能量代谢过程中发挥重要的传递作用。在对拟南芥干旱处理发现,拟南芥的呼吸作用受到抑制,呼吸电子传递链的5个复合体基因均呈现下调表达,对拟南芥细胞色素呼吸起着抑制作用[25]。细胞色素Cyt c介导的呼吸链电子漏旁路,可以清除由于呼吸链漏电子而产生的$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$和H2O2。徐建兴[26]研究发现,当植物遭受逆境胁迫时,线粒体内膜的完整性和呼吸电子传递链受到破坏,最终导致线粒体$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$产生速率加快,H2O2和MDA含量增高。自毒酚酸物质邻苯二甲酸和丁香酸使草莓根系线粒体MPTP、Δψm持续降低,H+-ATPase活性下降,Cyt c从内膜上脱落使呼吸链解偶联。初步结论是高剂量酚酸类物质对草莓根系线粒体的结构和功能产生严重的伤害。线粒体内膜包含以细胞色素氧化酶(COX)和交替氧化酶(AOX)为末端氧化酶的交替电子途径,是氧化磷酸化的主要场所,易遭受逆境条件影响[27,28,29,30,31]。本研究结果显示,3种酚酸胁迫处理的草莓根系线粒体Cyt c/a值明显低于CK,而处理D+L的Cyt c/a明显高于处理D,根系中的H2O2和MDA含量也低于处理D水平。表明在外源施入两种混合溶液后,一定程度上保护了线粒体膜及其他细胞器膜,缓解了丁香酸对于草莓植株根系线粒体功能的伤害。
逆境下,纵观有关质膜PM-ATPase活性的报道,刘炜等[32]发现低温处理后质膜Ca2+-ATPase迅速失活,很少看到它们的活性反应产物,本试验观察到,在外源酚酸丁香酸处理草莓根系过程中,质膜H+-ATPase活性呈现持续下降趋势,可能由于酚酸抑制质膜H+-ATPase的基因表达,根系质膜H+-ATPase活性降低,随着处理时间的延长,H2O2和$ \mathrm{O}_{2}^{\mathop{}_{.}^{-}}$大量积聚,膜脂过氧化加剧,导致质膜H+-ATPase活性进一步下降,质膜功能损伤。
根系作为对地下部分胁迫最敏感的部位,当植物受到外界胁迫时,根系首先感知地下部分环境变化,根系呼吸代谢发生改变。本研究中,在受到外源酚酸胁迫后,根系呼吸速率显著降低,虽仍以EMP-TCA途径为主,贡献率却显著降低,而PPP途径呈现出明显的增大趋势,EMP、TCA途径关键酶活性均持续降低,PPP途径关键酶活性出现短暂升高再降低的趋势。说明在酚酸胁迫初期,植株根系对环境变化做出应激反应,根系PPP途径正向调控,对胁迫做出积极响应。但后期随着胁迫时间的延长,各呼吸关键酶活性均受到抑制作用,进而导致各呼吸途径受阻,与前人研究相似[33]。自然环境中,植物最终表现出的化感活性,除具有化感潜力的单体物质外,与各物质间的互作效应也有一定的关系[34]。本研究发现,两种溶液混合处理后,其作用效果显著优于丁香酸单独处理,各呼吸代谢途径贡献率变化幅度都显著低于丁香酸处理,且酶活性变化也显著提高,可能原因是2种物质之间存在拮抗效应,与单一酚酸物质作用效果不同,混合溶液产生的拮抗作用能一定程度降低丁香酸的伤害程度,改善了土壤环境,提高了草莓植株对外源酚酸的适应能力,此研究结果与李琳琳等[35]探究不同外源酚酸化感物质组合对棉花种子萌发和幼苗生长的结果相似。
4 结论
研究外源酚酸物质对草莓根系线粒体功能及抗氧化系统的影响,发现丁香酸和邻苯二甲酸均降低草莓根系的根系活力和质子泵,阻碍细胞内外各离子的运转能力,使线粒体功能的发挥受到抑制;酚酸抑制各呼吸关键酶活性,导致各呼吸途径受阻;超氧化物歧化酶、过氧化物酶和过氧化氢酶等活性也受到不同程度的抑制作用,最后致使草莓根系的防御系统崩溃,植株受到伤害。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1126/science.1083245URLPMID:12958360 [本文引用: 1]

Here we present evidence that Centaurea maculosa (spotted knapweed), an invasive species in the western United States, displaces native plant species by exuding the phytotoxin (-)-catechin from its roots. Our results show inhibition of native species' growth and germination in field soils at natural concentrations of (-)-catechin. In susceptible species such as Arabidopsis thaliana, the allelochemical triggers a wave of reactive oxygen species (ROS) initiated at the root meristem, which leads to a Ca2+ signaling cascade triggering genome-wide changes in gene expression and, ultimately, death of the root system. Our results support a
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/aob/mcl213URLPMID:17028297 [本文引用: 1]

BACKGROUND AND AIMS: Determining the mode of action of allelochemicals is one of the challenging aspects in allelopathic studies. Recently, allelochemicals have been proposed to cause oxidative stress in target tissue and induce an antioxidant mechanism. alpha-Pinene, one of the common monoterpenoids emitted from several aromatic plants including forest trees, is known for its growth-inhibitory activity. However, its mechanism of action remains unexplored. The aim of the present study was to determine the inhibitory effect of alpha-pinene on root growth and generation of reactive oxygen species, as indicators of oxidative stress and changes in activities of antioxidant enzymes. METHODS: Effects of alpha-pinene on early root growth were studied in five test species, Cassia occidentalis, Amaranthus viridis, Triticum aestivum, Pisum sativum and Cicer arietinum. Electrolyte leakage, lipid peroxidation, hydrogen peroxide generation, proline accumulation, and activities of the enzymes superoxide dismutase (SOD), ascorbate peroxidase (APX), guaiacol peroxidase (GPX), catalase (CAT) and glutathione reductase (GR) were studied in roots of C. occidentalis. KEY RESULTS: alpha-Pinene inhibited the radicle growth of all the test species. Exposure of C. occidentalis roots to alpha-pinene enhanced solute leakage, and increased levels of malondialdehyde, proline and hydrogen peroxide, indicating lipid peroxidation and induction of oxidative stress. Activities of the antioxidant enzymes SOD, CAT, GPX, APX and GR were significantly elevated, thereby indicating the enhanced generation of reactive oxygen species (ROS) upon alpha-pinene exposure. Increased levels of scavenging enzymes indicates their induction as a secondary defence mechanism in response to alpha-pinene. CONCLUSIONS: It is concluded that alpha-pinene inhibits early root growth and causes oxidative damage in root tissue through enhanced generation of ROS, as indicated by increased lipid peroxidation, disruption of membrane integrity and elevated antioxidant enzyme levels.
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
URLPMID:12948388 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:22507106 [本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
