 ,, 刘晔, 赵爽, 房伟民, 蒋甲福, 陈素梅, 陈发棣, 管志勇
,, 刘晔, 赵爽, 房伟民, 蒋甲福, 陈素梅, 陈发棣, 管志勇 ,南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部景观农业重点实验室,南京 210095
,南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部景观农业重点实验室,南京 210095Effects of Rootstock and Scion Interaction on Salt Tolerance of Grafted Chrysanthemum Seedlings
MENG Rui ,, LIU Ye, ZHAO Shuang, FANG WeiMin, JIANG JiaFu, CHEN SuMei, CHEN FaDi, GUAN ZhiYong
,, LIU Ye, ZHAO Shuang, FANG WeiMin, JIANG JiaFu, CHEN SuMei, CHEN FaDi, GUAN ZhiYong ,College of Horticulture, Nanjing Agricultural University/State Key Laboratory of Crop Genetics and Germplasm Enhancement/Key Laboratory of Landscaping, Ministry of Agriculture and Rural Affairs, Nanjing 210095
,College of Horticulture, Nanjing Agricultural University/State Key Laboratory of Crop Genetics and Germplasm Enhancement/Key Laboratory of Landscaping, Ministry of Agriculture and Rural Affairs, Nanjing 210095通讯作者:
责任编辑: 赵伶俐
收稿日期:2020-05-14接受日期:2020-08-2网络出版日期:2021-02-01
| 基金资助: |
Received:2020-05-14Accepted:2020-08-2Online:2021-02-01
作者简介 About authors
孟蕊,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1894KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
孟蕊, 刘晔, 赵爽, 房伟民, 蒋甲福, 陈素梅, 陈发棣, 管志勇. 砧穗互作对菊花嫁接苗耐盐性的影响[J]. 中国农业科学, 2021, 54(3): 629-642 doi:10.3864/j.issn.0578-1752.2021.03.016
MENG Rui, LIU Ye, ZHAO Shuang, FANG WeiMin, JIANG JiaFu, CHEN SuMei, CHEN FaDi, GUAN ZhiYong.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】园林小菊是经长期人工杂交育种所得,其花色艳丽、植株低矮、株型紧凑,是理想的园林造景花卉,被广泛应用于园林、花海等景观营造和城市街道绿化美化[1]。但是菊花在沿海滩涂及干旱内陆盐碱地区栽培易受到盐胁迫而出现生长障碍,或长期在设施条件下栽培由于土壤次生盐渍化而易出现生理障碍[2]。‘钟山嫣红’为笔者课题自主选育并在近年广泛推广的园林小菊之一,该品种灌丛圆整、开花密集、花色浓艳、观赏价值高,但在苏北沿海等盐碱地区使用时,与多数园林小菊品种一样,有明显的盐害症状。因此,研究菊花通过嫁接能否提高其耐盐性,具有园林建设实践需求性及品种代表性。盐胁迫对植物造成的伤害首先是渗透胁迫,然后是离子失调引起的毒害和营养失衡,以及氧化胁迫导致的生理生化代谢紊乱和有毒物质积累,并最终影响植物的生长发育[3,4,5,6]。嫁接技术可利用砧木为接穗提供良好的根系,从而提高植株抵抗逆境的能力,保证植物在逆境环境下正常生长[7]。研究砧木嫁接对菊花耐盐性的影响,可以进一步了解砧穗互作影响菊花耐盐性的机制,并且为园林小菊的推广应用提供实践依据。【前人研究进展】研究表明,嫁接可以在多个方面提高植物的耐盐性,包括调节Na+、K+的吸收和分配[8,9,10,11],提高光合性能[12,13],增强抗氧化能力[14,15],以及增加可溶性糖、甜菜碱、可溶性蛋白等渗透调节物质的含量[16],这些因素综合构成了嫁接提高植物耐盐性的生理基础。黄蒿(Artemisia annua)是菊科蒿属的植物[17],以黄蒿为砧木嫁接菊花,可以提高菊花的抗旱性[18]、抗蚜性[19],缓解菊花的连作障碍[20]。可见,以黄蒿为砧木嫁接菊花是提高菊花抗性的有效手段。嫁接菊花的耐盐性研究发现,盐胁迫下以黄蒿为砧木的嫁接苗生物量、净光合速率、呼吸速率、抗氧化酶活性(SOD、CAT、APX)等均显著高于自根苗,而MDA、超氧阴离子自由基(O2-)增幅明显低于自根苗;并且异根嫁接苗茎、叶等部位的Na+含量均显著低于自根苗,砧木根系Na+含量高于自根苗,根、茎、叶的Ca2+、Mg2+、K+含量显著高于自根苗[2]。【本研究切入点】盐胁迫下,离子在异根嫁接苗不同器官的区域化分布是理解嫁接提高菊花耐盐性的重要因素,嫁接操作形成的伤口及愈合过程、不同的砧木与接穗组合是否会影响菊花的耐盐性,离子的分配策略是否因此而发生变化,已有的研究尚不能对上述问题完全阐述清楚。【拟解决的关键问题】本研究以黄蒿为砧木,盐敏感品种园林小菊‘钟山嫣红’为接穗进行嫁接,设置菊花‘钟山嫣红’扦插苗(自根苗)和扦插苗自根嫁接苗(自接苗)2组对照,研究NaCl胁迫条件下[21],嫁接对菊花耐盐性的影响以及盐离子在菊花(含砧木)不同器官的分配策略以及嫁接本身是否也能影响抗性,研究嫁接对菊花生理特性以及菊花不同部位Na+、K+含量的影响,旨在初步揭示嫁接提高菊花耐盐性的机理,为扩大园林小菊的应用范围提供参考。1 材料与方法
1.1 试验材料
供试植物材料黄蒿(A. annua)和园林小菊‘钟山嫣红’,均由南京农业大学中国菊花种质资源保存中心提供。1.2 试验处理
2019年2月中旬在玻璃温室内播种黄蒿种子,栽培基质为复合基质(草炭:珍珠岩=2:1),4月初选择生长良好的黄蒿幼苗移栽至塑料盆(直径19 cm,高17 cm)中。4月5日从菊花‘钟山嫣红’的母株上选择健壮的插穗进行扦插,4月20日生根后转移至塑料盆中用于菊花自根嫁接,同时扦插菊花‘钟山嫣红’。4月30日,黄蒿长至株高30 cm、茎粗5 mm时,菊花长至8片叶、茎粗5 mm时,采用劈接法,分别以黄蒿和菊花作为砧木进行嫁接。5月15日选择长势一致的异根嫁接苗、自接苗、自根扦插苗各60株进行试验。将材料移于盛有1/2 Hogland营养液的塑料周转箱(体积23.4 L)内进行通气水培,气泵24 h·d-1通气。缓苗生长7 d后,分别在清水和120 mmol·L-1 NaCl条件下进行胁迫处理,胁迫浓度以每日60 mmol·L-1的浓度增加,在同一时间达到不同处理浓度,每5 d更换一次营养液,每处理20株,重复3次。
1.3 测定方法
盐处理后第0、1、4和8天通过描叶称重法[22]结合Smartscape图像分析软件测量受害叶(黄叶、萎蔫叶、干枯叶)叶面积,计算叶片受害面积比率(叶片受害面积比率=受害叶叶面积/单株总叶面积),每处理测定6个单株,取平均值。盐处理后的第0、1、4和8天,选取自上向下第3片完全展开叶,用美国LI-COR公司产的LI-6400便携式光合测定系统,设定光量子通量密度为800 μmol·m-2·s-1,温度25℃,CO2浓度为390 μL·L-1,于上午9:00—11:00测定净光合速率。
盐处理后的第0、1、4和8天,选取自上向下第3片完全展开叶测定叶绿素含量、叶片相对电导率、丙二醛含量、脯氨酸含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性。叶绿素含量采用乙醇浸提比色法[23],质膜透性采用电导率法[24]。游离脯氨酸含量采用酸性茚三酮法[25],MDA含量测定采用硫代巴比妥酸(TBA)比色法[26],SOD活性测定采用氮蓝四唑(NBT)还原法,POD活性测定采用愈创木酚显色法,CAT采用紫外吸收法进行测定[27]。
盐处理后的第0、1、4和8天,取菊花上部(自上向下第1片完全展开叶)、中部(自上向下第3—4片完全展开叶)、下部(自上向下第8片完全展开叶)叶片,嫁接接口处向上1.5 cm的茎和嫁接接口处向下1.5 cm黄蒿的茎(自根苗取与自接苗相同位置菊花的茎),用去离子水冲洗3次,再用干净的吸水纸吸干水分,置于烘箱中105℃杀青15 min,再于75℃下烘干至恒重,用研钵研成粉末,过40目筛。使用微波消解仪进行消解,称取不同部位烘干样品50 mg至干燥消化管中,添加65%浓HNO3和30% H2O2(比例4:1)。从室温10 min匀速升温到165℃,保温15 min,然后风冷降温。消解完成后用超纯水定容至25 mL,稀释母液后,用电感耦合等离子体发射光谱仪(ICP-MS)测定Na+、K+浓度[28]。
1.4 数据处理和分析方法
采用Microsoft Excel 2003软件对试验数据进行处理和绘图,使用SPSS 23.0 Duncan’s多重比较法进行统计分析(P<0.05)。2 结果
2.1 嫁接降低了菊花叶面积受害比率
如表1所示,随着NaCl胁迫时间的延长,各处理的叶面积受害比率均有所升高。自根苗、自接苗的叶片分别在盐处理的第1天和第4天开始出现明显的受害症状,叶面积受害比率随着胁迫时间的延长逐渐升高,而异根嫁接苗直到胁迫的第8天才有轻微伤害,且异根嫁接苗的叶面积受害比率明显低于自根苗和自接苗;自根苗、自接苗的根系在第8天有明显发黑现象,而异根嫁接苗黄蒿砧木的茎段粗壮、根系发达,未见明显颜色变化。图1是自根苗、自接苗和异根嫁接苗在无NaCl(图1-A)和120 mmol?L-1 NaCl(图1-B)处理0、1、4和8 d的形态变化。由此可见,黄蒿嫁接缓解了盐胁迫对菊花造成的伤害。Table 1
表1
表1单株叶面积受害比率
Table 1
| 处理 Treatment | 时间 Time (d) | |||
|---|---|---|---|---|
| 0 | 1 | 4 | 8 | |
| 自根苗+NaCl Self-rooted seedlings+NaCl | 0 | 5.30% | 7.60% | 19.80% |
| 自接苗+NaCl Self-grafted seedlings+NaCl | 0 | 0 | 0.35% | 6.90% |
| 异根嫁接苗+NaCl Hetero-root grafted seedlings+NaCl | 0 | 0 | 0 | 0.19% |
新窗口打开|下载CSV
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1嫁接对菊花‘钟山嫣红’在无NaCl(A)和120 mmol?L-1 NaCl(B)胁迫下形态的影响
a-0、a-1、a-4、a-8表示自根苗在无胁迫第0、1、4、8天的形态;b-0、b-1、b-4、b-8表示自接苗在无NaCl胁迫第0、1、4、8天的形态;c-0、c-1、c-4、c-8表示异根嫁接苗在无NaCl胁迫第0、1、4、8天的形态;d-0、d-1、d-4、d-8表示自根苗在120 mmol?L-1 NaCl胁迫第0、1、4、8天的形态;e-0、e-1、e-4、e-8表示自接苗在120 mmol?L-1 NaCl胁迫第0、1、4、8天的形态;f-0、f-1、f-4、f-8表示异根嫁接苗在120 mmol?L-1 NaCl胁迫第0、1、4、8天的形态
Fig. 1The effects of 0 NaCl (A) and 120 mmol?L-1 NaCl (B) treatment on the appearance of chrysanthemum Zhongshan Yanhong
a-0, a-1, a-4, and a-8 represent the morphology of the self-rooted seedlings under 0 NaCl stress for 0, 1, 4, and 8 days, respectively; b-0, b-1, b-4 and b-8 represent the morphology of the self-grafted seedlings under 0 NaCl stress for 0, 1, 4, and 8 days, respectively; c-0, c-1, c-4 and c-8 represent the morphology of the hetero-root grafted seedlings under 0 NaCl stress for 0, 1, 4, and 8 days, respectively; d-0, d-1, d-4, d-8 represent the morphology of the self-rooted seedlings under 120 mmol?L-1 NaCl stress for 0, 1, 4, and 8 days, respectively; e-0, e-1, e-4 and e-8 represent the morphology of the self-grafted seedlings under 120 mmol?L-1 NaCl stress for 0, 1, 4, and 8 days, respectively; f-0, f-1, f-4 and f-8 represent the morphology of the hetero-root grafted seedlings under 120 mmol?L-1 NaCl stress for 0, 1, 4, and 8 days, respectively
2.2 嫁接对光合速率和叶绿素含量的影响
如图2-A所示,随着NaCl胁迫时间的延长,叶绿素(a+b)含量呈逐渐下降的趋势。在整个NaCl处理期间,异根嫁接苗叶绿素含量高于自根苗和自接苗,且降低幅度显著低于自根苗和自接苗。第8天时,自根苗、自接苗和异根嫁接苗叶片叶绿素含量分别为对照的82.47%、88.57%和98.78%。对照条件下,各组材料的净光合速率在整个处理期间保持相对稳定的状态;盐胁迫下,自根苗、自接苗和异根嫁接苗的净光合速率随着时间的延长逐渐下降。第8天时,与对照相比,自根苗、自接苗和异根嫁接苗叶片净光合速率分别降低33.56%、27.57%、15.15%,且异根嫁接苗的净光合速率始终高于自根苗和自接苗(图2-B)。结果表明,嫁接缓解了盐胁迫诱导对菊花幼苗生长的抑制,改善了植株的光合能力。嫁接使叶片光和色素的含量保持在较高水平,使光合系统保持相对稳定的状态,降低了对菊花生长发育的影响。图2
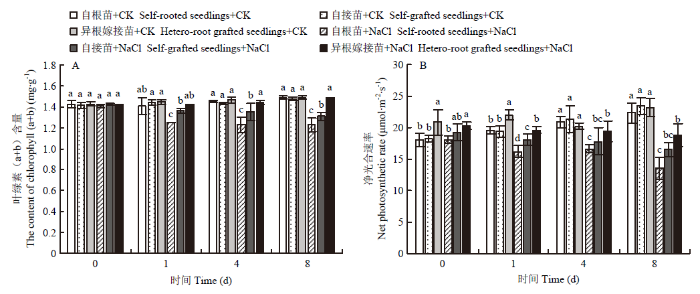 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下叶绿素(a+b)含量(A)、净光合速率(B)的影响
不同小写字母表示同一时间不同处理间差异显著(P<0.05)。下同
Fig. 2The effects of 120 mmol·L-1 NaCl treatment on the leaf net photosynthetic rate (A), content of chlorophyll (B) of chrysanthemum Zhongshan Yanhong
Different lowercase letters indicate the difference between different treatments at the same time are significant (P<0.05). The same as below
2.3 嫁接对菊花叶片相对电导率、MDA以及脯氨酸含量的影响
由图3可知,随着盐胁迫时间的延长,各处理的叶片相对电导率和MDA含量均逐渐升高。第8天时,盐胁迫下自根苗、自接苗和异根嫁接苗的相对电导率分别为对照的2.18、1.85、1.25倍,MDA含量分别为对照的1.69、1.62、1.08倍。表明盐胁迫下异根嫁接苗叶片的质膜透性和受害程度显著低于自根苗和自接苗。图3
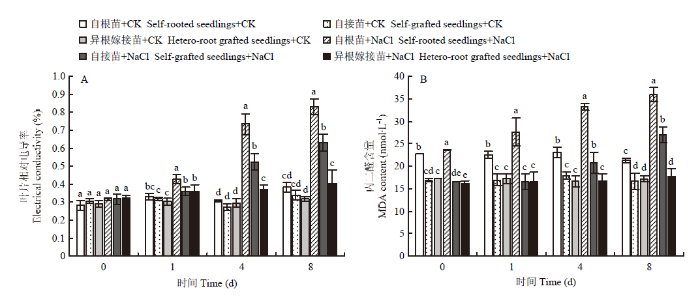 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下叶片相对电导率、丙二醛(MDA)含量的影响
Fig. 3The effects of 120 mmol·L-1 NaCl treatment on the electrical conductivity and MDA content of chrysanthemum Zhongshan Yanhong
如图4所示,随着胁迫时间的延长,各处理的脯氨酸含量呈逐渐上升的趋势,并在第8天达到最大值。从第4天开始,各处理之间表现出显著差异。到第8天时,盐胁迫下自根苗、自接苗和异根嫁接苗的脯氨酸含量分别为对照的14.08、15.0、6.24倍,自根苗含量最高,异根嫁接苗最低,自接苗居中。
图4
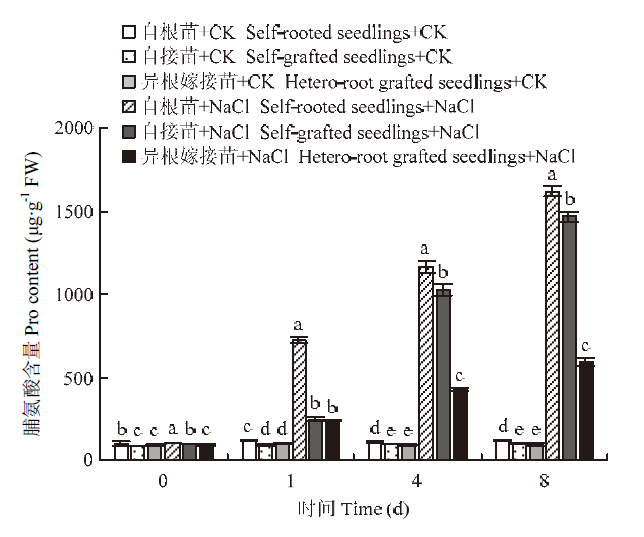 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下脯氨酸含量的影响
Fig. 4The effects of 120 mmol·L-1 NaCl treatment on the pro content of chrysanthemum Zhongshan Yanhong
2.4 嫁接对菊花抗氧化系统的影响
对照条件下,在不同的时间节点,自根苗、自接苗和异根嫁接苗的SOD活性存在一定波动,异根嫁接苗的SOD活性始终高于自根苗和自根嫁接苗。盐胁迫下,随着时间的延长,各组处理均表现出先下降再上升的趋势。第4天时,自根苗的SOD活性降到最低,仅为对照的59.74%,自接苗和异根嫁接苗在处理后的第1天降到最低,分别约为对照的89.40%、98.41%。异根嫁接苗的SOD活性降低幅度小,且活性始终高于自根苗和自接苗(表2)。由此可见,SOD可能在异根嫁接苗缓解盐胁迫的过程中发挥了重要作用。Table 2
表2
表2嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下叶片SOD、POD、CAT活性的影响
Table 2
| 指标 Index | 时间 Time (d) | 自根苗+CK Self-rooted seedlings+CK | 自接苗+CK Self-grafted seedlings+CK | 异根嫁接苗+CK Hetero-root grafted seedlings+CK | 自根苗+NaCl Self-rooted seedlings+NaCl | 自接苗+NaCl Self-grafted seedlings+NaCl | 异根嫁接苗+NaCl Hetero-root grafted seedlings+NaCl |
|---|---|---|---|---|---|---|---|
| 超氧化物歧 化酶 SOD | 0 | 1497.541c | 1723.173b | 1999.418a | 1565.914c | 1749.872b | 1926.829a |
| 1 | 1515.774ab | 1434.051b | 1589.519a | 1033.416d | 1282.002c | 1564.286ab | |
| 4 | 1437.860e | 1585.461d | 2110.881a | 858.959f | 1777.534c | 1890.630b | |
| 8 | 1364.903c | 1825.189b | 2089.685a | 1104.757d | 1255.950c | 1853.107b | |
| 过氧化物酶 POD | 0 | 150.400ab | 153.667a | 147.200b | 153.000a | 153.100a | 149.960ab |
| 1 | 148.600c | 153.500b | 148.920bc | 147.467c | 159.700a | 147.967c | |
| 4 | 152.833a | 151.300ab | 148.960ab | 141.100c | 142.500c | 146.567bc | |
| 8 | 147.633a | 148.733a | 147.400a | 130.700b | 127.100b | 144.167a | |
| 过氧化氢酶 CAT | 0 | 30.360b | 35.901a | 29.672b | 28.773b | 31.577b | 30.811b |
| 1 | 27.826d | 40.139c | 33.855cd | 34.974cd | 81.653a | 62.958b | |
| 4 | 50.822c | 63.389a | 57.141b | 33.383d | 67.180a | 49.207c | |
| 8 | 58.834ab | 65.549a | 51.922bc | 22.544d | 50.527bc | 45.853c |
新窗口打开|下载CSV
对照条件下,自根苗、自接苗和异根嫁接苗的POD活性保持在相对稳定的状态,且各处理间基本无显著性差异。盐胁迫下,随着时间的延长,各处理的POD活性逐渐下降,第8天时,自根苗、自接苗和异根嫁接苗的POD活性分别为对照的88.63%、85.46%、97.81%,异根嫁接苗POD活性降低幅度较小,且活性显著高于自根苗和自接苗。在盐胁迫下,自根苗、自接苗和异根嫁接苗的CAT活性表现出先升高后降低的趋势。在胁迫的整个过程中,自接苗的CAT活性显著高于自根苗和异根嫁接苗(表2)。
2.5 嫁接对菊花各部位Na+、K+含量及Na+/K+比值的影响
2.5.1 对上部叶片的影响 随着NaCl胁迫时间的延长,自根苗、自接苗和异根嫁接苗上部叶片的Na+含量均呈逐渐上升的趋势。自根苗的Na+含量始终高于自接苗和异根嫁接苗,自接苗和异根嫁接苗之间无显著性差异。到第8天时,盐胁迫下自根苗、自接苗和异根嫁接苗上部叶片的Na+含量分别为对照的56.01、52.5和45.93倍(图5-A)。NaCl胁迫对自根苗、自接苗和异根嫁接苗上部叶片的K+含量产生了影响,其中,自根苗的K+含量显著下降,变化最为显著(图5-B)。Na+/K+比值的变化趋势与Na+一致,在处理第1、4和8天,自根苗的Na+/K+比值显著低于自接苗和异根嫁接苗,自接苗和异根嫁接之间无显著性差异(图5-C)。图5
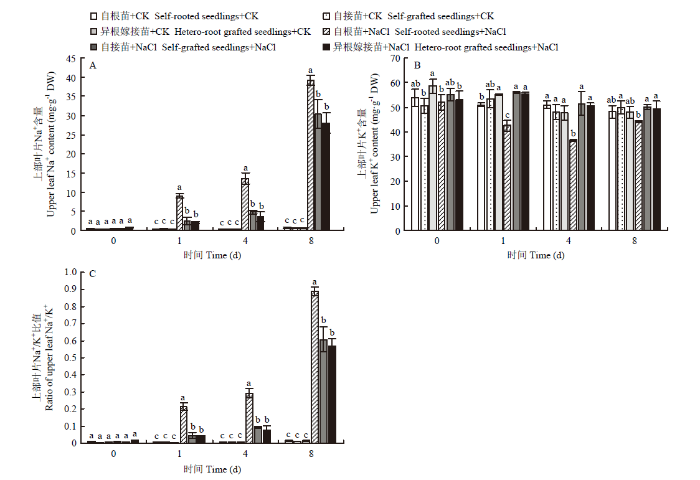 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下的上部叶片Na+(A)、K+(B)含量及Na+/K+(C)的影响
Fig. 5The effects of 120 mmol·L-1 NaCl treatment on the upper leaf Na+ (A), K+ (B) content and Na+/K+ (C) of chrysanthemum Zhongshan Yanhong
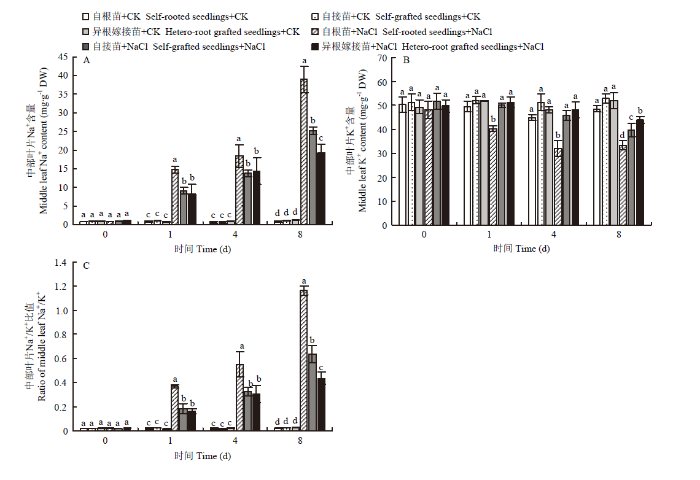
2.5.2 对中部叶片的影响 如图6-A所示,随着NaCl胁迫时间的延长,自根苗、自接苗和异根嫁接苗中部叶片的Na+含量均呈逐渐上升的趋势。在盐胁迫的第1天和第4天,自根苗的Na+含量始终高于自接苗和异根嫁接苗,自接苗和异根嫁接苗之间不表现显著性差异。到第8天时,盐胁迫下各组间表现出显著差异,其中自根苗的Na+含量最高,为对照的39倍;自接苗次之,为对照的25倍;异根嫁接苗最低。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫中部叶Na+(A)、K+(B)含量及Na+/K+(C)的影响
Fig. 6The effects of 120 mmol·L-1 NaCl treatment on the middle leaf Na+ (A), K+ (B) content and Na+/K+ (C) of chrysanthemum Zhongshan Yanhong
受NaCl胁迫的影响,随着时间延长,自根苗、自接苗和异根嫁接苗中部叶片的K+含量逐渐降低,在第8天时,自根苗、自接苗和异根嫁接苗中部叶片的K+含量分别为对照的68.74%、74.47%、84.60%(图6-B)。各处理的Na+/K+比值的变化与Na+趋势一致,均随胁迫时间的延长而逐渐升高,但是异根嫁接苗的Na+/K+比值显著低于自根苗和自接苗(图6-C)。结果表明,嫁接降低了菊花中部叶片Na+的积累,使Na+/K+比值维持在较低水平,缓解了对叶片造成的伤害。
2.5.3 对下部叶片的影响 随着NaCl胁迫时间的延长,自根苗、自接苗和异根嫁接苗下部叶片的Na+含量均呈逐渐上升的趋势。在盐胁迫的第1和第4天,自根苗的Na+含量始终高于自接苗和异根嫁接苗,自接苗和异根嫁接苗之间不表现显著性差异。到第8天时,盐胁迫下各组间表现出显著性差异,其中自根苗的Na+含量最高,为对照的45.61倍;自接苗次之,为对照的30.21倍;异根嫁接苗最低,仅为对照的25.56倍(图7-A)。
图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7嫁接对菊花‘钟山嫣红’在120 m mol·L-1 NaCl胁迫下的下部叶Na+(A)、K+(B)含量及Na+/K+(C)的影响
Fig. 7The effects of 120 mmol·L-1 NaCl treatment on the lower leaf Na+ (A), K+ (B) content and Na+/K+ (C) of chrysanthemum Zhongshan Yanhong
如图7-B所示,随着胁迫时间的延长,自根苗下部叶片的K+含量逐渐降低。自接苗和异根嫁接苗显著降低,自根苗、自接苗和异根嫁接苗中部叶片的K+含量分别为对照的31.50%、75.25%、84.58%。同样,各处理材料的Na+/K+比值在盐胁迫下显著提高,第8天时,自根苗、自接苗和异根嫁接苗的Na+/K+比值分别为2.45、1.12、0.75,异根嫁接苗的Na+/K+比值最低(图7-C)。结果表明,盐胁迫下菊花下部叶片聚集了大量的Na+,嫁接降低了菊花下部叶片Na+的积累,使Na+/K+比值显著低于自根苗和自接苗,缓解了Na+对叶片造成的伤害。
2.5.4 对嫁接接口上部茎的影响 盐胁迫下,自根苗、自接苗和异根嫁接苗接口上部茎的Na+含量均显著上升。处理第8天时,异根嫁接苗的Na+含量显著低于自根苗和自接苗(图8-A)。同时,受盐胁迫影响,自根苗、自接苗和异根嫁接苗接口上部茎的K+含量显著降低(图8-B)。第8天时,异根嫁接苗Na+/K+比值低于自根苗和自接苗,但是差异不显著(图8-C)。
图8
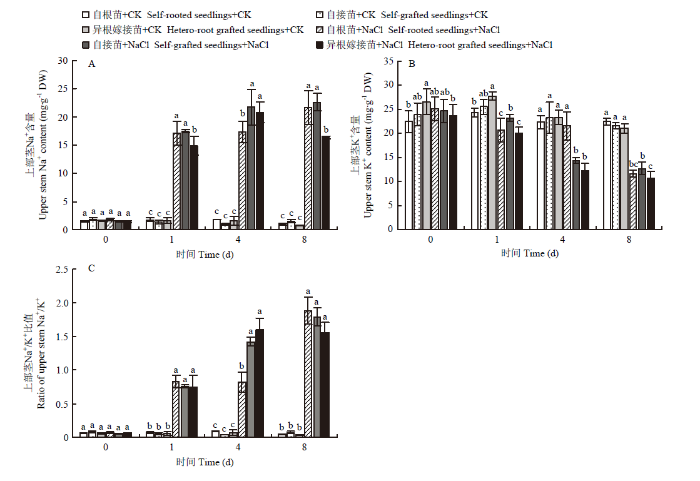 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下的上部茎Na+(A)、K+(B)含量及Na+/K+(C)的影响
Fig. 8The effects of 120 mmol·L-1 NaCl treatment on the upper stem Na+ (A), K+ (B) content and Na+/K+ (C) of chrysanthemum Zhongshan Yanhong
2.5.5 对嫁接接口下部茎的影响 NaCl处理后,自根苗、自接苗和异根嫁接苗接口下部茎的Na+含量均显著性上升。从第4天开始,异根嫁接苗下部茎的Na+含量显著高于自根苗和自接苗,到第8天时,自根苗、自接苗和异根嫁接苗接口下部茎的Na+含量分别为对照的6.44、5.55、8.24倍(图9-A)。NaCl处理后,自根苗、自接苗和异根嫁接苗接口下部茎的K+含量均显著性降低,处理第8天时,自根苗、自接苗和异根嫁接苗的K+含量分别为对照的93.07%、79.30%、59.22%(图9-B)。在盐胁迫第4、8天时,异根嫁接苗的Na+/K+比值显著高于自根苗和自接苗,第8天时,异根嫁接苗的Na+/K+比值约为自根苗和自接苗的2倍(图9-C)。结果表明,与自根苗和自接苗相比,盐胁迫下异根嫁接苗嫁接接口下部茎中富集了更多的Na+,使向上运输的Na+含量减少,从而缓解盐胁迫对叶片产生的离子毒害。
图9
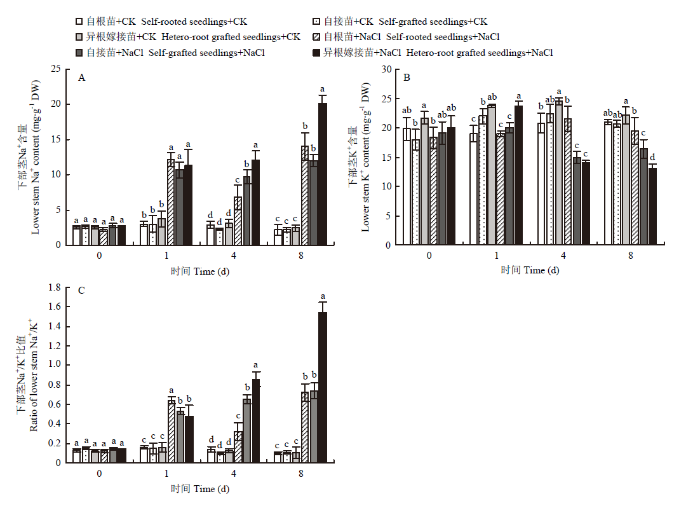 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下的下部茎Na+(A)、K+(B)含量及Na+/K+(C)的影响
Fig. 9The effects of 120 mmol·L-1 NaCl treatment on the lower stem Na+ (A), K+ (B) content and Na+/K+ (C) of chrysanthemum Zhongshan Yanhong
3 讨论
3.1 嫁接与NaCl胁迫下菊花生理特性的关系
嫁接体通过砧木、接穗间的相互作用,可以改变植物体内原有的一系列生理、生化反应,对植株的生长、发育、抗性等诸多方面产生影响[29]。形态变化是植物受到逆境胁迫最直接的反映[30]。叶片是生物量构成器官之一,在胁迫下变化明显,而叶片干、鲜重与叶面积又存在正相关关系,故叶片受害面积的变化可在一定程度上反映整株植物的生物量变化[31]。本研究中,120 mmol·L-1 NaCl处理下,异根嫁接苗的叶面积受害率显著低于自接苗,自接苗低于自根苗。这表明盐胁迫对砧木异根嫁接苗生物量的影响小于自根苗和自接苗,嫁接缓解了盐胁迫对植物生长造成的抑制,以及对叶片造成的伤害。盐逆境会使植物的光合速率下降,叶绿素是表征光合利用率最重要的指标之一[32]。本研究中,异根嫁接苗的净光合速率、叶绿素(a+b)含量的降低幅度显著低于自根苗和自接苗。COLLA[33]和杨立飞等[34]的研究表明,盐胁迫下,嫁接黄瓜幼苗的净光合速率(Pn)和叶绿素含量下降幅度小于自根黄瓜,和本研究结果一致。表明嫁接缓解了离子对光合系统造成的伤害,降低了叶绿素的降解,使异根嫁接苗的光合性能高于自接苗和自根苗,从而降低了异根嫁接苗叶片的受害程度。
植物可以通过抗氧化酶系统清除氧自由基,阻止细胞氧化损伤,达到在逆境环境中生存的目的,其中,抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)[35]。此前有多项研究表明,盐胁迫下番茄[36]、辣椒[37]和黄瓜[38]嫁接苗的抗氧化酶活性均高于自根苗,表明嫁接对盐胁迫下植物的抗氧化系统起到了积极作用。本研究中,异根嫁接苗的SOD活性在对照条件和NaCl胁迫下均高于自接苗和自根苗,这表明砧穗互作赋予了异根嫁接苗更高的SOD活性,同样,异根嫁接苗的POD活性在盐胁迫下高于自根苗和自接苗,但是CAT活性低于自接苗。WANG[39]等在研究抗氧化系统对不同品种棉花耐盐性的差异影响时发现,不同材料在盐胁迫下会诱导一种或几种抗氧化酶,并不是所有的抗氧化酶都会参与到ROS的清除。因此,本研究中SOD和POD在异根嫁接苗适应盐胁迫的过程中发挥了重要作用。
在盐胁迫条件下,细胞质膜首先受到盐离子胁迫影响而产生胁变,导致质膜受伤。同时,盐分能增加细胞膜透性,加强脂质过氧化作用,最终导致膜系统的破坏[30]。相对电导率和MDA含量分别是衡量质膜透性和质膜受害程度的指标,它们的值越大,质膜受到的伤害也越大。本研究中,异根嫁接苗叶片的相对电导率和MDA含量增加幅度最低,自接苗居中,自根苗最高,表明异根嫁接苗叶片质膜受到的伤害小于自接苗,而自接苗小于自根苗。脯氨酸在盐害条件下的积累起到了胞质渗透压调节剂的作用,保护膜与酶的结构,缓解胁迫压力[40]。本研究各材料的受害程度与脯氨酸含量表现出正相关的关系,反映了材料在盐胁迫下的适应性反应。
同时,自根嫁接苗的受害程度轻于自根苗,自根苗‘钟山嫣红’本身为盐敏感品种,以其自身作为砧木嫁接形成的嫁接植株耐盐表现优于自根苗,与嫁接伤口形成引发的“交叉适应性”有关。有研究表明,植物在受重度机械损伤处理后,SOD、POD、PPO和PAL等保护酶活性均被诱导增加[41]。本试验中,自接苗的SOD、CAT活性均显著高于自根苗的活性,也支持了这一观点。
3.2 嫁接与NaCl胁迫下菊花各部位离子分布的关系
MUNNS等[42]提出,增强耐盐性有两种途径,一是降低渗透胁迫对植株长势的影响,二是通过降低有毒离子的浓度来维持植株长势和功能[43,44]。在盐胁迫下,Na+大量进入细胞,细胞内Na+增加,而K+外渗,使Na+/K+值增大,从而打破原有的离子平衡,当Na+/K+比值增大到阈值时植物即受害[30]。本研究中,120 mmol·L-1 NaCl胁迫下菊花各部位叶片的Na+含量差异显著,下部叶片的Na+含量、Na+/K+比值最高,中部和上部叶片的Na+含量接近。盐胁迫下,异根嫁接苗的接口下部茎(砧木茎)Na+离子含量、Na+/K+比值显著高于自根苗和自接苗,中部、下部叶片,以及接口上部茎的Na+含量、Na+/K+比值显著低于自接苗,而自接苗低于自根苗,K+含量高于自根苗和自接苗。这与黄蒿嫁接其他菊花品种的异根嫁接苗接穗各部分Na+含量低于菊花扦插苗的结果相同[2]。所以,黄蒿砧木对Na+的富集能力强于菊花茎,阻止了Na+向上的大量运输,使接穗部分的Na+/K+比值降低,这是黄蒿砧木嫁接提高菊花耐盐性的主要原因;嫁接会使接穗的导管面积、筛管面积变小,木质部生长减弱[45],推测嫁接伤口及砧穗愈合会在一定程度上影响离子的向上运输,使菊花自接苗接口以上部位叶片的Na+含量减少,其受害程度也低于自根苗。
阳艳娟等[46]的研究也发现,盐胁迫下嫁接西瓜苗将Na+更多地集中在根系和砧木茎,阻止了Na+向接穗地上部的大量运输,防止了离子毒害的发生,增强了嫁接西瓜植株的耐盐性。耐盐南瓜砧木嫁接限制了Na+从根部向地上部黄瓜接穗的长距离运输是嫁接苗耐盐性提高的原因。COBAN等[47]以耐盐砧木嫁接盐敏感番茄,发现耐盐砧木嫁接可以减少Na+向叶片的转运。HUANG等[48]以耐盐南瓜为砧木嫁接黄瓜,显著降低了接穗部分地上部Na+的含量,从而提高了黄瓜的耐盐性。进一步对根部进行X射线微区分析,结果表明耐盐砧木具有限制Na+进入接穗木质部的能力,避免由于过多的Na+在地上部分积累对植株造成伤害。嫁接作为一个特异的研究系统已被广泛应用于物质运输和信号的长距离传导机制等方面的研究[49]。砧木和接穗间物质的运输可能是引起嫁接植物性状改变的原因[50]。孙静宇[51]通过构建南瓜和黄瓜正反嫁接组合阐述了更加有说服力的砧穗互作关系,发现以耐盐南瓜为砧木的嫁接组合可有效限制Na+在地上部的积累,缓解地上部盐害程度,而以盐敏感黄瓜为砧木的嫁接组合,则不能限制Na+向地上部运输,表明耐盐南瓜砧木在嫁接黄瓜耐盐中的决定作用。进一步的研究证实南瓜的Na+特异转运蛋白基因Cm HKT1;1通过限制Na+向根系木质部装载,减少了Na+向地上部运输,进而减少地上部Na+积累,是黄瓜接穗耐盐性增强的原因。此外,本试验中黄蒿砧木的Na+特异转运蛋白基因是否也在嫁接耐盐性提高中发挥了关键作用,有待进一步研究。
4 结论
相对于‘钟山嫣红’菊花的扦插苗,以黄蒿作为砧木、‘钟山嫣红’作为接穗进行嫁接后的菊花耐盐性有所提高。主要原因是异种砧木对Na+的有效截留,运输到‘钟山嫣红’茎段、中下部叶片的Na+减少;此外,嫁接切口损伤引发的“交叉适应性”导致了保护酶活性的升高,这些效应的共同作用减弱了盐胁迫对异根嫁接苗质膜造成的伤害,使叶片的光合速率维持在较高水平,从而在盐胁迫下保持了较好的生长状态。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
DOI:10.1007/s11120-013-9813-6URLPMID:23539361 [本文引用: 1]

Salt tolerance is an important economic trait for crops growing in both irrigated fields and marginal lands. The plant kingdom contains plant species that possess highly distinctive capacities for salt tolerance as a result of evolutionary adaptation to their environments. Yet, the cellular mechanisms contributing to salt tolerance seem to be conserved to some extent in plants although some highly salt-tolerant plants have unique structures that can actively excrete salts. In this review, we begin by summarizing the research in Arabidopsis with a focus on the findings of three membrane transporters that are important for salt tolerance: SOS1, AtHKT1, and AtNHX1. We then review the recent studies in salt tolerance in crops and halophytes. Molecular and physiological mechanisms of salt tolerance in plants revealed by the studies in the model plant, crops, and halophytes are emphasized. Utilization of the Na(+) transporters to improve salt tolerance in plants is also summarized. Perspectives are provided at the end of this review.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.tplants.2009.11.009URLPMID:20036181 [本文引用: 1]

Proline accumulates in many plant species in response to environmental stress. Although much is now known about proline metabolism, some aspects of its biological functions are still unclear. Here, we discuss the compartmentalization of proline biosynthesis, accumulation and degradation in the cytosol, chloroplast and mitochondria. We also describe the role of proline in cellular homeostasis, including redox balance and energy status. Proline can act as a signaling molecule to modulate mitochondrial functions, influence cell proliferation or cell death and trigger specific gene expression, which can be essential for plant recovery from stress. Although the regulation and function of proline accumulation are not yet completely understood, the engineering of proline metabolism could lead to new opportunities to improve plant tolerance of environmental stresses.
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/jxb/eri027URLPMID:15557292 [本文引用: 1]

With the aim of determining whether grafting could improve salinity tolerance of tomato (Lycopersicon esculentum Mill.), and what characteristics of the rootstock were required to increase the salt tolerance of the shoot, a commercial tomato hybrid (cv. Jaguar) was grafted onto the roots of several tomato genotypes with different potentials to exclude saline ions. The rootstock effect was assessed by growing plants at different NaCl concentrations (0, 25, 50, and 75 mM NaCl) under greenhouse conditions, and by determining the fruit yield and the leaf physiological changes induced by the rootstock after 60 d and 90 d of salt treatment. The grafting process itself did not affect the fruit yield, as non-grafted plants of cv. Jaguar and those grafted onto their own root showed the same yield over time under non-saline conditions. However, grafting raised fruit yield in Jaguar on most rootstocks, although the positive effect induced by the rootstock was lower at 25 mM NaCl than at 50 and 75 mM NaCl. At these higher levels, the plants grafted onto Radja, Pera and the hybrid VolgogradskijxPera increased their yields by approximately 80%, with respect to the Jaguar plants. The tolerance induced by the rootstock in the shoot was related to ionic rather than osmotic stress caused by salinity, as the differential fruit yield responses among graft combinations were mainly related to the different abilities of rootstocks to regulate the transport of saline ions. This was corroborated by the high negative correlation found between fruit yield and the leaf Na(+) or Cl(-) concentrations in salt-treated plants after 90 d of salt treatment. In conclusion, grafting provides an alternative way to enhance salt tolerance, determined as fruit yield, in the tomato, and evidence is reported that the rootstock is able to reduce ionic stress.
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
刘越, 孔秋生, 译.
[本文引用: 1]
LIU Y, KONG Q S, Trans.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1186/s12864-019-6158-3URLPMID:31653200 [本文引用: 1]

BACKGROUND: Aphid (Macrosiphoniella sanbourni) stress drastically influences the yield and quality of chrysanthemum, and grafting has been widely used to improve tolerance to biotic and abiotic stresses. However, the effect of grafting on the resistance of chrysanthemum to aphids remains unclear. Therefore, we used the RNA-Seq platform to perform a de novo transcriptome assembly to analyze the self-rooted grafted chrysanthemum (Chrysanthemum morifolium T. 'Hangbaiju') and the grafted Artermisia-chrysanthemum (grafted onto Artemisia scoparia W.) transcription response to aphid stress. RESULTS: The results showed that there were 1337 differentially expressed genes (DEGs), among which 680 were upregulated and 667 were downregulated, in the grafted Artemisia-chrysanthemum compared to the self-rooted grafted chrysanthemum. These genes were mainly involved in sucrose metabolism, the biosynthesis of secondary metabolites, the plant hormone signaling pathway and the plant-to-pathogen pathway. KEGG and GO enrichment analyses revealed the coordinated upregulation of these genes from numerous functional categories related to aphid stress responses. In addition, we determined the physiological indicators of chrysanthemum under aphid stress, and the results were consistent with the molecular sequencing results. All evidence indicated that grafting chrysanthemum onto A. scoparia W. upregulated aphid stress responses in chrysanthemum. CONCLUSION: In summary, our study presents a genome-wide transcript profile of the self-rooted grafted chrysanthemum and the grafted Artemisia-chrysanthemum and provides insights into the molecular mechanisms of C. morifolium T. in response to aphid infestation. These data will contribute to further studies of aphid tolerance and the exploration of new candidate genes for chrysanthemum molecular breeding.
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1186/s12870-015-0459-8URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
URL [本文引用: 1]

在NaCl胁迫下, 对番茄嫁接苗和自根苗的保护酶活性、渗透调节物质含量及光合特性等进行了比较。结果表明, 番茄嫁接苗叶片超氧化物歧化酶( SOD) 、过氧化物酶( POD) 和抗坏血酸过氧化物酶(APX) 活性以及抗坏血酸(AsA) 含量均显著高于自根苗, 丙二醛(MDA) 含量显著低于自根苗; 嫁接苗叶片游离脯氨酸、可溶性糖和可溶性蛋白质含量均显著高于自根苗; NaCl胁迫抑制光合作用, 但嫁接苗仍表现出优势; 嫁接苗根系Na + /K+比值显著低于自根苗。以上结果表明, 嫁接苗耐盐性优于自根苗。
URL [本文引用: 1]

在NaCl胁迫下, 对番茄嫁接苗和自根苗的保护酶活性、渗透调节物质含量及光合特性等进行了比较。结果表明, 番茄嫁接苗叶片超氧化物歧化酶( SOD) 、过氧化物酶( POD) 和抗坏血酸过氧化物酶(APX) 活性以及抗坏血酸(AsA) 含量均显著高于自根苗, 丙二醛(MDA) 含量显著低于自根苗; 嫁接苗叶片游离脯氨酸、可溶性糖和可溶性蛋白质含量均显著高于自根苗; NaCl胁迫抑制光合作用, 但嫁接苗仍表现出优势; 嫁接苗根系Na + /K+比值显著低于自根苗。以上结果表明, 嫁接苗耐盐性优于自根苗。
[本文引用: 1]
[本文引用: 1]
URLPMID:28866234 [本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
