 ,中国农业科学院特产研究所/中国农业科学院特种经济动物分子生物学重点实验室,长春 130112
,中国农业科学院特产研究所/中国农业科学院特种经济动物分子生物学重点实验室,长春 130112Eukaryotic Expression, Purification and Biological Activity of Recombinant Cervus Nippon Activin A Protein
ZHANG YuFei, CAO ManYuan, WANG LiYing, ZHAO WeiGang, LI XiaoXia, CHANG Tong, XU BaoZeng ,Institute of Special Animal and Plant Sciences, Chinese Academy of Agricultural Sciences/State Key Laboratory for Molecular Biology of Special Economic Animal, Chinese Academy of Agricultural Sciences, Changchun 130112
,Institute of Special Animal and Plant Sciences, Chinese Academy of Agricultural Sciences/State Key Laboratory for Molecular Biology of Special Economic Animal, Chinese Academy of Agricultural Sciences, Changchun 130112通讯作者:
责任编辑: 林鉴非
收稿日期:2018-12-22接受日期:2019-10-8网络出版日期:2020-03-01
| 基金资助: |
Received:2018-12-22Accepted:2019-10-8Online:2020-03-01
作者简介 About authors
张宇飞,Tel:17743401925;E-mail:enjoy_zyf@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (2223KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张宇飞, 曹满园, 王丽英, 赵伟刚, 李晓霞, 常彤, 许保增. 梅花鹿激活素A重组蛋白真核表达、纯化 及其生物活性的测定[J]. 中国农业科学, 2020, 53(5): 1058-1070 doi:10.3864/j.issn.0578-1752.2020.05.016
ZHANG YuFei, CAO ManYuan, WANG LiYing, ZHAO WeiGang, LI XiaoXia, CHANG Tong, XU BaoZeng.
0 引言
【研究意义】激活素(Activins)是TGF-β家族的33个成员之一,其最初被确认为垂体FSH产生和释放的激活剂[1,2]。然而,激活素的生物学作用众多且非常复杂,其在胚胎发育的早期到终末分化的细胞和组织中发挥着多种生物作用[3]。此外,激活素也被证明可以促进卵母细胞成熟同时对体外培养的颗粒细胞有促进增殖的作用[3,4,5,6,7]。梅花鹿(Cervus nippon)是我国东北地区一种重要的特种经济动物,对其激活素的生殖生物学功能进行研究,将对深入了解梅花鹿卵母细胞减数分裂的机制、建立高效的卵母细胞体外成熟体系、提高梅花鹿的繁殖效率和养殖效益等具有重要意义。【前人研究进展】在哺乳动物的卵巢内表达的Activin基因有两种,分别是βA亚基基因和βB亚基基因,因此它们可以产生3种激活素异构体,激活素A(由βA和βA组成),激活素B(由βB和βB组成)和激活素AB(由βA和βB组成)。激活素A及其I型和II型受体在早期卵泡中表达,并可以通过自分泌或旁分泌机制来调节卵泡的发育[4]。抑制素α-亚单位(Inhibin α-subunits, INHα)基因敲除小鼠显示激活素的过量表达导致卵巢肿瘤的发生,这充分表明激活素可促进颗粒细胞增殖[5]。此外,激活素受体II基因敲除小鼠表现出卵泡发育停滞且不孕[6,7]。激活素除了在卵母细胞成熟和颗粒细胞增殖中的作用之外,大量研究发现激活素还充当卵巢类固醇生成的调节剂。在体外培养的颗粒细胞中,激活素A可以促性腺激素刺激的细胞色素P450芳香化酶(芳香酶)活性和雌二醇的生成,同时抑制黄体酮的分泌[8,9]。在体外培养的卵泡膜细胞中,激活素A抑制LH诱导的雄激素产生[10]。在体外培养的黄体细胞中,激活素A抑制LH诱导的黄体酮合成[11,12]。在大多数组织中,激活素A通过结合两种类型的丝氨酸/苏氨酸激酶受体(Act RⅠ和Act RⅡ)启动细胞信号转导[13,14]。激活素A与其受体Act RⅡ结合后,Act RⅡ被激活,活化的Act RⅡ募集Act RⅠ并与之结合形成复合体,同时磷酸化了Act RⅠ的抑制性结构域 GS(富含丝/苏氨酸残基),进而活化Act RⅠ。活化的Act RⅠ促使Smad 2、3蛋白 C 端的丝氨酸残基磷酸化,磷酸化后的Smad 2、3蛋白与Smad 4结合形成复合体并移位到细胞核内,并与靶基因的启动子互相结合,从而调控靶基因转录和表达[8, 15]。这也是目前激活素A研究最为广泛的一条信号通路。【本研究切入点】 激活素A在调控颗粒细胞扩增和颗粒细胞介导的动物繁殖生理中具有重要作用。因此,本研究对体外转录并纯化的梅花鹿激活素A在卵巢颗粒细胞的生物学功能进行了研究,以确定本研究获得的激活素A具有生物活性。【拟解决的关键问题】本研究利用分子生物学技术克隆了梅花鹿激活素βA(Activin βA,ACTBA)亚基基因,并成功构建了pcDNA4/ACTBA重组表达质粒,并在CHO细胞中表达。采用Western blot方法对表达的目的蛋白进行验证后,进行分离纯化,同时对其生物活性进行了测定。旨在探索梅花鹿激活素A的表达及纯化的基本条件,同时研究体外培养的颗粒细胞中类固醇合成酶基因在激活素A处理下的转录水平变化情况,为后续深入研究梅花鹿Activin A在卵母细胞成熟过程中的生物学机制奠定基础。1 材料与方法
本试验于2017年6月至2018年4月在中国农业科学院特产研究所国家重点实验室完成。1.1 试验动物与样品的采集
试验动物梅花鹿来源于中国农业科学院特产研究所茸鹿实验基地。在2016年10月通过手术法活体摘除梅花鹿卵巢组织放入液氮中运送至实验室,放置于超低温冰箱内保存。猪卵巢来源于吉林省长春市东旭屠宰场。将从屠宰场收集的母猪卵巢放在加有抗生素、温度在35—37℃生理盐水的保温瓶中快速带到实验室。
1.2 主要试剂
DMEM-F12培养基、胰蛋白酶、青霉素、链霉素从HyClone公司购买;胎牛血清从Gibco公司购买;PrimeSTAR HS高保真DNA聚合酶、反转录试剂盒(PrimeScript One Script RT-PCR Kit Ver.2)从大连宝生物工程有限公司购买;RNA提取试剂盒从天根生化科技(北京)有限责任公司购买;凝胶回收、质粒小提试剂盒、去内毒素质粒大提试剂盒从康为世纪有限责任公司购买;pEASY-Blunt Simple Cloning Vector平端克隆载体、大肠杆菌DH5α感受态细胞从北京全式金生物技术有限公司购买;T4 DNA 连接酶从Promega公司购买;核酸染料(Super GelRed Nucleic Acid Gel Stain,10 000× in DMSO)从苏州宇恒生物科技有限公司购买;限制性内切酶、Lipofectamine® LTX、pcDNA4/myc-His真核表达载体从Thermo Scientific 公司购买;Ni-NTA Spin Kit试剂盒从QIAGEN公司购买。1.3 引物设计
根据牛ACTBA的mRNA预测序列(No. NM_174363.2),利用Primer 5.0软件,在ACTBA基因CDS区域设计1对可以扩增梅花鹿的ACTBA基因完整开放阅读框的引物(预期扩增产物大小1 290 bp)。引物为:上游引物(ACTBA-F):5′-GCTGCCAGGAT GCCCTTG-3′,下游引物(ACTBA-R):5′- GCTCTATG AGCAACCACACTC -3′。同时利用Primer 5.0软件设计1对用于构建真核表达质粒的引物。引物为:上游引物(P4-ACTBA-F):5′-CGGGATCCCGATAATGGCC TTGCTCTGGC-3′,下游引物(P4-ACTBA-R):5′-CGG AATTCTGAGCAACCACACTCC-3′。引物在上海生工生物公司合成。1.4 总RNA的提取
利用RNA提取试剂盒提取梅花鹿卵巢组织总RNA,利用分光光度计和1.0%变性琼脂糖凝胶电泳检测RNA的纯度及完整性。利用PrimeScript One Script RT-PCR Kit Ver.2反转录试剂盒将总RNA反转录为cDNA,-20℃保存备用。1.5 梅花鹿ACTBA基因的扩增
以上述cDNA为模板,使用引物ACTBA-F、ACTBA-R和PrimeSTAR HS高保真DNA聚合酶,按常规方法进行PCR扩增。反应体系50 μL:5X PrimeSTAR Buffer 10 μL;dNTP Mixture(2.5 mmol·L-1 each)4 μL;上游引物ACTBA-F 1 μL;下游引物ACTBA-R 1 μL;梅花鹿卵巢组织cDNA 2 μL;PrimeSTAR HS DNA Polymerase(2.5 U·μL-1)1 μL;ddH2O 31 μL。反应条件为:95℃预变性3 min;95℃ 变性30 s、60℃退火30 s、72℃延伸2 min,反应35个循环;最后72℃延伸10 min。PCR扩增产物利用琼脂糖凝胶电泳鉴定。1.6 梅花鹿ACTBA基因克隆载体的构建
PCR产物经1.0%的琼脂糖凝胶电泳鉴定并回收。回收后的目的基因片段和pEASY-Blunt Simple Cloning Vector平端克隆载体进行连接。然后将连接产物加入50 μL大肠杆菌DH5α感受态细胞中进行转化,最后将菌液均匀涂布在含有Kanamycin的LB固体培养基上,放入37℃生化培养箱内过夜培养。用PCR法鉴定出连接成功的阳性克隆后,送到上海生工生物公司测序。同时应用MEGA4软件对测序得到的梅花鹿ACTBA基因序列和GenBank已经登陆的12种物种的参考序列进行比较、分析同时绘制进化树[16,17,18]。1.7 pcDNA4/ACTBA真核表达质粒的构建
以上述质粒pEASY-ACTBA为模板,使用引物P4-ACTBA-F、P4-ACTBA-R和PrimeSTAR HS高保真DNA聚合酶,按常规方法进行PCR扩增。PCR产物经1.0%的琼脂糖凝胶电泳鉴定并回收。将纯化后的P4-ACTBA基因与真核表达载体pcDNA4/myc-His同时利用限制性内切酶BamH I和Hind III进行双酶切,经1.0%的琼脂糖凝胶电泳鉴定并回收。回收后的P4-ACTBA基因片段和经同样双酶切的真核表达载体pcDNA4/myc-His进行连接。将连接产物加入50 μL大肠杆菌DH5α感受态细胞中进行转化。随机挑取15株单克隆菌落,用PCR法鉴定阳性克隆菌落。提取阳性克隆菌的重组质粒。用PCR法、BamH I和Hind III单双酶切鉴定连接正确后将菌液送到上海生工生物公司测序。测序鉴定插入载体的目的基因方向及读码框完全正确后用去内毒素质粒提取试剂盒提取质粒。用微量紫外分光光度计测定其浓度及纯度,-20℃贮存备用。所得到的重组真核表达质粒命名为pcDNA4/ ACTBA。1.8 pcDNA4/ACTBA在CHO细胞中瞬时表达并鉴定
CHO细胞系在含10% FBS的DMEM-F12培养基中,于37℃、5%的CO2孵箱中培养。在转染的前一天将5×106个细胞接种到直径为60 mm的一次性培养皿内。待CHO细胞汇合度为70%—80%时(大约24 h后),按照Lipofectamine® LTX试剂盒说明书操作,将重组表达质粒pcDNA4/ACTBA转染细胞。同时设转染pcDNA4/myc-His空质粒的细胞为阴性对照。转染48 h后,使用兔抗His标签多克隆抗体对转染重组表达质粒pcDNA4/ACTBA、pcDNA4/myc-His的CHO细胞进行免疫荧光及Western blot鉴定。1.9 梅花鹿激活素A纯化
pcDNA4/ACTBA质粒转染CHO细胞12 h后,用ExpiCHO™ Expression Medium继续培养48 h后,收集细胞培养液,4℃、10 000×g离心10 min,收集并保存上清液。根据Ni-NTA Spin Kit说明书,用含10 mmol·L-1 咪唑的平衡液NPI-10(不含1%Igepal®CA- 630)平衡Ni-NTA离心柱。以890×g(约2 900 r/min)离心2 min。将含有梅花鹿激活素A的细胞培养液加入预先平衡的Ni-NTA离心柱上。 以270×g(约1 600 r/min)离心5 min。用600 μL缓冲液NPI-20(含20 mmol·L-1 咪唑)洗涤Ni-NTA离心柱两次。分别以890×g(约2 900 r/min)离心2 min。最后用300 μL Buffer NPI-500(含500 mmol·L-1 咪唑)将蛋白质洗脱两次。以890×g(约2 900 r/min)离心2 min,并收集洗脱液。用Western blot 法鉴定蛋白纯化。1.10 梅花鹿激活素A生物活性的测定
1.10.1 猪卵丘颗粒细胞的培养 将采集到的母猪卵巢,用含有双抗的灭菌生理盐水冲洗5 次,洗净卵巢上的血污,装入大烧杯并用37℃的灭菌生理盐水淹没后带入无菌室。用灭菌纱布拭干卵巢表面,选取直径>2 mm的卵泡,用10 mL注射器配10号针头抽取卵泡液。将收集的卵泡液置于37℃水浴中静置5—10 min,弃去上清液。将沉淀用捡卵液反复清洗3—5次后在光镜下使用拉制好的玻璃吸管捡出卵丘-卵母细胞复合体。将捡出来的卵丘-卵母细胞复合体放入1.5 mL离心管内,通过反复吹打脱落颗粒细胞,置于离心管内以2 000 r/min 离心5 min。用含有10%胎牛血清、100 U·mL-1青霉素、100 μg·mL-1硫酸链霉素和1X GlutaMAX的DMEM-F12细胞培养液将颗粒细胞吹打混匀后,接种到60 mm培养皿内,同时利用玻璃吸管捡出所有卵母细胞并弃掉。最后置于37℃、5%的CO2培养箱中培养。在猪卵丘颗粒细胞生长密度达到80%左右时,将培养基更换为低血清培养基(含有0.5%胎牛血清),继续培养细胞24 h。然后在低血清培养基中加入外源性重组的梅花鹿激活素A(25 ng·mL-1)处理细胞24 h。然后用RT-qPCR和Western blot检测芳香化酶、StAR和P450等类固醇激素激素合成关键基因的mRNA和蛋白水平。
1.10.2 荧光定量PCR 将外源性重组的梅花鹿激活素A(25 ng·mL-1)处理的猪卵丘颗粒细胞以及对照组的猪卵丘颗粒细胞用冷的PBS清洗后,按照RNA提取试剂盒说明书提取细胞总RNA。然后利用PrimeScript One Script RT-PCR Kit Ver.2反转录试剂盒将总RNA反转录为cDNA,-20℃保存备用。
以正常猪卵丘颗粒细胞cDNA为模板,使用表1中的引物和PrimeSTAR HS高保真DNA聚合酶,按常规方法进行PCR扩增。PCR产物经2.0%的琼脂糖凝胶电泳鉴定并回收。回收后的目的基因片段和pMD19-T克隆载体进行连接。用PCR法鉴定出连接成功的阳性克隆后,送到上海生工生物公司测序[14],筛选出特异性的引物后进行荧光定量PCR反应。反应体系:12.5 μL FS Universal SYBR Green Master(ROX)、0.5 μL上游引物(10 μmol·L-1)、0.5 μL下游引物(10 μmol·L-1)、2 μL cDNA(1 ng·μL-1)样品和9.5 μL Nuclease-Free H2O。荧光定量PCR反应程序:95℃预变性10 min;95℃变性30 s、60℃退火及延伸30 s,45个循环。每个循环的退火及延伸阶段采集荧光信号数据。扩增结束后立即进行熔解曲线分析,根据熔解曲线判断反应的特异性,根据每个样品的Ct值,用2-ΔΔCt法计算目的基因的相对表达量,每个试验样品设置3次重复,同是有3个生物学重复。
Table 1
表1
表1引物序列与real-time PCR 反应参数
Table 1
| 基因 Gene | GenBank登陆号 GenBank accession No. | 上下游引物 (5′-3′) Primer | 产物长度 Product size (bp) | 退火温度 Annealing temperature (℃) |
|---|---|---|---|---|
| Aromatase | NM_214427.1 | CGCTCAGTCCTGGTCAAAGG ACCAGGAGAGGGGATCTCAC | 141 | 60.0 |
| P450scc | NM_214429.1 | ACCAGCATGGTGTCTGAAGTT GACCTGGTATTGAAGATGTGTTTT | 109 | 60.0 |
| StAR | NM_213755.2 | TTAAGCTGTGTGCTGGGAGC CCATGACCCTGAGGTTGGAC | 128 | 60.0 |
| 3β-HSD | NM_001004049.2 | TCGTCCACTTGTTGCTGGAG TGCTCTGGAGCTTAGAAAATTCC | 102 | 60.0 |
| LHR | NM_214449.1 | ACATAACCACCGTACCAGCA GGAAGGCGTCATTGTGCATC | 177 | 60.0 |
| FSHR | NM_214386.3 | TCTGGATTTGGGGACCTGGA GAAGGCATCAGGGTCGATGT | 150 | 60.0 |
| GAPDH | XM_021091114.1 | GTATGATTCCACCCACGGCA CACCCCATTTGATGTTGGCG | 122 | 60.0 |
新窗口打开|下载CSV
1.10.3 Western blot检测Smad信号通路 在猪卵丘颗粒细胞生长密度达到80%左右时,将培养基更换为低血清培养基(含有0.5%胎牛血清),继续培养细胞24 h。然后在低血清培养基中加入外源性重组的梅花鹿激活素A(25 ng·mL-1)处理细胞2 h。将外源性重组的梅花鹿激活素A(25 ng·mL-1)处理的猪卵丘颗粒细胞以及对照组的猪卵丘颗粒细胞用冷的PBS清洗后,按照M-PER ® Mammalian试剂盒说明书提取细胞总蛋白。蛋白上样量为30 μg,浓缩胶的电泳电压为90 V,时间30 min,分离胶的电泳电压为120 V,时间为75 min。转膜电压为90 V,时间为80 min。用TBST稀释的5%BSA室温振荡封闭1 h。本研究中使用的一抗信息见表2。最佳稀释比例的一抗在4℃冰箱孵育过夜,TBST 洗涤3次,每次10 min,再加入用5%BSA稀释的HRP标记的二抗(表2),37℃孵育1 h,TBST洗涤3次,每次10 min,最后用ECL显影。
Table 2
表2
表2抗体信息表
Table 2
| 抗体名字 Name of antibody | 生产厂家 Manufacturer | 种属(单抗/多抗) Species raised (Monoclonal or polyclonal) | 稀释比例 Dilution ratio |
|---|---|---|---|
| Smad2(L16D3) | Cell Signaling Technology | Mouse (M) | 1:1000 |
| p- Smad2(Ser465/467) | Cell Signaling Technology | Rabbit (M) | 1:1000 |
| Smad3(C67H9) | Cell Signaling Technology | Rabbit (M) | 1:1000 |
| p- Smad3(Ser423/425) | Cell Signaling Technology | Rabbit (M) | 1:1000 |
| P450 Aromatase | BIO-RAD | Mouse (M) | 1:200 |
| StAR(ab96637) | abcam | Rabbit (P) | 1:1000 |
| 6X His tag(ab9108) | abcam | Rabbit(M) | 1:1000 |
| β-actin(49900) | abcam | Mouse (M) | 1:10000 |
| GAPDH(181602) | abcam | Rabbit (M) | 1:5000 |
| Goat Anti-Mouse (HRP) (ab6728) | abcam | Goat (P) | 1:5000 |
| Goat Anti-Rabbit (HRP) (ab6721) | abcam | Goat (P) | 1:5000 |
新窗口打开|下载CSV
1.11 实验数据处理
试验数据用SPSS 16.0统计分析软件One-way ANOVA进行方差分析和显著性检验,结果用平均值和标准方差(SEM)表示,P<0.05时判为差异显著,P>0.05时判为差异不显著。2 结果
2.1 梅花鹿ACTBA基因的扩增
RT-PCR扩增的产物分别经1%琼脂糖凝胶电泳显示,在约1 290 bp处有一明显扩增条带,与预期的目的基因ACTBA大小一致(图1)。图1
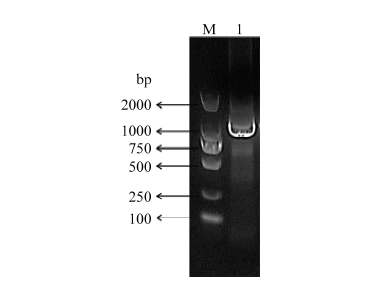 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1ACTBA基因的扩增
M. DNA相对分子质量标准(DL2000);1. ACTBA基因扩增产物
Fig. 1Amplification of ACTBA gene
M. DNA Marker(DL2000); 1. PCR product of ACTBA
2.2 真核表达质粒pcDNA4/ACTBA的构建与鉴定
构建好的重组质粒pcDNA4/ACTBA,经PCR、BamH I单酶切、BamH I和Hind III双酶切鉴定结果显示(图2)pcDNA4/ACTBA质粒构建成功,然后进一步进行核苷酸序列测定,结果显示插入pcDNA4/myc- His的ACTBA基因的读码框架和插入方向均正确。图2
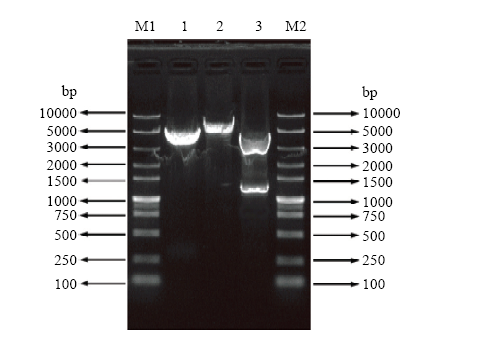 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2重组质粒pcDNA4/ACTBA单双酶切鉴定
M1. DNA相对分子质量标准(DL10000);1. BamHⅠ单酶切pcDNA4/myc-His空质粒;2. BamH I单酶切pcDNA4/ACTBA重组质粒;3. BamH I和Hind III双酶切pcDNA4/ACTBA重组质粒;M2. DNA相对分子质量标准(DL10000)
Fig. 2Identification of recombinant plasmid pcDNA4/ACTBA by single and double restriction endonuclease digestion
M1. DNA Marker (DL10000); 1. Digested product of pcDNA4/myc-His with BamH I; 2. Digested product of pcDNA4/ACTBA with BamH I; 3. Digested product of pcDNA4/ACTBA with BamH I and Hind III; M2. DNA Marker (DL10000)
2.3 ACTBA基因核苷酸序列及氨基酸序列分析
将梅花鹿ACTBA基因核苷酸与NCBI数据库中登录的8个代表性物种的ACTBA基因序列进行同源性比较,发现梅花鹿ACTBA基因与牛的ACTBA基因同源性最高达98.4%,与猪的ACTBA基因同源性达92.2%(图3)。同时我们应用MEGA4软件对20种不同动物的ACTBA基因的氨基酸序列进行进化树分析。结果发现这20种动物的ACTBA基因的氨基酸序列形成6个明显不同的大分支。其中偶蹄目(反刍兽以及猪)、奇蹄目、肉食目、灵长目和啮齿目等动物各占一个大分支,这说明ACTBA基因在不同物种间是非常保守的。我们克隆的梅花鹿ACTBA基因处于偶蹄目反刍动物的小分支内,其中梅花鹿ACTBA基因与牛的亲缘关系最近,猪的ACTBA基因次之(图4)。图3
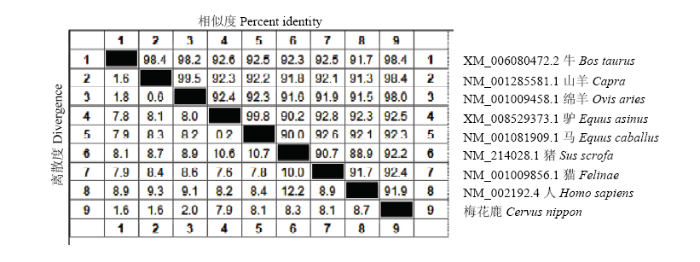 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3ACTBA基因的CDS区核苷酸序列同源性分析
Fig. 3Analysis of nucleotide acid homology of CDS region of ACTBA genes
图4
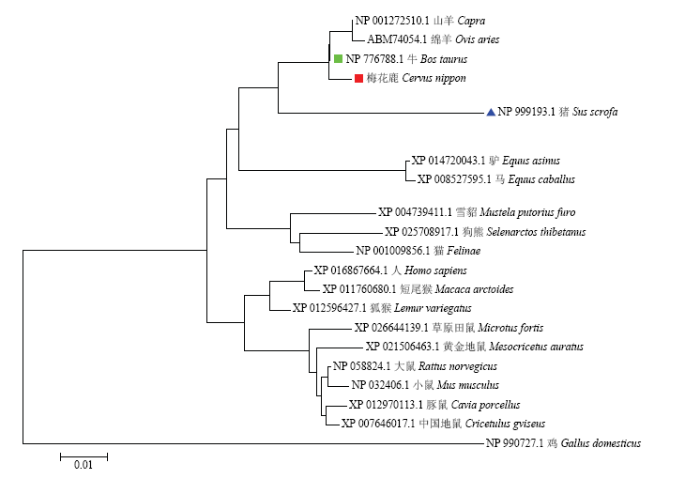 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4ACTBA基因的系统进化树分析
Fig. 4Analysis of phylogenetic tree based on the ACTBA gene
2.4 ACTBA基因在CHO细胞中瞬时表达
将重组质粒pcDNA4/ACTBA和对照空载体pcDNA4/myc-His转染CHO细胞48 h后进行免疫荧光染色。结果在荧光显微镜下发现转染pcDNA4/ACTBA质粒的CHO细胞的胞质内有大量的红色荧光显现,细胞核内没有红色荧光分布(图5-A3);然而转染pcDNA4/myc-His空质粒的细胞在细胞质和细胞核内没有红色荧光(图5-B3)。表明ACTBA在CHO细胞中表达后,主要分布于细胞质内。将转染重组质粒pcDNA4/ACTBA和对照空载体pcDNA4/myc-His 48 h后的CHO细胞总蛋白进行Western blot鉴定,结果(图6)发现转染重组质粒pcDNA4/ACTBA的CHO细胞在45 kD处有一条特异的条带,这与梅花鹿激活素A的bate A亚基大小一致。然而转染空载体pcDNA4/ myc-His的CHO细胞没有条带。图5
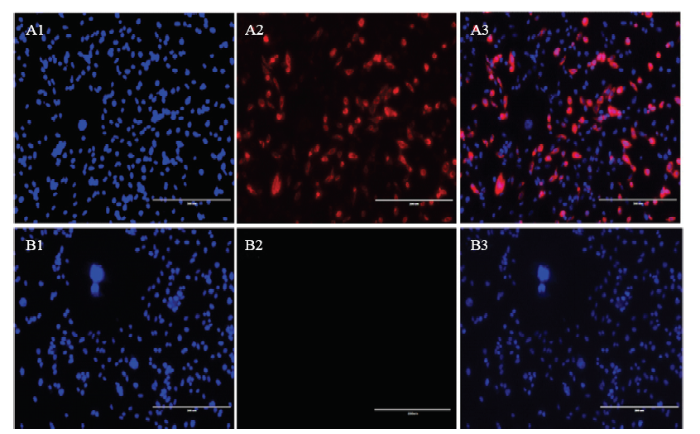 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5ACTBA在CHO细胞中瞬时表达
A1、A2、A3为CHO细胞转染pcDNA4/ACTBA后荧光显微镜照片(A1:DAPI染核,A2:ACTBA-His融合蛋白,A3:重叠后照片);B1、B2、B3为CHO细胞转染pcDNA4/myc-His空载体后荧光显微镜照片(B1:DAPI染核,B2:阴性对照,B3:重叠后照片)
Fig. 5Transient expressions of ACTBA gene in CHO cells (×200)
A1,A2,A3: The CHO cells transfected with pcDNA4/ACTBA (A1: Cell stained with DAPI, A2: Expression of ACTBA-His, A3: Merge);B1,B2,B3: The CHO cells transfected with pcDNA4/myc-His (B1: Cell stained with DAPI, B2: Negative control, B3: Merge)
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6Western blot检测重组质粒在CHO细胞中表达
1:转染重组质粒pcDNA4/ACTBA的CHO 细胞破碎产物;2:转染空载体pcDNA4/myc-His的CHO 细胞破碎产物
Fig. 6Western blot detected the expression of recombinant plasmid in the cells of CHO
1: Sonication product of transfected recombinant plasmid pcDNA4/ACTBA of CHO; 2: Sonication product of transfected empty vector pcDNA4/myc- His of CHO
2.5 梅花鹿激活素A蛋白纯化及鉴定
利用无血清CHO表达系统,表达了梅花鹿激活素A,结果显示梅花鹿激活素A条带明显,大小一致,约26 kD(图7)。同时利用His 标签蛋白纯化试剂盒纯化梅花鹿激活素A,然后利用BCA试剂盒测定蛋白浓度,结果发现体外表达梅花鹿激活素A的蛋白含量为15 ng·μL-1。利用His 标签抗体对纯化后的梅花鹿激活素A进行Western blot检测,结果发现利用非还原性SDS-PAGE上样缓冲液变性的梅花鹿激活素A所得目的条带有两条,大小约为58和26 kD这与预期梅花鹿激活素A的大小一致(图8-A)。使用还原性SDS-PAGE上样缓冲液变性的梅花鹿激活素A所得目的条带有两条,大小约为45 kD和13 kD这与预期梅花鹿激活素A的大小一致(图8-B)。体外表达的梅花鹿激活素A有两条目的条带主要是因为,它包含了前体蛋白和成熟蛋白两种形式,前体蛋白主要由一分子全长ACTBA亚单位(约45 kD)和一分子切割后的成熟的ACTBA亚单位(约13 kD)组成。然而成熟的梅花鹿激活素A是由2分子成熟的ACTBA亚单位(约13 kD)组成(图9)。图7
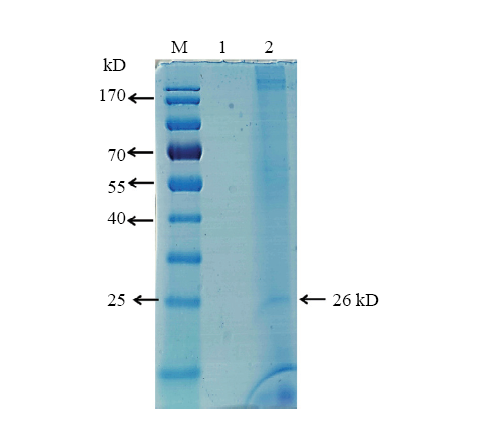 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7SDS-PAGE检测激活素A的表达
1:转染空载体pcDNA4/myc-His的CHO 细胞培养液上清;2:转染重组质粒pcDNA4/ACTBA的CHO 细胞培养液上清(非还原性SDS-PAGE上样缓冲液变性)
Fig. 7SDS-PAGE detected the expression of Activin A
1: Culture medium of transfected empty vector pcDNA4/myc-His of CHO; 2: Culture medium of transfected recombinant plasmid pcDNA4/ACTBA of CHO(SDS-PAGE loading buffer, non-reducing)
图8
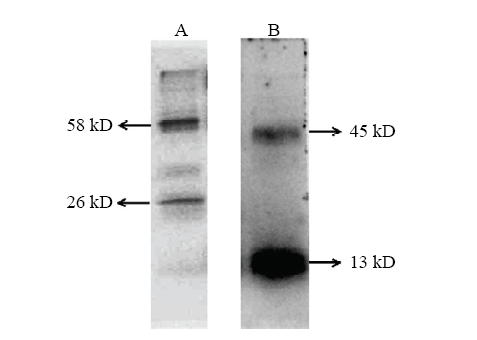 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8Western blot检测激活素A的表达
A:转染空载体pcDNA4/ACTBA的CHO 细胞培养液上清(非还原性SDS-PAGE上样缓存液变性);B:转染重组质粒pcDNA4/ACTBA的CHO 细胞培养液上清(还原性SDS-PAGE上样缓存液变性)
Fig. 8Western blot detected the expression of Activin A
A: Culture medium of transfected recombinant plasmid pcDNA4/ACTBA of CHO (SDS-PAGE Loading buffer, non-reducing); B: Culture medium of transfected recombinant plasmid pcDNA4/ACTBA of CHO (SDS-PAGE loading buffer, reducing)
图9
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9前体和成熟形式的激活素
Fig. 9Precursor and mature forms of Activins
2.6 梅花鹿激活素A可以激活SMAD信号通路
为了检测体外表达纯化的梅花鹿激活素A是否具有生物学活性,我们利用猪颗粒细胞测试了体外表达的梅花鹿激活素A能否激活经典的SMAD信号通路。结果发现利用25 ng·mL-1纯化的梅花鹿激活素A处理猪颗粒细胞60 min后,明显诱导SMAD2与SMAD3发生磷酸化(图10)。图10
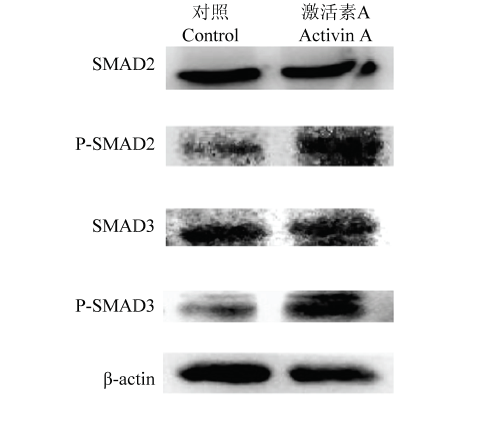 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10激活素A对SMAD信号通路蛋白表达的影响
Fig. 10The effect of Activins A on the expression of SMAD signal pathway protein
2.7 梅花鹿激活素A对颗粒细胞类固醇生成的影响
为了进一步研究,梅花鹿激活素A在类固醇激素生成过程中的生物学作用,我们利用纯化的梅花鹿激活素A处理猪原代颗粒细胞24 h后,检测芳香化酶(Aromatase)以及StAR(Steroidogenic acute regulatory protein)的mRNA和蛋白质水平的变化。结果发现(图11)梅花鹿激活素A处理后的猪原代颗粒细胞芳香化酶的mRNA和蛋白质水平均上调,然而StAR的mRNA和蛋白质水平均下调。图11
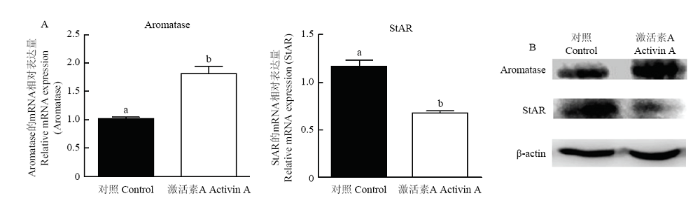 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图11激活素A对猪颗粒细胞Aromatase和StAR表达量的影响
A:实时荧光定量PCR检测P450 aromatase和StAR mRNA表达量水平;B:Western blot检测P450 aromatase和StAR 蛋白表达量水平
Fig. 11Effects of Activins A on Aromatase and StAR expression in pig granulosa lutein cells
A: P450 aromatase and StAR mRNA levels were measured by RT-qPCR; B: P450 aromatase and StAR protein levels were measured by Western blot
与此同时我们利用Real-time PCR技术检测了梅花鹿激活素A处理的猪原代颗粒细胞中P450侧链裂解酶(P450 side chain cleavage enzyme, P450scc)、3'-羟基类固醇脱氢酶(3'-hydroxysteroid dehydrogenase, 3β-HSD)、FSH和LH的特异性受体(FSHR and LHR)的mRNA水平。结果发现(图12)梅花鹿激活素A处理后的猪原代颗粒细胞中P450scc与3β-HSD mRNA表达量不发生变化,但FSHR基因表达量升高,LHR基因表达量降低。
图12
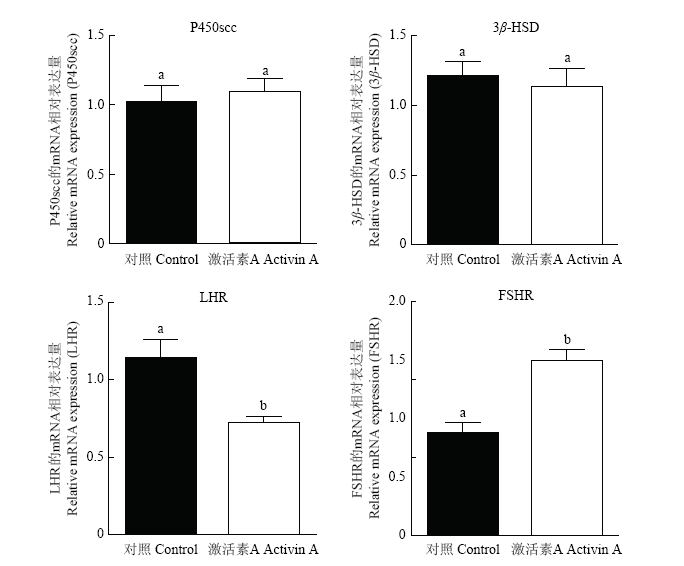 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图12激活素A对猪颗粒细胞细胞P450scc、3β-HSD、FSHR和LHR表达量的影响
Fig. 12Effects of Activins A on P450scc, 3β-HSD, FSHR and LHR expression in pig granulosa lutein cells
3 讨论
激活素A几乎在动物的所有发育阶段,以及各种组织中发挥广泛生物学作用。激活素A在卵巢卵泡发生以及睾丸精子发生过程中发挥了重要的自分泌和旁分泌作用。在整个卵泡发生过程中激活素的表达量呈动态变化,尤其在优势卵泡选择阶段,激活素A的相对表达量显著增加[5, 9, 19-20]。在绵羊发情期,随着卵泡大小的增加,卵泡液中激活素A浓度降低[11,12]。大量研究发现激活素A可以增强卵母细胞的成熟并促进体外颗粒细胞的增殖[21,22,23]。本研究中,采用了分子克隆技术构建了梅花鹿抑制素βA亚基基因的真核重组质粒pcDNA4/ACTBA,体外转染CHO细胞并制备出具有生物学活性的梅花鹿激活素A蛋白,对于深入研究梅花鹿激活素A的生物学功能至关重要。利用无血清CHO表达系统,表达了梅花鹿激活素A。考马斯亮蓝染色,结果显示梅花鹿激活素A条带明显,大小约26 kD。因为成熟的梅花鹿ACTBA亚单位约13 kD。然而成熟的梅花鹿激活素A是由2分子成熟的ACTBA亚单位组成约26 kD。利用His 标签蛋白纯化试剂盒纯化后的梅花鹿激活素A,利用His 标签抗体进行Western blot检测,结果发现利用非还原性SDS-PAGE上样缓存液变性的梅花鹿激活素A所得目的条带有两条,大小约为58和26 kD。体外表达的梅花鹿激活素A有两条目的条带主要是因为,它包含了前体蛋白和成熟蛋白两种形式,前体蛋白主要由一分子全长ACTBA亚单位(约45 kD)和一分子切割后的成熟的ACTBA亚单位(约13 kD)组成,约58 kD。然而成熟的梅花鹿激活素A是由2分子成熟的ACTBA亚单位组成约26 kD。使用还原性SDS-PAGE上样缓冲液变性的梅花鹿激活素A所得目的条带有两条,大小约为45和13 kD。由于使用还原性SDS-PAGE上样缓冲液变性,所以梅花鹿激活素A前体蛋白和成熟蛋白内的二硫键被打开,二聚体变为单体,因此45 kD蛋白为一分子全长ACTBA亚单位,13 kD蛋白为成熟的ACTBA亚单位。综上所述,本研究成功体外表达和纯化的梅花鹿激活素A。
激活素A的生物学作用是由TGF-β家族I型和II型丝氨酸-苏氨酸激酶受体组成的异四聚体复合物介导的[24]。首先激活素A结合激活素IIA型(ACVR2A)或激活素IIB型(ACVR2B)受体后,募集激活素I型受体ActRIB(ALK4)和ActRI(ALK2)并使其丝氨酸和苏氨酸残基磷酸化[3, 14]。然后,活化的ALK受体通过C末端细胞质激酶结构域磷酸化SMAD 2和SMAD 3蛋白,形成SMAD 2/3复合物,其与SMAD 4蛋白结合形成三聚体复合物。这种复合物迁移到细胞核,并与DNA结合以调节基因转录。在本研究中,为了证实体外表达的梅花鹿激活素A是否具有生物学活性,利用猪颗粒细胞测试了体外表达的梅花鹿激活素A能否激活经典的SMAD信号通路。结果发现纯化的梅花鹿激活素A可以诱导猪颗粒细胞SMAD2与SMAD3发生磷酸化。这充分说明纯化的梅花鹿激活素A具有生物学活性。
除了其在卵母细胞成熟和颗粒细胞增殖中的作用外,大量证据表明激活素A还可作为卵巢类固醇生成的调节剂。用激活素A处理大鼠和牛颗粒细胞可以增强细胞色素P450芳香酶(cytochrome P450 aromatase, P450 arom)活性和雌二醇分泌量,同时抑制孕酮分泌[9, 14, 25-26]。在人颗粒细胞中,激活素A减弱FSH和人绒毛膜促性腺激素(hCG)诱导的类固醇激素急性调节蛋白(Steroidogenic acute regulatory protein,StAR)mRNA水平,并减少促性腺激素(FSH,LH或hCG)诱导的孕酮产生[27,28]。在本研究中我们对梅花鹿激活素A在类固醇激素生成过程中的生物学作用进行了研究,结果发现梅花鹿激活素A处理后的猪原代颗粒细胞P450 arom的mRNA和蛋白质水平均上调,然而StAR的mRNA和蛋白质水平均下调。目前已经有大量研究报道激活素A可以上调P450 arom,这是由于激活素A活化的SMAD3蛋白可与P450 arom启动子区域结合,可促进P450 arom转录[14, 25, 29]。同样也有研究发现激活素A可以下调人颗粒细胞、卵泡膜细胞中的StAR[18, 30-32]。同时我们还发现梅花鹿激活素A处理后的猪原代颗粒细胞P450scc与3β-HSD mRNA表达量不发生变化,但FSHR基因表达量升高,LHR基因表达量降低。这说明激活素A可以增强FSH对颗粒细胞的生物学作用,也可以减弱LH对颗粒细胞的生物学作用。
4 结论
利用CHO无血清表达系统成功表达出具有生物活性的梅花鹿激活素A的重组蛋白,同时发现梅花鹿激活素A在类固醇激素生成中具有重要作用,它可以上调P450 arom的mRNA和蛋白质水平,下调StAR的mRNA和蛋白质水平。另外,梅花鹿激活素A可以促进颗粒细胞FSHR基因的表达,抑制LHR基因的表达,表明其可以增强FSH对颗粒细胞的生物学作用,也可以减弱LH对颗粒细胞的生物学作用。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 2]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 5]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
