 ,1
,1Fine Mapping and Candidate Gene Analysis of a Short Internodes Gene Cmdm1 in Melon (Cucumis melo L.)
MA Jian1, LI CongCong2, WANG JianShe ,1
,1通讯作者:
责任编辑: 赵伶俐
收稿日期:2019-08-7接受日期:2019-09-16网络出版日期:2020-02-16
| 基金资助: |
Received:2019-08-7Accepted:2019-09-16Online:2020-02-16
作者简介 About authors
马建,E-mail:majian@nercv.org。

摘要
关键词:
Abstract
Keywords:
PDF (1518KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
马建, 李丛丛, 王建设. 甜瓜短蔓基因Cmdm1的精细定位及候选基因分析[J]. 中国农业科学, 2020, 53(4): 802-810 doi:10.3864/j.issn.0578-1752.2020.04.012
MA Jian, LI CongCong, WANG JianShe.
0 引言
【研究意义】甜瓜(Cucumis melo L.)为葫芦科(Cucurbitaceae)甜瓜属(Cucumis)甜瓜种一年生草本植物,是一种世界范围内广泛种植的重要园艺经济作物。株型对于甜瓜的生产栽培具有重要意义,可影响甜瓜的种植密度、产量、品质、坐果性等方面,而节间长度是甜瓜株型的重要构成因素,短蔓(节间)品种往往具有株型紧凑的特点,生产上可通过增加种植密度来提高单位面积产量而增加经济效益。因此,短蔓性状作为株型的关键性状,逐步受到育种家的关注。深入挖掘并利用甜瓜短蔓资源,鉴定短蔓控制基因,从而利用分子手段培育短蔓甜瓜新品种,进而解决甜瓜栽培上的密植问题,对促进甜瓜产业化发展具有重要意义。【前人研究进展】研究表明,植物矮化基因在抗倒伏、产量、早熟、分蘖能力上都有潜在作用而具有重要的经济价值[1]。20世纪五六十年代,由于半矮杆基因semidwarf 1(sd-1)的应用,在世界范围内掀起了一场“绿色革命”,使作物产量大幅度提高[2]。葫芦科作物是蔬菜作物的主要大类之一,常见的有黄瓜、西瓜、南瓜、甜瓜等10余种,而短蔓现象似乎在葫芦科作物中普遍存在,比如已报道的黄瓜上的cp[3]、cp-2[4]、scp[5]、si[6]和csdm1[7]等矮化突变体;西瓜上的dw-1[8]和DMSW(dwarf male sterile watermelon)[9]等矮化材料;南瓜上利用无蔓(矮生)突变体育成的无蔓1号和无蔓4号无蔓南瓜的新品种以及无蔓南瓜Bu[10]、南瓜矮化突变体dm1[11]和SQ026[12]等突变体。甜瓜的短蔓性状研究起步较早,1968年,美国****DENNA报道了一份甜瓜短蔓甜瓜材料UC Topmark bush,后来表明其携带基因si-1,si-1表达受1个至多个修饰基因影响,其短蔓植株株型紧凑、节间细、脆、短、蔓弯曲、果小,属于矮生型[13];PARIS等[13]报道了Persia202携带基因si-2,其短蔓植株株型紧凑直立,座瓜靠近茎基部,属于丛生型或鸟巢型;KNAVEL[14]报道了品种Maindwarf携带基因si-3,报道的3个基因彼此间非等位且为独立遗传的隐性单基因。HWANG等[15]对一份短节间甜瓜PNU-D1的遗传模式进行了研究,表明短节间表型受一对隐性基因mdw1控制。王建设等[16]以长蔓品种状元和短蔓资源1A533、1A440为材料,分析了甜瓜短蔓性状的遗传规律,研究结果表明两份短蔓甜瓜各携带l对非等位的隐性短蔓基因。随着瓜类作物基因组的测序完成,近几年通过图位克隆等方法在瓜类作物上也陆续鉴定出一些植株矮化基因,LI等[3]将源于黄瓜PI 308915的cp精细定位到220 kb区间内,鉴定到其中的一个细胞分裂素氧化酶基因(cytokinin oxidase,CKX),该基因由于第一个外显子上发生3 bp缺失而造成矮化表型。LIN等[6]对一份EMS诱变来源的短节间矮化黄瓜突变体si进行了研究,发现编码F-box蛋白的CsaVFB1(Csa4P641640)与表型最相关。XU等[7]对黄瓜矮化突变体Csdw进行研究,鉴定出一个编码CLAVATA1类型的受体激酶基因Csa3G872760(CsCLAVATA1)发生突变,可能是导致Csdw产生矮化表型的原因。ZHANG等[12]对一份矮化突变体SQ026进行研究,利用genotyping-by-sequencing方法鉴定到一个编码赤霉素20氧化酶基因(gibberellin 20-oxidase,qCmB2),该基因的启动子区在突变体中存在1 249 bp缺失,可能与矮化表型相关。HWANG等[15]对短蔓甜瓜PNU-D1中的隐性控制基因mdw1进行了研究,最终将该基因定位于1.8 cM距离内。【本研究切入点】茎蔓长度是甜瓜株型重要的性状之一,直接影响单位面积的种植密度。尽管前人已对甜瓜的短蔓性状进行了大量的研究,但尚未提升到基因水平。王建设等[16]研究表明短蔓自然突变体材料1A440的短蔓性状受l对隐性基因控制,本研究在此基础上通过对1A440再次进行自交提纯获得了稳定遗传的甜瓜短蔓突变体Z8,在此基础上拟对Z8中的短蔓基因进行精细定位并分析可能的目的基因。【拟解决的关键问题】本研究以甜瓜短蔓突变体Z8为材料,通过表型和遗传分析、基因定位和候选基因分析等研究手段,拟确定造成短蔓表型的关键目的基因,为将来该基因的转基因功能验证以及利用分子标记辅助手段培育短蔓甜瓜新品种,提供资源、基因和方法。1 材料与方法
试验于2018年在北京市农林科学院蔬菜研究中心进行。1.1 实验材料、群体构建及表型调查
父本材料:厚皮甜瓜短蔓材料1A440自交5代获得的短蔓突变体Z8,母本材料:源于甜瓜地方品种‘一窝猴’的高代自交系B15。两者杂交、自交获得BC1F1(31株)和F2(780株)代分离群体,所有材料于春季育苗后移栽于北京市农林科学院蔬菜研究中心四季青基地大棚内。选取父、母本各10个单株自然生长,不整枝不掐头,于果实成熟期分别调查各单株主蔓节数,用软尺测量各单株主蔓以及基部最长的5个侧枝长度,并进行数据统计分析。1.2 DNA提取及PCR扩增、检测
取甜瓜新鲜叶片,利用CTAB法[17]提取基因组总DNA。PCR扩增反应体系为10 μL,包括0.8 μL Buffer、0.8 μL dNTPs(2.5 mmol∙L-1 each)、1 μL Primers(10 μmol∙L-1,F+R)、1 μL基因组DNA(50 ng∙μL-1)、0.1 μL EasyTaq® DNA Polymerase for PAGE(购自北京全式金生物技术有限公司)和6.3 μL ddH2O。反应程序:94℃预变性4 min;94℃变性30 s,59℃退火30 s,72℃延伸30 s,运行35个循环;72℃延伸5 min。扩增产物采用8%聚丙烯酰胺凝胶电泳检测,银染后在观片机上拍照、记录。1.3 RNA提取与基因测序、表达分析
两周左右的甜瓜幼苗经液氮研磨后,利用天根生化科技(北京)有限公司的RNAprep pure Plant Kit试剂盒进行总RNA提取,第一链cDNA采用北京全式金生物技术有限公司的TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒合成,操作步骤参照说明书。扩增候选基因长片段PCR反应体系如下:2×PCR Buffer for KOD FX 25 μL,10 μL dNTPs(2 mmol∙L-1 each),2 μL引物(10 μmol∙L-1,F+R),1 μL KOD FX酶(1 U∙μL-1,购自东洋纺(上海)生物科技有限公司),2 μL DNA模板(100 ng∙μL-1),加ddH2O至50 μL。扩增反应条件:94℃预变性2 min;98℃变性10 s,59℃退火30s,68℃依片段大小延伸~1 kb/min,35个循环;68℃延伸5 min。扩增产物经1%琼脂糖胶检测后送至北京博迈德科技发展有限公司测序,获得序列用DNAMAN软件拼接比对,确定突变位点。基因表达分析采用实时定量荧光PCR方法[18],利用宝日医生物技术(北京)有限公司(TaKaRa)的SYBR Premix Ex TaqTM II试剂盒进行扩增,选用Applied Bio systems公司的96孔PCR板在ABI PRISM 7500实时定量PCR仪上运行。以甜瓜的CmActin(AY859055)作为内参[19],反应程序:95℃预变性15 s;95℃变性5 s,60℃延伸34 s,40个循环。每个反应重复3次,采用2-ΔΔCT算法分析结果[20]。引物序列见表1。
Table 1
表1
表1本研究所用的PCR引物序列
Table 1
| 引物名称 Primer | 正向引物 Forward primer (5'-3') | 反向引物 Reverse primer (5'-3') |
|---|---|---|
| c7-3 | AATTCCCTTACCCTTGACAGCA | GTTGAACCGACTCGACCGAC |
| c7-13 | CAGGCAGGCTACGCTACATT | CGCTCTGACGTTATGAAGTTGT |
| c7-70 | GGAGAAAATGACGCTCTTAATTGAT | CCCCATCTCCATTACAATGTTTACT |
| c7-94 | ATGCATGTTAAGTTGTCCTACGG | CCCACCACTATGGCATGTGTAA |
| c7-101 | ACATGTCAGAGCAACAGAATTGA | AAGCTCCATTCGAGGATTCATT |
| c7-103 | ACCTCGTTCATGCCAAAGATG | ACCTTTGACTCCAAAAGAAGGA |
| c7-112 | GTGTTCGACCAACCAATTTTCAC | GGTGTTAGTGTGGATTTGGGA |
| c7-119 | AAAACCTTCAAATCATGGACTGTT | ACAGTTAAAATAGCATGCAAGAAGT |
| c7-120 | AATTTTTAGATCCACCGCTGCT | CATACTTCTCCCCAATCTTCCC |
| c7-130 | GTGTCATGTCGAAACACCGTC | CTTCGTGGTACGTCGGGAAA |
| c7-132 | AAAGGTGTAATTCACATTCATCCAA | ACTTTGTTGGAACATAGAGTTGGT |
| c7-167 | ATTCCACGACTGCCCATCAG | TGCTGTCTGCAACATTAAAGGG |
| c7-200 | TCGTTTACCGACTACATTGAGC | TGTCCAGATTTTAAAGTTGATTCGT |
| c7-206 | CAATACATGGCTCTAAAGACAAACT | AGAGTGTTTCACTCGCATCCT |
| dm-1 | CAACTTCAAAATCTTCTCTCCTTGT | TAAACATGCAGCAGGAAGGAAA |
| s2 | GGCTGTTGCTTGGACTTTGG | AGCATGACCGGCTCATCAAA |
| MELO3C016916 | CCAGCCATGAACACTGCAAAA | CCATGTTGCTGCTTGCCTAC |
| MELO3C016917 | CTCTCCTTGTTGTCACTGTTCAAA | ATCTGCTACCCTCAGCTTTCC |
| MELO3C016918 | CTTCTGGATCTCGCTAGGGTTT | TGGTGTGGCACCTGTGTTT |
| MELO3C016919 | TTTGTAGGCTGGCTTTGAGGA | ACTCCCCAAAAGAGAAGTCCCA |
| q3C016916 | TCGTCCGAACAACACAATACCT | CTCATAAACGTGAAGGGCCA |
| CmActin | TTCCCTCAGCACTTTCCAACA | TCCCTTTCCACCTTTTTGCTTC |
新窗口打开|下载CSV
1.4 基因定位及引物的开发
参考甜瓜基因组数据库(https://www.melonomics. net/)公布的基因组及基因注释数据,利用在线引物设计程序Primer-BLAST(http://www.ncbi.nlm.nih.gov/ tools/primer-blast/index.cgi?LINK_LOC=BlastHome)设计引物,引物由北京博迈德科技发展有限公司合成,引物序列见表1。2 结果
2.1 突变体Z8植株的表型分析
与野生型对照B15相比,突变体Z8在子叶期即表现为矮化(图1-A),伸蔓期植株生长较慢,节间长度变短,植株矮化(图1-B)。此外,突变体另一个明显的特征是顶端花序紧凑簇生(图1-C),最终影响到整个植株形态建成。突变体Z8主蔓平均长度为(181±13.9) cm,表现为短蔓,与对照差异极显著(P=0.006);平均节间长度(3.2±0.2 cm)与对照差异极显著(P<0.01);而总节数和平均最长侧枝长度与对照无显著差异(表2)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1B15(野生型)和Z8(短蔓)表型
A:子叶期表型(标尺1 cm);B:伸蔓期表型(标尺20 cm);C:Z8植株顶端表型(红色箭头所示,标尺5 cm)
Fig. 1Phenotypes of wild-type B15 and Z8 mutant
A: Cotyledon stage (Scale bars, 5 cm); B: Vine elongation stage (Scale bars, 20 cm); C: The top inflorescence of Z8 (Scale bars, 5 cm)
Table 2
表2
表2B15(野生型)和Z8(突变体)4个农艺性状比较分析
Table 2
| 材料名称 Material | 主蔓节数 Node number (No.) | 主蔓长度 Main stem length (cm) | 主蔓平均节间长度 Main stem internodes length (cm) | 侧枝长度 Lateral branch length (cm) |
|---|---|---|---|---|
| B15 | 43±9.8 | 363.3±77.7 | 8.5±0.1 | 61.6±10.4 |
| Z8 | 47.3±8.1 | 181±13.9** | 3.2±0.2** | 64.7±15.3 |
新窗口打开|下载CSV
2.2 突变体Z8短蔓性状的遗传分析
为了解突变体短蔓形成的遗传机制,以突变体Z8为父本,野生型B15为母本配制杂交组合,所得F1代植株蔓长均表现为野生型B15表型,表明Z8的短蔓性状受隐性核基因控制(表2)。F2代群体中蔓长出现分离,其中似野生型植株175株,短蔓植株55株,表现3﹕1的孟德尔遗传分离比(χ2=0.4<3.84),BC1F1代群体表现为1﹕1的分离比(表2),这些结果表明Z8中的短蔓性状由单隐性核基因控制,暂定该基因名称为Cmdm1(dwarf melon 1)。Table 3
表3
表3Z8短蔓性状的遗传分析
Table 3
| 品种或组合 Generation | 正常单株 Normal individuals | 短蔓单株 Short internodes individuals | 分离比 Expected ratio | χ20.05 值 χ20.05 |
|---|---|---|---|---|
| B15 (P1) | 20 | 0 | ||
| Z8 (P2) | 0 | 20 | ||
| F1 (P1 × P2) | 25 | 0 | ||
| F2 (F1)? | 175 | 55 | 3﹕1 | 0.40 |
| BC1F1 (F1 × P2) | 15 | 16 | 1﹕1 | 0.39 |
新窗口打开|下载CSV
2.3 Cmdm1的定位和物理图谱构建
为分离控制蔓长性状的Cmdm1,首先,利用两亲本B15和Z8的DNA对实验室保存的分布在12对染色体上的331对InDel引物进行筛选,其中表现出多态性的引物共120对。随后,选取15个短蔓F2单株DNA等量混合建立混池,加上亲本B15和Z8,共3个样品对120对引物进行筛选。结果表明,7号染色体短臂引物c7-3和c7-206与混池DNA表现出共分离。进一步利用两对引物对55个短蔓F2单株进行分子标记数据分析,发现引物与短蔓表型表现出连锁关系,并将控制短蔓性状的Cmdm1初步定位于两个引物c7-3和c7-206之间(图2-A)。图2
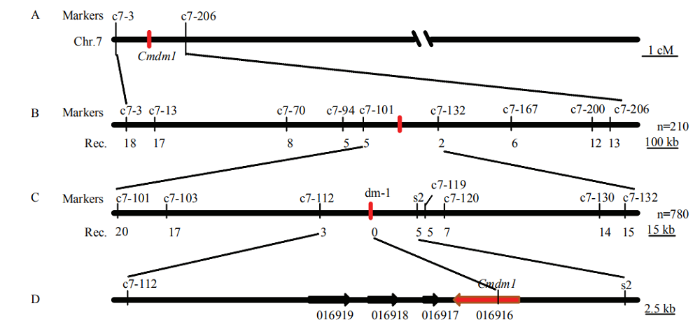 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2Cmdm1的物理图谱
A:Cmdm1定位于7号染色体短臂c7-3和c7-206标记之间;B:利用210个短蔓F2单株的初定位;标记下面的数字代表重组单株数目;C:利用780个短蔓F2单株的精细定位;D:定位区间的物理图谱,箭头代表注释的4个基因
Fig. 2Physical maps of the Cmdm1 locus
A: the Cmdm1 gene was located on the short arm of chromosome 7 between markers c7-3 and c7-206; B: the Cmdm1 gene was preliminarily delimited to the c7-101-c7-132 interval using 210 short internodes F2 individuals; the numerals below the corresponding markers indicate the numbers of recombinants (Rec) identified among F2 plants; C: fine genetic mapping of the Cmdm1 gene based on 780 short internodes F2 individuals; D: physical map of the Cmdm1 region based on the reference sequence and arrows indicated four annotated ORFs in this region
在此基础上,根据甜瓜参考基因组序列(https:// www.melonomics.net/)在两引物之间开发出7对多态性分子标记,随后对210个短蔓F2单株进行分子标记数据分析,初步将Cmdm1定位于标记c7-101和c7-132之间(图2-B)。进一步将定位群体扩大到780个短蔓F2单株,最终将Cmdm1精细定位于标记c7-112和s2之间,物理距离约为56 kb(chr7:1127514—1183716),并与标记dm-1共分离(图2-C)。
2.4 定位区间内候选基因分析
根据甜瓜参考基因组对该区间内的基因注释,56 kb区间内共包含4个预测的编码基因,分别为MELO3C016916、MELO3C016917、MELO3C016918和MELO3C016919(图2-D)。其中MELO3C016916编码一个富含亮氨酸重复序列的类受体激酶蛋白(LRR receptor-like serine/threonine-protein kinase),MELO3C016917编码一个未知功能蛋白(Uncharacterized protein),MELO3C016918编码一个脂肪酸结合蛋白2(Fatty-acid-binding protein 2),MELO3C016919编码鸟嘌呤核苷酸结合蛋白α-1亚基(Guanine nucleotide- binding protein alpha-1 subunit)。随后,分别对野生型B15和突变体Z8中4个基因的编码区DNA进行测序,结果显示,相比B15和参考基因组序列,Z8中MELO3C016917编码区发生两处未造成编码氨基酸变化的同义突变C180T和C255T;MELO3C016918编码区发生一处点突变A359G,造成编码氨基酸由天冬酰胺突变为丝氨酸;MELO3C016919编码区无差异;MELO3C016916编码区共发生4处同义突变,分别位于ATG下游C381T、C961T、C2112T和T2388C处。此外,Z8中该基因第1995位置处碱基位点由T突变为G,造成密码子由TAT突变为终止密码子TAG(图3-A)。基因组注释表明MELO3C016916编码区包含27个外显子,突变位点位于第25外显子。SMART软件(http://smart.embl-heidelberg.de/)预测该基因编码991个氨基酸组成的类受体激酶蛋白,突变造成翻译蛋白提前终止,仅编码664个氨基酸组成的截短蛋白,造成后面激酶结构域完全缺失(图3-B),从而影响了该蛋白的功能。另外,荧光定量PCR检测显示,与对照B15相比,Z8中该基因表达水平明显降低(图4)。MELO3C016916与已报道的拟南芥的ERECTA同源[21],编码蛋白的氨基酸序列相似性为88.6%,推测MELO3C016916即为控制蔓长的基因Cmdm1。图3
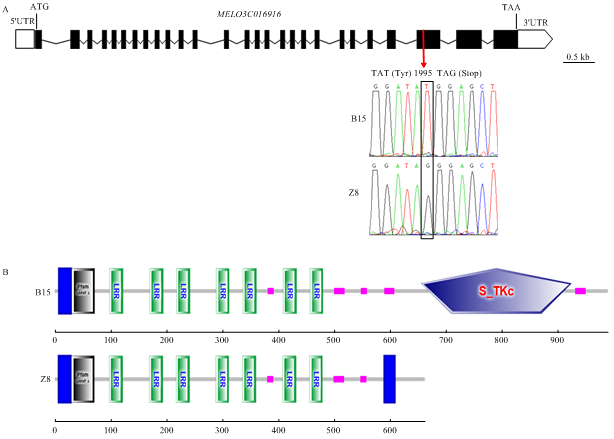 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3MELO3C016916结构、蛋白结构域及表达分析
A:MELO3C016916基因结构及其突变位点分析;B:野生型B15和突变体Z8中的MELO3C016916基因编码的蛋白结构域示意图
Fig. 3Gene structure, predicated function domains and gene expression levels of MELO3C016916 gene
A: Gene structure of MELO3C016916 and T1995 to G1995 mutation site was identified in the 25th exon generating a premature termination codon; B: The predicted function domains of MELO3C016916 protein in B15 and Z8, respectively
图4
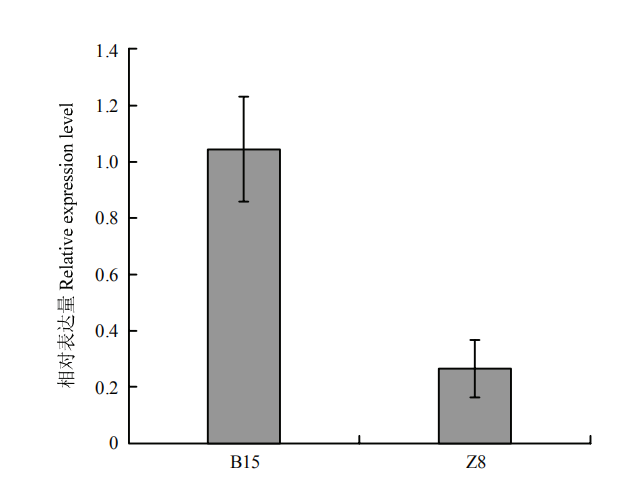 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4MELO3C016916在B15和Z8中的相对表达分析
Fig. 4Relative expression analysis of MELO3C016916 in B15 and Z8
3 讨论
“高产、优质、高效”始终是甜瓜生产追求的目标,合理密植是实现这一目标的关键措施之一。甜瓜的种植密度依赖于品种类型、熟性、种植方式、土壤肥力等条件。目前,西北甜瓜主产区以露地匍匐栽培为主,现有的推广品种瓜蔓长达3 m以上,栽培上株距、行距较大;东部地区保护地栽培一般采用直立吊蔓栽培,与匍匐栽培相比,利用了空间资源,但生育前期需要不间断绑蔓、吊蔓,生育后期基部叶片相互遮蔽,光合效率有所降低[16]。因此,在现有栽培方式下,通过改良甜瓜品种株型,有效利用土地及光热资源,在改善品质的同时进一步提高产量是甜瓜株型育种的新方向。主蔓长度是甜瓜株型的重要构成因素,利用短蔓基因,培育株型紧凑、适应密植、能充分利用土地与光热资源而且早熟的短蔓品种,可显著降低绑蔓、吊秧次数,提高单位面积产量,从而节约劳动力、降低成本、提高经济效益。之前的报道中,美国科学家就曾选育出‘Mininesota 266’‘U.C. Grenshaw Bush’‘Honey Dew Bush’‘Top Mark Bush’‘Perlita Bush’‘G515’‘KyP7’‘Main Dwarf’等早熟、丰产、优质和短蔓的甜瓜新品种[13-14,22-23],也先后报道了3个独立遗传的短蔓基因si-1、si-2和si-3[13,14]。本研究的短蔓突变体Z8源于短蔓材料1A440的多代自交系,短蔓性状受一对隐性基因控制,该突变体幼苗期即表现矮化,成株期株型紧凑、主蔓较短、顶端花序紧凑簇生,对该突变体的研究极大的丰富了甜瓜的短蔓资源。此外,OH[24]研究数据表明,短蔓材料PNU-D1的短蔓性状与短节间表现出正相关性(r2=0.69,P<0.005),即PNU-D1的侧枝长度也变短,但本研究结果表明Z8中5个最长侧枝长度与对照无明显的差异,这与OH[24]报道不一致,可能是由于材料不同,也可能是统计方法不同所造成。基因组学研究是近年来发展最为迅速的一个研究领域[25]。随着甜瓜全基因组测序的完成,甜瓜功能基因组学取得了快速发展,顺利定位和克隆了一批控制甜瓜重要园艺性状的基因,如甜瓜枯萎病抗性基因Fom1[26]、橙色果肉基因CmOr[27]、卷须控制基因CmTCP1[28]、白粉病抗性基因Pm-Edisto47-1[29]等。2014年,HWANG等[15]对一份韩国的短蔓突变体PNU-D1进行研究,通过构建遗传连锁图谱最终将控制蔓长的mdwl定位于7号染色体1.8 cM内,两侧标记mERE和mUBI距离分别为0.6 cM和1.7 cM,但定位区间较大,作者没有确定最终的候选基因。本研究通过对短蔓突变体Z8中的短蔓基因进行精细定位,最终将控制蔓长的Cmdm1定位于7号染色体短臂56 kb区间内,该位置与mdwl所在位置距离较近,不排除两者互为等位基因的可能性。通过对定位区间内候选基因编码区序列分析,发现定位区间内包含一个拟南芥基因ERECTA(AT2G26330)的同源基因MELO3C016916,两者编码蛋白序列相似性为88.6%,ERECTA是从拟南芥中分离到的一个编码富含亮氨酸重复序列的类受体激酶基因(leucine-rich repeats receptor-like serine/threonine-protein Kinase,LRR- RLK)[18]。拟南芥ERECTA在调控顶端分生组织的发育中起重要作用,该基因发生突变会导致节间缩短、花梗变短,具有紧凑的花序和粗而直立的花序茎,造成花簇集中在茎的顶端,最终影响植株形态建成[18],这些表型与Z8的表型极为相似。突变体Z8中该基因第25外显子发生T1995G单碱基突变,造成编码蛋白的激酶结构域完全缺失,表达水平显著降低,而拟南芥的研究表明ERECTA参与了生长素信号途径[30],C端激酶结构域对下游信号转导具有重要作用[31]。因此,本研究推测MELO3C016916为Cmdm1最终的候选基因。将来利用转基因手段对该基因功能进行验证,将为深入阐明Cmdm1控制节间长度的分子机制奠定基础,而且为培育短蔓甜瓜新品种提供支持。
4 结论
甜瓜短蔓突变体Z8平均节间缩短,顶端花序簇生。遗传分析表明该突变性状受一对隐性核基因Cmdm1控制,利用分子标记最终将该基因定位于7号染色体短臂标记c7-112和s2之间,物理距离约为56 kb,并与标记dm-1共分离。此定位区间内MELO3C016916与拟南芥的ERECTA同源,Z8中该基因发生T1995G碱基突变,造成编码蛋白提前终止,表达水平显著降低,推测该基因为控制蔓长的Cmdm1。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 4]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 2]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
