 ,1,41
,1,41 2
3
4
5
Occurrence and Biological Characteristics of Tomato mottle mosaic virus on Solanaceae Crops in China
LI YueYue1,5, ZHOU WenPeng1, LU SiQian1, CHEN DeRong1, DAI JianHong2, GUO QiaoYou2, LIU Yong3, LI Fan1, TAN GuanLin ,1,41
,1,41 2
3
4
5
通讯作者:
责任编辑: 岳梅
收稿日期:2019-08-7接受日期:2019-09-19网络出版日期:2020-02-01
| 基金资助: |
Received:2019-08-7Accepted:2019-09-19Online:2020-02-01
作者简介 About authors
李月月,E-mail:yuey_li@126.com。

摘要
关键词:
Abstract
Keywords:
PDF (2797KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李月月, 周文鹏, 路思倩, 陈德荣, 戴剑鸿, 郭乔优, 刘勇, 李凡, 谭冠林. 番茄斑驳花叶病毒在我国茄科作物上的发生及生物学特性[J]. 中国农业科学, 2020, 53(3): 539-550 doi:10.3864/j.issn.0578-1752.2020.03.007
LI YueYue, ZHOU WenPeng, LU SiQian, CHEN DeRong, DAI JianHong, GUO QiaoYou, LIU Yong, LI Fan, TAN GuanLin.
0 引言
【研究意义】番茄斑驳花叶病毒(Tomato mottle mosaic virus,ToMMV)为近几年发现的烟草花叶病毒属(Tobamovirus)的一种新成员,该病毒的致病力比同属的烟草花叶病毒(Tobacco mosaic virus,TMV)和番茄花叶病毒(Tomato mosaic virus,ToMV)均强,且自该病毒首次被发现以来,已在越来越多的国家被发现。尽快了解和掌握ToMMV目前在我国的发生情况、分布地区和自然寄主,以及病毒的寄主范围和传播方式等生物学特性对ToMMV的预测防控具有重要意义。【前人研究进展】ToMMV是2013年首次在墨西哥番茄(Solanum lycopersicum)上发现的Tobamovirus一个新种[1],同年笔者实验室在我国西藏自治区拉萨市和云南省元谋县的辣椒(Capsicum annuum)上也发现了该病毒,并于2014年进行了报道[2]。2015—2019年美国的弗罗里达和纽约[3,4]、以色列[5]、西班牙[6]、巴西[7]、中国[8,9]等相继报道了番茄上ToMMV的侵染。2018年我国山东、河南、辽宁和河北的茄子(Solanum melongena)上也报道了ToMMV的侵染[10]。GenBank中已公布的来自伊朗的病毒分离物HQ593616、JX112024、JX112025、JX121570、JX121574、JX121575、JX121576,来自巴西的病毒分离物AF411922、AM411425、AM411430[11]以及中国病毒分离物JX025564在ToMMV被鉴定成为一个新种之前,均被认为是ToMV,而根据核苷酸序列的同源性比对结果,发现这些病毒分离物外壳蛋白(coat protein,CP)基因的核苷酸序列与ToMMV的同源性在97.7%—99.2%,所以这些ToMV分离物应该也是ToMMV,其中2003年在巴西发现的番茄分离物(AF41192)可能是第一个被发现的ToMMV分离物。这些病毒分离物有的来自番茄(AF411922、JX025564、JX112024、JX112025、JX121575和JX121576),有的来自辣椒(AM411425、AM411430和JX121574),有的来自菜豆(Phaseolus vulgaris)(JX121570),还有的来自墙生藜(Chenopodium murale)(HQ593616)。由此推断,ToMMV很可能早就在国内外很多地区发生,而且可能是侵染茄科作物的主要病毒之一,除了茄科作物外,ToMMV还可以侵染豆科和藜科作物,只是由于被误认为是与ToMMV全基因组序列同源性达84.3%的ToMV而被忽略[8,12]。将ToMMV人工接种至辣椒、番茄、烟草等茄科作物上,感病植株表现严重花叶、泡斑、畸形、坏死,生长期缩短,比同一环境下接种TMV的植物表现症状更为严重[12]。SUI等[13]通过人工接种,将ToMMV和ToMV分别接种至7科27种植物上,发现ToMMV可以侵染茄科大部分植物,比ToMV的寄主范围更广,侵染性更强,ToMMV可以系统性侵染珊西烟(Nicotiana tabacum var. Xanthi nc)和曼陀罗(Datura stramonium),但ToMV在珊西烟和曼陀罗上无明显症状,且有些对ToMV有抗性的番茄品种却可以被ToMMV系统性侵染;AMBRÓS等[6]将ToMMV西班牙分离物人工接种到番茄、辣椒、本氏烟(N. benthamiana)、昆诺藜(Chenopodium quinoa)和拟南芥(Arabidopsis thaliana)等植物上,发现ToMMV对这些接种植物均可侵染,除拟南芥外,其余几种植物发病症状均比较明显。【本研究切入点】虽然ToMMV及其引起的病毒病目前在中国尚未出现大发生及流行,但是一旦具备合适的气候、感病品种等有利于病害发生的条件,ToMMV很有可能会在茄科作物上大面积发生,而一旦暴发,对茄科作物造成的损失将非常严重。近年来番茄褪绿病毒(Tomato chlorosis virus,ToCV)在我国多地暴发流行并造成巨大经济损失的案例[14,15,16,17,18],显示对新发病害前期基础研究不够充分带来的严重后果,因此,亟需加强对ToMMV的研究以防范其在我国的流行危害。【拟解决的关键问题】全面普查我国13个省(自治区)尤其是云南省主要茄科作物上ToMMV的发生与分布,测试ToMMV的寄主范围和传播方式,开展不同辣椒和番茄材料对ToMMV的抗性鉴定,并分析ToMMV在国内的发生趋势,为该病毒的预防及综合防控提供理论依据。1 材料与方法
1.1 供试材料
1.1.1 样本来源 ToMMV检测的样品为2013年4月至2017年10月,在我国云南、贵州、四川、湖南、海南、河南、陕西、山东、湖北、浙江、辽宁、西藏和内蒙古13个省(自治区)采集/收集的表现为花叶、皱缩、畸形、黄化、坏死等疑似病毒病症状的茄科作物样品1 622份,其中辣椒样品958份、番茄样品520份、茄子样品19份、马铃薯(Solanum tuberosum)样品50份、烟草样品75份。ToMMV初始毒源为感染ToMMV单一病毒的辣椒样品,后期寄主范围测定毒源为再次接种至珊西烟进行扩繁的珊西烟样品。所有采集的样品均于-80℃或-20℃超低温冰箱中保存备用。1.1.2 ToMMV传播方式测定材料 摩擦和注射鉴定材料为健康的黄花烟(N. rustica)和珊西烟;种传鉴定材料为自然条件下感染ToMMV的辣椒种子、ToMMV接种并感病的珊西烟种子;土传鉴定材料为健康的辣椒和番茄种子、灭菌无毒土壤,培育过感染了ToMMV的辣椒和番茄植株且检测到ToMMV的土壤。
1.1.3 ToMMV寄主范围测定供试植物 茄科的辣椒、番茄、茄子、马铃薯、普通烟(N. tobacum)、本氏烟、黄花烟、珊西烟、三生烟(N. tabacum var. Samsun)、心叶烟(N. glutinosa)、矮牵牛(Petunia hybrida)、酸浆(Physalis alkekengi)、假酸浆(Nicandra physaloides)、曼陀罗;十字花科的大白菜(Brassica pekinensis)、青菜(B. chinensis)、青花菜(B. oleacea var. italica)、花椰菜(B. oleracea var. botrytis)、油菜(B. campestris)、萝卜(Raphanus sativus);葫芦科的西葫芦(Cucurbita pepo)、黄瓜(Cucumis sativus)、南瓜(Cucurbita moschata)、丝瓜(Luffa cylindrica)、苦瓜(Momordica charantia);豆科的菜豆、豇豆(Vigna unguiculata)、豌豆(Pisum sativum);旋花科的蕹菜(Ipomoea aquatica),藜科的昆诺藜,共6科30种植物。
1.1.4 辣椒和番茄抗性鉴定供试材料 接种测试的辣椒材料有10份,分别为当前云南市场所售和实验室收集保存,其中韩国原种朝天椒、8819线椒、金满田II号、丘北辣、日本朝天椒、日本高抗天鹰椒、新陇2号和甜椒王这8个品种为云南市场所售,野生小辣椒和小米辣为笔者实验室在云南当地所收集。接种测试的番茄材料共10份,为湖南省农业科学院蔬菜研究所张战泓研究员提供,分别为T596小樱桃、钻红1号、T3108、TM40456、T3068粉果、T808、TM3167、宝石F1、T367和T364。
1.1.5 试剂 反转录(RT)试剂盒TaKaRa Reverse Transcriptase M-MLV(RNase H-)、PCR扩增试剂盒TaKaRa TaqTM以及克隆连接载体pMD19-T simple Vector购自宝生物工程(大连)有限公司;DNA纯化回收试剂盒Universal DNA Purification Kit购自天根生化科技(北京)有限公司。E. coli DH5α菌株为笔者实验室保存。
1.2 试验方法
1.2.1 总核酸提取、RT-PCR扩增 利用CTAB法,从疑似病毒病样本中提取病株总核酸[19]。其中土壤样本总核酸的提取也采用CTAB法,但不宜采用高通量组织研磨仪,应在灭菌的研钵中加入液氮进行研磨,将研磨后的土壤粉末加入1.5 mL灭菌离心管1/3处,加入1.2 mL CTAB缓冲液(含0.2% β-巯基乙醇);混匀后离心管放入65℃水浴中保温45—60 min,保温过程中不时颠倒离心管充分混匀;水浴完成后,4℃,13 000 r/min离心10 min,取650 µL上清液至一新的1.5 mL灭菌离心管中,按1﹕1比例加入氯仿/异戊醇(24﹕1),涡旋振荡混匀30 s;之后再次4℃,13 000 r/min离心10 min,取500 µL上清液至一新的1.5 mL灭菌离心管中,加入350 µL异丙醇,反复颠倒数次,室温放置10 min后4℃,13 000 r/min离心15 min,小心地用微量移液器吸除上清丢弃;最后向沉淀中加入75%乙醇1 mL,4℃,13 000 r/min离心10 min,小心地用微量移液器吸除上清丢弃,室温下自然干燥10—30 min,至沉淀完全干燥;干燥后根据沉淀的量加入适量(70—100 µL)ddH2O至核酸沉淀,置于冰上30 min后离心振荡使沉淀充分溶解,于-20℃冰箱保存备用。以提取的样品总核酸为模板,使用Reverse Transcriptase M-MLV(RNase H-)试剂盒反转录合成病毒cDNA,检测引物为ToMMV特异性检测引物ToMMVdF(CTGGAGAAGACTGGGTCTAG)/ToMMVdR(TTCGGTAAGTTCAATGGGACCT)。反转录(10 μL体系)方法:将含2 μL核酸模板、1 μL下游引物ToMMVdR、3 μL ddH2O的混合样混匀后,70℃下反应10 min,迅速拿出,置冰上冷却3 min,依次加入含2 μL 5×M-MLV Buffer、0.5 μL dNTP Mixture(10 mmol·L-1 each)、0.5 μL RTase M-MLV(RNase H-)和1 μL ddH2O的混合液,42℃反应1 h,70℃下15 min终止反应。PCR(10 μL)反应体系:上述合成的cDNA模板1 μL、6.7 μL ddH2O,1 μL 10×PCR Buffer(Mg2+ plus)、0.8 μL dNTP Mixture(2.5 mmol·L-1 each)、上游引物ToMMVdF和下游引物ToMMVdR各0.2 μL,0.1 μL TaKaRa Taq。反应程序:94℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,循环35次;72℃延伸10 min;4℃终止反应。反应产物经1%琼脂糖凝胶电泳后在紫外灯下观察结果。
1.2.2 克隆和测序 参照DNA纯化回收试剂盒说明书割胶纯化目标PCR产物,回收目的片段与载体pMD19-T simple连接,转化E. coli DH5α,菌落PCR筛选阳性克隆。阳性克隆测序由华大基因科技有限公司完成,测序结果提交NCBI核酸数据库进行BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)序列比对分析。
1.2.3 生物学接种 当供试植物幼苗在4—5片真叶期时用常规摩擦接种方法和注射接种方法分别进行接种。注射接种方法:用PBS缓冲液(NaCl 136 mmol·L-1,KCl 2.7 mmol·L-1,Na2HPO4·12H2O 8 mmol·L-1,KH2PO4 1.5 mmol·L-1,pH 7.2)浸泡ToMMV染病叶片1 h后充分研磨,6 000 r/min稍离心后取上清,接种前先用1 mL注射器针头在接种植株叶片扎孔数个,注射器吸取上清后从叶片背面轻轻注射,注射时按住注射孔另一端以免溢出。
1.2.4 ToMMV种传和土传测试 种传测试方法:对感染ToMMV的珊西烟获得的种子进行ToMMV检测,并对土壤进行高温高压灭菌和ToMMV检测以确保土壤不带毒,将检测后确定携带ToMMV的珊西烟种子150粒播种到不含ToMMV的灭菌土壤上,播种30 d后,对珊西烟幼苗进行ToMMV检测。土传测试方法:对辣椒、番茄种子及培育过感染ToMMV的辣椒和番茄植株的土壤(可能含ToMMV病残体)分别进行ToMMV检测,在确定辣椒和番茄种子不携带ToMMV而土壤中含有ToMMV后,将健康的辣椒和番茄种子播种到含有ToMMV的土壤中,待辣椒和番茄幼苗长至6—8叶期,对其进行ToMMV检测。
1.2.5 辣椒和番茄种质资源对ToMMV的抗/感性鉴定 ToMMV为Tobamovirus的新成员,目前尚无对其病级划分标准和抗性鉴定等相关技术规程,因此本文中辣椒和番茄对ToMMV抗性鉴定的病级划分标准和抗性鉴定技术规程均分别参考中华人民共和国农业行业标准NY/T 2060.3—2011辣椒抗病性鉴定技术规程第3部分的辣椒抗烟草花叶病毒病鉴定技术规程和NY/T 1858.6—2010番茄主要病害抗病性鉴定技术规程第6部分的番茄抗番茄花叶病毒病鉴定技术规程。病情指数DI=100×∑(病级值×该病情级别的植株数)/(最高病级值×调查总植株数)。根据抗病程度分为免疫(I)、高抗(HR)、抗病(R)、中抗(MR)、感病(S)、高感(HS)6大类,辣椒抗性鉴定结果对应的病情指数(DI)分别为DI=0、0<DI<10、10≤DI<20、20≤DI<40、40≤DI<60、60≤DI<100;番茄抗性鉴定结果对应的病情指数分别为DI=0、0<DI<10、10≤DI<30、30≤DI<50、50≤DI<70、70≤DI<100。依据鉴定材料3次重复的DI平均值确定其抗性水平。
2 结果
2.1 ToMMV在我国的发生情况及分布
在我国13个省(区)尤以云南省为主采集的1 622份茄科疑似病毒病样品中,ToMMV的平均检出率为2.59%,共在7个省(区)有发生,分别为云南、湖南、海南、辽宁、陕西、西藏和内蒙古。在辣椒样品中共检测到感染ToMMV的样品24份,在番茄样品中共检测到感染ToMMV的样品18份,在茄子、马铃薯和烟草样品中均尚未检测到ToMMV的侵染。根据所收集样品的病毒检测结果,目前ToMMV主要在我国的辣椒和番茄上发生。2.1.1 ToMMV在辣椒上的发生情况 共在全国13个省(区)采集辣椒疑似病毒病样品958份,ToMMV在所有辣椒样品中的平均检出率为2.51%,发生地区为云南、湖南、西藏、陕西以及海南(表1),其中在云南省楚雄州的元谋县、红河州蒙自市、玉溪市澄江县和峨山县等多个地区有发生。在云南采集的样品数较多,而其他地区由于样品采集地区范围窄、数量少,ToMMV的检出率反而较高。受ToMMV侵染的辣椒主要表现症状为斑驳、花叶、坏死和皱缩,不同地区或不同品种辣椒上表现症状有一定的差异。
Table 1
表1
表1我国13个省(区)辣椒样品ToMMV检测结果
Table 1
| 采样地区Sampling area | 样品采集数Sampling number | 检出数Number of positive | 检出率Detection rate (%) |
|---|---|---|---|
| 云南Yunnan | 847 | 17 | 2.01 |
| 湖南Hunan | 4 | 4 | 100.00 |
| 西藏Tibet | 7 | 1 | 14.29 |
| 陕西Shaanxi | 9 | 1 | 11.11 |
| 海南Hainan | 12 | 1 | 8.33 |
| 贵州Guizhou、湖北Hubei、河南Henan、山东Shandong、辽宁Liaoning、内蒙古Inner Mongolia、浙江Zhejiang、四川Sichuan | 79 | 0 | 0 |
| 总检出率Total detection rate (%) | 958 | 24 | 2.51 |
新窗口打开|下载CSV
2.1.2 ToMMV在番茄上的发生情况 共在全国8个省(区)采集番茄样品520份,ToMMV在所有番茄样品中的平均检出率为3.46%,发生地区为云南、辽宁、内蒙古及海南(表2)。受ToMMV侵染的番茄主要表现症状为斑驳、黄化、坏死、畸形、泡斑等,同样,不同地区或不同品种番茄的表现症状也有一定的差异。
Table 2
表2
表2我国8个省(区)番茄样品ToMMV检测结果
Table 2
| 采样地区Sampling area | 样品采集数Sampling number | 检出数Number of positive | 检出率Detection rate (%) |
|---|---|---|---|
| 云南Yunnan | 446 | 5 | 1.12 |
| 辽宁Liaoning | 8 | 6 | 75.00 |
| 内蒙古 Inner Mongolia | 6 | 2 | 33.33 |
| 海南 Hainan | 17 | 5 | 29.41 |
| 陕西Shaanxi、山东Shandong、西藏Tibet、河南Henan | 43 | 0 | 0 |
| 总检出率Total detection rate (%) | 520 | 18 | 3.46 |
新窗口打开|下载CSV
2.2 ToMMV的传播方式
2.2.1 ToMMV可通过摩擦和注射方式进行传播 通过PBS缓冲液摩擦或注射接种方式,将ToMMV分别接种到健康的黄花烟和珊西烟上,接种30 d后,供试的黄花烟表现出泡斑、皱缩、系统性坏死斑等症状(图1-A、1-C),珊西烟表现出花叶、泡斑、皱缩、畸形、线形叶的症状(图1-B、1-D),且在接种植株上均检测到ToMMV,说明ToMMV可以通过摩擦和注射接种的方式进行传播。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1ToMMV接种黄花烟和珊西烟的症状
A:摩擦接种黄花烟N. rustica infected by mechanical inoculation;B:摩擦接种珊西烟N. tabacum var. Xanthi nc infected by mechanical inoculation;C:注射接种黄花烟N. rustica infected by injection;D:注射接种珊西烟N. tabacum var. Xanthi nc infected by injection
Fig. 1Sympotoms on N. rustica and N. tabacum var. Xanthi nc inoculated with ToMMV
2.2.2 ToMMV可通过珊西烟种子进行传播 收集田间感染了ToMMV的辣椒种子和温室条件下ToMMV接种发病的珊西烟种子,将这些种子提取核酸进行ToMMV检测,在种子上均能检测到ToMMV(图2)。为了进一步验证携带ToMMV的珊西烟种子是否可以将病毒传递到种苗,将感染ToMMV的珊西烟种子在无毒土壤中进行育苗,并对种苗系统叶进行ToMMV检测。共检测种苗122株,检出带毒种苗48株,平均检出率为39.34%。其中同一生育时期长势较好、长势一般、长势较差的种苗中,ToMMV的检出率分别为23.26%、42.86%和56.67%。说明携带ToMMV的珊西烟种子可以将ToMMV垂直传播到烟苗,且传毒效率较高。另外,出苗时种子携带ToMMV的比率越高,对种苗的生长影响越大。
图2
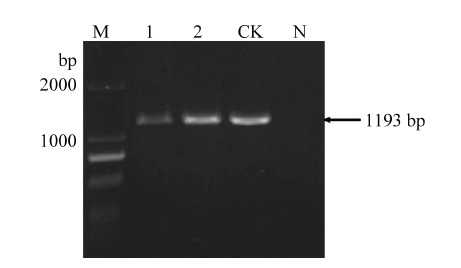 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2感病珊西烟种子的ToMMV检测结果
M:DL 2000 Marker;1、2:感病珊西烟种子Seeds of N. tabacum var. Xanthi nc infected with ToMMV;CK:ToMMV阳性对照ToMMV positive control;N:阴性对照(健康烟种子)Negative control (healthy tobacco seeds)
Fig. 2ToMMV detection results of N. tabacum var. Xanthi nc seeds infected with ToMMV
2.2.3 ToMMV可通过土壤进行传播 分别随机挑选8个品种的辣椒、番茄种子进行ToMMV检测,结果显示这些辣椒和番茄种子均未携带ToMMV,为健康的种子(图3-A)。同时对培育过感染ToMMV植株的土壤进行ToMMV检测,确认土壤中含有ToMMV(图3-B)。用含ToMMV的土壤对健康无毒的辣椒和番茄种子进行育苗,并对苗期的辣椒和番茄进行ToMMV的检测,在辣椒和番茄的种苗上均检测到ToMMV,检出率分别为80%和78.79%,说明ToMMV可以通过土壤进行传播,且传毒效率非常高。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3健康种子和带毒土壤中ToMMV的检测结果
A:健康辣椒、番茄种子中ToMMV的检测ToMMV detection of the healthy pepper and tomato seeds,M:DL 2000 Marker;1—8:健康辣椒种子Healthy pepper seeds;9—16:健康番茄种子Healthy tomato seeds;CK:ToMMV阳性对照ToMMV positive control。B:土壤中ToMMV的检测ToMMV detection in the soil,M:DL 2000 Marker;1—3:带毒土壤Soil pre-grew ToMMV-infected plants;N:无毒灭菌土壤Sterilized soil;CK:ToMMV阳性对照ToMMV positive control
Fig. 3ToMMV detection results from the healthy pepper and tomato seeds as well as the soil pre-grew ToMMV-infected plants
2.3 ToMMV的寄主范围
通过摩擦和注射接种,将ToMMV分别接种到茄科作物辣椒、番茄、茄子、马铃薯、普通烟、本氏烟、黄花烟、珊西烟、三生烟、心叶烟、矮牵牛、酸浆、假酸浆、曼陀罗;十字花科作物大白菜、青菜、青花菜、花椰菜、油菜、萝卜;葫芦科作物西葫芦、黄瓜、南瓜、丝瓜、苦瓜;豆科作物菜豆、豇豆、豌豆;旋花科蕹菜及藜科的昆诺藜6个科30种植物上。接种20 d后,用ToMMV检测引物进行RT-PCR检测,在茄科的辣椒、番茄、茄子、马铃薯、普通烟、本氏烟、黄花烟、珊西烟、三生烟、心叶烟、矮牵牛、酸浆、假酸浆,十字花科的大白菜、青菜、青花菜、花椰菜、油菜、萝卜,葫芦科的西葫芦、黄瓜和南瓜,以及豆科的菜豆这4个科23种供试植株中检测到ToMMV(表3)。感染ToMMV的茄科植株发病症状均比较明显,主要为斑驳、花叶和泡斑,严重的伴随有畸形、坏死(图4-A—C);感染ToMMV的菜豆叶片有斑驳、坏死症状,豆角上有坏死症状(图4-D),将豆荚和豆粒进行ToMMV特异性检测,均可以检测到ToMMV;而感染ToMMV的十字花科和葫芦科植株的症状不明显,主要为褪绿或轻斑驳(图4-E、4-F)。Table 3
表3
表3供试植株接种ToMMV后的症状表现及ToMMV的RT-PCR检测结果
Table 3
| 供试植株所属科 Family of tested plants | 供试植株 Tested plant | 表现症状 Symptom | RT-PCR检测结果 Results of RT-PCR |
|---|---|---|---|
| 茄科 Solanaceae | 辣椒Capsicum annuum | 花叶Mosaic、黄化Yellowing、坏死Necrosis、皱缩Shrinking | + |
| 番茄Solanum lycopersicum | 花叶Mosaic、泡斑Blistering、畸形Distortion、线形叶Leaf narrowing | + | |
| 茄子Solanum melongena | 斑驳Mottle、坏死Necrosis | + | |
| 马铃薯Solanum tuberosum | 斑驳Mottle、黄化Yellowing、坏死Necrosis | + | |
| 普通烟Nicotiana tobacum | 花叶Mosaic | + | |
| 本氏烟N. benthamiana | 褪绿Chlorosis、黄化Yellowing | + | |
| 黄花烟N. rustica | 泡斑Blistering、畸形Distortion、坏死Necrosis | + | |
| 珊西烟N. tabacum var. Xanthi nc | 花叶Mosaic、泡斑Blistering、畸形Distortion、线形叶Leaf narrowing | + | |
| 三生烟N. tabacum var. Samsun | 花叶Mosaic、线性叶Leaf narrowing | + | |
| 心叶烟N. glutinosa | 坏死斑Necrosis spot | + | |
| 矮牵牛Petunia hybrida | 泡斑Blistering、畸形Distortion | + | |
| 酸浆Physalis alkekengi | 褪绿Chlorosis、斑驳Mottle | + | |
| 假酸浆Nicandra physaloides | 花叶Mosaic | + | |
| 曼陀罗Datura stramonium | 无症状No symptom | - | |
| 十字花科 Cruciferae | 大白菜Brassica pekinensis | 褪绿Chlorosis、轻斑驳Mild mottle | + |
| 青菜B. chinensis | 褪绿Chlorosis、轻斑驳Mild mottle | + | |
| 青花菜B. oleacea var. italica | 症状不明显No obvious symptom | + | |
| 花椰菜B. oleracea var. botrytis | 症状不明显No obvious symptom | + | |
| 油菜B. campestris | 轻斑驳Mild mottle | + | |
| 萝卜Raphanus sativus | 轻斑驳Mild mottle | + | |
| 葫芦科 Cucurbitaceae | 西葫芦Cucurbita pepo | 褪绿Chlorosis、轻斑驳Mild mottle | + |
| 黄瓜Cucumis sativus | 症状不明显No obvious symptom | + | |
| 南瓜Cucurbita moschata | 症状不明显No obvious symptom | + | |
| 丝瓜Luffa cylindrica | 无症状No symptom | - | |
| 苦瓜Momordica charantia | 无症状No symptom | - | |
| 豆科 Leguminosae | 菜豆Phaseolus vulgaris | 斑驳Mottle、坏死Necrosis | + |
| 豇豆Vigna unguiculata | 无症状No symptom | - | |
| 豌豆Pisum sativum | 无症状No symptom | - | |
| 旋花科 Convolvulaceae | 蕹菜Ipomoea aquatica | 无症状No symptom | - |
| 藜科 Chenopodiaceae | 昆诺藜Chenopodium quinoa | 无症状No symptom | - |
新窗口打开|下载CSV
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4部分供试植株接种ToMMV后的症状
A:辣椒上花叶、黄化、坏死、皱缩症状Mosaic, yellowing, necrosis and shrinking symptoms on Capsicum annuum;B:番茄上花叶、泡斑、畸形、线形叶症状Mosaic, blistering, distortion and leaf narrowing symptoms on Solanum lycopersicum;C:马铃薯上黄化、坏死症状Yellowing and necrosis symptoms on Solanum tuberosum;D:四季豆上斑驳、坏死症状Mottle and necrosis symptoms on Phaseolus vulgaris;E:油菜上褪绿、轻斑驳症状Chlorosis and mild mottle symptoms on Brassica campestris;F:西葫芦上斑驳症状Mottle symptom on Cucurbita pepo
Fig. 4Symptoms on some tested plants inoculated with ToMMV
2.4 不同辣椒、番茄材料对ToMMV的抗/感性鉴定
将ToMMV毒源样品分别以摩擦和注射两种方式接种到供试的辣椒和番茄植株上,21 d后对接种植株进行症状观察,记录每株接种植株的发病情况,并采样进行ToMMV检测。每份材料重复3次。2.4.1 辣椒材料对ToMMV的抗/感性 10份辣椒材料共接种193株,接种的辣椒中感病的植株多生长缓慢但发病症状较轻,多数表现为轻斑驳,少数有严重花叶、畸形和坏死。病情级别多为3级和5级,少部分为7级。鉴定的这10份辣椒材料中,大多为抗性品种,其中野生小辣椒为对ToMMV免疫的品种,小米辣和韩国原种朝天椒为高抗品种,8819线椒、金满田Ⅱ号和丘北辣为抗病品种,日本朝天椒和日本高抗天鹰椒为中抗品种,新陇2号为感病品种,甜椒王为高感品种(表4)。
Table 4
表4
表4辣椒、番茄材料对ToMMV的抗/感性表现
Table 4
| 供试植株 Tested plant | 品种 Variety | 发病率 Incidence (%) | 病情指数 Disease index (DI) | 抗性评价 Evaluation of resistance level |
|---|---|---|---|---|
| 辣椒 Pepper | 野生小辣椒Wild little pepper | 0 | 0 | 免疫I |
| 小米辣Spicy millet | 8.33 | 6.48 | 高抗HR | |
| 韩国原种朝天椒Korea pod pepper | 20.00 | 7.78 | 高抗HR | |
| 8819线椒8819 string-pepper | 30.77 | 15.38 | 抗病R | |
| 金满田Ⅱ号Jinmantian Ⅱ | 32.00 | 16.00 | 抗病R | |
| 丘北辣 Qiubei pepper | 34.15 | 18.43 | 抗病R | |
| 日本朝天椒 Japan pod pepper | 38.10 | 21.16 | 中抗MR | |
| 日本高抗天鹰椒Japan highly resistant tianying pepper | 50.00 | 25.56 | 中抗MR | |
| 新陇2号 Xinlong 2 | 100.00 | 54.25 | 感病S | |
| 甜椒王Sweet pepper king | 90.00 | 61.11 | 高感HS | |
| 番茄 Tomato | T596小樱桃T596 little cherry | 35.85 | 3.98 | 高抗HR |
| 钻红1号Zuan hong 1 | 38.64 | 8.84 | 高抗HR | |
| T3108 | 50.00 | 16.18 | 抗病R | |
| TM40456 | 65.31 | 23.13 | 抗病R | |
| T3068粉果T3068 pink tomato | 64.44 | 28.40 | 抗病R | |
| T808 | 76.09 | 35.02 | 中抗MR | |
| TM3167 | 61.36 | 35.61 | 中抗MR | |
| 宝石F1 Baoshi F1 | 85.71 | 42.86 | 中抗MR | |
| T367 | 89.47 | 57.89 | 感病S | |
| T364 | 91.84 | 70.52 | 高感HS |
新窗口打开|下载CSV
2.4.2 番茄材料对ToMMV的抗/感性 10份番茄材料中共接种428株,接种的番茄品种中感病植株多数症状为斑驳,一部分为花叶,一部分为蕨叶或线形叶,少数为黄化、坏死。病情级别多为3级和5级,一部分为7级,极少数为9级。高抗的番茄品种有少数植株可以被ToMMV侵染,但无明显症状,高感的番茄品种表现症状多为花叶、泡斑、畸形、线形叶和坏死。供试番茄种质资源中尚无对ToMMV免疫的品种,10份材料均可以感染ToMMV,其中T596小樱桃和钻红1号仅有个别接种植株感病,且无症状表现,为高抗品种,T3108、TM40456和T3068粉果为抗病品种,T808、TM3167、宝石F1为中抗品种,T367为感病品种,T364为高感品种。仅从发病率来看,接种ToMMV的10份番茄材料发病率均较高,说明番茄易被ToMMV感染(表4)。
3 讨论
本研究对我国13个省(区)的茄科作物进行了ToMMV特异性检测,并结合目前我国对ToMMV的相关报道发现,自2014年首次报道了ToMMV在我国辣椒上的侵染[2],短短几年,我国辣椒、番茄和茄子上均已发现了ToMMV的侵染,在云南、湖南、海南、辽宁、陕西、西藏、内蒙古、山东、河南、河北10个省(区)均已有ToMMV的发生[8-10,12]。2013年仅在云南和西藏的辣椒上检测到ToMMV[2],2015—2016年又在湖南和云南的辣椒上检测到ToMMV[12],2017年在云南、海南、内蒙古以及辽宁的番茄上检测到ToMMV[9],同年相继在云南、陕西、海南的辣椒上检测到ToMMV,其中先后在云南元谋县、蒙自县、澄江县和峨山县等多个地区检测到ToMMV。2018年国内其他课题组也相继报道了ToMMV在海南、山东、河南和河北的发生[8,10],尤其是在海南番茄上发生比较严重。在国际上,自2013年首次在墨西哥番茄上报道了ToMMV的侵染后,相继在我国的辣椒上[2],美国的弗罗里达和纽约等地区[3,4],以色列北部[5],西班牙巴伦西亚[6],巴西圣保罗[7],我国番茄[8,9]、茄子上[10]报道了ToMMV的侵染。这些结果表明,ToMMV正在经历由点到面的发展、扩散,正在由最初的番茄向其他植物扩散,有发生流行的趋势,很有可能像ToCV一样,形成大面积暴发。ToCV自2013年在北京和山东发生以来[20,21],短短几年已从北京和山东扩散到河北、天津、陕西、甘肃、广东、山西、内蒙古、辽宁、吉林、云南等地[14-18,20-25],其中ToCV于2016年才在陕西、广东和云南被发现,但是已经在这些省份的局部地区造成番茄绝产等严重损失[15,17-18]。因此,应采取相关措施,提早防范ToMMV在我国的发生流行。本研究对ToMMV的寄主范围鉴定结果表明,ToMMV可侵染茄科、十字花科、豆科和葫芦科作物,几乎供试的茄科和十字花科植株均可以被ToMMV侵染,而部分豆科和葫芦科的作物可以被侵染。ToMMV在茄科作物上的表现症状较其他科作物严重,由此可见,ToMMV很可能会成为侵染茄科作物的潜在重要病毒之一。除茄科作物外,人工接种实验发现ToMMV能被接种在十字花科、豆科和葫芦科等植物上,但在云南省检测了十字花科、豆科、葫芦科等非茄科作物样品940份,均未发现ToMMV的感染(相关数据未展示),推测可能与采集样品的数量和地域有限有关,不排除ToMMV目前在我国除番茄、辣椒和茄子外的其他植物上的发生,ToMMV对这些植物依然存在潜在的威胁。Tobamovirus属中与该病毒亲缘关系较近的ToMV寄主范围很广,能够侵染茄科、十字花科、豆科、禾本科、藜科等多种植物[26],因此推测比ToMV侵染性更强的ToMMV的寄主范围应该也很广[13],下一步还需要更广泛的测试供试寄主,为探寻ToMMV的初侵染源、侵染循环以及抗病育种等提供依据。
Tobamovirus病毒中已被证实可种传的病毒有TMV、ToMV、辣椒轻斑驳病毒(Pepper mild mottle virus,PMMoV)、烟草轻绿花叶病毒(Tobacco mild green mosaic virus,TMGMV)、黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)等[27,28,29],其中CGMMV是我国禁止进境的检疫性有害生物[30],足以说明种传病毒在作物上的危害程度之大。本研究证实了ToMMV也可进行种传,且出苗时带毒率越高,对种苗的生长影响越大,再次证实了播种种子带毒率的高低直接影响该病害在田间的流行和危害的程度。本研究还发现健康的种子在混有ToMMV病残体的土壤中育出的苗也会带毒,证实了混有病残体的土壤也可以成为ToMMV的初侵染源。既可种传又能土传的病毒病是最难防治的病害之一,在实践生产中,育苗前除了应对种子进行抽样检测是否带毒,也应提取土样检测是否带毒。选择无病良种、加强对种子的消毒处理均能有效地降低种子传毒的概率,并应做好土壤的消毒工作和育苗期预防工作,以防止ToMMV的发生传播和蔓延。
病毒病的发生给作物的生产造成严重的经济损失,且一旦发生难以防控,最经济有效的防治措施是培育抗病品种。在病毒病的抗病育种研究方面,国内外已经有一些通过常规杂交和转基因技术获得抗病材料或品种的研究报道[31,32]。在病毒病的防控中,抗源材料的筛选十分重要,而优良品种的抗性鉴定对抗性基因的筛选及抗病品种的培育都具有重要的意义[33,34,35]。鉴于ToMMV较强的致病性,应全面开展茄科常见作物辣椒、番茄、茄子、马铃薯、烟草等种质资源抗ToMMV的筛选和鉴定,为抗ToMMV育种提供具有更高抗性水平的抗源材料,并加强ToMMV抗病基因的筛选鉴定等研究,通过相关技术达到有效防治番茄斑驳花叶病毒病的目的。
4 结论
目前Tobamovirus属新种ToMMV在我国多个地区的辣椒和番茄上有发生,且传播方式多样、寄主范围广、致病性强。可通过摩擦、注射、带毒种子和带毒土壤进行传播;在常见的茄科、十字花科、豆科和葫芦科作物上均可侵染,尤其是在茄科作物上的致病力较强。结果暗示ToMMV很可能会成为我国蔬菜作物尤其是茄科作物上危害严重的主要病毒之一,且正在经历由点到面的发展、扩散过程,有发生流行和不断向其他省(区)和作物扩散的趋势,应在ToMMV流行发生之前做好相关防控和抗病品种、抗病基因筛选鉴定等方面的工作。致谢:
湖南省植物保护研究所张松柏博士、西藏自治区农牧科学院相栋先生和王翠玲女士、中国热带农业科学院环境与植物保护研究所车海彦博士、西北农林科技大学郝兴安博士和刘欢博士、山东农业大学竺晓平教授、内蒙古农业大学李正男博士、长江大学章松柏博士等在样品收集中给予了大力支持和帮助;湖南省农业科学院蔬菜研究所张战泓研究员提供了番茄种质资源。在此一并表示感谢!参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 4]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 2]
[本文引用: 5]
[本文引用: 3]
[本文引用: 3]
[本文引用: 4]
[本文引用: 1]
[本文引用: 4]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
