 ,1, 杨金广
,1, 杨金广 ,2
,2Cloning of Hsc70-2 and Its Promoting Effect on Potato virus Y Infection in Nicotiana benthamiana
GONG MingYue1, DUAN XiaoTian1, YU TingTing1, WANG Jie2, SHEN LiLi2, LI Ying2, LIU MingHong3, LI YongLiang4, Lü HongKun5, ZHANG SongBai ,1, YANG JinGuang
,1, YANG JinGuang ,2
,2通讯作者:
责任编辑: 岳梅
收稿日期:2019-08-19接受日期:2019-09-18网络出版日期:2020-02-16
| 基金资助: |
Received:2019-08-19Accepted:2019-09-18Online:2020-02-16
作者简介 About authors
龚明月,E-mail:576092384@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (5763KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
龚明月, 段啸天, 余婷婷, 王杰, 申莉莉, 李莹, 刘明宏, 李永亮, 吕洪坤, 章松柏, 杨金广. 烟草Hsc70-2的克隆及对马铃薯Y病毒侵染烟草的促进作用[J]. 中国农业科学, 2020, 53(4): 771-781 doi:10.3864/j.issn.0578-1752.2020.04.009
GONG MingYue, DUAN XiaoTian, YU TingTing, WANG Jie, SHEN LiLi, LI Ying, LIU MingHong, LI YongLiang, Lü HongKun, ZHANG SongBai, YANG JinGuang.
0 引言
【研究意义】烟草马铃薯Y病毒病又称“烟草脉坏死病”或“烟草脉带病”,是由马铃薯Y病毒(Potato virus Y,PVY)侵染烟草引起的一种系统性侵染病害[1,2]。PVY于1931年由SMITH首次发现[3],属于马铃薯Y病毒属(Potyvirus)成员,是危害烟草、马铃薯、番茄、辣椒等茄科作物的一种病毒。马铃薯Y病毒属病毒为正链RNA病毒,分布广泛,几乎在全世界都有发生,尤其在热带和亚热带地区更为流行,给农业生产带来巨大损失[4]。因此,研究PVY的致病机制对于烟草马铃薯Y病毒病的防治具有重要意义。【前人研究进展】正链RNA病毒通过诱导宿主蛋白来促进其在受感染宿主中的高效复制。在模型RNA病毒——番茄丛矮病毒(Tomato bushy stunt virus,TBSV)致病机理的研究中发现,该病毒的复制酶复合物中含有热激蛋白70(heat shock protein 70,Hsp70),是TBSV复制所必需的一种丰富的细胞质伴侣,这种胞质Hsp70在TBSV复制过程中发挥着多种作用,如影响病毒复制蛋白的亚细胞定位和膜插入,以及病毒复制酶的组装[5]。并且通过蛋白质组学分析证明,Hsp70是TBSV病毒复制复合体(virus replication complex,VRC)的一种组成成分[6]。热激蛋白(Hsp)是植物细胞内重要的分子伴侣,该蛋白在进化上高度保守,按照分子量大小的不同分为6个家族,即Hsp110s、Hsp90s、Hsp70s、Hsp60s、小分子sHsps和泛素[7],其中研究最多的是Hsp70家族。根据热激蛋白70的表达类型,可分为组成型Hsc70和诱导型Hsp70,前者在正常条件下就有本底表达,以维持细胞正常生命活动的需要[8,9];而后者在受环境因素胁迫时诱导表达,以应付外界恶劣环境条件的威胁[10];Hsc70广泛分布于原核及真核生物细胞中,是维持生命活动的重要功能蛋白,具有多项生物学功能:协助新生蛋白的折叠,参与细胞内蛋白质的转运,参与免疫复合物的形成和分解及降解冗余蛋白[11,12]。【本研究切入点】Hsp70蛋白家族在多种病毒和寄主互作中的作用已有大量研究报道,而Hsc70对植物病毒尤其是对PVY侵染复制的影响并不明确。前期研究发现本氏烟(Nicotiana benthamiana)在PVY侵染后NbHsc70-2 mRNA水平显著上升,推测NbHsc70-2可能参与PVY的侵染过程。【拟解决的关键问题】以本氏烟为材料,通过开展生物信息学分析、亚细胞定位、组织特异性表达和基因功能验证等研究,探索NbHsc70-2在PVY侵染复制中的作用,为烟草抗马铃薯Y病毒病研究提供理论依据。1 材料与方法
试验于2018—2019年在中国农业科学院烟草研究所植物保护研究中心进行。1.1 植物材料与病毒
供试植物材料为本氏烟,本氏烟种子点播于混合土中(土壤﹕草炭= 1﹕1),于25℃人工气候室中培养,光周期为14 h光照/10 h黑暗,相对湿度为70%,试验采用5—6叶期烟苗。PVY毒源为中国农业科学院烟草研究所保存的N株系。取1 g PVY野生型毒源植株的叶片,放入提前灭菌消毒的研钵中,加入40 mL PBS缓冲液,研磨成浆并用纱布过滤除去叶片残渣获得悬浮液以备用;浸润PVY病毒汁液于本氏烟烟苗(4周)的第3—4片真叶,每片叶200 µL。
PVY-GFP属于PVY坏死株系(PVYN)的侵染性克隆,是通过无义突变在PVY侵染性克隆的P1与HC-pro间插入一个SacⅡ限制性内切酶酶切位点,并在该酶切位点中插入表达了外源绿色荧光蛋白(GFP)的重组病毒,该病毒能系统侵染本氏烟,病毒扩增至植株非接种部位而呈现荧光[13]。
1.2 NbHsc70-2的克隆与分析
本氏烟RNA提取按照TaKaRa RNAiso Plus(Total RNA 提取试剂)试剂盒手册进行,并反转录为cDNA(Vazyme),根据拟南芥中已报道的Hsc70核苷酸序列在美国本氏烟草数据库(https://solgenomics.net/ organism/nicotiana_benthamiana/genome)中比对得到一个描述为Heat shock 70 kD protein 基因(基因号:Niben101Scf00449g06008.1),根据该基因序列设计特异性引物NbHsc70-2 F/R(表1),以本氏烟cDNA为模板PCR扩增NbHsc70-2;PCR产物连接pEasy-Blunt Simple载体并转化E. coil感受态菌株(TaKaRa),阳性克隆委托派森诺生物科技有限公司测序;利用MEGA 6.0[14]进行核苷酸多序列比对分析后,基于最低的贝叶斯标准(Bayesian information criterion,BIC)确定最适合核苷酸替代模型为木村双参数模型(Kimura two-parameter model,K2P),应用于最大似然法(maximum-likelihood,ML)构建系统发育树。各分支的置信度通过1 000次自举抽样(bootstrapping)进行评估。Table 1
表1
表1试验中采用的引物及序列
Table 1
| 引物 Primer | 序列 Sequence (5′ to 3′) | 限制性内切酶 Restriction enzyme |
|---|---|---|
| NbHsc70-2 F | ATGCGTATTATTAACGAGCCTAC | |
| NbHsc70-2 R | TTAATCAACTTCCTCAATCTTAGGAC | |
| NbHsc70-2-XbaI F | CTTTAGATCTTCTAGAATGCGTATTATTAACGAGCCTACTG | XbaI |
| NbHsc70-2-KpnI R | ATATTAATGTCGACGGTACCATCAACTTCCTCAATCTTAGGACC | KpnI |
| RNAi NbHsc70-2 F | TAAGGTTACCGAATTCATTCTTTCAGGTGAGGGTAATGAG | EcoRI |
| RNAi NbHsc70-2 R | AGACGCGTGAGCTCGGTACCCAGGAGGAATACCAGAAAGTTC | KpnI |
| NbHsc70-2-AhdI F | AGCAGGCTTTGACTTTAGGTCATGCGTATTATTAACGAGCCTACTG | AhdI |
| NbHsc70-2-AhdI R | TGGGTCTAGAGACTTTAGGTCTTAATCAACTTCCTCAATCTTAGGA | AhdI |
| NbHsc70-2qRT-F | AGGCTCCACTAGGATTCCGAAGG | |
| NbHsc70-2qRT-R | AGTGACATCCAACAGCAACAGGTC | |
| PVY-CP-F | GATGAATGGGCTTATGGTTTGGTG | |
| PVY-CP-R | GATTTGCCTAAGGGTTGGTTTCG | |
| Actin-F | CAAGGAAATCACCGCTTTGG | |
| Actin-R | AAGGGATGCGAGGATGGA |
新窗口打开|下载CSV
1.3 NbHsc70-2蛋白的亚细胞定位
利用BaCelLo[15]和SignalP 4.0[16]进行NbHsc70-2的亚细胞定位和信号肽预测;根据NbHsc70-2序列设计不含有终止密码子的带XbaI/KpnI酶切位点的特异性引物NbHsc70-2-XbaI F/KpnI R(表1),并以本氏烟cDNA为模板进行PCR扩增,利用In-Fusion技术(TaKaRa)将产物与Fu46载体相连,构建NbHsc70-2::RFP融合基因,再利用LR同源重组技术(Invitrogen)将融合基因连接到pEarleyGate100载体,最终得到pEarleyGate100::NbHsc70-2::RFP载体;将含有pEarleyGate100::NbHsc70-2::RFP载体和pEarleyGate100::RFP载体的LBA4404农杆菌(OD600=0.8)浸润本氏烟下表皮,培养于25℃人工气候室中,光周期为14 h光照/10 h黑暗,相对湿度为70%,72 h后制片置于激光共聚焦显微镜(SP8,Leica)下观察明、暗视野下的表达情况。1.4 NbHsc70-2沉默载体的构建
根据NbHsc70-2基因序列,用Premier 5.0 设计一对含有限制性核酸内切酶EcoRI、KpnI的特异性引物RNAi NbHsc70-2 F/R(表1),PCR扩增大小为350 bp目的沉默片段,利用In-Fusion技术(TaKaRa)将产物与pTRV2载体相连,构建pTRV::NbHsc70-2重组载体;将含有pTRV::NbHsc70-2载体、pTRV::PDS及pTRV00空载体的LBA4404农杆菌(OD600=0.8)注射本氏烟下表皮,7 d后检测沉默效率,进行后续试验。1.5 NbHsc70-2瞬时过表达载体的构建
根据NbHsc70-2基因序列设计含有AhdI酶切位点的特异性引物NbHsc70-2-AhdI F/R(表1),并以本氏烟cDNA为模板进行PCR扩增,利用In-Fusion技术(TaKaRa)将产物与GWC载体相连,构建GWC::NbHsc70-2入门载体,再利用LR同源重组原理(Invitrogen)将入门载体连接到pEarleyGate100载体,最终得到pEarleyGate100::GWC::NbHsc70-2表达载体;提前24 h给本氏烟浸润PVY病汁液,将含有pEarleyGate100::GWC::NbHsc70-2表达载体和pEarleyGate100::GWC载体的LBA4404农杆菌(OD600=0.8)浸润本氏烟下表皮,48 h后开始采样检测PVY CP基因积累量。1.6 qRT-PCR与统计分析
根据不同样品中特定基因的基因序列设计各基因的荧光定量检测引物(表1),同时设置Actin作为内参。分别提取各取样时间点的处理组及对照组材料的总RNA(TaKaRa),反转录成cDNA(Vazyme)。以cDNA为模板,按照ChamQTM Universal SYBR® qPCR Master Mix(Vazyme)试剂盒说明书进行操作,在Applied Biosystems 7500 real-time PCR机型上进行扩增。反应体系:10 µL 2×ChamQ Universal SYBR qPCR Master Mix,0.4 µL Primer1(10 µmol·L-1),0.4 µL Primer2(10 µmol·L-1),2 µL cDNA,补蒸馏水至总体积20 µL。反应程序:95℃ 30 s;95℃ 5 s;60℃ 30 s;40循环;95℃ 15 s;60℃ 1 min,95℃ 15 s。相对表达量采用2-ΔΔCt法计算[17,18],使用7500 Software v2.3进行数据统计分析并使用GraphPad Prism6.0绘图。P<0.05表示差异显著,P<0.01表示差异极显著。2 结果
2.1 NbHsc70-2克隆与序列分析
根据拟南芥中已报道的Hsc70核苷酸序列在美国本氏烟草数据库中比对得到一个描述为Heat shock 70 kD protein基因(基因号:Niben101Scf00449g06008.1)。为鉴定Niben101Scf00449g06008.1基因,在NCBI(美国国立生物技术信息中心数据库)中比对发现Niben101Scf00449g06008.1与NaHsc70-2、NsHsc70-2、NtHsc70-2序列相似性最高,分别有69.07%、69.07%、68.25%核苷酸相似性,但NaHsc70-2、NsHsc70-2、NtHsc70-2的编码序列(coding sequence,CDS)均有1 953 bp,而Niben101Scf00449g06008.1基因的CDS序列中只有1 443 bp,因此推测Niben101Scf00449g06008.1基因CDS序列部分缺失,通过比对NCBI上已发表的Hsc70序列发现该基因非常保守,设计特异性引物,通过PCR扩增得到Niben101Scf00449g06008.1基因的完整CDS序列;将该CDS序列与NaHsc70-2、NsHsc70-2、NtHsc70-2序列进行比对,发现分别具有94.49%、94.49%、93.78%核苷酸相似性,对应的蛋白质间分别具有97.38%、97.38%、97.23%氨基酸相似性。通过获取与Niben101Scf00449g06008.1相似度高于96%的基因CDS序列,并用Clustal W进行核酸序列比对,利用ML算法构建系统发育树,结果均表明Niben101Scf00449g06008.1与NaHsc70-2关系最近(图1),暗示Niben101Scf00449g06008.1可能是Hsc70-2在本氏烟中的同源基因。从图2中可以看出,Niben101Scf00449g06008.1与NaHsc70-2蛋白氨基酸序列相似性最高,表明Niben101Scf00449g06008.1是Hsc70-2在本氏烟中的同源基因,命名为NbHsc70-2。图1
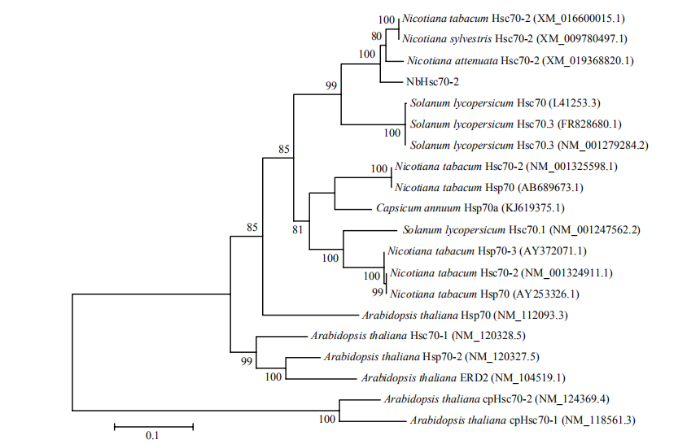 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1NbHsc70-2及其同源基因系统发育分析(ML算法)
Fig. 1Phylogenetic analyses of NbHsc70-2 and its homologues (ML algorithm)
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2NbHsc70-2、NaHsc70-2、NtHsc70-2及NsHsc70-2蛋白氨基酸序列比对分析
深蓝色表示氨基酸完全相同,浅蓝色表示有两个氨基酸不同,粉色表示有一个氨基酸不同 Dark blue indicates that the amino acids are identical, light blue indicates that there are two amino acids differences, and pink indicates that there is one amino acid difference
Fig. 2Amino acid sequences multiple alignment among NbHsc70-2, NaHsc70-2, NtHsc70-2 and NsHsc70-2
2.2 NbHsc70-2组织表达特异性
以Actin作为内参基因,利用qRT-PCR分别检测NbHsc70-2在本氏烟根、茎、叶中的表达情况。结果显示NbHsc70-2在叶中的相对表达量较高,在根和茎中的表达量很低,其中叶片相对表达量是根中的1.91倍(图3)。因此,后期试验均采集叶片样品进行研究。图3
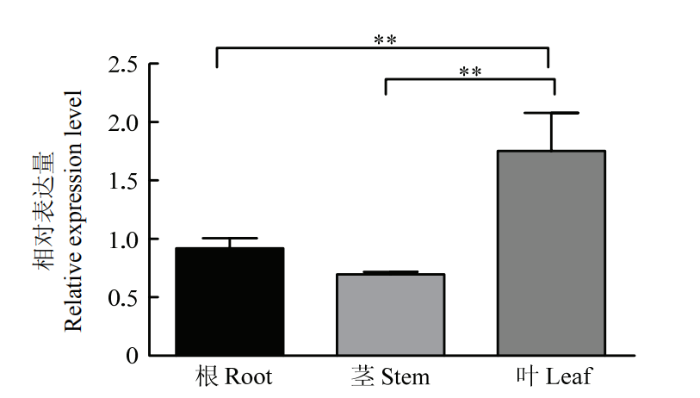 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3NbHsc70-2的组织表达特异性分析
取同一植株的不同组织样品进行分析Different tissue samples from the same plant were taken for analysis;误差线表示3组生物学重复的标准差,**表示差异极显著(P<0.01)。下同 Error bars indicate the standard deviations of three sets of biological replicates, and ** indicates that the difference is extremely significant (P<0.01). The same as below
Fig. 3Analysis of tissue expression specificity of NbHsc70-2
2.3 PVY侵染对NbHsc70-2的影响
采用qRT-PCR检测PVY侵染1、3 d后NbHsc70-2 mRNA水平的变化,结果显示PVY侵染后NbHsc70-2 mRNA水平明显上升,与对照相比,处理组1 d无明显差异,PVY处理3 d后NbHsc70-2 mRNA水平上调,处理组是对照组的9.24倍(图4),表明PVY侵染会引起NbHsc70-2 mRNA水平上调,暗示NbHsc70-2可能在PVY侵染过程中发挥重要作用。图4
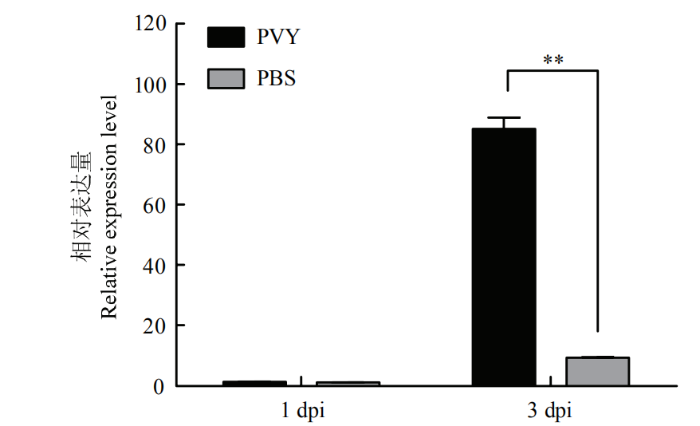 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4PVY侵染本氏烟后NbHsc70-2水平的变化
Fig. 4Gene accumulation of NbHsc70-2 after PVY infection in N. benthamiana
利用BaCelLo预测NbHsc70-2蛋白的亚细胞定位,发现NbHsc70-2蛋白定位于细胞质上的可能性高于其他部位。SignalP4.0 Server信号肽预测结果显示该蛋白无信号肽,即NbHsc70-2蛋白不属于分泌蛋白。为验证亚细胞定位的预测,将NbHsc70-2蛋白与红色荧光蛋白RFP构建融合表达载体,注射本氏烟表皮瞬时表达进行亚细胞定位,激光共聚焦显微镜显示融合蛋白与Cytoplasm-FDA(细胞质Marker)定位重合,表明NbHsc70-2蛋白定位在细胞质中(图5)。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5PVY不侵染和PVY侵染NbHsc70-2蛋白的亚细胞定位
A:NbHsc70-2蛋白的亚细胞定位,Cytoplasm-FDA为细胞质Marker Subcellular localization of NbHsc70-2 protein, Cytoplasm-FDA is cytoplasmic Marker;B:PVY-GFP侵染本氏烟对NbHsc70-2蛋白定位的影响,箭头所指为细胞核The effect of PVY-GFP infecting N. benthamiana on NbHsc70-2 protein localization, the arrow is referred to the nucleus
Fig. 5Subcellular localization of NbHsc70-2 protein by PVY (B) and not by PVY (A)
利用PVY-GFP融合表达载体与NbHsc70-2-RFP融合表达载体共浸润本氏烟叶片48 h后,观察PVY-GFP侵染对NbHsc70-2蛋白定位的影响。结果显示,PVY-GFP侵染后,NbHsc70-2-RFP融合蛋白的细胞质定位发生变化,部分转移至细胞核中,NbHsc70-2-RFP融合蛋白与PVY-GFP共定位在细胞质及细胞核中,推测NbHsc70-2可能是PVY病毒复制复合体的一种组成成分,参与胞内移动过程。
2.4 沉默NbHsc70-2对PVY积累量的影响
为了进一步研究NbHsc70-2编码的Hsc70-2蛋白在PVY侵染本氏烟中的功能,利用病毒诱导基因沉默技术构建VIGS沉默体系下调本氏烟中NbHsc70-2的含量,分析寄主中NbHsc70-2的含量降低后对PVY侵染本氏烟的影响。由于NbHsc70-2具有高度的CDS核酸相似性,因此选择NbHsc70-2相对不保守区设计沉默靶标。同时,根据不保守区设计qRT-PCR引物以扩增NbHsc70-2,用于检测基因沉默效率(表1)。含NbHsc70-2沉默重组质粒农杆菌浸润本氏烟7 d后,对NbHsc70-2沉默效率为(67.50±0.29)%(图6-B)。从图6-A可以看出沉默NbHsc70-2导致心叶皱缩及植株矮化,暗示NbHsc70-2编码的NbHsc70-2蛋白可能参与调节植株生长发育。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6沉默NbHsc70-2表型分析
A:沉默NbHsc70-2 7 d后的烟草表型Tobacco phenotype after 7 days of silencing NbHsc70-2;B:沉默NbHsc70-2 7 d后的沉默效率Silencing efficiency after 7 days of silencing NbHsc70-2;C:接种PVY-GFP 7 d后的烟草表型Tobacco phenotype after 7 days of PVY-GFP inoculation;D:接种PVY-GFP 7 d后的烟草相对荧光强度Relative fluorescence intensity of tobacco after 7 days of PVY-GFP inoculation
pTRV1与pTRV2::NbHsc70-2或空的pTRV2(作为阴性对照)通过根癌农杆菌共浸润培养3周的本氏烟。侵染7 d后统计NbHsc70-2沉默效率并拍照pTRV1 and pTRV2::NbHsc70-2 or empty pTRV2 (as a negative control) were co-infiltrated with Agrobacterium tumefaciens for 3 weeks of N. benthamiana. The silencing efficiency of NbHsc70-2 was counted 7 days after infection and photos were taken
Fig. 6Phenotype analysis of NbHsc70-2 silencing
含不同重组质粒农杆菌浸润寄主植株7 d后,将PVY-GFP接种于TRV浸润叶的上面第3片叶,接种7 d后,在手提式紫外灯下观察本氏烟中的绿色荧光情况;在TRV对照组中PVY-GFP系统侵染使得非接种叶片呈现荧光现象,而NbHsc70-2沉默组中无明显绿色荧光出现(图6-C),荧光点数约是对照组的28%(图6-D)。表明本氏烟中NbHsc70-2的mRNA含量降低,可导致PVY-GFP系统性侵染受到抑制。
为了进一步明确下调NbHsc70-2表达后抑制PVY侵染本氏烟,浸润接种pTRV::NbHsc70-2后7 d接种野生型病毒PVYN,从RNA水平检测病毒的相对累积量。从图7-A可以看出沉默组与对照组的PVY CP表达量都呈现上升趋势,但沉默组的上升趋势较对照组慢;在沉默组上接种PVY后 1 d,CP表达量较对照组已有下降;3 d沉默组中的表达量是对照组的14%;5 d沉默组中的表达量是对照组的0.004%。表明沉默NbHsc70-2后,显著延缓植株内PVY CP的mRNA积累。
图7
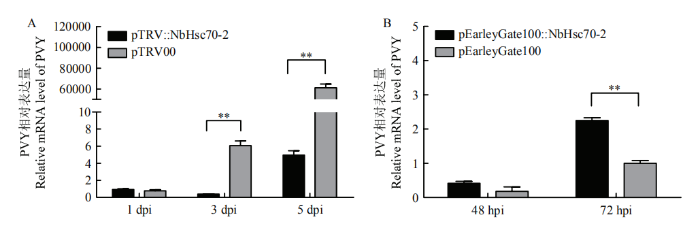 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7沉默及过表达NbHsc70-2对PVY积累的影响
A:沉默NbHsc70-2后对PVY积累的影响Effect of silencing NbHsc70-2 on PVY accumulation;B:过表达NbHsc70-2后对PVY积累的影响Effect of overexpression of NbHsc70-2 on PVY accumulation
pTRV1与pTRV2::NbHsc70-2或空的pTRV2(作为阴性对照)通过根癌农杆菌共浸润培养3周的本氏烟。侵染7 d后接种PVY开始取样进行检测。pEarleyGate100:: NbHsc70-2或空的pEarleyGate100(作为阴性对照)通过根癌农杆菌共浸润培养3周的本氏烟,提前24 h接种PVY。侵染48 h后开始取样进行检测pTRV1 and pTRV2::NbHsc70-2 or empty pTRV2 (as a negative control) were co-infiltrated with A. tumefaciens for 3 weeks of N. benthamiana. Seven days after infection, PVY was inoculated and samples were taken for test. pEarleyGate100:: NbHsc70-2 or empty pEarleyGate100 (as a negative control) was inoculated with A. tumefaciens for 3 weeks and was inoculated with PVY 24 hours in advance. Sampling was taken 48 h after infection
Fig. 7Effects of NbHsc70-2 silencing and overexpression on PVY accumulation
2.5 过表达NbHsc70-2对PVY积累量的影响
为了进一步确定NbHsc70-2编码的Hsc70-2蛋白在PVY侵染寄主过程中的作用,通过LR反应将构建好的pGWC-NbHsc70-2与pEarleyGate100重组,构建NbHsc70-2瞬时表达载体,以表达载体pEarleyGate100在本氏烟中过量表达NbHsc70-2,提高寄主中NbHsc70-2含量,分析PVY侵染植株后RNA水平上的病毒累积量。从图7-B可以看出经过表达载体处理48 h后,过表达组的PVY CP表达量较对照组已有上升,过表达组中的表达量是对照组的2.31倍;处理72 h后过表达组中的PVY CP表达量是对照组的2.56倍。表明过表达寄主中NbHsc70-2的含量能显著增加植株内PVY CP的积累。
3 讨论
植物热激蛋白70是热激蛋白家族中保守、普遍表达的,家族中通常具有两个主要功能区:N端核酸结合区(nucleotide binding domain,NBD)和C端底物结合区(substrate binding domain,SBD)。N末端核酸结合区具有结合并水解ATP的活性中心,它与ATP的结合-水解过程调控其对多肽的亲和力[19]。C端存在高度保守基序结构(motif),通常用于指示亚细胞定位信号或与其他伴侣或共同伴侣相互作用[20,21]。例如定位于叶绿体中的Hsp70其motif结构的氨基酸序列为PECDVLDADFTDSK,定位于线粒体中的为PEAEYEEAKK,定位于内质网中的为HDEL,而定位于细胞质中的为EEVD[22]。本试验中,在美国本氏烟草数据库中筛选到的Niben101Scf00449g06008.1基因经鉴定为NbHsc70-2,编码649个氨基酸,与已报道的NaHsc70-2蛋白的相似性达到97.38%,系统进化树也显示NbHsc70-2与NaHsc70-2基因亲缘性最高,并且该蛋白C端存在EEVD基序,亚细胞定位结果显示该蛋白也定位于细胞质中,这说明NbHsc70-2是Hsc70-2在本氏烟中的同源基因。Hsc70蛋白是一种结构型Hsp70,在所有的细胞内均可表达,是一种ATP结合蛋白[23],其在非生物胁迫下无明显表达差异,如热刺激后表达量不增加或减少增加;在生物胁迫中,如在病毒的侵染过程中,Hsc70被认为影响病毒蛋白的复制、积累、运动和折叠。许多病毒将Hsc70招募到膜复制工厂,如红花苜蓿坏死花叶病毒(Red clover necrotic mosaic virus,RCNMV)[24]、芜菁花叶病毒(Turnip mosaic virus,TuMV)[25]和中国小麦花叶病毒(Chinese wheat mosaic virus,CWMV)[26]。WANG等[27]研究表明,宿主Hsc70是乙型肝炎病毒(Hepatitis B virus,HBV)复制的辅助因子,Hsc70的表达水平与HBV的复制呈正相关性;MATHIOUDAKIS等[28]研究表明,Hsc70-3 mRNA水平及蛋白水平在番茄花叶病毒(Pepino mosaic virus,PepMV)侵染过程中被诱导增加;有研究表明,Hsp70家族与VRC相关,能增强病毒RNA的复制;例如Hsp70在番茄丛矮病毒(Tomato bushy stunt virus,TBSV)侵染复制中是TBSV VRC的一种组成成分[5,6];在TuMV中Hsc70-3是膜结合复制复合体的一部分[25]。此外Hsc70还与病毒基因组成分相互作用,以增强病毒在宿主植株中的RNA积累;Hsp72在丙肝病毒(Hepatitis C virus,HCV)复制中与复制蛋白NS5A、NS5B(RNA-dependent RNA polymerase,RdRp)互作[29]。Hsc70-3在PepMV复制中与PepMV CP相互作用;并且Hsc70还参与病毒细胞间转运,在苘麻花叶病毒(Abutilon mosaic virus,AbMV)中运动蛋白(movement protein,MP)与Hsc70相互作用[30],表明Hsc70可能在病毒转运方面具有一定的功能;在PepMV中Hsc70-3与PepMV CP相互作用复合物出现在细胞质和细胞核中,表明Hsc70-3参与PepMV的细胞内移动[28];ALAM等[31]研究表明,Hsc70-2与纯化的黄瓜坏死病毒(Cucumber necrosis virus,CNV)病毒粒子结合,并在病毒颗粒的解体中发挥作用。
本研究发现PVY侵染的本氏烟中NbHsc70-2 mRNA水平上升,且引起部分NbHsc70-2蛋白定位转移至细胞核中,NbHsc70-2蛋白与PVY共定位在细胞质及细胞核中;在AbMV中MP与Hsc70相互作用,在PepMV中也发现Hsc70-3参与PepMV的胞内移动;推测NbHsc70-2可能参与PVY的胞内移动过程。本研究利用VIGS技术下调宿主中NbHsc70-2含量,进一步发现该基因缺失后,能够显著抑制PVY CP的积累量,表明NbHsc70-2的表达水平与PVY的复制呈正相关,沉默组与对照组相比下降幅度较大可能是由于NbHsc70-2是PVY侵染复制所需要的重要组成部分,NbHsc70-2是PVY VRC的一部分,PVY侵染需要招募宿主NbHsc70-2蛋白到膜复制工厂形成PVY病毒复制复合体,缺失NbHsc70-2导致PVY无法形成VRC进而导致沉默组与对照组的差异较大;并且病毒的复制是快速增长的,这也是导致沉默组与对照组差异较大的原因;同时沉默NbHsc70-2后7 d植株出现皱缩及矮化症状,这也暗示了NbHsc70-2在植物生长发育中具有重要的作用。但NbHsc70-2功能的丧失可能造成了植株的一些生理缺陷,因此本研究进一步上调宿主中NbHsc70-2的含量,结果表明过表达NbHsc70-2能够提高PVY CP的积累量,这与WANG等[27]的研究结果一致。
4 结论
NbHsc70-2为Hsp70家族蛋白,PVY侵染后导致其基因表达上升。NbHsc70-2是响应PVY侵染的重要基因,正向调控PVY病毒的复制,抑制该基因的表达可以提高植株对PVY的抗性,该基因在烟草抗马铃薯Y病毒病方面具有较大的应用价值,未来可将该蛋白作为一个抗病毒药剂靶标。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
