 ,, 李强
,, 李强 ,西南大学/中国农业科学院柑桔研究所,重庆 400712
,西南大学/中国农业科学院柑桔研究所,重庆 400712Screening of Interacting Proteins of Anti-Canker Transcription Factor CsBZIP40 in Citrus by GST Pull-Down Combined with LC-MS/MS
DOU WanFu, QI JingJing, HU AnHua, CHEN ShanChun, PENG AiHong, XU LanZhen, LEI TianGang, YAO LiXiao, HE YongRui ,, LI Qiang
,, LI Qiang ,Citrus Research Institute, Southwest University/Chinese Academy of Agricultural Sciences, Chongqing 400712
,Citrus Research Institute, Southwest University/Chinese Academy of Agricultural Sciences, Chongqing 400712通讯作者:
责任编辑: 岳梅
收稿日期:2019-03-12接受日期:2019-04-3网络出版日期:2019-07-01
| 基金资助: |
Received:2019-03-12Accepted:2019-04-3Online:2019-07-01
作者简介 About authors
窦万福,E-mail:douwanfu@foxmail.com

摘要
关键词:
Abstract
Keywords:
PDF (3463KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
窦万福, 祁静静, 胡安华, 陈善春, 彭爱红, 许兰珍, 雷天刚, 姚利晓, 何永睿, 李强. GST pull-down联合LC-MS/MS筛选柑橘抗溃疡病转录因子CsBZIP40的互作蛋白[J]. 中国农业科学, 2019, 52(13): 2243-2255 doi:10.3864/j.issn.0578-1752.2019.13.005
DOU WanFu, QI JingJing, HU AnHua, CHEN ShanChun, PENG AiHong, XU LanZhen, LEI TianGang, YAO LiXiao, HE YongRui, LI Qiang.
0 引言
【研究意义】柑橘产业在中国具有重要的经济地位,而病害严重影响着柑橘产业的健康发展。柑橘溃疡病(citrus bacterial canker,CBC)是主要的病害之一,它是一种由柑橘黄单胞杆菌柑橘亚种(Xanthomonas citri subsp. citri,Xcc)所引起的检疫性细菌病害[1]。传统的防治方法具有环境污染、毁园、效果差、成本高等弊端,且无法根治[2]。培育优良抗性品种是解决柑橘溃疡病危害的有效途径,而通过分子育种方法培育抗性品种是控制柑橘溃疡病最为经济、有效、环保的方法。挖掘有潜力的候选基因是分子育种的重要基础,CsBZIP40是一个与溃疡病抗性相关的转录因子[3],可通过与具有转录激活作用的结构域相互作用调控下游相关基因的表达[4]。对CsBZIP40调控机理的研究首先需要明确该转录因子是否与其他蛋白互作共同发挥功能,因此,筛选CsBZIP40响应柑橘溃疡病菌侵染过程中的互作蛋白很有必要。【前人研究进展】大部分的转录因子无法单独调控基因的表达,一般情况下,几个转录因子同时直接或间接地与顺式作用元件结合,才能调控下游基因的表达[5]。转录因子间形成多聚体或与其他蛋白质因子形成调控复合因子时首先是转录因子的聚集,由一个转录因子招募与其共同作用的转录因子,然后结合通用转录因子和RNA聚合酶形成启动子复合物,开启基因的转录。一个转录因子是否能够促进基因的转录,必须有相关蛋白同时出现,而且这个转录因子必须处于能够与其他转录因子结合的状态[5],一些基因在调控网络中参与多条途径。转录因子在植物抵抗病原菌的反应中起重要作用[6,7],比如会通过识别不同的顺式作用元件,影响多种基因的表达,响应生物胁迫[8,9]。BZIP蛋白在抵抗病害、调节植物抗性应答方面发挥着重要的作用,过表达MeBZIP3和MeBZIP5的转基因植株可以提高对木薯枯萎病的抗性[10],干扰表达水稻中的BZIP转录因子TGA2.1使水稻对稻瘟病抗性明显增强[11]。GST pull-down是一种体外筛选与已知蛋白相互作用的未知蛋白的经典技术[12,13],广泛应用于互作蛋白的研究中。AKIYAMA等[14]将稻瘟病抗性相关的碱性几丁质酶基因RC24和苜蓿β-1,3-葡萄糖酶基因β-1,3-Glu同时导入水稻中,利用GST pull-down技术从水稻中分离出一个抗稻瘟病蛋白的互作蛋白;赵文等[15]应用GST pull-down技术对抗病蛋白PID2的早期响应蛋白进行了探索,得到31个蛋白在感病状态下特异结合;林生等[16]使用GST pull-down技术钓取出Gibberella fujikuroi侵染下SoSGT1的7个响应蛋白。【本研究切入点】CsBZIP40为笔者实验室验证的与柑橘抗溃疡病相关的转录因子,为了研究其生物学功能,构建了过表达载体并转化柑橘获得了转基因植株,可作为研究CsBZIP40的功能和柑橘溃疡病菌侵染过程中CsBZIP40的互作蛋白和分子机理的试验材料。但CsBZIP40在柑橘体内发挥作用的分子机理尚不清晰。【拟解决的关键问题】通过对溃疡病菌侵染过程中CsBZIP40互作蛋白的挖掘,从蛋白质层面探明CsBZIP40在调控柑橘对溃疡病抗性过程中发挥功能的关键因子,为进一步研究CsBZIP40的调控网络和分子机理打下基础,并为抗溃疡病分子育种提供参考依据。1 材料与方法
试验于2018年在西南大学/中国农业科学院柑桔研究所完成。1.1 材料与试剂
试验植物材料为过表达CsBZIP40的晚锦橙植株叶片。供试溃疡病菌是西南大学柑桔研究所保存的亚洲种A株系。植物总RNA提取、胶回收、反转录和质粒提取采用AIDLAB公司的相关试剂盒;实时荧光定量PCR(real-time fluorescent quantitative PCR,qRT-PCR)使用BIORAD公司的荧光染料;T-A克隆试剂和pGEMT easy载体购自TaKaRa公司;PGEX-4T-1载体、克隆菌株Top10和BL21(DE3)原核表达菌株购于南京德泰生物。1.2 CsBZIP40过表达植株柑橘溃疡病抗性评价
使用引物(FCsBZIP40-1:TAACCAAGAAGGACCTG CTTTTGAT,R CsBZIP40-1:CTTTTCTTGTGATGGTTTT GCATCT)鉴定转基因菌株。阳性菌株提取叶片总RNA并反转录,根据CsBZIP40基因特异性区域和柑橘内参基因Actin设计定量PCR引物(FCsBZIP40-2:AGTTCCCTTTGGGCATCTCG,RCsBZIP40-2:ACCATT TGCAGATCCGTCGT,Factin:CATCCCTCAGCACCTT CC,Ractin:CCAACCTTAGCACTTCTCC),并用qRT-PCR检测CsBZIP40的表达量,相对表达量采用2-ΔΔCt法(ΔCt=CtCsBZIP40-CtActin)计算,使用Excel进行数据统计分析并绘图。于液体LB培养基中培养柑橘溃疡病菌至OD600nm为0.5,菌液进行离心并用LB培养基重悬后分装备用;采集的叶片清洗并用75%的酒精消毒后放入超纯水中冲洗,置于超净台;以叶脉为中心进行针刺,六针为一组,每侧两组;用移液器点样溃疡病菌菌液,每针孔点样1 μL。然后将柑橘叶片的叶柄用浸湿的脱脂棉包裹,石蜡带密封于培养皿,于28℃恒温光照培养箱中培养(16 h光照/8 h黑暗)。对照组用LB代替溃疡病菌菌液,其他操作保持一致。分别在0、1、3、5 d取样。部分叶片点菌后培养10 d拍照,用Image J V1.47软件统计病斑面积(mm2)。按照病斑面积将病情分为0—7共8级,以字母R表示病斑面积,0级(R≤0.25 mm2),1级(0.25 mm2<R≤0.5 mm2),2级(0.5 mm2<R≤0.75 mm2),3级(0.75 mm2<R≤1 mm2),4级(1 mm2<R≤1.25 mm2),5级(1.25 mm2<R≤1.5 mm2),6级(1.5 mm2<R≤1.75 mm2),7级(R>1.75 mm2);根据公式计算病情指数:DI=100×Σ(各级病斑数×相应级数值)/(病斑总数×最大级数)[17]。1.3 GST-CsBZIP40融合蛋白载体构建、表达与纯化
以锦橙cDNA为模板,上游引物FCsBZIP40-3:CGCGGATCCATGGCGAGTCACA GAATTGG(带BamHI酶切位点),下游引物FCsBZIP40-3:CGCCTCGAG TCA AAAGTTCGAGAAATGAT(带XhoI酶切位点),进行PCR扩增CsBZIP40的CDS序列;PCR产物连接T载体后转化大肠杆菌DH5α;用BamHI和XhoI酶切质粒和表达载体PGEX-4T-1,将线性化的载体和基因片段连接并转化大肠杆菌Top10感受态;提取阳性菌株质粒转化到BL21(DE3)中培养至菌液OD值为0.6,加入0.2 mmol?L-1 IPTG诱导,置于15℃摇床诱导表达;全菌采用50 mmol?L-1 Tris,150 mmol?L-1 NaCl(pH 8.0)缓冲液(含1% Triton X-100,1 mmol?L-1 DTT,1 mmol?L-1 PMSF)超声波裂解,同时以50 mmol?L-1 Tris,150 mmol?L-1 NaCl(pH 8.0)缓冲液平衡GST亲和层析磁珠,之后用含40 mmol?L-1 GSH的平衡缓冲液洗脱目标蛋白,并收集洗脱组分进行SDS-PAGE检测;收集纯度浓度相对较高的样品,将其透析到1×PBS(pH 7.8),5% Glycerol中,透析结束后用0.22 μm过滤器过滤,分装并保存于-80℃。采用Bradford法测定蛋白浓度,用R250染色的SDS-PAGE判断纯度。1.4 柑橘总蛋白提取
取1 g柑橘叶片(分别接种溃疡病菌和LB),充分研磨后加入1 mL裂解液(50 mmol?L-1 Tris-HCl,50 mmol?L-1 NaCl,1 mmol?L-1 EDTA,1% Triston X-100,1 mmol?L-1 DTT,1 mmol?L-1 PMSF,pH 8.0)重悬叶片组织;4℃冰浴30 min,期间每隔5 min混匀一次,利用超声波破碎仪在冰浴中破碎叶片组织(750 W,超声6 s,间隔1 s,超声20次);用高速冷冻离心机(12 000 r/min)离心20 min,取上清。取50 μL上清加50 μL 2×点样缓冲液沸水浴5 min,12 000 r/min离心2 min,取上清进行SDS-PAGE。1.5 GST pull-down反应
(1)取3个EP管标号为①、②、③,分别加入100 μL GST-磁珠到①、②、③管中,用1 mL PBS润洗3次。将150 μg的GST-CsBZIP40诱饵蛋白(标号6)加入到①号管中,150 μg GST标签蛋白(标号1)加入到②号管中,③号管中不做处理,将①、②、③号管中分别加入PBS补至600 μL并混合均匀,4℃层析柜孵育结合2 h;(2)将①、②号管离心后分别用PBS+1% Triton X-100洗3次,再用PBS洗3次,两个管中分别取出50 μL GST-CsBZIP40诱饵蛋白和GST-磁珠的混合物(标号2)、GST标签蛋白与GST-磁珠的混合物(标号7)进行SDS-PAGE验证;(3)分别向上述①、②、③号管剩余的GST-磁珠中同时加入150 μg的溃疡病菌侵染后柑橘叶片总蛋白(标号11),并用PBS补足液体到600 μL左右,以便蛋白之间能充分结合,4℃层析柜孵育结合2 h,离心后收集流出液体进行SDS-PAGE验证(①、②、③号管流出液体收集后标号8、3、12);(4)分别用PBS+1% Triton X-100洗3次,再用PBS洗3次,收集第1次的洗杂液备用,①、②、③号管洗杂液收集标号9、4、13)。然后用BBI(还原型谷胱甘肽GSH)洗磁珠,收集洗脱液进行SDS-PAGE验证(①、②、③号管洗脱液收集后标号10、5、14);(5)将上述标号1-14的液体分别加入50 μL 2×点样缓冲液沸水浴5 min,12 000 r/min离心2 min,取上清采用SDS-PAGE进行检测(泳道与收集标号一致)。未侵染溃疡病菌柑橘GST pull-down试验总蛋白换为未感病柑橘总蛋白即可,其他操作相同。1.6 LC-MS/MS分析
将样品送至南京德泰生物有限公司进行LC-MS/ MS分析,质谱结果用在线软件MaxQuant V1.5检索数据库[18],获取在溃疡病菌侵染过程中与CsBZIP40特异结合的蛋白序列、分子量等信息,进行后续信息学分析。1.7 生物信息学分析
将溃疡病菌侵染过程中特异表达的蛋白用在线软件OmicsBean(http//www. omicsbean.cn)从分子功能方面进行GO富集分析和KEGG[19]信号通路富集分析。KEGG数据库以文献为基础,表示分子相互作用和反应的网络通路数据,包括比较全面的代谢通路图谱。STRING[20]是一个用来共享已知或预测的蛋白相互作用的数据库,用STRING(https://string-db.org)在线软件进行蛋白互作验证。2 结果
2.1 过表达植株鉴定与评价
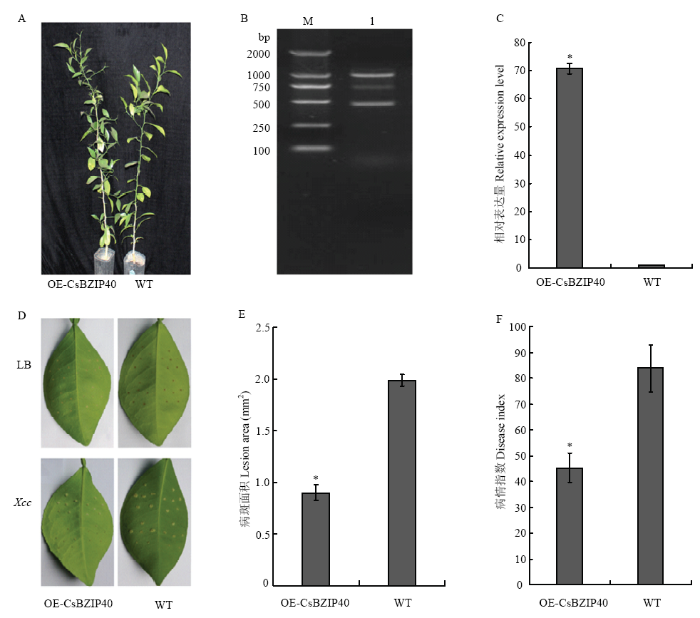
CsBZIP40过表达植株表型正常,与对照植株无明显差异(图1-A)。以全基因组DNA为模板进行PCR,在1 000 bp和500 bp有两条植株特征条带出现,分别为扩增自基因组和转入的外源基因,在750 bp有一条模糊条带可能是柑橘基因组中的非特异性扩增结果(图1-B)。qRT-PCR检测发现CsBZIP40表达量在转基因植株中表达量相比野生型高出70倍(图1-C)。转基因柑橘叶片接种溃疡病菌10 d后接种LB的叶片无菌斑生成,而接种溃疡病菌的叶片均有溃疡菌斑出现。同野生型相比,过表达植株的柑橘叶片发病轻,表现出一定的抗病性(图1-D)。对病斑面积进行统计显示过表达CsBZIIP40叶片上的病斑面积小于野生型叶片上的病斑面积,仅为野生型的45%(图1-E)。病情指数结果显示,转基因的病情指数植株明显低于野生型叶片上的病情指数,仅为野生型的54%(图1-F)。上述结果表明过表达CsBZIIP40的柑橘对溃疡病具有较高的抗性。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1过表达CsBZIP40柑橘植株验证和溃疡病抗性评价
A:过表达CsBZIP40转基因植株表型 Phenotypes of CsBZIP40 overexpression lines。B:转基因植株系中CsBZIP40的阳性检测The positive detection of CsBZIP40 in transgenic lines;M:Marker;1:阳性检测条带Positive detection band。C:过表达CsBZIP40的相对表达量 The relative expression of overexpressed CsBZIP40。D:接种溃疡病菌的转基因植株和野生型对照叶片 Disease spots of transgenic lines and the wild-type (WT) inoculated with LB and Xcc。E:接种溃疡病菌的转基因植株和野生型对照病斑面积 Lesion area of transgenic lines and the wild-type inoculated with Xcc;F:接种溃疡病菌的转基因植株和野生型对照病情指数 Disease index of transgenic lines and the wild-type inoculated with Xcc
Fig. 1Verification and canker resistance evaluation of overexpressed CsBZIP40 lines
2.2 GST-CsBZIP40诱饵蛋白载体构建、表达与纯化
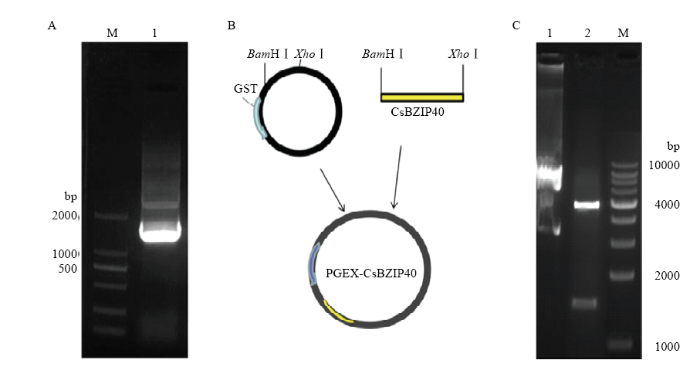
PCR扩增CsBZIP40的编码序列(图2-A),用BamHⅠ和XhoⅠ酶切CsBZIP40的编码序列和PGEX-4T-1表达载体,酶切产物连接获得融合表达载体PGEX-CsBZIP40(图2-B)。双酶切验证表达载体确认目的片段插入无误(图2-C)。重组表达载体转化大肠杆菌Top10菌株,培养并提取质粒后转化BL21(DE3)表达菌株,IPTG诱导表达GST-CsBZIP40诱饵蛋白,结果表明在0.2 HYPERLINK "https://www.baidu.com/s?wd=mm&tn=SE_PcZhidaonwhc_ngpagmjz&rsv_dl=gh_pc_zhidao" \t "_blank" mmol·L-1 IPTG诱导和15℃培养条件下上清液中的GST-CsBZIP40蛋白表达比较均一且表达量稳定,融合蛋白分子量82 kD(图3-A)。通过GST琼脂糖凝胶亲和层析纯化GST- CsBZIP40诱饵蛋白(图3-B)。随后对纯化的GST- CsBZIP40诱饵蛋白进行质检,浓度为0.214 mg·mL-1(图3-C),纯度为90%(图3-D)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2融合表达载体构建。
A:CsBZIP40的PCR扩增 PCR amplification of CsBZIP40;M:2000 bp分子量标记2000 bp molecular marker;1:扩增产物,约1 530 bp Amplified product, about 1 530 bp。B:CsBZIP40-GST融合表达载体的构建 Construction of CsBZIP40-GST fusion expression vector。C:融合表达载体的酶切验证Enzymic digestion of CsBZIP40-GST vector;1:完整质粒条带The complete plasmid band;2:CsBZIP40-GST;M:10 000 bp分子量标记10 000 bp molecular marker
Fig. 2Construction of fusion expression vector
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3融合蛋白诱导表达、纯化检测
A:GST-CsBZIP40融合蛋白表达 Expression of GST-CsBZIP40;M1:Marker;1:无IPTG诱导表达对照Expression of GST-CsBZIP40 without IPTG;2:15℃加IPTG诱导表达IPTG and 15℃ induced expression。B:诱饵蛋白纯化Bait protein purification;3:全菌破碎离心后上清Supernatant after centrifugation;4:上清同GST孵育后流出液Supernatant after incubation with GST;M2:Marker;5、6:40 HYPERLINK "https://www.baidu.com/s?wd=mm&tn=SE_PcZhidaonwhc_ngpagmjz&rsv_dl=gh_pc_zhidao" \t "_blank" mmol?L-1洗脱GST-CsBZIP40 40 HYPERLINK "https://www.baidu.com/s?wd=mm&tn=SE_PcZhidaonwhc_ngpagmjz&rsv_dl=gh_pc_zhidao" \t "_blank" mmol?L-1 eluent GST-CsBZIP40。C:诱饵蛋白纯化后浓度检测Concentration detection after purification of bait protein;M3:SDS-PAGE Marker;7:标准BSA Standard BSA;8:GST-CsBZIP40。D:诱饵蛋白纯化后纯度检测Fineness detection after purification of bait protein;M4:WB Marker;9:GST-CsBZIP40
Fig. 3Induced expression and purification detection of fusion protein
2.3 GST pull-down
成功提取接种溃疡病菌和未接种溃疡病菌柑橘叶片总蛋白,然后将这两组总蛋白分别与结合在GST-磁珠上的GST-CsBZIP40诱饵蛋白进行孵育,收集流出、洗杂、洗脱液体,上样泳道编号与方法介绍中一致(图4)。SDS-PAGE结果显示GST-CsBZIP40诱饵蛋白能够与GST-磁珠亲和,吸附在GST-磁珠上的融合蛋白能够从柑橘总蛋白中成功钓取蛋白,扣除GST标签蛋非特异性吸附的条带后,仍然有差异条带,说明GST-CsBZIP40蛋白能够从柑橘总蛋白中获得有相互作用的未知蛋白,可以将洗脱样做LC-MS/MS检测,做进一步确认分析。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4GST pull-down结果检测
A:感染溃疡病菌的叶片总蛋白GST pull-down结果 The GST pull-down from total protein of leaves infected by Xcc;B:未感染溃疡病菌的叶片总蛋白GST pull-down结果 The GST pull-down from total protein of leaves infected by LB medium
Fig. 4The detection of GST pull-down results
2.4 LC-MS/MS检测
质谱得到的GST-CsBZIP40的结合蛋白除去GST蛋白对照组鉴定的蛋白后,共鉴定到53个潜在的直接或间接相互作用的蛋白。这53个蛋白在柑橘溃疡病菌侵染过程中与CsBZIP40直接或间接结合。用软件MaxQuant V1.5检索数据库获得蛋白的序列信息。使用甜橙基因组数据库[21]对这些蛋白进行注释,注释出植物广谱抗性相关蛋白(Cs1g02310)、转录因子(Cs3g23950)、抗病蛋白(Cs3g05280)和活性氧代谢相关蛋白(Cs6g13880)等(表1)。这些蛋白可能与CsBZIP40共同起作用以提高柑橘对溃疡病的抗性。其中,NPR蛋白(Cs1g02310)为已经报道过的明确与BZIP40有相互作用的蛋白,证明本试验得到的结果可信[22]。Table 1
表1
表1抗病相关的CsBZIP40互作蛋白
Table 1
| 基因 ID Gene ID | 功能预测 Predicted protein function | 等电点 PI | 分子量 Molecular weight (kD) | 染色体位置 Chromosomal loci |
|---|---|---|---|---|
| Cs1g02310 | TGA1 resistance (SAR) via its interaction with NPR1 | 7.07 | 40.83 | chr1:1,637,432..1,643,794 |
| Cs3g05280 | Disease resistance protein | 5.83 | 130.03 | chr3:6,932,350..6,936,297 |
| Cs3g23950 | Transcription factor MYB | 8.75 | 28.06 | chr3:26,088,190..26,089,510 |
| Cs6g13880 | Peroxiredoxin-2 | 8.49 | 29.50 | chr6:15,280,950..15,284,180 |
| Cs7g12130 | Heat shock protein 83 | 5.34 | 90.12 | chr7:8,048,239..8,054,656 |
| orange1.1t04973 | Death-associated protein kinase 1 | 5.85 | 35.14 | chrUn:40,320,115..40,324,317 |
新窗口打开|下载CSV
2.5 CsBZIP40互作蛋白GO富集分析
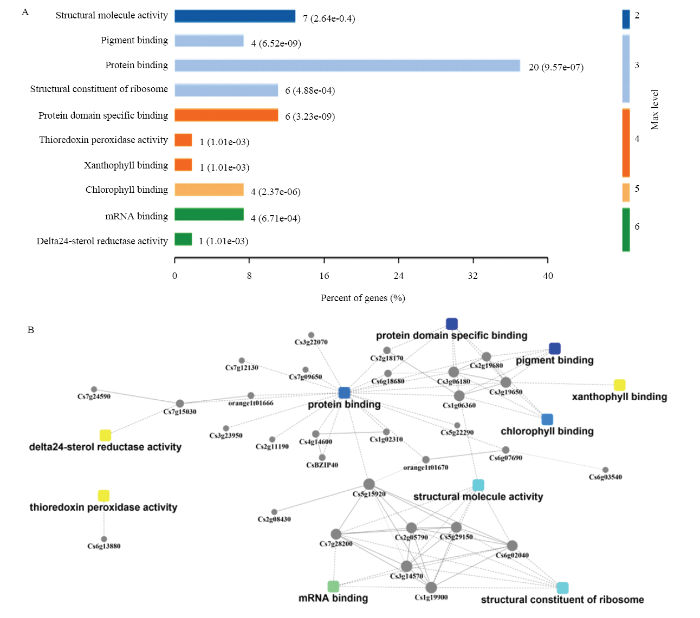
对质谱得到的蛋白用OmicsBean在线软件从分子功能层面进行GO功能富集分析,证明这些蛋白的功能主要集中在分子功能。分子功能的前10个GO分别与结构分子活性(7个)、色素结合(4个)、蛋白质结合(20个)、核糖体结构成分(6个)、蛋白结构域特异性结合(6个)、硫氧还蛋白过氧化物酶活性(1个)、叶黄素结合(1个)、叶绿素结合(4个)、mRNA结合(4个)、Delta24甾醇还原酶活性(1个)有关或相关(图5-A)。在这些分子功能富集中,20个蛋白与蛋白结合有关,提示与CsBZIP40结合的蛋白主要参与了蛋白结合调控过程。从这53个蛋白的功能富集网络可以看出许多基因参与了几个不同的功能,比如Cs2g19680参与了蛋白结构域特异性结合、蛋白质结合、色素结合和叶绿素结合等多个功能(图5-B)。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5CsBZIP40互作蛋白的GO分析
A:CsBZIP40互作蛋白GO分子功能富集分析 GO molecular functional enrichment analysis of CsBZIP40 interacting proteins;B:CsBZIP40互作蛋白GO分子功能蛋白互作分析 GO molecular functional protein interaction analysis of CsBZIP40 interacting proteins
Fig. 5GO analysis of CsBZIP40 interacting proteins
2.6 CsBZIP40互作蛋白的KEGG分析
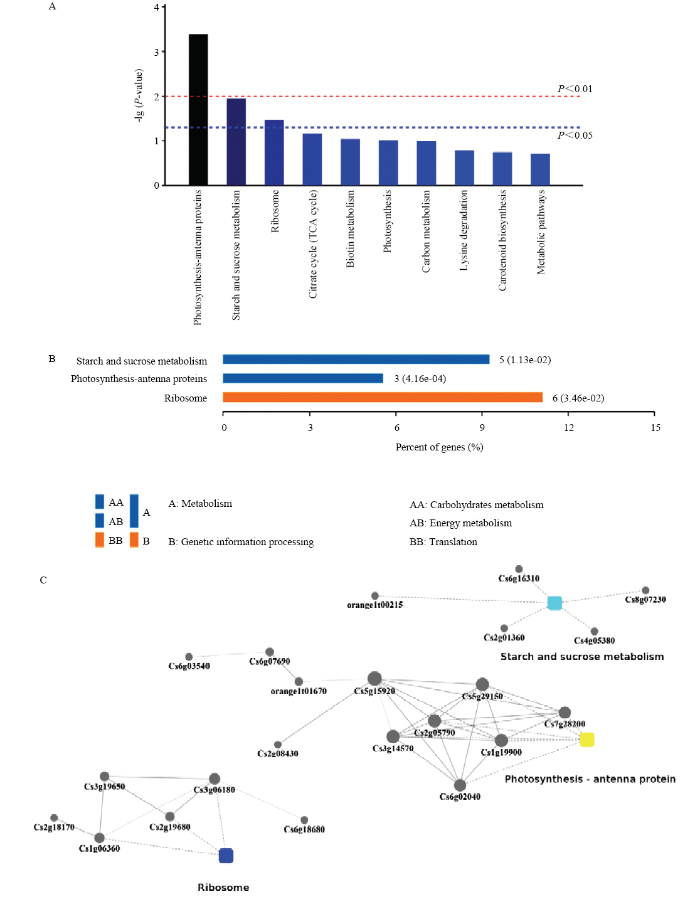
P<0.05时,有3个可信度较高的富集通路,分别为淀粉和蔗糖代谢通路、光合作用天线蛋白通路和核糖体通路(图6-A)。这3个通路中淀粉和蔗糖代谢通路与光合作用天线蛋白通路属于代谢相关的通路,而核糖体通路则与遗传信息相关(图6-B)。有5个基因参与淀粉和蔗糖代谢通路、11个基因参与光合作用天线蛋白通路、6个基因参与核糖体通路,而且每个代谢通路中的几个蛋白之间也往往存在相互作用(图6-C)。KEGG结果表明CsBZIP40的互作蛋白可能在代谢、光合以及能量转换与利用方面发挥重要的作用。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6CsBZIP40互作蛋白的KEGG分析
A:CsBZIP40互作蛋白KEGG信号通路分析 KEGG signaling pathway analysis of CsBZIP40 interacting proteins;B:可信信号通路基因数量统计 Gene quantity statistics of trusted signaling pathway;C:信号通路蛋白互作分析Interaction analysis of signaling pathway protein
Fig. 6KEGG analysis of CsBZIP40 interacting proteins
2.7 蛋白互作分析
用CsBZIP40的53个互作蛋白序列同模式植物拟南芥的蛋白互作数据库进行比对,挖掘与CsBZIP40同源的TGA9相互作用的蛋白(图7)。互作网络显示53个蛋白中与TGA9直接或间接结合的蛋白有44个已经得到数据支持,证明了本研究的可靠性。有9个蛋白在数据库中尚无数据支撑。在这44个蛋白的互作网络中有15个基因处于重要节点位置,它们与较多的蛋白存在相互作用,比如蛋白AT5G27850与其他6个蛋白存在相互作用;蛋白CR88与其他10个蛋白存在相互作用。这些节点蛋白在响应柑橘溃疡病菌侵染的过程中可能发挥着重要的作用,节点蛋白CR88是一个热休克蛋白,植物正常生长状态下组织中很少能检测到热休克蛋白的表达,而在胁迫下会有大量热休克蛋白表达,因此热休克蛋白在植物抵抗外界胁迫中具有重要意义[23]。同时与之互作的蛋白MYB[24]、NPR1[22]均与植物抵抗生物胁迫密切相关。CR88蛋白与多个广谱抗性蛋白互作,在柑橘体内协同发挥作用,共同抵抗溃疡病菌对机体的侵染。图7
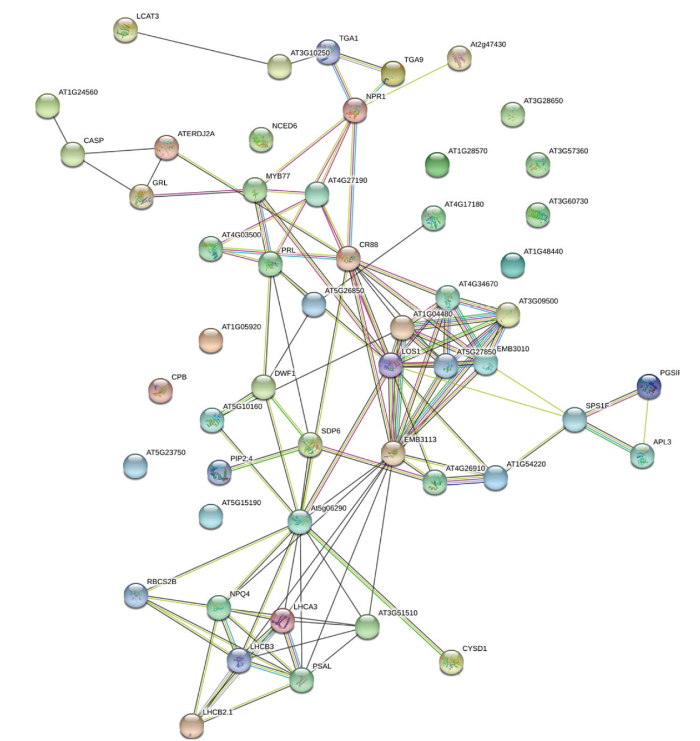 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7CsBZIP40结合蛋白互作分析
节点代表溃疡病菌侵染过程中CsBZIP40的结合蛋白,圆圈中的图案为预测的蛋白三级结构,空白表示三级结构未知。不同颜色的连线表示不同数据来源 The circle in the figure is the binding protein of CsBZIP40. The pattern in the circle is the predicted protein tertiary structure, and the blank indicates that the tertiary structure is unknown. Line segments indicate that there is a clear link between the two proteins that has been proven or reported
Fig. 7Interaction analysis of CsBZIP40 binding proteins
3 讨论
植物在漫长的进化过程中逐渐形成了一系列复杂而有效的识别和保护机制来抵抗病原菌的侵染[23],主要包括植物抗病基因介导的侵染部位细胞程序性死亡、超敏反应与系统获得抗性等[25,26,27]。拟南芥中BZIP(TGA)转录因子在免疫反应网络中处于重要的位置,在前人的研究中发现,BZIP转录因子上游受到NPR(non-expressor of PR gene)基因的调控,NPR基因在植物的系统获得性抗性(systemic acquired resistance,SAR)响应中起关键的调节作用[28],NPR蛋白与TGA蛋白互作调控下游基因的表达[29]。CsBZIP40是柑橘中一个重要转录因子[30],前期对CsBZIP40的功能研究与分析发现该转录因子与柑橘溃疡病抗性明显相关,柑橘基因组中转录因子CsBZIP40与拟南芥中TGA9高度同源,均属于在病菌防御方面发挥作用的D亚家族[31]。CsBZIP40作为下游基因的调控因子[32,33,34,35],对植物的转录调控发挥着重要的作用。本研究中,对过表达CsBZIP40柑橘植株的抗溃疡病评价结果表明过表达CsBZIP40能显著提高柑橘对溃疡病的抗性,但机理尚不明确。本文从蛋白质层面入手,利用GST pull-down技术获取与CsBZIP40蛋白直接作用的蛋白,筛选出柑橘溃疡病菌侵染过程中的结合蛋白,对解析CsBZIP40的调控机理具有重要意义。对溃疡病菌侵染过程中特异表达的53个蛋白结合相关的数据库检索、生物信息学预测、比对和功能分析,结果表明与数据库中得到的蛋白调控网络中部分重合,证明了该研究的准确性,同时丰富了数据库。GO注释显示,这53个蛋白的功能主要归类为能量代谢、光合作用以及植物抗逆相关蛋白。其中Cs1g02310、Cs3g05280、Cs3g23950、Cs6g13880、Cs7g12130、orange1.1t04973可能与柑橘抗病抗逆性密切相关。转录因子会通过上调或下调下游相关基因的表达来实现对某一过程的调控[36],CsBZIP40转录因子如何实现的这个调控尚不明确,直接调控还是间接调控也不明晰。在这个过程中,一些与转录调控相关的蛋白可能发挥关键作用。本研究结果显示,溃疡病菌侵染过程中特异表达的某些蛋白可能在柑橘抵抗溃疡病菌的过程中发挥着重要的作用,比如Cs3g05280在感染溃疡病中特异结合,此蛋白在其他物种中的同源基因几乎都参与抗病反应,在植物抗逆过程中起着重要的作用;Cs1g02310与拟南芥中TGA1高度同源,NPR1和TGA1是植物体内获得系统抗性的关键氧化还原调控因子[37];Cs6g13880是编码Peroxiredoxin-2酶的基因,过氧化物酶是一类清除生物体内活性氧的重要的酶,与提高植物抗逆性密切相关[38] ;活性氧在植物局部和整体防御反应中发挥着重要的作用[39]。因此,这两个基因(Cs1g02310、Cs6g13880)在提高转基因植株溃疡病抗性中可能发挥着重要的作用。还有部分基因能够提高柑橘对恶劣环境的耐受性,比如Cs3g05280与MYB44同源性较高,过表达MYB44能够提高拟南芥对渗透胁迫的耐受性[30];Cs7g12130编码热休克蛋白,热休克蛋白是植物逆境条件下产生的应激蛋白,通过分子伴侣保护机制保护逆境中的细胞,从而提高植物对逆境的忍耐力[40];Cs7g15030与油菜素甾类生物合成相关,油菜素甾类能诱导H2O2的积累,增强植物抗氧化性[41]。这些蛋白在柑橘抵抗溃疡病菌时,能够增强柑橘本身的防御功能,延缓发病时间,减轻发病症状,从而表现出过表达CsBZIP40转基因植株对溃疡病的抗性。
4 结论
BZIP40属于病原菌抗性相关的转录因子,过表达CsBZIP40转基因晚锦橙表现出对溃疡病的抗性。GST pull-down联合LC-MS/MS筛选出53个在感染溃疡病菌过程中与CsBZIP40互作的蛋白,这些蛋白包括转录调控蛋白、植物抗病性蛋白、细胞壁合成调控蛋白、过氧化物酶、细胞程序性死亡调控蛋白等,参与不同的分子功能和代谢通路,在响应柑橘溃疡病菌的侵染过程中与CsBZIP40协同发挥作用。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.16420/j.issn.0513-353x.2015-0128Magsci [本文引用: 1]

对柑橘溃疡病菌(Xanthomonas citri subsp. citri,Xcc)的分类地位、菌系分化和致病机理进行了总结,重点阐述了运用生物学、血清学和分子生物学方法鉴定溃疡病菌遗传变异的研究进展,并介绍了该病的防治方法。
DOI:10.16420/j.issn.0513-353x.2015-0128Magsci [本文引用: 1]

对柑橘溃疡病菌(Xanthomonas citri subsp. citri,Xcc)的分类地位、菌系分化和致病机理进行了总结,重点阐述了运用生物学、血清学和分子生物学方法鉴定溃疡病菌遗传变异的研究进展,并介绍了该病的防治方法。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

植物在它的生命周期中要经历各种逆境胁迫。植物许多胁迫相关基因的表达主要受特定转录因子在转录水平的调控。ERF转录因子家族参与植物的生物胁迫和非生物胁迫的应答,是同植物抗逆应答密切相关的一类转录因子大家族。它们通过识别不同的顺式元件,调节多种功能基因的表达,调节植物抗性应答。综述简要介绍ERF转录因子及其相关顺式作用元件。阐述植物ERF转录因子家族在植物抗逆应答中的功能。
Magsci [本文引用: 1]

植物在它的生命周期中要经历各种逆境胁迫。植物许多胁迫相关基因的表达主要受特定转录因子在转录水平的调控。ERF转录因子家族参与植物的生物胁迫和非生物胁迫的应答,是同植物抗逆应答密切相关的一类转录因子大家族。它们通过识别不同的顺式元件,调节多种功能基因的表达,调节植物抗性应答。综述简要介绍ERF转录因子及其相关顺式作用元件。阐述植物ERF转录因子家族在植物抗逆应答中的功能。
DOI:10.1016/j.bbagrm.2016.08.005URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.2174/1389203717666160619185308URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/S1366-2120(08)70153-3URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.11926/j.issn.1005-3395.2015.03.004Magsci [本文引用: 1]

为了解果蔗(<i>Saccharum officenarum L.</i>)在防御<i>Gibberella fujikuroi</i> 过程中与SoSGT1 互作的蛋白,利用GST 蛋白标签载体pGEX-6p-1 与果蔗SoSgt1 基因构建pGEX-6p-1-sgt1 表达载体,诱导表达GST-SoSGT1 融合蛋白,并通过GST pull down 技术捕捉到7 个与SoSGT1 互作蛋白.这些蛋白的功能主要归类为信号转导、抗逆与能量代谢相关蛋白,其中一些蛋白可能与果蔗SoSGT1 直接互作,如HSP90 与RAR1 蛋白,另外一些蛋白与果蔗SoSGT1 可能产生次级互作.在<i>G. fujikuroi</i> 侵染果蔗‘福农’叶片时,HSP70、14-3-3 蛋白、2-半胱氨酸-过氧化物酶与吡哆醇生物合成蛋白的编码基因呈上调表达,初步说明这些蛋白可能与SoSGT1 蛋白互作共同参与了果蔗防御梢腐病病原<i>G. fujikuroi</i>的病理过程.
.
DOI:10.11926/j.issn.1005-3395.2015.03.004Magsci [本文引用: 1]

为了解果蔗(<i>Saccharum officenarum L.</i>)在防御<i>Gibberella fujikuroi</i> 过程中与SoSGT1 互作的蛋白,利用GST 蛋白标签载体pGEX-6p-1 与果蔗SoSgt1 基因构建pGEX-6p-1-sgt1 表达载体,诱导表达GST-SoSGT1 融合蛋白,并通过GST pull down 技术捕捉到7 个与SoSGT1 互作蛋白.这些蛋白的功能主要归类为信号转导、抗逆与能量代谢相关蛋白,其中一些蛋白可能与果蔗SoSGT1 直接互作,如HSP90 与RAR1 蛋白,另外一些蛋白与果蔗SoSGT1 可能产生次级互作.在<i>G. fujikuroi</i> 侵染果蔗‘福农’叶片时,HSP70、14-3-3 蛋白、2-半胱氨酸-过氧化物酶与吡哆醇生物合成蛋白的编码基因呈上调表达,初步说明这些蛋白可能与SoSGT1 蛋白互作共同参与了果蔗防御梢腐病病原<i>G. fujikuroi</i>的病理过程.
[本文引用: 1]
DOI:10.1038/nbt.1511 [本文引用: 1]
[本文引用: 1]
DOI:10.1093/nar/gkw937URL [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
DOI:10.1093/jxb/erv297URL [本文引用: 1]
DOI:10.1016/S0168-9525(00)02107-7URL [本文引用: 1]
DOI:10.1038/35081161 [本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0092-8674(03)00429-XURL [本文引用: 1]
.
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.107.112821URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1126/science.1080405URL [本文引用: 1]
DOI:10.1038/29087 [本文引用: 1]
DOI:10.1016/j.jksus.2010.06.022URL [本文引用: 1]
DOI:10.1093/jxb/erq243URL [本文引用: 1]
