 ,1
,1Establishment and Application of Real-Time PCR for Quantitatively Detecting Plasmopara viticola in Vitis vinifera
LI WenXue1, XIAO RuiGang2, Lü MiaoMiao1, DING Ning1, SHI HuaRong2, GU PeiWen ,1
,1通讯作者:
收稿日期:2018-12-4接受日期:2019-01-17网络出版日期:2019-05-01
| 基金资助: |
Received:2018-12-4Accepted:2019-01-17Online:2019-05-01
作者简介 About authors
李文学,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (4438KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李文学, 肖瑞刚, 吕苗苗, 丁宁, 石华荣, 顾沛雯. 葡萄霜霉病菌实时荧光定量PCR检测体系的建立和应用[J]. 中国农业科学, 2019, 52(9): 1529-1540 doi:10.3864/j.issn.0578-1752.2019.09.005
LI WenXue, XIAO RuiGang, Lü MiaoMiao, DING Ning, SHI HuaRong, GU PeiWen.
0 引言
【研究意义】由葡萄生单轴霉(Plasmopara viticola)引起的葡萄霜霉病遍及世界各葡萄产区,是危害最严重的葡萄叶部病害之一[1]。一般年份葡萄霜霉病导致的葡萄减产约为10%—20%,葡萄霜霉病流行年份可达50%—80%,甚至绝产,严重制约葡萄产业的发展[2,3]。葡萄霜霉病是一种典型的流行性病害[4],病菌从侵入到发病需要3—5 d[5]。在条件适宜时,从田间出现中心病株到全田普发,仅需10—15 d[6]。葡萄霜霉病菌是营活体营养专性寄生的真菌,目前人工无法培养,在一定程度上制约了葡萄霜霉病菌的早期诊断[7]、监测[4,8]和群体遗传分化[9,10]等方面的研究。尤其在病害潜伏侵染期间,传统的检测鉴定时间长,给该病害的防控工作带来极大的困难。因此,建立葡萄霜霉病早期的快速、便捷、定量的检测技术对于指导该病害防控工作具有重要意义。【前人研究进展】葡萄霜霉病菌的检测方面,传统的方法是保湿培养、活体接种纯化菌株、显微观察和形态鉴定[11,12],其程序繁琐、周期长,且无法定量研究[7,13]。随着生物技术的发展,近年来多种分子检测手段广泛应用于病原菌的检测和定量研究,如常规PCR、实时荧光定量PCR(real-time quantitative PCR,real-time PCR)和环介导等温扩增技术(loop- mediated isothermal amplification method,LAMP)。李荣[14]利用真菌的rDNA-ITS、β-tubulin和Cyt b基因序列研究了葡萄霜霉病菌菌株的遗传变异,得出Cyt b基因序列的辨析度最高,分类效果最清晰;秦文韬等[15]根据葡萄霜霉病菌细胞色素c氧化酶亚型2(cytochrome c oxidase II,cox2)基因设计特异性引物,检测了78份来自国内不同葡萄产区的葡萄霜霉病菌样本,准确率达100%。Real-time PCR是美国应用生物系统(Applied Biosystems,ABI)公司推出的通过检测荧光信号的变化进行核酸定量的技术[16],主要应用于分子快速检测和定量研究。随着该技术在植物病害诊断和防控工作中的快速发展,在指导生产中发挥了重要作用。ZHENG等[17]构建了定量检测小麦白粉病菌(Blumeria graminis f. sp. tritici)在叶片中潜伏侵染量的real-time PCR方法,通过人工和自然接种的方式进行田间小麦白粉病菌的早期监测,指导小麦白粉病的早期预测与防控;孙炳剑等[18]建立了基于小麦纹枯病菌(Rhizoctonia cerealis)β-tubilin的SYBR Green I real-time PCR体系,确定了病原菌DNA拷贝数与接种量及病情指数的相关关系;贺字典等[19]构建了定量检测土壤中棘孢木霉(Trichoderma asperellum)定殖的real-time PCR方法,并对防治黄瓜枯萎病后该生防木霉菌数量在土壤中的动态变化进行了检测;DUVIVIER等[20]利用real-time PCR技术研究小麦叶锈病的流行学,定量检测了孢子捕捉器捕获的空中小麦叶锈菌(Puccinia triticina)夏孢子量,探讨空中夏孢子量与病害严重度之间的关系;谢学文等[21]构建了短密木霉(Trichoderma brevicompactum)的real-time PCR体系,示踪短密木霉对辣椒疫霉(Phytophthora capsici)在南瓜根际土中的动态变化,揭示根际微生物的拮抗过程。在霜霉病菌的定量研究方面,VALSESIA等[22]利用探针法对叶片中的葡萄霜霉病菌进行了相对定量研究;LEE等[23]建立了定量检测黄瓜叶部古巴假霜霉(Pseudoperonospora cubensis)的real-time PCR方法;张娜等[24]构建了基于甜菜霜霉病菌(Peronospora farinosa)cox2的SYBR Green Ⅰ real-time PCR方法,该体系检测灵敏度为100 fg病菌DNA。【本研究切入点】在前人定性检测葡萄霜霉病菌的研究基础上,根据葡萄霜霉病菌cox2基因序列设计特异性引物,构建real-time PCR分子检测体系;通过人工接种的方法,研究潜育期葡萄叶片菌含量与接种时间的关系。【拟解决的关键问题】构建快捷、准确和定量检测葡萄霜霉病菌的real-time PCR方法,分析葡萄霜霉病菌在葡萄叶部潜育期菌含量的动态变化,建立相关模型,为田间葡萄霜霉病早期预测、风险评估和防治决策提供理论依据。1 材料与方法
试验于2017年6月至2018年10月在宁夏大学植物病理实验室和宁夏葡萄与葡萄酒研究院生理实验室完成。1.1 主要仪器和试剂
qTOWER 2.2荧光定量PCR仪(Jena公司,德国);Azure c200凝胶成像系统(Azure Biosystems公司,美国);Simpli Nano超微量分光光度计(GE公司,美国);电泳仪(北京六一厂);真菌DNA提取试剂盒(Biospin? Fungus Genomic DNA Extraction Kit,BioFlux公司,日本);植物DNA提取试剂盒(E.Z.N.A.? HP Plant DNA Mini Kit,Omega Bio-tek公司,美国);胶纯化试剂盒(Universal DNA Purification Kit,天根生化公司);质粒DNA小量试剂盒(AxyPrep? Plasmid Miniprep Kit,CORNING公司,美国);EcoTaq? PCR SuperMix(+dye)、TransStart? Tip Green qPCR SuperMix(全式金公司)。1.2 材料
14种葡萄及其他作物病原菌和拮抗菌包括 葡萄霜霉病菌、葡萄炭疽病菌(Colletotrichum gloeosporioides)、葡萄白粉病菌(Uncinula necator)、葡萄灰霉病菌(Botrytis cinerea)、葡萄白腐病菌(Coniella diplodiella)、葡萄溃疡病菌(Botryosphaeria dothidea)、白菜黑斑病菌(Alternaria brassicae)、辣椒炭疽病菌(C. capsica)、甘草根腐病菌(Fusarium solani)、西葫芦白粉病菌(Sphaerotheca fuliginea)、番茄菌核病菌(Sclerotinia sclerotiorum)、马铃薯干腐病菌(F. equiseti)、西瓜枯萎病菌(F. oxysporum)、哈茨木霉(Trichoderma harzianum)(表1)。其中马铃薯干腐病菌、西瓜枯萎病菌和哈茨木霉由宁夏农林科学院植物保护研究所沈瑞清研究员提供,其他菌株由宁夏大学农学院植物病理实验室纯化保存。Table 1
表1
表1供试菌株
Table 1
| 菌株编号 Number | 拉丁学名 Latin name | 寄主(品种) Host (Variety) | 菌株编号 Number | 拉丁学名 Latin name | 寄主(品种) Host (Variety) | |
|---|---|---|---|---|---|---|
| P1 | P. viticola | 葡萄(黑比诺) Vitis vinifera (Pinot Noir) | 6 | S. fuliginea | 西葫芦 Cucurbita pepo | |
| P2 | P. viticola | 葡萄(霞多丽) V. vinifera (Chardonnay) | 7 | C. diplodiella | 葡萄(威代尔) V. vinifera (Vidal) | |
| P3 | P. viticola | 葡萄(赤霞珠) V. vinifera (Cabernet Sauvignon) | 8 | B. cinerea | 葡萄(红地球) V. vinifera (Red Globe) | |
| 1 | A. brassicae | 白菜 Brassica pekinensis | 9 | S. sclerotiorum | 番茄 Lycopersicon esculentum | |
| 2 | C. gloeosporioides | 葡萄(红地球) V. vinifera (Red Globe) | 10 | F. equiseti | 马铃薯 Solanum tuberosum | |
| 3 | C. capsici | 辣椒 Capsicum annuum | 11 | F. oxysporum | 西瓜 Citrullus lanatus | |
| 4 | F. solani | 甘草 Glycyrrhiza uralensis | 12 | B. dothidea | 葡萄(红地球) V. vinifera (Red Globe) | |
| 5 | U. necator | 葡萄(赤霞珠) V. vinifera (Cabernet Sauvignon) | 13 | T. harzianum | 马铃薯 S. tuberosum |
新窗口打开|下载CSV
1.3 方法
1.3.1 样品DNA的提取 称取0.5 g葡萄叶片,利用E.Z.N.A.? HP Plant DNA Kit(OMEGA公司)提取葡萄叶片总DNA;称取真菌菌丝体0.1 g,用Biospin? Fungus Genomic DNA Extraction Kit(BioFlux公司)提取真菌菌丝体DNA。超微量分光光度计检测DNA浓度及OD值,DNA浓度均稀释至200 ng·μL-1,-20℃保存备用。1.3.2 引物的设计与合成 使用Primer Premier 5.0,根据GenBank中葡萄霜霉病菌的cox2基因序列 (登录号:HM628756.1、KC774622.1、KJ654170.1、KP684908.1、KT944077.1等)设计2对引物F-Pv(5′-CA AGATCCAGCAACTCCAGTTATGGA-3′)/R-Pv(5′- ACATTGTCCATAAAAAACACCTTGT-3′)和F-cox- Pv(5′-TCGTGTATTGATTACTGCGTCAAA-3′)/R-Pv,由生工生物工程(上海)有限公司合成。
1.3.3 引物特异性检查 对提取的上述(表1)13种葡萄、白菜、辣椒、甘草、西葫芦、番茄、马铃薯、西瓜上的病原菌和1种拮抗菌(T. harzianum)的DNA,以ddH2O为空白对照,用引物对F-Pv/R-Pv和F-cox-Pv/R-Pv进行常规PCR和real-time PCR扩增,检测引物特异性。
常规PCR反应体系(25 μL):2×EcoTaq? PCR SuperMix(+dye)12.5 μL,上下游引物(10 μmol·L-1)各0.5 μL,DNA模板1 μL,ddH2O补足。反应条件:94℃预变性10 min;94℃变性30 s,57℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min,4℃ ∞。PCR产物经1.5%琼脂糖凝胶电泳检测后,凝胶成像系统分析结果。
Real-time PCR反应体系(20 μL):以SYBR Green Ⅰ为荧光染料,进行real-time PCR反应。2× TransStart? Tip Green qPCR SuperMix 10 μL,正反引物(10 μmol·L-1)0.4 μL,模板DNA 1.0 μL,ddH2O补足。Real-time PCR反应条件(三步法):94℃预变性30 s;94℃变性5 s,59℃退火15 s,72℃延伸30 s(收集荧光信号),40个循环。PCR循环结束后,加热至95℃后降至60℃并保持15 s,然后按照5℃·s?1升温至95℃,在升温时每0.5℃收集荧光信号一次,建立熔解曲线,熔解曲线分析中有单一特异的峰为判断引物特异性的标准。
1.3.4 优化real-time PCR反应退火温度 为提升real-time PCR反应扩增特异性,优化退火温度(annealing temperature,Tm)。按1.3.3 real-time PCR反应体系及条件,以扩增曲线和熔解曲线荧光值(ΔRn)最高、循环阈值(每个反应管内的荧光信号到达设定的阈值时所经历的循环数,cycle threshold,Ct)最小且在熔解曲线分析中有单一吸收峰为标准,进行最佳退火温度的优化。
1.3.5 灵敏度检测 基因组DNA经超微量分光光度计测定浓度后按10倍稀释,分别釆用常规PCR和real-time PCR的扩增方法进行PCR检测,根据扩增片段的有无和荧光值的大小,评价引物在两种PCR技术下对葡萄霜霉病菌DNA检测的灵敏度。
1.3.6 重组质粒的制备 葡萄霜霉病菌特异性引物F-cox-Pv/R-Pv扩增产物经纯化后,与pEASY?-T1 Simple Cloning Vector于25℃连接后,转至Trans1-T1感受态细胞中,37℃过夜培养,挑取白色单克隆,转于含有Amp的LB液体培养基中,37℃、200 r/min振荡培养12 h。提取重组质粒,使用PCR验证和测序(生工生物工程(上海)有限公司)的方法检测是否正确插入目的片段。超微量分光光度计测定质粒DNA浓度和纯度,根据摩尔定律,计算单位体积质粒所含的DNA拷贝数浓度。
质粒拷贝数=[质粒浓度(ng?μL-1)×质粒体积(μL)×6.02×1023]/[(载体长度bp+片段长度bp)×660 g?mol-1]
1.3.7 Real-time PCR标准曲线绘制及方法有效性检验 将定量后的高拷贝数重组质粒按10倍梯度进行稀释,作为标准品。用引物F-cox-Pv/R-Pv进行real-time PCR检测,选择荧光值稳定且线性比例良好的浓度范围,以拷贝数对数值为x轴、Ct值为y轴,构建real-time PCR标准曲线(由软件real-time PCR soft 3.2生成)。根据real-time PCR标准曲线的相关系数、斜率、PCR扩增效率等,验证该方法的有效性。其中,相关系数R2>0.98;曲线斜率为-3.0—-3.5;PCR扩增效率(E)为0.9—1.2;标准偏差<0.2;real-time PCR扩增效率E=10(-1/斜率)-1。
1.3.8 Real-time PCR定量检测接种后叶片中病原菌含量 选用在? MS培养基上培养40 d,根系达到4—5根的赤霞珠葡萄无菌组培苗,摘取大小相似的叶片进行接种试验。葡萄霜霉病菌来源于田间发病初期的葡萄叶片,取回后无菌水冲洗表面灰尘,气候培养箱中24℃、相对湿度95%的黑暗条件下进行保湿培养,至叶背密集长出新的霉层,选取霉层厚度一致的部位,用1.5 cm打孔器打取病斑叶盘,将叶盘霉层直接与无菌组培苗叶背拓贴接菌,一叶一盘。在气候培养箱中24℃、相对湿度95%的黑暗条件下保湿培养6 h,去掉叶盘,共接种葡萄叶片30片,以空白无菌组培苗叶片为对照;在气候培养箱中培养6、12、24、48、72和96 h(接种96 h后叶片出现霉层)收集接种叶片,每处理重复3次。将葡萄叶片无菌水清洗,剪碎,混匀,称取0.5 g,按照1.3.1的方法提取葡萄叶片总DNA。用引物F-cox-Pv/R-Pv进行real-time PCR扩增,应用已构建的标准曲线计算潜育期叶片中葡萄霜霉病菌的带菌量(反应体系和条件同1.3.3),建立接种叶片内霜霉病菌DNA量随时间变化的定量关系。
1.4 数据处理
采用统计软件IBM SPSS Statistics 19.0的Regression-Curve Estimation程序进行曲线模拟。2 结果
2.1 引物特异性验证
应用引物F-Pv/R-Pv和F-cox-Pv/R-Pv对葡萄霜霉病菌、12株植物病原菌和1株拮抗菌(表1)的DNA进行常规PCR扩增,结果显示仅葡萄霜霉病菌DNA扩增出570和139 bp的目标条带,而其他供试菌DNA和清水对照等均未扩增出条带(图1)。应用引物F-cox- Pv/Pv-R进行real-time PCR扩增,结果表明该引物仅对葡萄霜霉病菌有唯一的产物吸收峰(图2)。图1
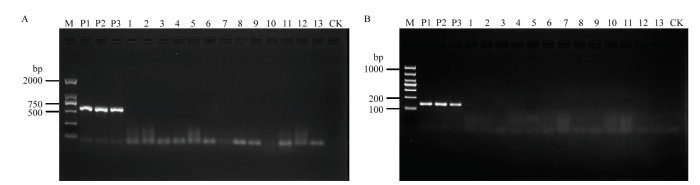 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1引物F-Pv/R-Pv(A)和F-cox-Pv/R-Pv(B)特异性检测
M:Marker;P1—P3:葡萄霜霉病菌P. viticola;1—13:12种病原菌和1种拮抗菌名称见
Fig. 1Specificity detection of P. viticola primers F-Pv/R-Pv (A) and F-cox-Pv/ R-Pv (B) by using genomic DNA with conventional PCR
图2
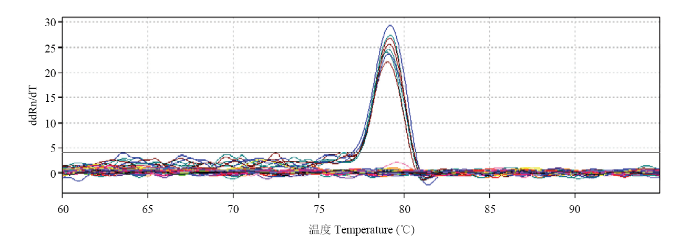 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2Real-time PCR熔解曲线
Fig. 2Melting curves of real-time PCR amplification
2.2 引物灵敏度检测
利用10倍浓度梯度稀释的基因组DNA对引物F-Pv/R-Pv和F-cox-Pv/R-Pv进行常规PCR灵敏度测定,结果表明常规PCR的检测灵敏度为1.0×10-2 ng·μL-1(图3);Real-time PCR技术利用引物对F-cox-Pv/R-Pv的检测灵敏度为1.0×10-4 ng·μL-1(图4),是常规PCR检测灵敏度的100倍。图3
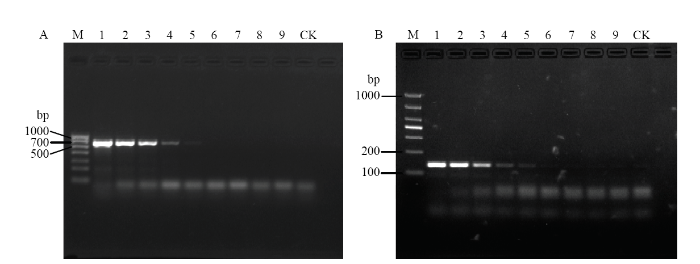 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3引物F-Pv/R-Pv(A)和F-cox-Pv/R-Pv(B)常规PCR灵敏度检测
M:Marker;1—9:模板浓度依次为 50、5、1×100—1×10-6 ng·μL-1 The template concentration of 1-9 is 50, 5, 1×100-1×10-6 ng·μL-1;CK:清水对照Negative control group
Fig. 3Sensitivity detection of P. viticola primers F-Pv/R-Pv (A) and F-cox-Pv/R-Pv (B) by using series genomic DNA dilutions with conventional PCR
图4
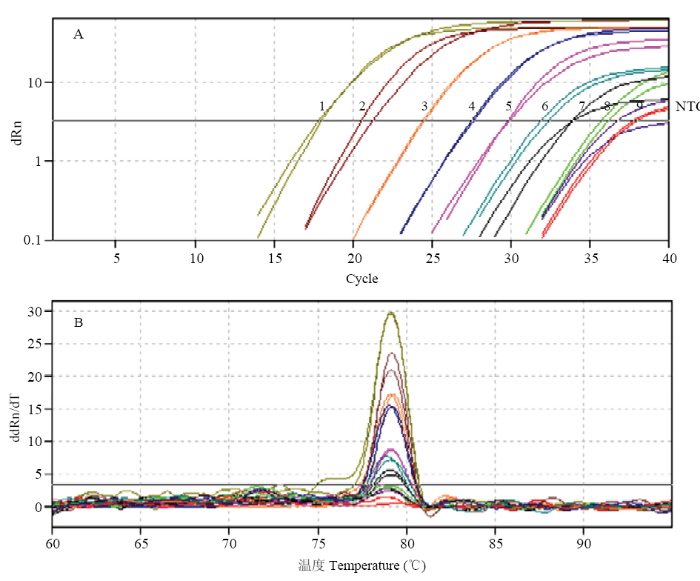 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4Real-time PCR检测引物灵敏度
1—9:模板浓度依次为50、5、1×100—1×10-6 ng·μL?1 The template concentration of 1-9 is 50, 5, 1×100-1×10-6 ng·μL-1;NTC:无模板清水对照No template
Fig. 4Sensitivity detection of P. viticola primers with real-time PCR
2.3 Real-time PCR反应退火温度的优化
优化real-time PCR反应退火温度(Tm),提升反应扩增特异性。以引物对F-cox-Pv/R-Pv常规PCR最优Tm值57℃为基础,采用线性±1℃筛选最优Tm值(图5)。结果表明引物对F-cox-Pv/R-Pv在59℃时获得最小Ct值(图5-A)和最高荧光强度(图5-A、5-B),为最优Tm值,因此选择59℃作为葡萄霜霉病菌real-time PCR反应的Tm值。图5
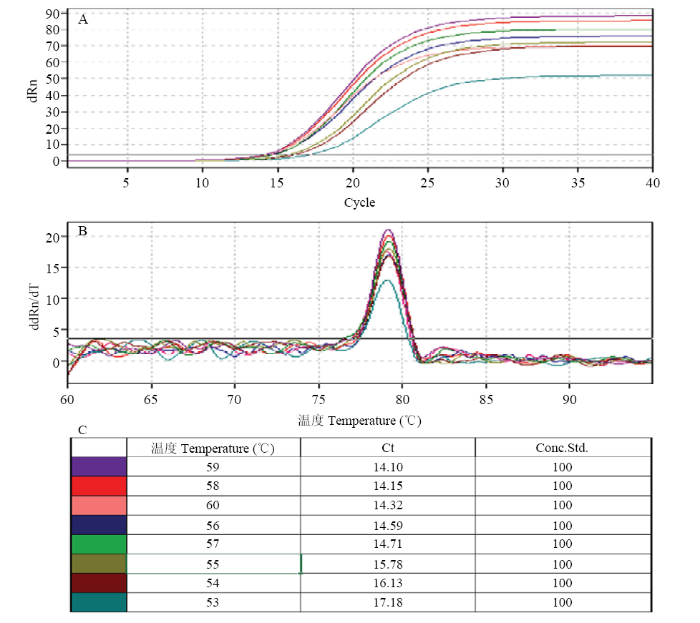 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5Real-time PCR反应Tm值的优化
Fig. 5Optimization of Tm value of real-time PCR assays
2.4 Real-time PCR标准曲线的建立及方法有效性检验
2.4.1 重组质粒的制备 成功将目的片段插入到pEASY?-T1 Simple克隆载体,常规PCR检测插入的片段大小约140 bp(图6),与测序结果139 bp一致;提取的重组质粒浓度和纯度(A260/A280=1.874)均较高,重组质粒的制备符合试验要求。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6重组质粒的构建
M:Marker;P:基因组DNA的常规PCR结果 Conventional PCR results of genomic DNA;D:白色单克隆的常规PCR结果 Conventional PCR results of white monoclonal;W、V:质粒DNA的常规PCR结果Conventional PCR results of plasmid DNA;CK:清水对照Negative control group
Fig. 6Construction of recombinant plasmid
2.4.2 标准曲线的建立及方法有效性检验 重组质粒以10倍梯度稀释制备标准品进行real-time PCR检测,引物F-cox-Pv/R-Pv的扩增对数曲线规律较好(图7-A);以不同稀释梯度的质粒拷贝数对数为x轴、Ct值为y轴构建标准曲线(图7-B),该体系线性关系良好(y=42.27-3.36x),相关系数R2=0.9968,斜率为-3.36,截距为42.27,扩增效率为98.50%,线性范围达7个数量级(2.4×103—2.4×109 copies/μL)。
图7
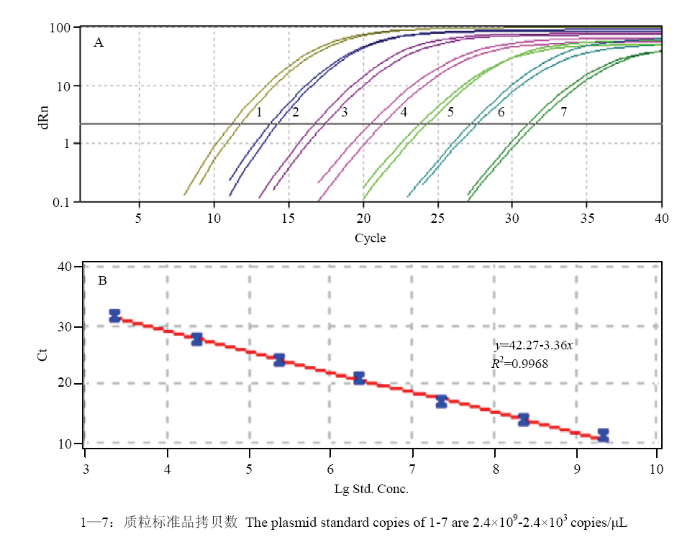 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7Real-time PCR标准曲线的建立
1—7:质粒标准品拷贝数 The plasmid standard copies of 1-7 are 2.4×109-2.4×103 copies/μL
Fig. 7Establishment of real-time PCR standard curve
2.5 潜伏侵染叶片中病原菌的real-time PCR定量测定
应用构建的real-time PCR体系测定葡萄霜霉病菌在葡萄叶部潜育期的量,接种6 h后就可以检测到葡萄霜霉病菌DNA(图8-A),通过Ct值在标准方程中换算得到葡萄霜霉病菌DNA的拷贝数(表2),接种48 h内叶中潜伏的病原菌量变化不显著,而到72、96 h时显著高于48 h。潜伏侵染显症前葡萄霜霉病菌DNA量随接种时间呈指数增长(图8-B),可用如下方程表示:y=6.34×104·e0.084x(R2=0.936),其中y为葡萄叶片内葡萄霜霉病菌DNA量的拷贝数,x为接种后小时数。图8
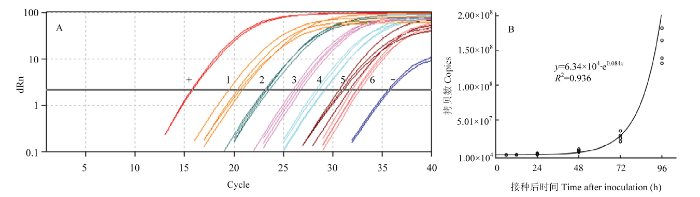 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8葡萄霜霉病菌叶部潜育期的检测(A)及其动态模拟(B)
“+”:阳性样本Positive sample;“?”:阴性样本Negative sample;1—6:依次表示接种后96、72、48、24、12和6 h The time after inoculation of 1-6 is 96, 72, 48, 24, 12, and 6 h
Fig. 8Detection of leaf latent period of P. viticola (A) and its dynamic simulation (B)
Table 2
表2
表2潜伏侵染叶片中葡萄霜霉病菌的real-time PCR定量测定
Table 2
| 接种后时间 Time after inoculation (h) | Ct值 Ct value | 检测结果 Detection result (copies/μL) |
|---|---|---|
| 6 | 32.36±0.57 | (5.68±2.76) ×104c |
| 12 | 31.04±0.81 | (2.12±1.17) ×105c |
| 24 | 28.89±1.06 | (1.26±0.72) ×106c |
| 48 | 26.33±0.40 | (5.95±1.52) ×106c |
| 72 | 23.77±0.21 | (2.62±0.37) ×107b |
| 96 | 20.15±0.29 | (1.30±0.20) ×108a |
新窗口打开|下载CSV
3 讨论
葡萄霜霉病是典型的单年流行病害,在田间潜育期短,发病快[4,25],建立潜伏侵染阶段的病原菌监测与定量方法对早期准确估计田间病情、确定发病中心并制定及时有效的防治方案具有重要意义[26,27,28]。目前有关葡萄霜霉病菌的real-time PCR检测体系和早期分子诊断的方法报道较少。本研究基于葡萄霜霉病菌cox2设计了特异性引物F-cox-Pv/R-Pv,该引物对葡萄霜霉病菌具有较高的特异性,real-time PCR熔解曲线在79℃有唯一的产物吸收峰,灵敏性达到0.1 pg·μL-1,是常规PCR的100倍。陈长军等[29]建立的油菜菌核病菌(Sclerotinia sclerotiorum)real-time PCR检测方法,最低检测值为1.4×10-3 ng·μL-1,灵敏度是常规PCR的10—100倍;程颖超等[30]根据辣椒疫霉Actin构建的real-time PCR体系灵敏度为0.1 pg·μL-1,为常规PCR灵敏度的100倍;秦文韬[31]利用LAMP技术对葡萄霜霉病菌进行了扩增,其灵敏度也是常规PCR的100倍,但与real-time PCR相比,LAMP引物设计较为繁琐[32],成本高,准确性差,易产生假阳性[33],若无特殊仪器(如浑浊仪)无法进行定量分析。而real-time PCR由于操作简单,特异性高,扩增过程通过收集荧光信号可实时观察反应的全过程,反应灵敏,是进行定量研究最为常用的技术之一,在植物病原的早期诊断和定量检测中发挥着重要的作用。Real-time PCR与常规PCR相比对引物特异性和扩增片段大小的要求更高,引物扩增片段大小一般为100—300 bp[19,29-30]。扩增片段过长,增加了非特异性扩增的概率,熔解曲线表现为多吸收峰[18,34]。本试验选择的引物扩增片段大小符合real-time PCR扩增要求,为139 bp,且对葡萄霜霉病菌特异性高。在优化葡萄霜霉病菌real-time PCR检测体系时发现,太低的退火温度,扩增反应出现更大的Ct值、更小的荧光信号值,这可能与低的退火温度产生非特异性扩增有关[29,35]。扩增反应结束后,将反应体系温度升高至95℃后迅速降温至60℃,有利于熔解曲线阶段捕获稳定的荧光信号,获得更好的产物吸收峰[18,36],这可能与高温减少引物二聚体的含量,降低其对荧光信号的干扰有关。
目前,利用real-time PCR方法对病原菌潜伏侵染的定量分析多集中于禾谷类作物病害的研究,而对于葡萄霜霉病菌的潜伏侵染定量研究报道较少。陈清清等[36]利用SYBR Green I real-time PCR定量检测索氏平脐蠕孢(Bipolaris sorokinianaa)引起的小麦根腐病,可以检测出田间小麦样品中52.8 fg·μL-1的病菌DNA;潘娟娟等[37]利用real-time PCR方法检测到接种12 h后小麦条锈病菌(P. striiformis)的DNA含量,潜育期病原菌量检测范围为100 fg—10 ng。本研究构建的葡萄霜霉病菌real-time PCR体系具有良好的线性关系(R2=0.9968),范围为2.4×103—2.4×109 copies/μL,扩增效率为98.50%,重复性较好,可定量检测低至5.68×104 copies/μL的叶片内葡萄霜霉病菌潜伏侵染量,达到病害早期预警的病原检测要求[30,35,37]。利用该体系定量检测葡萄霜霉病菌在葡萄叶片潜育期病原菌的DNA量,能检测到病原菌侵入叶片6 h后的低侵染量,这为葡萄霜霉病的早期诊断与预测提供了技术支持。
处于潜育期的葡萄霜霉病叶片不表现症状,叶片内病原菌含量太低,采用传统的生物学检测方法耗时较长,待显症后已造成损失,为病害的预测和防控带来困难。金恭玺等[7]曾采用病部研磨-过筛-离心-镜检的方法证明葡萄霜霉病菌卵孢子在病残体上越冬;于舒怡等[8,25]采用田间捕获孢子囊的方法探讨了孢子囊密度与葡萄霜霉病始发期、田间病害发生程度以及气候条件的相关性,这些传统的葡萄霜霉病菌检测方法手段繁琐、无法进行早期的病害预测。目前,根据真菌ITS、β-tublin以及cox2等保守序列设计的特异性引物,利用real-time PCR方法定量研究如种子[38]、叶片[37,39-40]、土壤[19,21,36]中潜伏侵染的病原菌,确定了病原菌DNA拷贝数与接种量及病情指数的相关性,可为病害的早期预测、风险评估和防治决策提供理论依据[35,36,37]。本研究建立的葡萄霜霉病菌real-time PCR体系和病原潜伏侵染量的检测方法,对预测葡萄霜霉病始发期的意义更大,结合田间微环境条件确定田间发病中心,从而及时有效地控制病害的发生和蔓延。
4 结论
将real-time PCR技术应用于葡萄霜霉病菌的快速检测,显著提高了病菌检测的灵敏度,同时可对葡萄霜霉病菌潜育期叶片的病原量进行准确的定量检测。通过定量检测潜育期叶片中病原菌量,结合田间微气候、寄主植物感病程度等条件预测田间病害的始发期,可及时有效地防控葡萄霜霉病的发生,在葡萄生产上具有重要的理论和实际应用价值。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s10658-013-0188-5URL [本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
Magsci [本文引用: 1]

实现对受到病原侵染的小麦植株进行早期检测,对于小麦病害的监测预警和及早防治具有重要意义。为研究热红外成像技术早期检测小麦病害的可行性,该研究以小麦条锈病为例,以健康小麦植株、条锈病潜育期和发病期小麦植株为试验材料,利用热红外成像技术采集他们的热红外图像和叶片温度,在潜育期内连续检测其热红外图像和叶片温度随接种天数的变化。通过图像对比发现,接种后第5天,肉眼观察热红外图像可将受到侵染但未显症的小麦植株与健康植株区分开来。进一步数据处理,表明接种后第3天处于条锈病潜育期的小麦植株叶片平均温度和不同部位最大温差分别比健康植株叶片的低0.08℃和高0.04℃(P<0.05),可将处于条锈病潜育期的小麦植株与健康植株区分开来。随着接种后天数的增加,处于条锈病潜育期的小麦植株叶片的平均温度和最大温差与健康小麦植株叶片的差异逐渐增大。接种后第12天,接种小麦植株叶片平均温度比健康植株叶片低1.22℃,接种小麦植株叶片最大温差比健康植株叶片高1.58℃。可见,利用热红外成像技术可以早期检测到小麦受到病原侵染后的温度变化,热红外成像技术作为一种小麦病害早期检测的方法是可行的。
Magsci [本文引用: 1]

实现对受到病原侵染的小麦植株进行早期检测,对于小麦病害的监测预警和及早防治具有重要意义。为研究热红外成像技术早期检测小麦病害的可行性,该研究以小麦条锈病为例,以健康小麦植株、条锈病潜育期和发病期小麦植株为试验材料,利用热红外成像技术采集他们的热红外图像和叶片温度,在潜育期内连续检测其热红外图像和叶片温度随接种天数的变化。通过图像对比发现,接种后第5天,肉眼观察热红外图像可将受到侵染但未显症的小麦植株与健康植株区分开来。进一步数据处理,表明接种后第3天处于条锈病潜育期的小麦植株叶片平均温度和不同部位最大温差分别比健康植株叶片的低0.08℃和高0.04℃(P<0.05),可将处于条锈病潜育期的小麦植株与健康植株区分开来。随着接种后天数的增加,处于条锈病潜育期的小麦植株叶片的平均温度和最大温差与健康小麦植株叶片的差异逐渐增大。接种后第12天,接种小麦植株叶片平均温度比健康植株叶片低1.22℃,接种小麦植株叶片最大温差比健康植株叶片高1.58℃。可见,利用热红外成像技术可以早期检测到小麦受到病原侵染后的温度变化,热红外成像技术作为一种小麦病害早期检测的方法是可行的。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 3]

采用高通量实时荧光定量PCR 技术建立检测和监测油菜菌核病菌群体数量的方法。利用油菜菌核病菌(Sclerotiniasclerotiorum)的茁-微管蛋白基因内含子序列的特异性,设计引物对SclSF (5'-CTCAAATCTCCGAAAGTT -3') / SclAF (5'-TGCAGACGGGTAATATG -3'),建立和优化了SYBR Green 玉实时荧光定量PCR 检测体系。结果表明,该引物对能够从8种所测试的十字花科植物常见病原真菌中特异性扩增出油菜菌核病菌;所建立的实时定量PCR 技术可应用于油菜病叶和病茎中菌核病菌的早期检测及菌核病的预测预报。
Magsci [本文引用: 3]

采用高通量实时荧光定量PCR 技术建立检测和监测油菜菌核病菌群体数量的方法。利用油菜菌核病菌(Sclerotiniasclerotiorum)的茁-微管蛋白基因内含子序列的特异性,设计引物对SclSF (5'-CTCAAATCTCCGAAAGTT -3') / SclAF (5'-TGCAGACGGGTAATATG -3'),建立和优化了SYBR Green 玉实时荧光定量PCR 检测体系。结果表明,该引物对能够从8种所测试的十字花科植物常见病原真菌中特异性扩增出油菜菌核病菌;所建立的实时定量PCR 技术可应用于油菜病叶和病茎中菌核病菌的早期检测及菌核病的预测预报。
[本文引用: 3]
[本文引用: 3]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1002/rmv.v18:6URL [本文引用: 1]
DOI:10.1006/bbrc.2001.5921URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.13346/j.mycosystema.130075Magsci [本文引用: 4]

由索氏平脐蠕孢Bipolaris sorokiniana引起的小麦根腐病,常和其他土传真菌病害混合发生,传统的症状鉴别方法很难区分,导致病害防控难度增加。为建立病菌实时荧光定量检测体系,根据ITS序列设计引物,筛选出1对特异性引物BS-F/R,扩增片段大小为280bp。以菌丝DNA为标准品构建实时荧光定量标准曲线,并对其灵敏度、特异性、可重复性进行评价。结果表明,建立的实时荧光定量PCR检测方法速度快,灵敏度高,特异性强,重复性好。构建的荧光定量PCR标准曲线循环阈值与模板浓度呈良好的线性关系,溶解曲线的吸收峰单一,扩增效率良好。利用该定量检测体系,可以检测出田间小麦样品中52.8fg/μL的病菌DNA。
DOI:10.13346/j.mycosystema.130075Magsci [本文引用: 4]

由索氏平脐蠕孢Bipolaris sorokiniana引起的小麦根腐病,常和其他土传真菌病害混合发生,传统的症状鉴别方法很难区分,导致病害防控难度增加。为建立病菌实时荧光定量检测体系,根据ITS序列设计引物,筛选出1对特异性引物BS-F/R,扩增片段大小为280bp。以菌丝DNA为标准品构建实时荧光定量标准曲线,并对其灵敏度、特异性、可重复性进行评价。结果表明,建立的实时荧光定量PCR检测方法速度快,灵敏度高,特异性强,重复性好。构建的荧光定量PCR标准曲线循环阈值与模板浓度呈良好的线性关系,溶解曲线的吸收峰单一,扩增效率良好。利用该定量检测体系,可以检测出田间小麦样品中52.8fg/μL的病菌DNA。
[本文引用: 4]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

<P><FONT face=Verdana>【目的】建立荧光定量PCR体系以准确灵敏的鉴定小麦黑穗菌(Tilletia controversa Kühn,TCK)【方法】根据筛选的TCK独有差异基因片段(1 322 bp)设计特异性引物对CQUTCK4/CQUTCK5和TaqMan 探针CQUP1,建立SYBR GreenⅠ荧光染料法和TaqMan水解探针法定量PCR检测体系,并对体系进行优化。【结果】建立的两套定量PCR检测体系的检测下限相当,可达到0.1fg,对应的拷贝数为2.31×104个,检测灵敏度比常规PCR高2~3个数量级,均可成功鉴别出TCK与小麦网腥黑穗病菌(Tilletia caries (DC)Tul,TCT),并可快速准确检测小麦矮腥黑穗菌冬孢子和检测罹病小麦植株体内的侵染菌丝体。【结论】建立的2种定量PCR检测技术可运用于小麦矮腥黑穗病的早期诊断。<BR></FONT></P>
Magsci [本文引用: 1]

<P><FONT face=Verdana>【目的】建立荧光定量PCR体系以准确灵敏的鉴定小麦黑穗菌(Tilletia controversa Kühn,TCK)【方法】根据筛选的TCK独有差异基因片段(1 322 bp)设计特异性引物对CQUTCK4/CQUTCK5和TaqMan 探针CQUP1,建立SYBR GreenⅠ荧光染料法和TaqMan水解探针法定量PCR检测体系,并对体系进行优化。【结果】建立的两套定量PCR检测体系的检测下限相当,可达到0.1fg,对应的拷贝数为2.31×104个,检测灵敏度比常规PCR高2~3个数量级,均可成功鉴别出TCK与小麦网腥黑穗病菌(Tilletia caries (DC)Tul,TCT),并可快速准确检测小麦矮腥黑穗菌冬孢子和检测罹病小麦植株体内的侵染菌丝体。【结论】建立的2种定量PCR检测技术可运用于小麦矮腥黑穗病的早期诊断。<BR></FONT></P>
