 ,1, 李凡
,1, 李凡 ,2, 李月月2, 张松柏1, 高希武3, 谢艳4, 燕飞5, 张安盛6, 戴良英7, 程兆榜8, 丁铭16, 牛颜冰18, 王升吉6, 车海彦19, 江彤12, 史晓斌1, 何自福15, 吴云锋10, 张德咏1, 青玲20, 严婉荣21, 杨学辉17, 汤亚飞15, 郑红英5, 唐前君7, 章松柏9, 章东方14, 蔡丽13, 陶小荣11
,2, 李月月2, 张松柏1, 高希武3, 谢艳4, 燕飞5, 张安盛6, 戴良英7, 程兆榜8, 丁铭16, 牛颜冰18, 王升吉6, 车海彦19, 江彤12, 史晓斌1, 何自福15, 吴云锋10, 张德咏1, 青玲20, 严婉荣21, 杨学辉17, 汤亚飞15, 郑红英5, 唐前君7, 章松柏9, 章东方14, 蔡丽13, 陶小荣11Identification, Distribution and Occurrence of Viruses in the Main Vegetables of China
LIU Yong ,1, LI Fan
,1, LI Fan ,2, LI YueYue2, ZHANG SongBai1, GAO XiWu3, XIE Yan4, YAN Fei5, ZHANG AnSheng6, DAI LiangYing7, CHENG ZhaoBang8, DING Ming16, NIU YanBing18, WANG ShengJi6, CHE HaiYan19, JIANG Tong12, SHI XiaoBin1, HE ZiFu15, WU YunFeng10, ZHANG DeYong1, QING Ling20, YAN WanRong21, YANG XueHui17, TANG YaFei15, ZHENG HongYing5, TANG QianJun7, ZHANG SongBai9, ZHANG DongFang14, CAI Li13, TAO XiaoRong11
,2, LI YueYue2, ZHANG SongBai1, GAO XiWu3, XIE Yan4, YAN Fei5, ZHANG AnSheng6, DAI LiangYing7, CHENG ZhaoBang8, DING Ming16, NIU YanBing18, WANG ShengJi6, CHE HaiYan19, JIANG Tong12, SHI XiaoBin1, HE ZiFu15, WU YunFeng10, ZHANG DeYong1, QING Ling20, YAN WanRong21, YANG XueHui17, TANG YaFei15, ZHENG HongYing5, TANG QianJun7, ZHANG SongBai9, ZHANG DongFang14, CAI Li13, TAO XiaoRong11通讯作者:
责任编辑: 岳梅
收稿日期:2018-08-25接受日期:2018-10-21网络出版日期:2019-01-16
| 基金资助: |
Received:2018-08-25Accepted:2018-10-21Online:2019-01-16

摘要
关键词:
Abstract
Keywords:
PDF (651KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
刘勇, 李凡, 李月月, 张松柏, 高希武, 谢艳, 燕飞, 张安盛, 戴良英, 程兆榜, 丁铭, 牛颜冰, 王升吉, 车海彦, 江彤, 史晓斌, 何自福, 吴云锋, 张德咏, 青玲, 严婉荣, 杨学辉, 汤亚飞, 郑红英, 唐前君, 章松柏, 章东方, 蔡丽, 陶小荣. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J]. 中国农业科学, 2019, 52(2): 239-261 doi:10.3864/j.issn.0578-1752.2019.02.005
LIU Yong, LI Fan, LI YueYue, ZHANG SongBai, GAO XiWu, XIE Yan, YAN Fei, ZHANG AnSheng, DAI LiangYing, CHENG ZhaoBang, DING Ming, NIU YanBing, WANG ShengJi, CHE HaiYan, JIANG Tong, SHI XiaoBin, HE ZiFu, WU YunFeng, ZHANG DeYong, QING Ling, YAN WanRong, YANG XueHui, TANG YaFei, ZHENG HongYing, TANG QianJun, ZHANG SongBai, ZHANG DongFang, CAI Li, TAO XiaoRong.
0 引言
【研究意义】我国是世界蔬菜种植大国,种植面积、总产量、人均蔬菜消费量和出口量均居世界第一[1]。自2011年以来,蔬菜产量和产值均超越粮食作物,成为我国的第一大类农作物。2016年,我国蔬菜产量已达7.98亿吨,种植面积达2 232.8万公顷左右,总产值1.9万亿元,超过水稻、小麦、玉米等粮食作物总产值之和(1.3万亿元)(数据来源:农业农村部种植业管理司等)。近年来,国家非常重视蔬菜产业的发展,根据《全国蔬菜产业发展规划(2011-2020年)》,将全国蔬菜产区划分为华南与西南热区冬春蔬菜、长江流域冬春蔬菜、黄土高原夏秋蔬菜、云贵高原夏秋蔬菜、北部高纬度夏秋蔬菜、黄淮海与环渤海设施蔬菜等6个优势区域,重点建设580个蔬菜产业重点县(市、区),为保障和提高全国蔬菜均衡供应能力发挥了重要作用[2]。随着全国各地蔬菜种植规模的逐步扩大,尤其是大棚蔬菜的普及和规模化发展,病毒病的发生范围越来越广,已成为危害我国蔬菜生产的第一大类病害,年危害面积达758.6万公顷,造成的经济损失已超1 000亿元(数据来源:农业农村部种植业管理司等)。病毒病的发生往往造成部分地区蔬菜绝收,给种植户造成巨大的经济损失,成为严重制约我国蔬菜产业健康持续发展的首要因素。因此,尽快探明当前我国茄科、葫芦科、豆科和十字花科等主要蔬菜作物的病毒种类和分布,分析主要病毒的发生和流行趋势等,对减轻蔬菜病毒病的危害和制定合理的蔬菜产业发展规划均具有重要意义。【前人研究进展】蔬菜作物感染病毒病后主要表现为花叶、斑驳、坏死、皱缩、黄化、矮化和畸形等症状,不同病毒在同一种蔬菜作物上或同一种病毒在不同蔬菜作物上甚至同一病毒在同一种蔬菜的不同生长期产生的症状都不尽相同。目前我国广泛种植的蔬菜主要涉及茄科、葫芦科、豆科和十字花科等常见蔬菜品种,如茄科的辣椒、番茄和茄子等,葫芦科的南瓜、西葫芦、黄瓜等,豆科的菜豆、豇豆等,十字花科的大白菜、萝卜等。茄科蔬菜作物种植面积大、分布范围广,辣椒和番茄上发生的病毒病较为普遍,世界各地陆续报道的辣椒病毒有70种以上[3,4,5],仅我国报道的已达31种[4,5,6,7,8,9,10,11,12],主要为烟草花叶病毒(Tobacco mosaic virus,TMV)等烟草花叶病毒属(Tobamovirus)病毒、马铃薯Y病毒(Potato virus Y,PVY)等马铃薯Y病毒属(Potyvirus)病毒、番茄斑萎病毒(Tomato spotted wilt tospovirus,TSWV)等番茄斑萎病毒属(Tospovirus)病毒、辣椒脉黄化病毒(Pepper vein yellows virus,PeVYV)等马铃薯卷叶病毒属(Polerovirus)病毒、以及黄瓜花叶病毒(Cucumber mosaic virus,CMV)、蚕豆萎蔫病毒2号(Broad bean wilt virus 2,BBWV2)、马铃薯X病毒(Potato virus X,PVX)等其他属的28种RNA病毒和菜豆金色花叶病毒属(Begomovirus)的番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)等3种DNA病毒。总体来讲,CMV和TMV仍然是世界大部分地区辣椒病毒病的主要优势病毒,但不同地区优势病毒也会有所差异。目前,国内外报道至少有136种病毒可以侵染番茄[13],在我国已报道的番茄病毒达34种,其中RNA病毒23种,DNA病毒11种。侵染番茄的RNA病毒主要包括黄瓜花叶病毒属(Cucumovirus)、Tobamovirus、Potyvirus、Tospovirus、毛形病毒属(Crinivirus)以及马铃薯X病毒属(Potexvirus)、蚕豆病毒属(Fabavirus)等病毒;侵染番茄的DNA病毒主要为Begomovirus的双生病毒等[14,15,16,17,18,19,20,21,22,23]。国际上报道的可以侵染葫芦科作物的病毒有89种,以Begomovirus和Potyvirus病毒最多,分别达20种和16种,其余常见的还有Tobamovirus病毒、TSWV和CMV等[24]。我国报道的危害葫芦科作物的病毒常见的有10余种,主要为CMV、TMV、番木瓜环斑病毒(Papaya ringspot virus,PRSV)、南瓜蚜传黄化病毒(Cucurbit aphid-borne yellows virus,CABYV)、南瓜花叶病毒(Squash mosaic virus,SqMV)、西瓜花叶病毒(Watermelon mosaic virus,WMV)、小西葫芦黄花叶病毒(Zucchini yellow mosaic virus,ZYMV)、黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)和甜瓜坏死斑点病毒(Melon necrotic spot virus,MNSV)等[25,26,27,28,29,30,31,32,33]。国际上报道的侵染豆科作物的病毒超过130种[34],我国报道的侵染豌豆的病毒有10余种[35,36,37,38,39,40],侵染蚕豆的病毒有20余种[40,41,42,43,44,45,46,47,48,49],侵染菜豆的病毒有8种[50],其中发生比较普遍的为CMV和BBWV2。十字花科蔬菜上报道的病毒种类较少,我国早期报道的侵染十字花科蔬菜的病毒有7种,分别为CMV、TMV、BBWV2、芜菁花叶病毒(Turnip mosaic virus,TuMV)、花椰菜花叶病毒(Cauliflower mosaic virus,CaMV)、萝卜花叶病毒(Radish mosaic virus,RaMV)及长叶车前草花叶病毒(Ribgrass mosaic virus,RMV),其中CMV和TuMV为主要侵染病毒[51,52,53,54]。【本研究切入点】目前,蔬菜产业的发展对提高人民生活水平、促进农业结构调整、增加农民收入乃至精准扶贫等方面均发挥着重要的作用。随着我国蔬菜种植面积和区域的不断扩大以及耕作制度、栽培模式的改变,蔬菜病毒病的种类相应发生巨大变化,危害程度也不断加重,一般病毒病危害对蔬菜产量造成的损失为20%—30%,有的高达60%以上,严重的可造成绝产。国内外关于常见蔬菜病毒病的报道很多,但基本都是关于某种蔬菜在某个地区,或者某个地区蔬菜病毒病的种类普查、病毒鉴定等报道,同时涉及到茄科、葫芦科、豆科和十字花科蔬菜病毒病的几乎未见报道,也未见同时涉及我国大陆31个省(市、自治区)主要蔬菜病毒病的相关报道。【拟解决的关键问题】2013年以来,在国家公益性行业(农业)科研专项“蔬菜主要病毒病防控技术研究与示范”的资助下,湖南省农业科学院植物保护研究所联合国内从事植物病毒研究的数十家研究机构,连续5年对我国大陆31个省(市、自治区)茄科、葫芦科、豆科和十字花科等主要蔬菜作物病毒病的发生与分布开展全面普查,对病毒种类进行系统鉴定,并对主要病毒病及新发现的病毒病在国内的发生趋势开展分析,以期为我国主要蔬菜产区病毒病的预防及综合防控提供理论依据。1 材料与方法
1.1 供试材料
1.1.1 样本来源 2013—2017年,在我国大陆地区的31个省(市、自治区),开展了茄科、葫芦科、豆科和十字花科等蔬菜作物主要病毒种类鉴定和发生情况的普查。共采集表现为花叶、皱缩、畸形、黄化、坏死等症状的疑似蔬菜病毒病样品41 653份(表1),其中茄科蔬菜(番茄、辣椒、茄子)16 819份,葫芦科蔬菜(南瓜、黄瓜、西葫芦、丝瓜、苦瓜、冬瓜、瓠瓜等)12 344份,豆科蔬菜(菜豆、豇豆、豌豆、蚕豆、大豆、扁豆、绿豆、赤豆等)6 340份,十字花科蔬菜(萝卜、青菜、大白菜、甘蓝、油菜、花椰菜、牛皮菜、芥菜、青花菜、白菜苔、菜薹等)6 150份。采集的样品于-80℃或-20℃冰箱中保存备用。1.1.2 试剂 CMV、TMV、TSWV、TuMV、BBWV2及CGMMV等病毒的单克隆抗体由浙江大学周雪平教授惠赠,二抗为碱性磷酸酶标记羊抗鼠IgG whole molecule(Sigma公司,Anti-Mouse IgG)。RT-PCR反转录TaKaRa Reverse Transcriptase M-MLV(RNase H-)试剂盒和PCR扩增试剂盒TaKaRa Taq Polymerase购自宝生物工程(大连)有限公司(TaKaRa);DNA纯化回收试剂盒Universal DNA Purification Kit购自天根生化科技(北京)有限公司(TIANGEN)。Dot-ELISA用硝酸纤维素膜(Hybond TM-C Nitro-Cellulose membrance,NC膜),购自Amersham公司;底物显色试剂BCIP/NBT购自Promega公司。
Table 1
表1
表1我国主要蔬菜病毒病样品采集地区及样品数
Table 1
| 采样地区 Sampling area | 采集样品数量 Sample number | 采样总数 Total number of samples | |||
|---|---|---|---|---|---|
| 茄科 Solanaceae | 葫芦科 Cucurbitaceae | 豆科 Leguminosae | 十字花科 Cruciferae | ||
| 吉林 Jilin | 37 | 17 | 20 | 17 | 91 |
| 辽宁 Liaoning | 754 | 356 | 371 | 215 | 1696 |
| 黑龙江 Heilongjiang | 0 | 0 | 0 | 295 | 295 |
| 北京 Beijing | 355 | 10 | 0 | 141 | 506 |
| 天津 Tianjin | 875 | 351 | 431 | 306 | 1963 |
| 河北 Hebei | 124 | 28 | 23 | 204 | 379 |
| 山西 Shanxi | 267 | 432 | 164 | 150 | 1013 |
| 内蒙古 Inner Mongolia | 163 | 38 | 19 | 22 | 242 |
| 上海 Shanghai | 943 | 942 | 1022 | 130 | 3037 |
| 江苏 Jiangsu | 470 | 2507 | 134 | 0 | 3111 |
| 浙江 Zhejiang | 533 | 488 | 231 | 201 | 1453 |
| 安徽 Anhui | 1192 | 1777 | 988 | 831 | 4788 |
| 福建 Fujian | 297 | 124 | 52 | 295 | 768 |
| 江西 Jiangxi | 416 | 211 | 190 | 128 | 945 |
| 山东Shandong | 1280 | 996 | 244 | 259 | 2779 |
| 河南 Henan | 177 | 57 | 73 | 41 | 348 |
| 湖北 Hubei | 206 | 142 | 194 | 528 | 1070 |
| 湖南 Hunan | 1696 | 1673 | 387 | 231 | 3987 |
| 广东 Guangdong | 488 | 423 | 94 | 57 | 1062 |
| 广西 Guangxi | 66 | 115 | 0 | 0 | 181 |
| 海南 Hainan | 1322 | 334 | 325 | 350 | 2331 |
| 四川 Sichuan | 78 | 80 | 34 | 27 | 219 |
| 重庆 Chongqing | 362 | 5 | 0 | 93 | 460 |
| 云南 Yunnan | 2691 | 283 | 362 | 132 | 3468 |
| 贵州 Guizhou | 920 | 97 | 462 | 48 | 1527 |
| 西藏 Tibet | 14 | 5 | 10 | 1 | 30 |
| 陕西 Shaanxi | 318 | 489 | 114 | 820 | 1741 |
| 甘肃 Gansu | 132 | 141 | 155 | 472 | 900 |
| 青海 Qinghai | 121 | 12 | 21 | 6 | 160 |
| 宁夏 Ningxia | 336 | 157 | 125 | 147 | 765 |
| 新疆 Xinjiang | 186 | 54 | 95 | 3 | 338 |
| 采样总数 Total number of samples | 16819 | 12344 | 6340 | 6150 | 41653 |
新窗口打开|下载CSV
1.2 试验方法
1.2.1 斑点酶联免疫吸附法(Dot-ELISA)检测 植物叶片称重后,按质量体积比1﹕10—1﹕50(g·mL-1)加入0.01 mol·L-1 PBS研磨。4℃,5 000 r/min离心3 min,取2 μL上清点到NC膜上,室温干燥10 min。NC膜浸入到含5%脱脂奶粉的PBST缓冲液中(按100 mL PBST缓冲液(含0.05% Tween-20的0.01 mol·L-1 PBS)加5 g脱脂奶粉的比例配制),室温封闭30 min。NC膜放入用含5%脱脂奶粉的PBST缓冲液按1﹕5 000倍稀释的相关病毒单抗中室温孵育30—60 min。PBST洗膜3—4次,每次3 min。NC膜放入用含5%脱脂奶粉的PBST缓冲液按1﹕10 000倍稀释的碱性磷酸酶标记羊抗鼠IgG二抗中室温孵育30—60 min。PBST洗膜5—6次,每次3 min。将66 μL NBT和33 μL BCIP显色底物加至10 mL底物缓冲液(0.1 mol·L-1 Tris-Cl、0.1 mol·L-1 NaCl、0.025 mol·L-1 MgCl2、pH 9.5)中混匀(现配现用),洗好的NC膜用滤纸吸干后放入底物显色液中反应,待阳性对照显色明显,而阴性对照没有任何显色时终止反应(一般显色5—20 min),NC膜在自来水中漂洗一下,观察并记录结果。1.2.2 总核酸提取、RT-PCR及PCR扩增 利用CTAB法,从疑似病毒病样本中提取病株总核酸。对于RNA病毒,先以提取的样品总核酸为模板,以各病毒的下游引物,利用TaKaRa Reverse Transcriptase M-MLV(RNase H-)试剂盒合成病毒cDNA。反转录(10 μL体系)方法:将含2 μL模板、1 μL下游引物、3 μL ddH2O的混合样混匀后,70℃下反应10 min,迅速拿出,置冰上冷却3 min,依次加入含2 μL 5×M-MLV Buffer、0.5 μL dNTP mix(10 mmol·L-1)、0.5 μL RTase M-MLV和1 μL ddH2O的混合液,42℃反应1 h,70℃下15 min终止反应。PCR反应体系(总体积为10 μL):上述合成的cDNA或DNA病毒核酸模板1 μL、6.7 μL ddH2O,1 μL 10×Taq Buffer、0.8 μL dNTP mix(2.5 mmol·L-1)、前后引物各0.2 μL(引物相关信息见表2),0.1 μL TaKaRa Taq。反应程序:94℃预变性2 min;94℃变性30 s,X℃(根据表2各病毒检测引物的Tm值设定)退火30 s,72℃延伸1 min,循环35次;72℃延伸10 min;4℃终止反应。反应产物经1%琼脂糖凝胶电泳后在紫外灯下观察结果。
Table 2
表2
表2主要蔬菜病毒检测引物
Table 2
| 检测病毒 Virus | 引物名称 Primer name | 序列 Sequence (5′-3′) | 长度 Fragment size (bp) | 退火温度 Annealing temperature (℃) |
|---|---|---|---|---|
| AMV | AMVdF | GTGCGTATAGATGCCGGTTC | 900 | 55 |
| AMVdR | GAGCGAATAGGACTTCATACC | |||
| BBWV2 | BBWV2dF | AGRTATATGCTTGGGCAAGCGCATG | 490 | 57 |
| BBWV2dR | CATGAACATTCCCCATCTCCACGTG | |||
| BCMV | BCMVdF | CAGCCTTCAATGGAGTTATAACAAT | 533 | 53 |
| BCMVdR | ATCTTCTGATTCCAAGTACTGAATTG | |||
| BYMV | BYMVdF | GGTGAATGGACAATGATGGATG | 550 | 55 |
| BYMVdR | CCTCACTAACTGCTTACCCTG | |||
| CCYV | CCYVdF | AGAACATGATCAAGTCGTGAGTC | 792 | 53 |
| CCYVdR | GGTAGGAATGAACTCAGTGTCG | |||
| CGMMV | CGMMVdF | ATGGCTTACAATCCGATCAC | 481 | 50 |
| CGMMVdR | CTAAGCTTTCGAGGTGGTAGC | |||
| ChiVMV | ChiVMVdF | GGAAARGCNCCNTAYAT | 790 | 52 |
| ChiVMVdR | CGCGCTAATGACATATCGGT | |||
| CMV | CMVCPuF | TCTCATGGATGCTTCTCCGCG | 760 | 55 |
| CMVCPuR | CCGTAAGCTGGATGGACAACC | |||
| CMVI | CMVIdF1 | CCGAAGTAACCCAYGGTCGT | 969 | 55 |
| CMVIdR1 | GATTTGTCCATGACTCGACTC | |||
| CMVII | CMVIIdF2 | CGCGAGTTAGCGTTTAGTTGT | 762 | 55 |
| CMVIIdR2 | TTAACGTCTTCGGACGCCG | |||
| MPV | MPVdF | GACCGTTCTCACCTTGACG | 924 | 55 |
| MPVdR | CAGTGCAAGTAACCCACATGC | |||
| MYSV | MYSVdF | TGACGTCATAATTTCACTAGCAG | 588 | 52 |
| MYSVdR | GTCAACTACCTTTACACATCTGA | |||
| PeVYV | PeVYVdF | CGTGGAAGCGTGCTACTCG | 579 | 57 |
| PeVYVdR | CTCATCAGTGAAGACTCGACC | |||
| PLRV | PLRVdF | CCAAGCATACGCGAGTTGC | 899 | 55 |
| PLRVdR | GTATGCCAACGTAAGCAATAAATC | |||
| PMMoV | PMMoVdF | CCTCTTCCGAGAGAATCTGAGAC | 703 | 54 |
| PMMoVdR | CGTGTTTCCAAACTTCAGCCAAG | |||
| PRSV | PRSVdF | GACCTACAAGCGTGACTTTAC | 703 | 52 |
| PRSVdR | CACCCATGCCATGCATCTTTC | |||
| PSbMV | PSbMVdF | GCAAGTGGTTTGATGGTRTGG | 536 | 55 |
| PSbMVdR | CATGGTGTCAAAGACACACTG | |||
| PStV | PStVdF | TCACAAATGGCTATACTGACATAG | 647 | 52 |
| PStVdR | TGGCATTCTTGGCTTGAACAGAG | |||
| 检测病毒 Virus | 引物名称 Primer name | 序列 Sequence (5′-3′) | 长度 Fragment size (bp) | 退火温度 Annealing temperature (℃) |
| PVX | PVXdF | AGTGCGCGAGGTTTACCAATC | 790 | 54 |
| PVXdR | GTGGTTTGCCGCGAACGATTC | |||
| SPFMV | SPFMVdF | TGAGTAGAGACGAGTGGTGTG | 1188 | 54 |
| SPFMVdR | GTAACACCGCCTACTATGTAGTG | |||
| SPLV | SPLVdF | GCACTCTCCTCAGCCTTTG | 1077 | 53 |
| SPLVdR | TCTGACGAGCATCATATAGTTTCC | |||
| SPVC | SPVCdF | GATTTCCAACTTTTCAAGTCGAAC | 783 | 55 |
| SPVCdR | AGCTGTTGCTGATGAAGAAATCCC | |||
| SPVG | SPVGdF | CCTCTATTGGATCATGCTGTC | 515 | 52 |
| SPVGdR | CTTTTAAGAGTCCCTTATGATACGT | |||
| STV | STVdF | TGATGGAGGATATCTACTGTCATT | 681 | 52 |
| STVdR | ACAAGATGTTTAAAGCCGTGTCC | |||
| TAV | TAVdF | ATGGCCCAAAACGGTACGG | 657 | 57 |
| TAVdR | TCACACCGGGAGCGTTGAAG | |||
| TBTV | TBTVdF | TACCACACCTAAACAGCGTTG | 1049 | 55 |
| TBTVdR | CTCATCTCCCGCTAAGTCAG | |||
| TMGMV | TMGMVdF | GAGGAAATTGAGGATAATGTAAGTG | 700 | 55 |
| TMGMVdR | ACGCCATACCACAGTATACAC | |||
| TMV | TMVdF | GATTCGTTTTAAATATGTCTTAC | 600 | 46 |
| TMVdR | CTTCGATTTAAGTGGAGGGA | |||
| ToCV | ToCVdF | GCTTCCGAAACTCCGTCTTG | 439 | 51 |
| ToCVdR | TGTCGAAAGTACCGCCACC | |||
| ToMMV | ToMMVdF | CTGGAGAAGACTGGGTCTAG | 1193 | 55 |
| ToMMVdR | TTCGGTAAGTTCAATGGGACCT | |||
| ToMV | ToMVdF | TCTCAAGAATGTTACACGGGAAG | 980 | 51 |
| ToMVdR | CGCATTCTCCGTAATTTTGATC | |||
| TSWV | TSWVdF | TCACTGTAATGTTCCATAGCAA | 861 | 52 |
| TSWVdR | AGAGCAATYGTGTCAATTTTATTC | |||
| TuMV | TuMVdF | TAAACGGAATGTGGGTGATGATGG | 377 | 56 |
| TuMVdR | GTCCTCGGTCGTATGCCTTTCC | |||
| TVDV | TVDVdF | GCAACAGCGAGACTTTCATCT | 357 | 56 |
| TVDVdR | CRTTGCCTTTATAGAGCAGCC | |||
| WMV | WMVdF | CATTGAAAATGGAGTGACACTG | 640 | 51 |
| WMVdR | GCCAAAACCTGCATC(A\G)CAC | |||
| ZYMV | ZYMVdF | CCATACATAGCTGAGACAGCAC | 717 | 55 |
| ZYMVdR | CATACCTCGGCATGTATGGTGCC | |||
| Begmoviruses | BegoAFor1 | TGYGARGGICCITGYAARGTYCARTC | 1200 | 50 |
| BegoARev1 | ATHCCMDCHATCKTBCTITGCAATCC | |||
| Poleroviruses | PoconF | GAYTGYTCYGGTTTTGACTGG | 1394 | 57 |
| PocoCPR | CGTCTACCTATTTSGGRTTN | |||
| Potyviruses | CIFor | GGIVVIGTIGGIWSIGGIAARTCIAC | 700 | 40 |
| CIRev | ACICCRTTYTCDATDATRTTIGTIGC | |||
| Tobamoviruses | TobamodF | TKGAYGGNGTBCCNGGNTGYGG | 880 | 55 |
| TobamodR | ACNGAVTBNABCTGTAATTGCTAT |
新窗口打开|下载CSV
1.2.3 小RNA测序分析 采集不同症状类型的蔬菜病毒病样品,混合后用于小RNA测序分析。提取样品总RNA,测定其浓度及纯度,将质量合格的RNA样品进行小RNA文库构建和测序,小RNA序列数据组装、比对和分析委托各测序公司完成。
1.2.4 克隆和测序 参照凝胶回收试剂盒说明书纯化PCR产物,回收目的片段与载体pMD19-T simple连接,转化大肠杆菌DH5α,菌落PCR筛选阳性克隆。阳性克隆测序由华大基因科技有限公司完成,测序结果提交NCBI核酸数据库进行BLAST(
2 结果
2.1 我国蔬菜主要病毒种类普查
2013—2017年,对我国大陆地区31个省(市、自治区)开展了茄科、葫芦科、豆科和十字花科等 41 653份蔬菜作物样品主要病毒种类鉴定和发生情况的普查(表1)。重点对茄科蔬菜的辣椒和番茄,葫芦科蔬菜的南瓜、黄瓜、西葫芦和丝瓜,豆科蔬菜的菜豆、豇豆、豌豆和蚕豆,十字花科蔬菜的萝卜、青菜、大白菜等进行了病毒种类的检测鉴定及相关分析。从这4科蔬菜作物共检出病毒63种,其中茄科蔬菜检出病毒40种,占所有检出病毒种类的63.49%;葫芦科蔬菜检出病毒26种,占所有检出病毒种类的41.27%;豆科蔬菜检出病毒19种,占所有检出病毒种类的30.16%;十字花科作物检出病毒 14种,占所有检出病毒种类的22.22%(表3)。其中比较重要的几种蔬菜作物中,茄科的辣椒上检出33种病毒,占所有检出病毒种类的52.38%,番茄上检出25种病毒,占所有检出病毒种类的39.68%;葫芦科的南瓜上检出病毒22种,占所有检出病毒种类的34.92%,黄瓜上检出病毒19种,占所有检出病毒种类的30.16%;豆科的菜豆上检出病毒12种,占所有检出病毒种类的19.05%,豇豆上检出病毒14种,占所有检出病毒种类的22.22%;十字花科的萝卜上检出12种病毒,占所有检出病毒种类的19.05%,大白菜上检出7种病毒,占所有检出病毒种类的11.11%。Table 3
表3
表3我国主要蔬菜作物上鉴定的63种病毒种类及其检出率
Table 3
| 序号 Number | 中文名 Chinese name | 学名 Scientific name | 检出率 Detection rate (%) |
|---|---|---|---|
| 1 | 黄瓜花叶病毒 | Cucumber mosaic virus (CMV) | 20.51 |
| 2 | 烟草花叶病毒 | Tobacco mosaic virus (TMV) | 9.29 |
| 3 | 小西葫芦黄花叶病毒 | Zucchini yellow mosaic virus (ZYMV) | 5.39 |
| 4 | 芜菁花叶病毒 | Turnip mosaic virus (TuMV) | 5.16 |
| 5 | 蚕豆萎蔫病毒2号 | Broad bean wilt virus 2 (BBWV2) | 4.82 |
| 6 | 黄瓜绿斑驳花叶病毒 | Cucumber green mottle mosaic virus (CGMMV) | 3.87 |
| 7 | 番茄花叶病毒 | Tomato mosaic virus (ToMV) | 2.04 |
| 8 | 番茄斑萎病毒 | Tomato spotted wilt tospovirus (TSWV) | 1.98 |
| 9 | 辣椒轻斑驳病毒 | Pepper mild mottle virus (PMMoV) | 1.60 |
| 10 | 西瓜花叶病毒 | Watermelon mosaic virus (WMV) | 1.53 |
| 11 | 马铃薯Y病毒 | Potato virus Y (PVY) | 1.50 |
| 12 | 番茄黄化曲叶病毒 | Tomato yellow leaf curl virus (TYLCV) | 1.27 |
| 13 | 南瓜蚜传黄化病毒 | Cucurbit aphid-borne yellows virus (CABYV) | 0.65 |
| 14 | 番茄褪绿病毒 | Tomato chlorosis virus (ToCV) | 0.65 |
| 15 | 烟草轻绿花叶病毒 | Tobacco mild green mosaic virus (TMGMV) | 0.47 |
| 16 | 大豆花叶病毒 | Soybean mosaic virus (SMV) | 0.46 |
| 17 | 马铃薯X病毒 | Potato virus X (PVX) | 0.39 |
| 18 | 红辣椒脉斑驳病毒 | Chilli veinal mottle virus (ChiVMV) | 0.35 |
| 19 | 辣椒隐潜病毒2号 | Pepper cryptic virus 2 (PCV2) | 0.34 |
| 20 | 辣椒脉黄化病毒 | Pepper vein yellows virus (PeVYV) | 0.33 |
| 21 | 甜瓜蚜传黄化病毒 | Melon aphid-borne yellows virus (MABYV) | 0.31 |
| 22 | 辣椒隐潜病毒1号 | Pepper cryptic virus 1 (PCV1) | 0.27 |
| 23 | 番木瓜环斑病毒 | Papaya ringspot virus (PRSV) | 0.26 |
| 序号 Number | 中文名 Chinese name | 学名 Scientific name | 检出率 Detection rate (%) |
| 24 | 菜豆普通花叶病毒 | Bean common mosaic virus (BCMV) | 0.24 |
| 25 | 甜菜西方黄化病毒 | Beet western yellows virus (BWYV) | 0.22 |
| 26 | 菜豆黄化花叶病毒 | Bean yellow mosaic virus (BYMV) | 0.21 |
| 27 | 西葫芦虎纹花叶病毒 | Zucchini tigre mosaic virus (ZTMV) | 0.18 |
| 28 | 瓜类褪绿黄化病毒 | Cucurbit chlorotic yellows virus (CCYV) | 0.17 |
| 29 | 甜椒内源RNA病毒 | Bell pepper endornavirus (BPEV) | 0.15 |
| 30 | 番茄斑驳花叶病毒 | Tomato mottle mosaic virus (ToMMV) | 0.12 |
| 31 | 马铃薯S病毒 | Potato virus S (PVS) | 0.12 |
| 32 | 甜瓜黄斑病毒 | Melon yellow spot tospovirus (MYSV) | 0.09 |
| 33 | 中国南瓜曲叶病毒 | Squash leaf curl China virus (SLCCNV) | 0.08 |
| 34 | 辣椒环斑病毒 | Chilli ringspot virus (ChiRSV) | 0.07 |
| 35 | 番茄环纹斑点病毒 | Tomato zonate spot tospovirus (TZSV) | 0.07 |
| 36 | 南瓜花叶病毒 | Squash mosaic virus (SqMV) | 0.07 |
| 37 | 菜豆内源RNA病毒 | Phaseolus vulgaris endornavirus (PvEV) | 0.07 |
| 38 | 辣椒斑驳病毒 | Pepper mottle virus (PepMoV) | 0.06 |
| 39 | 辣椒脉斑驳病毒 | Pepper veinal mottle virus (PVMV) | 0.06 |
| 40 | 番茄不孕病毒 | Tomato aspermy virus (TAV) | 0.06 |
| 41 | 豌豆种传花叶病毒 | Pea seed-borne mosaic virus (PSbMV) | 0.05 |
| 42 | 烟草丛顶病毒 | Tobacco bushy top virus (TBTV) | 0.04 |
| 43 | 烟草扭脉病毒 | Tobacco vein distorting virus (TVDV) | 0.03 |
| 44 | 泰国番茄黄化曲叶病毒 | Tomato yellow leaf curl Thailand virus (TYLCTHV) | 0.03 |
| 45 | 马铃薯V病毒 | Potato virus V (PVV) | 0.03 |
| 46 | 花生条纹病毒 | Peanut stripe virus (PStV) | 0.02 |
| 47 | 苜蓿花叶病毒 | Alfalfa mosaic virus (AMV) | 0.02 |
| 48 | 中国番木瓜曲叶病毒 | Papaya leaf curl China virus (PaLCuCNV) | 0.02 |
| 49 | 紫云英矮缩病毒 | Milk vetch dwarf virus (MDV) | 0.02 |
| 50 | 南方番茄病毒 | Southern tomato virus (STV) | 0.02 |
| 51 | 芸薹黄化病毒 | Brassica yellows virus (BrYV) | 0.01 |
| 52 | 萝卜青霉病毒1号 | Raphanus sativus chrysovirus 1 (RasCV1) | 0.01 |
| 53 | 黑树莓隐潜病毒1号 | Black raspberry cryptic virus 1 (BRCV1) | 0.01 |
| 54 | 辣椒内源RNA病毒 | Hot pepper endornavirus (HPEV) | 0.007 |
| 55 | 西瓜银色斑驳病毒 | Watermelon silver mottle virus (WSMoV) | 0.005 |
| 56 | 豇豆轻斑驳病毒 | Cowpea mild mottle virus (CPMMV) | 0.005 |
| 57 | 莴苣巨脉相关病毒 | Lettuce big-vein associated virus (LBVaV) | 0.005 |
| 58 | 野生番茄花叶病毒 | Wild tomato mosaic virus (WTMV) | 0.0025 |
| 59 | 苎麻花叶病毒 | Ramie mosaic virus (RamMV) | 0.0025 |
| 60 | 辣椒褪绿病毒 | Capsicum chlorosis tospovirus (CaCV) | 0.0025 |
| 61 | 葡萄卷叶伴随病毒 | Grapevine leafroll-associated virus (GLRaV) | 0.0025 |
| 62 | 葡萄A病毒 | Grapevine virus A (GVA) | 0.0025 |
| 63 | 葫芦内源RNA病毒 | Lagenaria siceraria endornavirus (LsEV) | 0.0025 |
新窗口打开|下载CSV
在这63种病毒中,4科蔬菜上均检测到的病毒为CMV、TMV、BBWV2、TuMV、PVY和马铃薯S病毒(Potato virus S,PVS)(表4),其中CMV、TMV、TuMV和BBWV2为优势病毒,在全国范围内分布广泛且发生严重,在全国所有蔬菜样品中的平均检出率分别为20.51%、9.29%、5.16%和4.82%(表3),尤其是CMV在全国31个省(市、自治区)均有分布,且在各地区均为优势病毒;TMV在除西藏外的30个省(市、自治区)均有发生;TuMV和BBWV2在全国大部分地区都有分布。ZYMV和CGMMV在全国所有蔬菜样品中的平均检出率分别为5.39%和3.87%,虽然ZYMV平均检出率比TuMV、BBWV2和CGMMV高,但是分布范围相对没有后3种病毒广泛。在这些病毒中,检出率最低的为西瓜银色斑驳病毒(Watermelon silver mottle tospovirus,WSMoV)、豇豆轻斑驳病毒(Cowpea mild mottle virus,CPMMV)、莴苣巨脉相关病毒(Lettuce big-vein associated virus,LBVaV)、野生番茄花叶病毒(Wild tomato mosaic virus,WTMV)、苎麻花叶病毒(Ramie mosaic virus,RamMV)、辣椒褪绿病毒(Capsicum chlorosis tospovirus,CaCV)、葡萄卷叶伴随病毒(Grapevine leafroll-associated virus,GLRaV)、葡萄A病毒(Grapevine virus A,GVA)和葫芦内源RNA病毒(Lagenaria siceraria endornavirus,LsEV)(表3),这几种病毒仅在其中一种蔬菜作物上有发生,并且检出率极低。
Table 4
表4
表4我国茄科、葫芦科、豆科、十字花科蔬菜上均检测到的病毒及其分布区域
Table 4
| 序号Number | 分布地区Distribution area | 病毒种类Virus species |
|---|---|---|
| 1 | 上海 Shanghai | CMV、TMV、BBWV2、PVY、PVS、TuMV |
| 2 | 陕西 Shaanxi | CMV、TMV、BBWV2、PVY、PVS、TuMV |
| 3 | 甘肃 Gansu | CMV、TMV、BBWV2、PVY、PVS、TuMV |
| 4 | 北京 Beijing | CMV、TMV、PVY、PVS、TuMV |
| 5 | 河北 Hebei | CMV、TMV、PVY、PVS、TuMV |
| 6 | 山东 Shandong | CMV、TMV、BBWV2、PVY、PVS |
| 7 | 吉林 Jilin | CMV、TMV、BBWV2、PVY、TuMV |
| 8 | 湖南 Hainan | CMV、TMV、BBWV2、PVY、TuMV |
| 9 | 贵州 Guizhou | CMV、TMV、BBWV2、PVY、TuMV |
| 10 | 云南 Yunnan | CMV、TMV、BBWV2、PVY、TuMV |
| 11 | 福州 Fuzhou | CMV、TMV、BBWV2、PVY、TuMV |
| 12 | 海南 Hainan | CMV、TMV、BBWV2、PVY、TuMV |
| 13 | 辽宁 Liaoning | CMV、TMV、BBWV2、TuMV |
| 14 | 天津 Tianjin | CMV、TMV、BBWV2、TuMV |
| 15 | 山西 Shanxi | CMV、TMV、BBWV2、TuMV |
| 16 | 青海 Qinghai | CMV、TMV、BBWV2、TuMV |
| 17 | 湖北 Hubei | CMV、TMV、BBWV2、TuMV |
| 18 | 重庆 Chongqing | CMV、TMV、BBWV2、TuMV |
| 19 | 安徽 Anhui | CMV、TMV、BBWV2、TuMV |
| 20 | 浙江 Zhejiang | CMV、TMV、BBWV2、TuMV |
| 21 | 江西 Jiangxi | CMV、TMV、BBWV2、TuMV |
| 22 | 广东 Guangdong | CMV、TMV、BBWV2、TuMV |
| 23 | 宁夏 Ningxia | CMV、TMV、PVY、TuMV |
| 24 | 四川 Sichuan | CMV、TMV、PVY、TuMV |
| 25 | 河南 Henan | CMV、TMV、BBWV2 |
| 26 | 江苏 Jiangsu | CMV、TMV、PVY |
| 27 | 新疆 Xinjiang | CMV、TMV、BBWV2 |
| 28 | 黑龙江 Heilongjiang | CMV、TMV |
| 29 | 内蒙古 Inner Mongolia | CMV、TMV |
| 30 | 广西 Guangxi | CMV、TMV |
| 31 | 西藏 Tibet | CMV、BBWV2 |
新窗口打开|下载CSV
2.2 侵染茄科蔬菜作物的病毒种类和分布
2.2.1 茄科蔬菜病毒种类和分布 共在我国大陆地区31个省(市、自治区)采集辣椒、番茄、茄子等茄科蔬菜样品16 819份,其中辣椒8 698份,番茄6 533份,茄子264份。茄科蔬菜上共检测到40种病毒,包括Potyvirus属病毒7种,分别为红辣椒脉斑驳病毒(Chilli veinal mottle virus,ChiVMV)、PVY、辣椒斑驳病毒(Pepper mottle virus,PepMoV)、辣椒脉斑驳病毒(Pepper veinal mottle virus,PVMV)、TuMV、辣椒环斑病毒(Chilli ringspot virus,ChiRSV)和WTMV;检测到Tobamovirus属病毒6种,分别为TMV、番茄花叶病毒(Tomato mosaic virus,ToMV)、番茄斑驳花叶病毒(Tomato mottle mosaic virus,ToMMV)、辣椒轻斑驳病毒(Pepper mild mottle virus,PMMoV)、烟草轻绿花叶病毒(Tobacco mild green mosaic virus,TMGMV)和CGMMV;Polerovirus属病毒5种,分别为PeVYV、甜菜西方黄化病毒(Beet western yellows virus,BWYV)、CABYV、甜瓜蚜传黄化病毒(Melon aphid-borne yellows virus,MABYV)和烟草扭脉病毒(Tobacco vein distorting virus,TVDV);Tospovirus属病毒4种,分别为TSWV、番茄环纹斑点病毒(Tomato zonate spot tospovirus,TZSV)、WSMoV和CaCV;Begomovirus属病毒3种,分别为TYLCV、泰国番茄黄化曲叶病毒(Tomato yellow leaf curl Thailand virus,TYLCTHV)和中国番木瓜曲叶病毒(Papaya leaf curl China virus,PaLCuCNV);内源RNA病毒属(Endornavirus)病毒3种,分别为甜椒内源RNA病毒(Bell pepper endornavirus,BPEV)、辣椒内源RNA病毒(Hot pepper endornavirus,HPEV)和菜豆内源RNA病毒(Phaseolus vulgaris endornavirus,PvEV);Cucumovirus属病毒2种,分别为CMV和番茄不孕病毒(Tomato aspermy virus,TAV);丁型双分病毒属(Deltapartitivirus)病毒2种,分别为辣椒隐潜病毒1号(Pepper cryptic virus 1,PCV1)和辣椒隐潜病毒2号(Pepper cryptic virus 2,PCV2);还有Fabavirus属的BBWV2、Crinivirus属的ToCV、Potexvirus属的PVX、幽影病毒属(Umbravirus)的烟草丛顶病毒(Tobacco bushy top virus,TBTV)、香石竹潜隐病毒属(Carlavirus)的PVS、Alfamovirus属的苜蓿花叶病毒(Alfalfa mosaic virus,AMV)、巨脉病毒属(Varicosavirus)的LBVaV、混合病毒属(Amalgavirus)属的南方番茄病毒(Southern tomato virus,STV)(表5)。在这些病毒中,CMV在所有茄科蔬菜样品中的检出率最高,为19.03%,其次为TMV,在所有茄科蔬菜样品中的检出率为12.44%。Table 5
表5
表5我国主要茄科蔬菜病毒种类
Table 5
| 病毒归属 Genus | 病毒种类 Virus species |
|---|---|
| Potyvirus | ChiVMV、PVY、PepMoV、PVMV、TuMV、ChiRSV、WTMV |
| Tobamovirus | TMV、ToMV、ToMMV、PMMoV、TMGMV、CGMMV |
| Polerovirus | PeVYV、BWYV、CABYV、MABYV、TVDV |
| Tospovirus | TSWV、TZSV、WSMoV、CaCV |
| Begomovirus | TYLCV、TYLCTHV、PaLCuCNV |
| Endornavirus | EPEV、HPEV、PvEV |
| Cucumovirus | CMV、TAV |
| Deltapartitivirus | PCV1、PCV2 |
| Fabavirus | BBWV2 |
| Crinivirus | ToCV |
| Potexvirus | PVX |
| Carlavirus | PVS |
| Umbravirus | TBTV |
| Alfamovirus | AMV |
| Varicosavirus | LBVaV |
| Amalgavirus | STV |
新窗口打开|下载CSV
辣椒检出病毒33种,番茄检出病毒25种,茄子检出病毒6种。这3种蔬菜均检测到的病毒有CMV、TMV、BBWV2、TSWV、PVX和TuMV,其中CMV和BBWV2在3种作物上普遍发生,而在辣椒和番茄上发生均比较普遍和严重的为CMV、TMV、ToMV、TSWV和BBWV2,其中TSWV在云南已成为主要侵染番茄和辣椒的优势种,在云南茄科蔬菜作物的平均检出率高达17.24%;ToCV在北京和山东为侵染番茄的优势种,在北京和山东番茄上的平均检出率分别为20.41%和16.39%。
2.2.2 辣椒病毒种类和分布 在采集的8 698份辣椒疑似病毒病样品中,共检测到病毒33种,存在多种病毒复合侵染现象。33种辣椒病毒包括Potyvirus属病毒6种,分别为ChiVMV、PVY、PepMoV、PVMV、TuMV和ChiRSV;Tobamovirus属病毒6种,分别为TMV、ToMV、ToMMV、PMMoV、TMGMV和CGMMV;Polerovirus属病毒5种,分别为PeVYV、BWYV、CABYV、MABYV和TVDV;Endornavirus属病毒3种,分别为BPEV、HPEV和PvEV;Cucumovirus属病毒2种,分别为CMV和TAV;Tospovirus属病毒2种,分别为TSWV和TZSV;Deltapartitivirus属病毒2种,分别为PCV1和PCV2;其余病毒分别为BBWV2、ToCV、AMV、PVX、TBTV、PVS和TYLCV。
侵染辣椒的33种病毒中,CMV和TMV检出率最高,在所有辣椒样品中的平均检出率分别为20.29%和14.64%(图1)。从全国范围来看,CMV和TMV依然是危害我国辣椒的主要病毒,除了安徽省和西藏自治区的辣椒上未检测到CMV外,其余地区的辣椒上均有CMV发生且检出率较高;除内蒙古自治区和西藏自治区的辣椒病样中未检测到TMV外,其余地区也均有TMV发生,西藏地区的辣椒病毒病发生较轻,采集的疑似病毒病样品数较少,但检测到了Tobamovirus属的ToMMV和PMMoV,其中ToMMV为首次在我国被发现,且首次发现辣椒是ToMMV的一个自然寄主[55],目前国外ToMMV仅报道在番茄上发生。其他病毒的平均检出率均在10%以下,依次为PMMoV、BBWV2、TSWV和ToMV,平均检出率分别为7.50%、6.93%、4.25%和3.93%。PMMoV在江苏辣椒上发生最为严重,平均检出率高达62.28%,其次为湖北,辣椒上PMMoV的检出率为20.18%;BBWV2和TSWV在部分地区辣椒上发生严重,其中BBWV2在湖南辣椒上发生最为严重,平均检出率为24.59%,TSWV在云南辣椒上发生最为严重,平均检出率为25.32%。综合而言,在全国范围内辣椒上发生最为严重且分布广泛的主要是CMV和烟草花叶病毒属病毒(tobamoviurses)。
图1
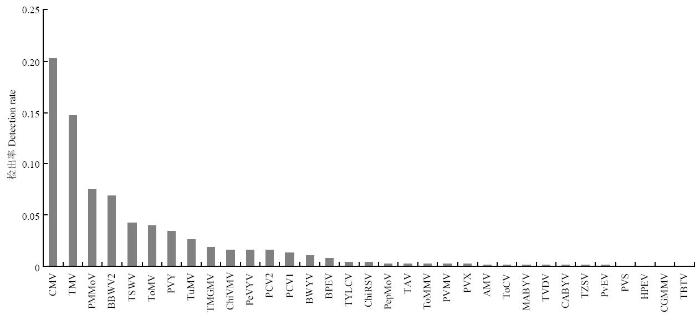 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1我国辣椒上病毒种类及其检出率
Fig. 1Virus species and their detection rates of pepper in China
2.2.3 番茄病毒种类和分布 在检测的6 533份番茄病毒病样品中,共检测到病毒25种,存在多种病毒复合侵染现象。主要包括Tobamovirus属病毒5种,分别为TMV、ToMV、ToMMV、TMGMV和PMMoV;Potyvirus 属病毒5种,分别为ChiVMV、PVY、PVMV、TuMV和WTMV;Tospovirus属病毒4种,分别为TSWV、TZSV、WSMoV和CaCV;Begomovirus属病毒3种,分别为TYLCV、TYLCTHV和PaLCuCNV;及CMV、BBWV2、ToCV、TBTV、PVX、LBVaV、STV和BPEV。这些危害番茄的病毒中,CMV的检出率依然最高,平均检出率达13.35%,其余依次是TMV、ToMV、TYLCV、TSWV和BBWV2,平均检出率分别为8.36%、7.56%、7.41%、5.20%和4.61%(图2)。除了在北京、江苏、安徽、广西和西藏等地区的番茄上未检测到外,CMV在大部分地区番茄上均有发生,在河南、天津和广东的番茄上检出率较高,平均检出率分别为58.33%、51.75%和49.69%。ToMV也在国内大部分地区的番茄上普遍发生,在浙江和北京番茄上检出率较高,平均检出率分别为44.75%和42.86%。有些病毒虽然目前仅在部分地区发生危害,但在这些地区的番茄上发生率较高,如BBWV2在浙江和江西番茄上发生最为普遍,平均检出率分别为45.83%和35.19%;TSWV在云南番茄上发病最为严重,平均检出率为13.11%,严重的地块往往造成绝产。
图2
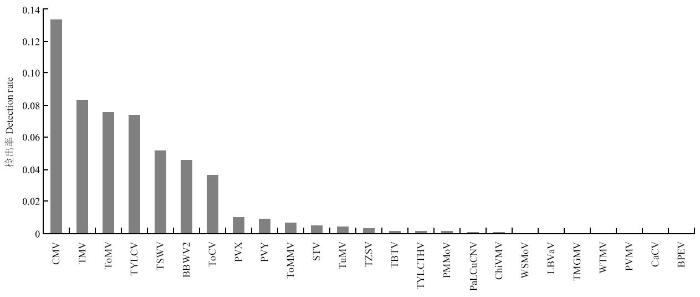 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2我国番茄上病毒种类及其检出率
Fig. 2Virus species and their detection rates of tomato in China
2.2.4 茄子病毒种类和分布 茄子病毒病的发生危害较轻,仅在内蒙古、上海、浙江、江西、湖北、贵州和云南等地区采集到茄子病毒病样品264份,共检测到病毒6种,分别为CMV、TMV、TSWV、BBWV2、PVX和TuMV。除内蒙古和江西外,CMV在其余几个地区茄子上均被检测到,平均检出率为35.61%;其次为BBWV2,检出率为9.09%;TMV和TSWV仅在上海和浙江茄子上发生,PVX仅在上海茄子上发生,TuMV仅在贵州茄子上发生,TMV、TSWV、PVX和TuMV在茄子上检出率均较低,仅为零星发生。
2.3 侵染葫芦科蔬菜作物的病毒种类和分布
2.3.1 葫芦科蔬菜病毒种类和分布 在全国采集葫芦科病毒病样品12 344份,包括南瓜、黄瓜、西葫芦、丝瓜、苦瓜、冬瓜、瓠瓜等,其中南瓜、黄瓜、丝瓜和西葫芦病毒病样品在大部分地区均有采集,而其余几种葫芦科蔬菜作物病毒病样品仅在个别地区采集到。在这些葫芦科蔬菜作物上共检测到病毒26种,包括Potyvirus属病毒8种,分别为ChiVMV、PVY、TuMV、ZYMV、ZTMV、WMV、PRSV和PStV;Tobamovirus属病毒4种,分别为TMV、PMMoV、TMGMV和CGMMV;Tospovirus属病毒2种,分别为TSWV和MYSV;Polerovirus属病毒2种,分别为CABYV和MABYV;Crinivirus属病毒2种,分别为ToCV和CCYV;Begomovirus属病毒2种,分别为TYLCV和SLCCNV;其余6种病毒分别为CMV、BBWV2、PVX、PVS、SqMV和LsEV(表6)。其中南瓜上检测到的病毒种类最多,共有22种,黄瓜上检测到病毒19种,西葫芦上检测到病毒8种,丝瓜上检测到病毒7种。在这些病毒中,CMV的检出率最高,平均检出率为26.32%,其次为ZYMV、CGMMV和TMV,平均检出率依次为18.23%、11.59%和10.29%。Table 6
表6
表6我国主要葫芦科蔬菜病毒种类
Table 6
| 病毒归属Genus | 病毒种类Virus species |
|---|---|
| Potyvirus | ChiVMV、PVY、TuMV、ZYMV、ZTMV、WMV、PRSV、PStV |
| Tobamovirus | TMV、PMMoV、TMGMV、CGMMV |
| Tospovirus | TSWV、MYSV |
| Polerovirus | CABYV、MABYV |
| Crinivirus | ToCV、CCYV |
| Begomovirus | TYLCV、SLCCNV |
| Cucumovirus | CMV |
| Fabavirus | BBWV2 |
| Potexvirus | PVX |
| Carlavirus | PVS |
| Comovirus | SqMV |
| Endornavirus | LsEV |
新窗口打开|下载CSV
2.3.2 南瓜病毒种类和分布 在全国范围内采集南瓜疑似病毒病样品3 426份,检测到22种病毒,包括Potyvirus属7种病毒,分别为ChiVMV、PVY、TuMV、ZYMV、ZTMV、WMV和PRSV;Tobamovirus属病毒4种,分别为TMV、PMMoV、TMGMV和CGMMV;Tospovirus属的TSWV和MYSV;Polerovirus属的CABYV和MABYV;Crinivirus属的ToCV和CCYV;以及CMV、BBWV2、PVX、PVS和SLCCNV。CMV的检出率最高,为30.50%,其次为ZYMV、TMV和CGMMV,检出率依次为25.72%、13.31%和12.26%。CMV几乎在所有地区的南瓜样品上均有发生并且检出率较高,其中在河南和海南的南瓜样品中检出率最高,分别为70.97%和53.80%,广西、山东和上海的南瓜病样中CMV的检出率也较高,分别为47.83%、46.62%和44.21%。ZYMV在上海和山东发生比较普遍,检出率分别为40.95%和37.04%。TMV在河南和山东南瓜样品中检出率最高,分别为70.97%和49.89%。CGMMV在广西和广东南瓜样品中检出率较高,分别为56.52%和44.60%。
2.3.3 黄瓜病毒种类和分布 在所检测的3 283份黄瓜疑似病毒病样品中,共检测到病毒19种,分别为Potyvirus属的ZTMV、PVY、TuMV、ZYMV、WMV、PRSV和PStV;Tobamovirus属的TMV和CGMMV;Tospovirus属的TSWV和MYSV;Polerovirus属的CABYV和MABYV;以及CMV、BBWV2、TYLCV、PVX、CCYV及LsEV。同样,所检测的黄瓜样品中,CMV的检出率最高,平均检出率为28.97%,其次为CGMMV、ZYMV和TMV,平均检出率依次为21.38%、14.35%和10.20%。
2.4 侵染豆科蔬菜作物的病毒种类和分布
2.4.1 豆科蔬菜病毒种类和分布 在全国范围内共采集豆科蔬菜疑似病毒病样品6 340份,包括菜豆、豇豆、豌豆、蚕豆、大豆、扁豆、赤豆和绿豆等,其中菜豆和豇豆病毒病发生较普遍,样品来源地分布在全国大部分省区,而其余几种豆科蔬菜作物病毒病样本仅在个别地区采集到。从这些豆科蔬菜样本中共检测到19种病毒,主要是Potyvirus属病毒10种,分别为TuMV、PVY、PVV、BYMV、PSbMV、SMV、BCMV、WMV、PStV和ZYMV,其余9种病毒分别为CMV、TMV、PVS、TSWV、BBWV2、RamMV、紫云英矮缩病毒(Milk vetch dwarf virus,MDV)、CPMMV和PvEV(表7)。其中CMV发生最为普遍,平均检出率最高,达21.21%,其次是BBWV2,平均检出率为11.03%。Table 7
表7
表7我国主要豆科蔬菜病毒种类
Table 7
| 病毒归属Genus | 病毒种类 Virus species |
|---|---|
| Potyvirus | TuMV、PVY、PVV、BYMV、PSbMV、SMV、BCMV、WMV、PStV、ZYMV |
| Carlavirus | PVS、CPMMV |
| Cucumovirus | CMV |
| Tobamovirus | TMV |
| Tospovirus | TSWV |
| Fabavirus | BBWV2 |
| Endornavirus | PvEV |
| Nanovirus | MDV |
| Begomovirus | RamMV |
新窗口打开|下载CSV
2.4.2 菜豆病毒种类和分布 共采集菜豆疑似病毒病样本1 996份,检测到病毒12种,分别为CMV、TMV、TSWV、BBWV2、TuMV、PVY、PVS、PVV、BYMV、PSbMV、SMV和BCMV。在这些病毒中,CMV的发生最为普遍和严重,几乎遍布所有采样地区,平均检出率达16.83%。其次为BBWV2,同样在大部分采样地区的菜豆上都有发生,平均检出率为5.61%。TMV和SMV的平均检出率分别为6.06%和5.41%,但是这2种病毒的发生地均比较集中,TMV仅在上海和贵州菜豆上检测到,SMV仅在上海和山西菜豆上检测到,TMV和SMV均在上海的菜豆上严重发生,平均检出率较高,分别为39.38%和34.93%,而TMV在贵州、SMV在山西均为零星发生。
2.4.3 豇豆病毒种类和分布 在采集的2 052份豇豆疑似病毒病样本中,共检测到病毒14种,分别为CMV、TMV、TSWV、BBWV2、TuMV、BYMV、ZYMV、PStV、SMV、BCMV、WMV、MDV、CPMMV和PvEV。其中CMV的发生较普遍,平均检出率最高,达19.01%,在内蒙古、上海、江苏、浙江、安徽、江西、河南、湖北、广东、海南和贵州等11个地区均有分布;其次为BBWV2,平均检出率为14.72%,在上海、浙江、安徽、江西、广东和西藏的豇豆上均有发生;其余病毒的平均检出率均低于4.00%。
2.5 侵染十字花科蔬菜作物的病毒种类和分布
2.5.1 十字花科蔬菜病毒种类和分布 共采集萝卜、青菜、大白菜、甘蓝、油菜、花椰菜、牛皮菜、芥菜、青花菜、白菜苔、菜薹等十字花科蔬菜疑似病毒病样品6 150份,其中萝卜和大白菜病毒病在大部分地区均有发生,而病毒病在其他十字花科蔬菜上仅在个别地区发生。十字花科蔬菜作物上共检测到14种病毒,分别为Tobamovirus属TMV、ToMV、CGMMV,Potyvirus属TuMV、PVY,以及 CMV、BBWV2、PVX、PVS、BrYV、RasCV1、BRCV1、GLRaV和GVA(表8)。在这些病毒中,TuMV发生最为普遍,是侵染十字花科蔬菜的主要病毒,平均检出率为29.87%,几乎在每个样品采集地的十字花科蔬菜作物上均有发生。其次为CMV和TMV,CMV的分布也比较广泛,平均检出率为12.23%;TMV仅在部分地区的十字花科作物上有发生,平均检出率为4.29%。而其余11种病毒仅在个别地区的十字花科蔬菜上零星发生,如CGMMV仅在天津的大白菜和吉林的萝卜上有发生,PVS仅在山西的大白菜上发生,BBWV2仅在湖北的大白菜和吉林的萝卜上有发生,ToMV和PVX仅在北京的萝卜上发生,BrYV仅在云南和重庆的萝卜及湖北的菜薹上发生,RasCV1仅在内蒙古和湖北的萝卜上发生,BRCV1仅在湖北的菜薹上有发生,GLRaV和GVA仅在重庆萝卜上发生。Table 8
表8
表8我国主要十字花科蔬菜病毒种类
Table 8
| 病毒归属 Genus | 病毒种类Virus species |
|---|---|
| Tobamovirus | TMV、ToMV、CGMMV |
| Potyvirus | TuMV、PVY |
| Cucumovirus | CMV |
| Fabavirus | BBWV2 |
| Potexvirus | PVX |
| Carlavirus | PVS |
| Polerovirus | BrYV |
| Chrysovirus | RasCV1 |
| Alphacryptovirus | BRCV1 |
| Closterovirus | GLRaV |
| Vitivirus | GVA |
新窗口打开|下载CSV
2.5.2 萝卜病毒种类和分布 在采集的1 790份萝卜病毒病样品中,共检测到12种病毒,且存在多种病毒复合侵染现象。这些病毒分别为CMV、TuMV、PVY、PVX、TMV、ToMV、CGMMV、BBWV2、BrYV、RaSCV1、GLRaV和GVA。TuMV和CMV几乎在所有采样地区的萝卜上均有发生,检出率分别为37.21%和7.93%。TuMV在湖北、山东、陕西和甘肃的萝卜上发生最为严重,检出率分别为78.79%、72.84%、55.61%和43.75%,CMV在各地区萝卜上的发生没有TuMV普遍,仅上海和吉林的萝卜样本中检出率较高,分别为96%和70.59%,但是这两个地区萝卜的采集样品数较少。TMV在北京、河北、福建、河南、陕西和甘肃的萝卜上零星发生,PVY仅在吉林、北京、河北和宁夏的萝卜上零星发生。RasCV1仅在内蒙古和湖北萝卜上检测到,ToMV、CGMMV、PVX、BBWV2、BrYV、GLRaV和GVA仅分别在某个省区的萝卜上检出。
2.5.3 大白菜病毒种类和分布 共检测大白菜病毒病样品2 539份,检测到7种病毒,且存在多种病毒复合侵染现象。7种病毒分别为CMV、TuMV、PVY、PVS、TMV、CGMMV和BBWV2。与萝卜病毒病的发生情况基本相似,TuMV和CMV几乎在所有采样地区的大白菜上均有发生,平均检出率分别为23.43%和7.17%。TuMV在湖北、陕西和甘肃的白菜上发生最为普遍,检出率分别达75.51%、51.55%和45.37%;CMV在各地区白菜上的发生没有TuMV普遍,仅在山西和河南的大白菜样品中检出率较高,分别为52.56%和52.00%。TMV仅在个别地区的大白菜上零星发生,CGMMV、PVY、PVS和BBWV2仅分别在某个省区的大白菜上检出。
2.6 我国蔬菜病毒病的复合侵染类型
我国大陆地区31个省(市、自治区)茄科、葫芦科、豆科和十字花科蔬菜病毒病的普查和检测结果表明,我国蔬菜普遍存在多种病毒复合侵染危害的现象,其中CMV与其他病毒的复合侵染最为普遍。2.6.1 茄科蔬菜病毒复合侵染类型 茄科蔬菜病毒复合侵染非常复杂,辣椒病毒复合侵染组合有33种,番茄病毒复合侵染组合有23种,茄子病毒复合侵染组合有4种。辣椒病毒复合侵染中,多为2种病毒复合侵染,主要有CMV+TMV、CMV+BBWV2、CMV+TSWV、CMV+PVY、ToMV+BBWV2、PVY+ BBWV2等复合侵染类型,其中CMV+TMV复合侵染最多,海南省检出率最高,为20.98%,湖南省最低,为2.04%。也有3—6种病毒复合侵染,其中天津和内蒙古辣椒病毒复合侵染类型中多为4—6种病毒复合侵染。其余类型为CMV或TMV与BWYV、BBWV2、ToMV、PVY、PVX、TSWV之一复合侵染,如CMV+BBWV2在天津辣椒上最为普遍,检出率高达11.99%。番茄上病毒复合侵染也主要为2种病毒的复合侵染,包括CMV+TMV、CMV+ToMV、ToMV+BBWV2、ToCV+ToMMV、ToCV+TYLCV等,其中CMV+TMV在全国范围内均较为普遍,尤其在河南番茄中检出率最高,为34.72%,其次是海南省,检出率为12.20%。山东番茄上检出5种病毒复合侵染,内蒙古番茄上检出6种病毒复合侵染。番茄上的其余病毒复合侵染类型主要是CMV与BBWV2、ToMV、PVY和TuMV之一复合侵染。茄子上病毒复合侵染类型主要为CMV+BBWV2,在湖北茄子中检出率最高,为42.31%。其他还有CMV+ TMV+ToMV、CMV+ToMV+BBWV2、ToCV+ ToMMV+ TYLCV、ToMV+ToCV+STV等3种病毒复合侵染类型,甚至有4—6种病毒复合侵染。
2.6.2 葫芦科蔬菜病毒复合侵染类型 葫芦科蔬菜常见病毒复合侵染类型为CMV+CGMMV。南瓜病毒复合侵染组合有9种,黄瓜病毒复合侵染组合有5种,西葫芦、丝瓜、冬瓜、苦瓜、瓠瓜等复合侵染类型均少于4种。黄瓜病毒复合侵染类型多为CMV+ CGMMV,在海南省黄瓜中检出率最高,为10.67%;较为普遍的复合侵染类型还有CMV+TMV,上海市黄瓜检出率最高,为9.90%。最常见的3种病毒复合侵染类型为CMV+TMV+CGMMV。南瓜病毒复合侵染类型同样为CMV+CGMMV,在广东省南瓜上检出率最高,达26.35%;南瓜复合侵染类型CMV+ZYMV也较普遍,上海市南瓜检出率最高,为20.18%。南瓜上其余病毒复合侵染类型常有TMV存在,最常见组合为CMV+TMV+CGMMV。
2.6.3 豆科蔬菜病毒复合侵染类型 豆科蔬菜中,豇豆有9种病毒复合侵染组合,菜豆有8种病毒复合侵染组合,其余蚕豆、大豆的复合侵染组合均仅有1种。豇豆病毒复合侵染类型多为CMV+TMV,在山东省豇豆中检出率最高,达26.03%;其他较为普遍的复合侵染类型还有CMV+BBWV2,在安徽省豇豆中检出率最高,为12.42%,最常见3种病毒组合为CMV+TMV+ MDV。菜豆病毒复合侵染类型主要为CMV+TMV,在上海菜豆中检出率最高,为16.44%,其余病毒复合侵染组合常有SMV存在,有CMV+SMV和CMV+ SMV+PVS,还有4种病毒复合侵染组合CMV+ BBWV2+PVY+TuMV。
2.6.4 十字花科蔬菜病毒复合侵染类型 十字花科蔬菜中,萝卜病毒复合侵染组合有12种,大白菜病毒复合侵染组合有6种,其余的芥菜、青菜、甘蓝、油菜病毒复合侵染类型均为1种。萝卜病毒复合侵染类型多为CMV+TuMV,在湖北萝卜样品中检出率最高,为27.27%,在北京萝卜上检出率次之,为25.64%。其余复合侵染类型还有CMV+TMV、CMV+TuMV或CMV+CGMMV。萝卜复合侵染类型多为3种病毒组合,吉林省萝卜检出CMV+CGMMV+TuMV以及CMV+BBWV2+PVY 2种类型的复合侵染,北京市萝卜检出CMV+TMV+TuMV。大白菜病毒复合侵染类型同样以CMV+TuMV为主,在海南省大白菜上检出率最高,达14.00%;TMV+TuMV也较普遍,在福建省大白菜上平均检出率最高,为4.72%;其余的复合侵染类型中常伴有BBWV2。湖北省菜薹TuMV+CMV复合侵染率高达30.85%,白菜苔TuMV+BBWV2复合侵染率高达36.71%。
2.7 国内、地区新纪录病毒和病毒新自然寄主
2.7.1 病毒的国内新纪录 首次在我国发现ToMMV[55]、PeVYV[56]、PCV-1、PCV-2[57]、ZTMV[58]的侵染。目前ToMMV已在我国多个地区的辣椒和番茄上发生,PeVYV、PCV-1和PCV-2主要在我国辣椒上发生,ZTMV主要在我国葫芦科作物上发生。虽然目前ZTMV仅在云南被发现危害葫芦科蔬菜,但在云南分布范围较为广泛,且对葫芦科蔬菜作物的危害已超过ZYMV,成为优势病毒,并常与ZYMV和PRSV复合侵染南瓜,其田间发病率高达80%—90%。2.7.2 病毒的地区新纪录 2013年和2014年,分别在北京甜椒[59]和河北番茄[60]上发现ToCV;2014年在北京和河北辣椒上发现BWYV[61];首次在广东辣椒上检测到WSMoV[62]、番茄上检测到ToCV[63];首次在湖南辣椒上发现ChiRSV、PMV和ChiVMV,首次从番茄种子中检测到STV;首次在重庆发现TMGMV、PVMV、TSWV;首次在山东发现PeVYV、BWYV、PCV-1、PCV-2侵染辣椒[12];首次在海南番茄上发现ToMMV;首次在云南的番茄上发现CaCV[64]、WSMoV[65]、ToCV、ToMMV和ChiVMV;首次在云南的西瓜上发现WSMoV[66];首次在云南辣椒上发现TMGMV、PeVYV。
2.7.3 发现的病毒新自然寄主 首次发现ToMMV[55]、MABYV、CABYV侵染辣椒,ZTMV侵染黄瓜[58],芹菜[67]、豇豆[68]、豌豆、曼陀罗、党参、大丽花、旱金莲和刺天茄等为TSWV的新自然寄主,TMGMV侵染南瓜[69],ChiVMV侵染红茄[70],辣椒和番茄为TBTV的新自然寄主[71]。
3 讨论
蔬菜是我国重要的经济作物,近年来随着蔬菜种植面积的扩大、种植模式的变化及气候影响,病毒病的发生越来越严重,对我国蔬菜作物的生产造成严重的经济损失。虽然各地陆续对特定蔬菜作物病毒种类有相关报道,但至今仍缺乏对我国主要蔬菜作物,尤其是茄科、葫芦科、豆科和十字花科蔬菜的病毒种类进行系统且全面的调查和鉴定。本研究对我国大陆31个省(市、自治区)的茄科、葫芦科、豆科和十字花科主要蔬菜作物开展了系统且全面的调查和检测,基本明确了4个科主要蔬菜上的病毒种类及优势病毒。早期各地报道的一些蔬菜作物优势病毒主要以TMV为主,而本研究表明,我国4个科主要蔬菜上检测到的63种病毒中,CMV已经超越TMV成为第一大优势病毒,在全国范围内发生最为普遍,检出率最高,在31个省(市、自治区)的蔬菜病毒病样本上均能被检测到,且在多种蔬菜上的检出率最高。其次发生范围较广的病毒为TMV、TuMV和BBWV2等,TMV在除西藏外的30个省(市、自治区)均能被检测到,TuMV在除黑龙江、内蒙古、江苏、山东、河南、广西、西藏和新疆外的23个省(市、自治区)蔬菜都能被检出,BBWV2在除黑龙江、内蒙古、北京、河北、江苏、广西、四川和宁夏外的23个省(市、自治区)都能被检出。BBWV2除了危害菜豆、豇豆等豆科蔬菜作物外,在辣椒、番茄和茄子等茄科蔬菜,南瓜、黄瓜等葫芦科蔬菜,大白菜、萝卜等十字花科蔬菜上都能侵染危害。通过分析发现,我国蔬菜上检测到的这63种病毒,除了优势病毒CMV、TMV、BBWV2和TuMV外,TSWV的寄主适应性非常强,传播效率也很高,在茄科、葫芦科和豆科蔬菜上均有逐渐扩大和流行的趋势,除了侵染辣椒、番茄外,TSWV还可以侵染茄子、马铃薯、烟草、莴苣、豇豆和芹菜等[67,68]。国内早在1944年就在成都附近的番茄上发现有番茄斑萎病,2000年以后,TSWV在云南很多作物上被发现,危害严重[72]。本研究表明,TSWV已从最初被发现的四川和云南向国内其他地区快速扩散,目前TSWV已在辽宁、天津、安徽、福建、河南、海南、云南、贵州、四川、重庆、山西、甘肃、上海、山东等14个地区的辣椒、番茄、茄子、南瓜、黄瓜、丝瓜、菜豆和豇豆等茄科、葫芦科和豆科蔬菜作物上被发现,且已经成为造成我国部分地区辣椒和番茄上绝产的主要病毒,尤其是在云南。另外,ToCV在我国茄科蔬菜作物上也有流行发生的趋势,自2011年和2012年首次分别在山东和北京发生以来,短短几年时间,ToCV已从山东和北京扩散到河北、天津、陕西、甘肃、广东、山西、内蒙古、辽宁、吉林、云南、湖南等地[59,63,73-75],虽然ToCV于2016年才在陕西、广东、云南和湖南被发现,但是已经在局部地区造成番茄绝产等严重损失[63,74-76]。CGMMV自2003年在我国广西观赏南瓜上首次被发现以来,近年来在多地的葫芦科作物上的危害渐趋严重。目前已在吉林、黑龙江、天津、上海、江苏、浙江、安徽、江西、山东、河南、广西、广东、海南、贵州、甘肃、青海、新疆等地被发现,平均检出率达3.88%。除了危害葫芦科作物外,在天津的大白菜、吉林的萝卜上也检测到了CGMMV的危害。CGMMV在江苏设施栽培黄瓜、南瓜、瓠瓜、西葫芦、西瓜等葫芦科作物上的检出率为75.80%—80.00%,已成为近年来江苏设施瓜类作物上的主要病毒。上述国内蔬菜病毒的危害和发生状况表明,当前我国蔬菜病毒的发生存在由局部地区逐渐向全国扩张、由最初的寄主植物向其他寄主植物传播扩散的趋势。发生普遍并造成重大经济损失的病毒,往往是昆虫传播或种子传播的病毒,防控难度大,因此,亟需加强全国植保植检部门协同合作防控。
随着气候变化、种植模式改变以及检测技术的发展,各地发现的蔬菜病毒种类逐渐增多,病毒复合侵染现象比较严重,其中部分蔬菜作物最多可被6种病毒同时复合侵染[12],增加了病毒病防控的难度。各科蔬菜的复合侵染类型以CMV与其他病毒的复合侵染类型较多,这可能与CMV是各地区蔬菜的优势病毒并以较常见且数量较多的蚜虫为传播介体有关。另外,CMV还可通过某些作物的种子进行传播,极大地增加了CMV与其他病毒复合侵染的概率。作物品种的单一化和规模化种植、介体昆虫的高效传播等往往是造成病毒复合侵染的一个重要原因,在生产实践中,应当采取相关措施,选择抗病/虫性较好的品种并进行蔬菜品种的多样化种植,尤其应在苗期做好防虫等工作。本研究在我国主要蔬菜作物上检测到的63种病毒中,一部分病毒为在我国首次发生的病毒,一部分病毒为在各地区首次发现的病毒,其中有5种病毒为首次在我国发现,对这些国内或地区的新纪录病毒应同样加以重视,它们很有可能会成为我国蔬菜病毒病大流行的潜在风险。
鉴于本文的研究数据是由国内众多单位共同合作完成,存在各单位技术水平不均衡、部分病毒未纳入一些单位的必检病毒,以及在检测过程中检测方法不够统一等现象,本研究在我国主要蔬菜作物上检测到的63种病毒及各病毒的检出率均为保守数据,实际上的病毒种类可能还会更多,检出率还会有一定的变化。为了确保数据的准确性,本文所涉及到的数据中,大部分样品的病毒种类检测是在Dot-ELISA检测结果的基础上再进行RT-PCR检测和测序验证,一部分样品的病毒种类检测是通过小RNA测序分析之后再进行RT-PCR检测,只有至少2种检测方法均为阳性的样品才用于本文的数据统计和分析。
4 结论
对我国大陆地区31个省(市、自治区)的41 653份茄科、葫芦科、豆科和十字花科的蔬菜样本进行检测,发现目前侵染这4个科蔬菜的病毒有63种,其中茄科蔬菜作物病毒有40种,葫芦科蔬菜作物病毒26种,豆科蔬菜作物病毒19种,十字花科蔬菜作物病毒14种。CMV、TMV、TuMV和BBWV2为优势病毒,在全国范围内分布最广并且发生严重,在全国所有蔬菜样本中的检出率分别为20.51%、9.29%、5.16%和4.82%,尤其是CMV在各地均有分布,且均为这些地区的优势病毒。其中,茄科蔬菜作物的优势病毒为CMV和TMV;葫芦科蔬菜作物的优势病毒依次为CMV、ZYMV、CGMMV和TMV;豆科蔬菜作物的优势病毒为CMV和BBWV2;十字花科蔬菜作物的优势病毒依次为TuMV、CMV和TMV。TSWV、ToCV、CGMMV及近年新发现的病毒ToMMV的发生存在由局部地区逐渐向全国扩张、由最初的寄主植物向其他寄主植物传播扩散的趋势。本研究首次发现国内新纪录病毒5种,在7个省(市、自治区)发现该地区新纪录相关病毒17种,首次发现了8种病毒的14种新自然寄主。致谢:本项研究得到国家公益性行业(农业)科研专项“蔬菜主要病毒病防控技术研究与示范”的大力资助。参加项目研究人员还有陈德荣、陈德西、陈绵才、陈莎、李世访、李婷婷、刘欢、刘雪建、路思倩、卢训、罗大全、王莉爽、吴元华、肖龙、张治家、张志想、周涛、周文鹏、竺晓平等。在项目实施过程中,全国有关科研教学单位和技术推广部门给予了积极配合和大力协助,在此一并致谢!
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 2]
.
[本文引用: 2]
[本文引用: 1]
.
[本文引用: 1]
DOI:10.16420/j.issn.0513-353x.2014-0774Magsci [本文引用: 1]

利用斑点免疫杂交法(Dot-ELISA)和RT-PCR法对重庆地区发生的辣椒病毒病的病原进行了鉴定和优势病毒分析。利用5种常见蔬菜病毒的血清对采自重庆8个区县的152份辣椒病毒病样品进行Dot-ELISA检测,结果表明,共有118份辣椒样品检测呈阳性,其中,黄瓜花叶病毒(Cucumber mosaic virus,CMV)的侵染最普遍,总检出率高达57.89%;番茄花叶病毒(Tomato mosaic virus,ToMV)的总检出率最低,为22.52%;烟草花叶病毒(Tobacco mosaic virus,TMV)、芜菁花叶病毒(Turnip mosaic virus,TuMV)和蚕豆萎蔫病毒2号(Broad bean wilt virus 2,BBWV-2)的总检出率分别为30.26%、36.18%和24.34%。在118份阳性样品中,有66.10%的样品受两种及以上病毒复合侵染,其中33.33%的样品受到CMV和TuMV复合侵染,有26.27%的样品受3种病毒复合侵染。设计5种病毒的特异性引物,随机选取16份阳性样品进行RT-PCR扩增,克隆测序结果表明扩增片段确实是5种病毒的相应序列,且RT-PCR与ELISA检测结果基本吻合。检测结果表明CMV是重庆地区辣椒上的优势病毒种类,且该地区辣椒上病毒复合侵染现象普遍。本文首次报道了ToMV和TuMV侵染辣椒。
DOI:10.16420/j.issn.0513-353x.2014-0774Magsci [本文引用: 1]

利用斑点免疫杂交法(Dot-ELISA)和RT-PCR法对重庆地区发生的辣椒病毒病的病原进行了鉴定和优势病毒分析。利用5种常见蔬菜病毒的血清对采自重庆8个区县的152份辣椒病毒病样品进行Dot-ELISA检测,结果表明,共有118份辣椒样品检测呈阳性,其中,黄瓜花叶病毒(Cucumber mosaic virus,CMV)的侵染最普遍,总检出率高达57.89%;番茄花叶病毒(Tomato mosaic virus,ToMV)的总检出率最低,为22.52%;烟草花叶病毒(Tobacco mosaic virus,TMV)、芜菁花叶病毒(Turnip mosaic virus,TuMV)和蚕豆萎蔫病毒2号(Broad bean wilt virus 2,BBWV-2)的总检出率分别为30.26%、36.18%和24.34%。在118份阳性样品中,有66.10%的样品受两种及以上病毒复合侵染,其中33.33%的样品受到CMV和TuMV复合侵染,有26.27%的样品受3种病毒复合侵染。设计5种病毒的特异性引物,随机选取16份阳性样品进行RT-PCR扩增,克隆测序结果表明扩增片段确实是5种病毒的相应序列,且RT-PCR与ELISA检测结果基本吻合。检测结果表明CMV是重庆地区辣椒上的优势病毒种类,且该地区辣椒上病毒复合侵染现象普遍。本文首次报道了ToMV和TuMV侵染辣椒。
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1007/s00705-015-2691-9URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.1094/MPMI-23-5-0539URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

采用RT-PCR的方法,用马铃薯Y病毒属病毒3′-末端序列的简并引物和黄瓜花叶病毒(Cucumber mosaic virus, CMV)外壳蛋白(CP)基因的特异引物,对采自山东聊城的一表现花叶、黄化、蕨叶及果实畸形的南瓜样品进行了检测,同时扩增到了西瓜花叶病毒(Watermelon mosaic virus, WMV)和CMV 2种病毒的基因组片段,说明该样品受到WMV和CMV 2种病毒的复合侵染。这2个病毒分离物分别被命名为WMV-liaocheng和CMV-liaocheng。序列测定及分析结果表明,它们与其它相应病毒分离物CP基因核苷酸序列的同源性分别为91.2-98.0%和77.0-97.9%,推导的氨基酸序列同源性分别为96.4-98.5%和81.2-99.1%。根据完整CP 基因核苷酸序列构建的系统进化树显示:18个WMV分离物可分为3组,其中WMV-liaocheng 与HLJ、CHN及Habenaria等分离物表现出较近的亲缘关系,形成Ⅲ组;30个CMV分为两个亚组,其中CMV-liaocheng属于亚组I,CMV-liaocheng可能发生过重组。
.
Magsci [本文引用: 1]

采用RT-PCR的方法,用马铃薯Y病毒属病毒3′-末端序列的简并引物和黄瓜花叶病毒(Cucumber mosaic virus, CMV)外壳蛋白(CP)基因的特异引物,对采自山东聊城的一表现花叶、黄化、蕨叶及果实畸形的南瓜样品进行了检测,同时扩增到了西瓜花叶病毒(Watermelon mosaic virus, WMV)和CMV 2种病毒的基因组片段,说明该样品受到WMV和CMV 2种病毒的复合侵染。这2个病毒分离物分别被命名为WMV-liaocheng和CMV-liaocheng。序列测定及分析结果表明,它们与其它相应病毒分离物CP基因核苷酸序列的同源性分别为91.2-98.0%和77.0-97.9%,推导的氨基酸序列同源性分别为96.4-98.5%和81.2-99.1%。根据完整CP 基因核苷酸序列构建的系统进化树显示:18个WMV分离物可分为3组,其中WMV-liaocheng 与HLJ、CHN及Habenaria等分离物表现出较近的亲缘关系,形成Ⅲ组;30个CMV分为两个亚组,其中CMV-liaocheng属于亚组I,CMV-liaocheng可能发生过重组。
[本文引用: 1]
.
[本文引用: 1]
DOI:10.7668/hbnxb.2010.05.001Magsci [本文引用: 1]

为从分子水平鉴定山东聊城的一表现明显花叶、黄化、蕨叶及果实畸形的南瓜病毒病的病原.采用RT-PCR的方法,用TMV外壳蛋白(CP)基因的特异引物,对该样品进行了检测,克隆到的基因序列进行分析,并使其在大肠杆菌中表达.结果表明,从该样品中扩增到了TMV的CP基因,说明该样品受到TMV的侵染,首次发现TMV自然侵染南瓜.对CP基因序列测定及分析表明,与GenBank上其他TMV分离物CP基因核苷酸序列的同源性为86.%~99.0%,推导的氨基酸序列同源性为93.7%~99.4%.根据完整CP 基因核苷酸序列构建的系统进化树显示:32个TMV分离物可分为个组,其中TMV-liaocheng与Nakron Pathom、Fujian、017等分离物属于Ⅳ组.TMV-liaocheng可能发生过重组.将TMV-liaocheng CP基因与原核表达载体pET-22b(+)连接,在大肠杆菌BL21(DE3)pLysS诱导表达出分子量约20 kDa的融合蛋白,并用Ni2+ -NTA His · Bind(R)树脂纯化,纯化后的蛋白可直接用于制备特异性的抗血清,为准确、快速地检测TMV奠定了基础.
.
DOI:10.7668/hbnxb.2010.05.001Magsci [本文引用: 1]

为从分子水平鉴定山东聊城的一表现明显花叶、黄化、蕨叶及果实畸形的南瓜病毒病的病原.采用RT-PCR的方法,用TMV外壳蛋白(CP)基因的特异引物,对该样品进行了检测,克隆到的基因序列进行分析,并使其在大肠杆菌中表达.结果表明,从该样品中扩增到了TMV的CP基因,说明该样品受到TMV的侵染,首次发现TMV自然侵染南瓜.对CP基因序列测定及分析表明,与GenBank上其他TMV分离物CP基因核苷酸序列的同源性为86.%~99.0%,推导的氨基酸序列同源性为93.7%~99.4%.根据完整CP 基因核苷酸序列构建的系统进化树显示:32个TMV分离物可分为个组,其中TMV-liaocheng与Nakron Pathom、Fujian、017等分离物属于Ⅳ组.TMV-liaocheng可能发生过重组.将TMV-liaocheng CP基因与原核表达载体pET-22b(+)连接,在大肠杆菌BL21(DE3)pLysS诱导表达出分子量约20 kDa的融合蛋白,并用Ni2+ -NTA His · Bind(R)树脂纯化,纯化后的蛋白可直接用于制备特异性的抗血清,为准确、快速地检测TMV奠定了基础.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 2]
.
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3321/j.issn:1000-7091.1986.03.012Magsci [本文引用: 1]

本文论述了天津地区十字花科蔬菜的病毒类型.主要分为四个类型:第一类芜菁花叶病毒(TuMV),第二类烟草花叶病毒(TMV),第三类黄瓜花叶病毒(CMV),第四类称为甘兰僵矮病毒,其中以芜菁花叶病毒为主导类型.调查鉴定结果表明,本地区夏季十字花科蔬菜病毒,主要来自种株白菜.二秋小白菜,小油菜以及秋甘兰,秋萝卜可为秋季大白菜直接提供毒源和传播介体.夏季栽培的或野生的十字花科植物是秋白菜病毒病的桥梁寄主.根据病毒消长规律的研究结果提出了秋白菜病毒病的防治途径.
DOI:10.3321/j.issn:1000-7091.1986.03.012Magsci [本文引用: 1]

本文论述了天津地区十字花科蔬菜的病毒类型.主要分为四个类型:第一类芜菁花叶病毒(TuMV),第二类烟草花叶病毒(TMV),第三类黄瓜花叶病毒(CMV),第四类称为甘兰僵矮病毒,其中以芜菁花叶病毒为主导类型.调查鉴定结果表明,本地区夏季十字花科蔬菜病毒,主要来自种株白菜.二秋小白菜,小油菜以及秋甘兰,秋萝卜可为秋季大白菜直接提供毒源和传播介体.夏季栽培的或野生的十字花科植物是秋白菜病毒病的桥梁寄主.根据病毒消长规律的研究结果提出了秋白菜病毒病的防治途径.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 3]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 2]
.
[本文引用: 2]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
DOI:10.16420/j.issn.0513-353x.2015-0316Magsci [本文引用: 1]

<p>2014 年在广东辣椒产区发现疑似番茄斑萎病毒属(Tospovirus)病毒侵染引起的辣椒褪绿坏<br>死环斑症状。Dot-ELISA 检测显示,该病毒分离物与番茄斑萎病毒(Tomato spotted wilt virus,TSWV)单<br>克隆抗体不产生血清学反应,表明该病毒不属于TSWV。利用Tospovirus 属病毒通用引物gL3637/gL4435C<br>进行RT-PCR 检测,可以从所有辣椒病样总RNA 中扩增出预期大小约800 bp 的目的片段。基因克隆与序<br>列分析表明,该片段序列与西瓜银斑驳病毒(Watermelon silver mottle virus,WSMoV)中国广州分离物的<br>同源性最高,为97.5%。系统进化分析也显示,该病毒分离物与WSMoV 各分离物亲缘关系最近,并聚类<br>在一个分支。因此,侵染广东辣椒的病毒分离物为WSMoV。</p>
.
DOI:10.16420/j.issn.0513-353x.2015-0316Magsci [本文引用: 1]

<p>2014 年在广东辣椒产区发现疑似番茄斑萎病毒属(Tospovirus)病毒侵染引起的辣椒褪绿坏<br>死环斑症状。Dot-ELISA 检测显示,该病毒分离物与番茄斑萎病毒(Tomato spotted wilt virus,TSWV)单<br>克隆抗体不产生血清学反应,表明该病毒不属于TSWV。利用Tospovirus 属病毒通用引物gL3637/gL4435C<br>进行RT-PCR 检测,可以从所有辣椒病样总RNA 中扩增出预期大小约800 bp 的目的片段。基因克隆与序<br>列分析表明,该片段序列与西瓜银斑驳病毒(Watermelon silver mottle virus,WSMoV)中国广州分离物的<br>同源性最高,为97.5%。系统进化分析也显示,该病毒分离物与WSMoV 各分离物亲缘关系最近,并聚类<br>在一个分支。因此,侵染广东辣椒的病毒分离物为WSMoV。</p>
[本文引用: 3]
.
[本文引用: 3]
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 2]
.
[本文引用: 2]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
