 , 刘军化, 杜丹, 闫萌, 郑丽媛, 吴雪, 桑贤春, 张长伟
, 刘军化, 杜丹, 闫萌, 郑丽媛, 吴雪, 桑贤春, 张长伟
西南大学水稻研究所 / 转基因植物与安全控制重庆市重点实验室, 重庆400716
Identification and Gene Mapping of a Lesion Mimic Mutant spl34 in Rice (Oryza sativa L.)
LIUBao-Yu , LIUJun-Hua, DUDan, YANMeng, ZHENGLi-Yuan, WUXue, SANGXian-Chun, ZHANGChang-Wei
, LIUJun-Hua, DUDan, YANMeng, ZHENGLi-Yuan, WUXue, SANGXian-Chun, ZHANGChang-Wei
通讯作者:
收稿日期:2017-05-22
接受日期:2017-11-21
网络出版日期:2018-03-12
版权声明:2018作物学报编辑部作物学报编辑部
基金资助:
作者简介:
-->
展开
摘要
关键词:
Abstract
Keywords:
-->0
PDF (3703KB)元数据多维度评价相关文章收藏文章
本文引用格式导出EndNoteRisBibtex收藏本文-->
植物类病斑突变体是指植物在未受到外界逆境胁迫、伤害或病原菌侵染的情况下, 在其叶片、叶鞘等部位自发形成各种类似于坏死病斑的一类突变体[1]。根据类病斑突变体表型特征及类病斑分布情况, 可将其分为起始型和扩散型, 起始型具有大小及分布位置较稳定的斑点, 而扩散型的斑点在形成后会扩散到叶片其他部位甚至叶鞘和茎秆[2,3]。类病斑突变体的发生机制主要有抗病抗逆相关基因的突变或缺失、活性氧及羟自由基在植物体内的积累、正常代谢途径的紊乱和外界条件(如光照、温度)的影响等[4]。植物类病斑的产生与植物受到环境胁迫或病原菌侵害时的应激反应类似, 都取决于植物的基因型和所处的环境条件, 因此可用于研究植物对环境胁迫和病原菌入侵的反应[5]。
迄今在拟南芥[6]、玉米[7]、番茄[8]、水稻[9]等植物中均有类病斑突变体报道。水稻中已报道的类病斑突变体很多与其抗性有关[10,11], 如突变体spl5[12]、spl11[13]、spl18[14]、spl28[15]等对稻瘟病和白叶枯病的抗性均增强; 突变体OsLSD1[16]对稻瘟病的抗性增强, 对白叶枯病的抗性则无影响; 突变体c5[17]和spl32[18]对白叶枯病的抗性增强, 对稻瘟病的抗性影响则尚不明确; 而spl7[19]对稻瘟病的抗性降低或不变。在这些水稻类病斑突变体中, 第一个被克隆的类病斑突变基因是spl7[2,19], 该基因位于第5染色体上, 编码一个热激转录因子蛋白; 其余已克隆的水稻类病斑突变体基因有spl28[15]、RLS1[20]、OsHPL3[21]、OsLMS[22]、OsACDR1[23]、noe1[24]、Rlin1[25]、Ospti1a[26]、Lmr[27]、spl5[12]、OsLSD1[16]、spl18[14]、Fgl[28]、NLS1[29]、spl11[13]、sl[30]、osNH1[31]、lmm5[32]和spl33[33], 但相比于发现的突变体数, 目前已被克隆的类病斑体基因数还比较少。
我们通过EMS诱变籼稻“缙恢10号”, 从其后代中筛选出1个遗传性状稳定的类病斑突变体spl34。与野生型相比, 该突变体苗期和分蘖前期表型正常, 从分蘖后期开始倒三、倒四叶的叶鞘出现褐色斑点, 随后斑点先沿着中脉向上部扩散, 再由中脉向叶片两侧扩散, 至成熟期褐色斑点分布于整个植株的叶片及叶鞘, 这与已报道的水稻类病斑突变体表型不同。因此, 本文从遗传特性、农艺性状、组织化学分析、稻瘟病抗性鉴定及基因定位等方面对类病斑突变体spl34进行系列试验, 以期为研究和应用控制该突变体性状的相关基因奠定基础。
1 材料与方法
1.1 供试材料
利用EMS化学诱变剂诱变籼型水稻恢复系“缙恢10号”获得突变体spl34, 经过连续4代种植, 发现该突变体表型稳定遗传。将spl34与籼稻不育系“西农1A”杂交获得F1和F2种子用于遗传分析, 利用F2群体对突变体基因进行分子定位。用于稻瘟病菌生理小种鉴别的7个供试品种分别为Tetep、珍龙13、四丰43、东农363、关东51、合江18和丽江新团黑谷。供试穗颈瘟标样采集自四川省的叙永县、冕宁县, 及重庆市的黔江、合川、南川、永川等地的一些主栽或新推广品种。1.2 农艺性状考察
将野生型“缙恢10号”和突变体spl34种植于田间小区, 3次重复, 每个重复10行, 每行10株。至成熟期, 随机从小区中央选取10株考察株高、有效穗数、穗长、穗粒数、结实率、千粒重等农艺性状, 并作t检验统计分析。1.3 遮光试验
在田间条件下, 用约2 cm长的锡箔纸分别对处于抽穗期即将出现表型的野生型和突变体叶片进行包裹遮光处理, 1周后揭掉锡箔纸对叶片进行复光处理, 复光处理时间也为1周; 期间分别对遮光处理和复光处理的叶片跟踪拍照记录。1.4 光合色素含量测定
参考Lichtenthaler[34]的方法, 分别测定野生型和突变体抽穗期的倒一、倒二和倒三叶的光合色素含量。8:30—9:00在小区中间选取长势相对一致的野生型和突变体植株各5株, 称取0.05 g叶片将其剪碎后浸泡于25 mL体积比为乙醇∶丙酮=1∶1的溶液中, 设置3个重复, 暗处理24 h, 期间振荡数次; 然后用分光光度计测定663、645和470 nm波长下的吸光值, 计算光合色素含量, 并作t检验统计分析。1.5 叶绿体的荧光显微镜观察
抽穗期, 分别剪取野生型和突变体倒二叶中部约1 cm长叶片包埋于包埋剂(Tissue-Tek, SAKURA)中, 然后-20°C冷冻至包埋剂凝固后用冷冻切片机切成8 μm厚的切片, 取冲洗干净的载玻片粘取切片, 用生理盐水将切片清洗3次, 把切片周围的包埋剂清洗干净后盖上盖玻片, 最后在荧光显微镜下观察叶绿体的荧光现象。1.6 突变体的组织化学分析
为检测突变体在类病斑形成过程中是否存在细胞死亡和过氧化氢积累, 在抽穗期分别取野生型和突变体相同部位的叶片, 参照Bowling等[35]的方法进行台盼蓝染色和参照Thordal-Christensen等[36]的方法进行DAB染色。1.7 生理指标测定
在抽穗期, 分别取野生型和突变体各3株, 用南京建成科技有限公司提供的试剂盒, 按其说明书测定倒一、倒二、倒三叶过氧化氢、羟自由基和超氧阴离子的含量, 以及过氧化氢酶(CAT)、过氧化物酶(POD)、总超氧化物歧化酶(T-SOD)的活性等生理生化指标, 并进行t检验。1.8 稻瘟病菌抗谱测定和抗性鉴定
在西南大学水稻研究所歇马基地温室内进行抗谱测定和苗瘟抗性鉴定, 在四川省农业科学院水稻高粱研究所叙永稻瘟病病圃进行叶瘟和穗颈瘟抗性鉴定。参照黄富等[37]的方法, 进行单孢分离纯化、产孢培养和制备孢子悬浮液, 共分离了56个单孢菌株。参照张长伟等[38]的方法进行稻瘟病菌抗谱测定和苗瘟、叶瘟、穗颈瘟的抗性鉴定。按全国稻瘟病菌生理小种联合试验组[39]的方法和标准对供试菌株进行生理小种划分和命名。以抗病频率作为野生型和突变体的抗谱评价指标, 抗病频率越高, 表明该材料对稻瘟病菌群体的抗谱范围越宽, 广谱抗性越强。抗病频率(%) = (对该供试材料非致病菌株数/测试有效菌株总数)×100
按国际水稻研究所(IRRI)水稻标准评级系统(0~9级)标准(IRRI, 2002)[40], 以苗瘟病情指数、叶瘟病情指数分别作为野生型和突变体的苗瘟、叶瘟抗性评价指标。
病情指数(%) = ∑(病害某一级别的植株数×病害的相对病级数值)/(病害的最高病级数值×调查总株数)×100。
另外, 以病穗率作为野生型和突变体的穗颈瘟抗性评价指标。
1.9 基因定位
根据F2群体中正常植株和突变体植株的比值, 选取F2中突变体植株用于基因定位, 采用CTAB 法[41]提取亲本和基因定位群体的基因组DNA。首先随机选取F2中正常植株和突变体植株各10株, 剪取叶片等量混匀构建正常基因池和突变体基因池。用本实验室已备好的96对均匀分布于水稻12条染色体上的多态性分子标记对基因池进行扩增, 将具有偏态的标记用单株进行验证, 以确定分子标记与突变位点是否连锁。再在连锁标记位点两侧自行设计InDel标记对突变位点进行初步定位。分子标记由上海英骏生物技术有限公司合成。PCR体系为12.5 μL, 含1.25 μL 10 × PCR buffer、0.5 μL 2.5 mmol L-1 dNTPs、正反引物各0.5 μL、1.0 μL模板DNA、0.1 μL 5 U rTaq DNA聚合酶、8.65 μL ddH2O。PCR程序为预变性94°C 5 min; 变性94°C 30 s, 退火55°C 30 s, 延伸72°C 30 s, 35个循环; 再延伸72°C 10 min。PCR产物经聚丙烯酰胺凝胶电泳及银染后记录带型。1.10 候选基因分析及测序
利用GRAMENE、国家水稻数据中心和NCBI等网站查阅定位区间内的基因注释并分析, 遴选候选基因。为候选基因设计引物, 以野生型和突变体spl34基因组DNA为模板进行PCR, 产物用于测序。用VectorNTI软件比对测序结果。1.11 总RNA提取及qRT-PCR
抽穗期取野生型的正常叶片、叶鞘和突变体有类病斑的叶片和叶鞘, 按试剂盒说明书提取总RNA, 试剂盒由北京普洛麦格生物技术有限公司提供。参照TAKARA的PrimeScript RT reagent Kit with gDNA Eraser (Perfect Real-time)试剂盒反转录。qRT-PCR反应体系为20 μL, 含10 μL 2 × SYBR Premix Ex Taq II, 0.4 μL 50 × ROX Reference Dye, 2 μL cDNA模板, 正、反引物(10 μmol L-1)各0.6 μL, 6.4 μL RNase-free H2O。在Bio-Rad荧光定量PCR仪上扩增后, 利用CFX-Manager软件收集和整理数据, 并进行t检验。2 结果与分析
2.1 突变体表型及主要农艺性状
整个生育期野生型植株未出现类病斑, 而在分蘖后期突变体spl34下部叶片的叶鞘上开始出现褐色斑点, 随后褐色斑点向植株上部扩散, 至成熟期整个植株的叶片和叶鞘均分布有褐斑(图1-A, B, C)。成熟期突变体spl34的株高、穗长较野生型显著降低, 每穗粒数、结实率和千粒重较野生型极显著降低, 但两者的有效穗数则无显著差异(表1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1分蘖期、成熟期野生型(WT)和突变体spl34的表型
A: 分蘖期野生型(WT)和突变体spl34植株; B: 成熟期野生型(WT)和突变体spl34植株; C: 成熟期野生型(WT)和突变体spl34的叶片。
-->Fig. 1Phenotype of the wild type (WT) and the spl34 mutant at tillering stage and mature period
A: plants of the wild type (WT) and the spl34 mutant at tillering stage; B: plants of the wild type (WT) and the spl34 mutant at mature period; C: leaves of the wild type (WT) and the spl34 mutant at mature period.
-->
Table 1
表1
表1野生型(WT)和spl34的主要农艺性状
Table 1Agronomic traits of the wild type (WT) and spl34 mutant
| 材料 Material | 株高 Plant height (cm) | 有效穗数 Effective panicle | 穗长 Panicle length (cm) | 每穗粒数 Grain number per panicle | 结实率 Seed-setting rate (%) | 千粒重 1000-grain weight (g) |
|---|---|---|---|---|---|---|
| WT | 107.12±3.35 | 8.60±1.20 | 25.26±1.40 | 180.90±12.48 | 78.41±4.45 | 25.57±0.81 |
| Spl34 | 100.32±3.59* | 8.80±0.82 | 22.34±1.22* | 135.42±8.66** | 53.65±3.96** | 22.68±0.30** |
新窗口打开
2.2 对遮光处理的响应
对野生型的叶片和突变体即将出现类病斑的叶片用锡箔纸进行遮光处理1周后显示, 突变体被锡箔纸遮盖的部位不出现或只出现极少量的类病斑, 而叶片其他部位出现大量的类病斑。遮光处理的部位复光1周后出现明显的类病斑(图2)。说明突变体spl34的类病斑受光诱导。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2遮光对野生型和突变体spl34叶片的影响
A: 野生型遮光处理后; B: 野生型遮光处理后复光1周; C: 突变体spl34遮光后; D: 突变体spl34遮光处理后复光1周后。
-->Fig. 2Effects of shading on the wild type and the spl34 mutant leaves
A: leaf of the wild type after shading; B: leaf of wild type regained normal light for one week after shading; C: leaf of spl34 after shading; D: leaf of spl34 regained normal light for one week after shading.
-->
2.3 光合色素含量的变化
抽穗期突变体的倒一叶光合色素含量均略高于野生型, 但未达到显著差异水平; 而倒二叶和倒三叶光合色素含量均较野生型低, 且分别达到了显著和极显著差异水平(图3), 这与突变体在抽穗期倒一叶还未出现类病斑, 倒二叶出现类病斑但较倒三叶少有关。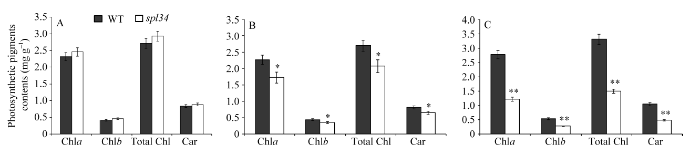 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3野生型(WT)和突变体spl34抽穗期光合色素含量
*在0.05水平上差异显著; **在0.01水平上差异显著。A~C: 抽穗期野生型(WT)和突变体spl34的倒一叶(A)、倒二叶(B)和倒三叶(C)光合色素含量。
-->Fig. 3Photosynthetic pigments contents of the wild type and the spl34 mutant at heading stage
A-C: photosynthetic pigments contents of the flag leaves, second leaves, third leaves respectively in the wild type and the spl34 mutant at heading stage. * Significantly different at P<0.05; ** significantly different at P<0.01.
-->
2.4 突变体荧光显微镜观察结果
抽穗期取野生型的叶片及突变体有类病斑的叶片制作冷冻切片, 于荧光显微镜下观察显示, 突变体spl34的叶绿体产生的红色荧光弱于野生型, 且突变体中出现类病斑的部位(图4-D中白色箭头处)叶绿体产生的红色荧光也较未出现类病斑的部位弱(图4-D中黄色箭头处), 说明突变体产生类病斑的部位发生了叶绿素降解。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4野生型和突变体spl34叶片的自发荧光
A, B: 野生型在自然光和紫外光下叶片横切显微结构; C, D: 突变体spl34在自然光和紫外光下叶片横切显微结构; 标尺: 100 μm。白色箭头所指部位为类病斑形成部位, 黄色箭头所指部位为未形成类病斑部位。
-->Fig. 4Autofluorescence of the wild type and the spl34 mutant
A, B: microstructure in cross section of wild type under natural light and UV light; C, D: microstructure in cross section of spl34 mutant under natural light and UV light; Bar=100 μm. The positions pointed by white arrows are the lesion formation sites, those with yellow arrows are the sites without lesion mimic.
-->
2.5 突变体叶片的细胞程序性死亡和H2O2积累
台盼蓝染色结果显示, 突变体spl34的叶片有类病斑的部位及其周围被染成深蓝色, 说明该部位存在细胞程序性死亡, 而野生型的叶片被染成均匀的浅蓝色, 说明其叶片上未发生细胞程序性死亡(图5-A, B)。这可能是产生类病斑的部位发生了过敏性反应而导致细胞死亡。DAB染色结果显示, 突变体spl34的叶片上有大量红褐色斑点, 而野生型的叶片上并未出现类似的斑点(图5-C, D), 说明突变体在类病斑产生的过程中伴随着H2O2的积累。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5野生型(WT)和突变体spl34的组织化学分析
A, B: 野生型(WT)和突变体spl34叶片的台盼蓝染色; C, D: 野生型(WT)和突变体spl34叶片的DAB染色。
-->Fig. 5Histochemical analysis of the wild type and the spl34 mutant
A, B: leaves of the wild type (WT) and the spl34 mutant stained by trypan blue; C, D: leaves of the wild type (WT) and the spl34 mutant stained by DAB.
-->
2.6 突变体生理指标的变化
抽穗期突变体的H2O2含量极显著高于野生型, 而其O2-含量只有倒三叶较野生型极显著升高, 倒一、倒二叶的O2-含量与野生型相比无显著差异, 这可能与突变体孕穗期倒一叶无类病斑, 倒二叶刚出现类病斑, 倒三叶类病斑较明显有关; 突变体的•OH含量与野生型相比无显著差异(图6-A~C)。对CAT、POD、SOD等抗氧化酶活性测定结果显示, 突变体的抗氧化酶活性显著或极显著低于野生型(图6-D~F), 说明植株体内的抗氧化酶活性降低使得突变体清除自由基能力下降, 导致突变体体内的H2O2和O2-含量升高, 而•OH因其氧化能力很强, 产生后便立刻与其他分子发生反应, 不需要专门的酶来清理, 因此突变体体内的抗氧化酶活性降低对其含量影响不大。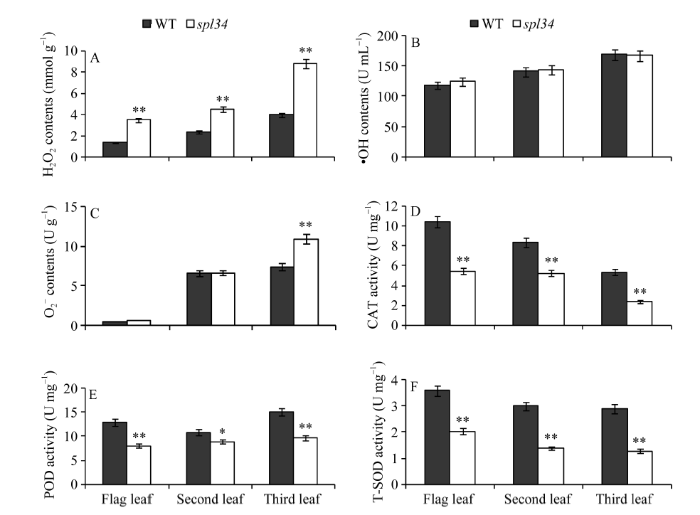 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6抽穗期野生型(WT)和突变体spl34的生理指标
*在0.05水平上差异显著; **在0.01水平上差异显著。
-->Fig. 6Physiological indices of the wild type (WT) and the spl34 mutant at heading stage
* Significantly different at P<0.05; ** significantly different at P<0.01.
-->
2.7 突变体的稻瘟病菌抗谱测定和稻瘟病抗性鉴定
56个供试单孢菌株中有54个菌株对丽江新团黑谷严重侵染, 为有效菌株。54个有效菌株经7个中国鉴别品种鉴定划分为6个中国生理群19个生理小种。ZB 群为优势种群, 小种出现频率为61.11%; ZA群为重要种群, 小种出现频率为20.37%; ZC、ZD、ZE和ZG等种群的小种出现频率均较低, 分别为3.7%、3.7%、1.86%和12.96%。表2显示, 突变体spl34对ZA生理群的抗病频率比野生型升高15.38%, 而对ZB生理群的抗病频率比野生型降低3.63%, 对ZC、ZD、ZE和ZG生理群的抗病频率则与野生型相同, 特别是对总群的抗病频率也与野生型相同。说明与野生型相比, 突变体的抗谱并未明显拓宽。
Table 2
表2
表2野生型(WT)与突变体spl34对稻瘟病菌的抗谱
Table 2Resistance spectrum of the wild type (WT) and the spl34 mutant to rice blast (%)
| 材料 Material | 对稻瘟病各生理群的抗病频率 Resistance frequency to each physiological group | 总群抗病频率 Resistance frequency to total population | |||||
|---|---|---|---|---|---|---|---|
| ZA | ZB | ZC | ZD | ZE | ZG | ||
| WT | 39.39±5.25 | 74.75±1.76 | 0 | 100 | 100 | 100 | 70.37±1.85 |
| spl34 | 45.45±5.45 | 72.04±4.10 | 0 | 100 | 100 | 100 | 70.37±3.20 |
新窗口打开
苗瘟、叶瘟和穗颈瘟的抗性鉴定结果(表3)显示, 突变体苗瘟、叶瘟病情指数和穗颈瘟的病穗率均比野生型略高, 但差异并不显著。说明突变体与野生型的稻瘟病抗性差异也不明显或略显降低。
Table 3
表3
表3野生型(WT)与突变体spl34的稻瘟病病情指标
Table 3Disease indices of the wild type and the spl34 mutant to rice blast (%)
| 材料 Material | 苗瘟病情指数 Disease indexes of leaf blast at seedling stage | 叶瘟病情指数 Disease indexes of leaf blast at tillering stage | 穗颈瘟发病率 Disease incidence of neck blast |
|---|---|---|---|
| WT | 32.00±2.23 | 71.43±3.31 | 3.94±0.61 |
| spl34 | 36.56±2.01 | 77.14±2.22 | 4.19±0.52 |
新窗口打开
2.8 突变体的遗传分析
以表型正常的“西农1A”为母本, 突变体spl34为父本杂交得到的F1表型正常, F1自交得到的F2出现性状分离, 正常株1774株, 突变株562株, 经卡方分析χ2=1.06<χ20.05=3.84, 符合3∶1分离比, 因此突变体表型受1对隐性基因控制。2.9 突变体的基因定位、候选基因分析及测序
将F2群体中的突变体植株用于基因定位。用本实验室已准备好的96对均匀分布于12条染色体上的具有多态的引物对正常基因池和突变体基因池进行扩增, 发现位于第4染色体编号为ID40的分子标记与突变基因连锁, 在该分子标记两侧开发新的具有多态的InDel分子标记(表4), 将目标基因定位于LR7和LR14两个分子标记之间, 为了进一步确定目标基因的位置在LR7和LR40之间又开发5对具有多态的InDel分子标记(表4), 最终将目标基因定位在LR49和LR52两个分子标记之间, 遗传距离分别为1.07 cM和0.09 cM, 区间大小约为200 kb。Table 4
表4
表4新开发的InDel标记
Table 4Newly designed InDel markers
| 标记 Marker | 正向引物 Forward primer (5°-3°) | 反向引物 Reverse primer (5°-3°) |
|---|---|---|
| LR7 | TTCCTACACGGTCGAAGATCAT | TCAAGTACCGGATTGAGTTTGAG |
| LR14 | GAGATTATCCTGCGGTCTTAATC | TTGATGATACGATGACCAAGTTC |
| LR25 | ATATTCACATGCGCCGTTTG | CTCCAACAGATCCATCTCAACC |
| LR31 | GATCCAATGCGATGCTACTCC | GCGATTAACTGGAGACATCACG |
| LR33 | TTCAATGTGCTGCATTTAGAAAT | AAAGATGGTTCAAGTCTTGAGGA |
| LR49 | GCCAAACAGATTGGTTAGCG | TTAGCGTAGCTGGCATAACATC |
| LR52 | TTGATCTCGACTTCGATCACTAG | GATGTCTGGACGTACACACACG |
新窗口打开
利用GRAMENE、国家水稻数据中心和NCBI等网站查阅定位区间内的基因注释, 发现区间内共包含了32个候选基因, 与类病斑突变有一定相关性的有: LOC_Os04g56360编码富含半胱氨酸的类受体蛋白激酶前体、LOC_Os04g56430编码类受体激酶、LOC_Os04g56480编码pelota蛋白、LOC_ Os04g56180编码过氧化物酶前体、LOC_ Os04g56320编码AAA-ATP酶, 因此对这5个候选基因进行测序分析。测序结果显示, 突变体中的LOC_Os04g56480基因发生了单碱基突变, 该基因的第3449位碱基, 即第5外显子的第9位碱基由G突变为T, 导致氨基酸替换, 由色氨酸突变为半胱氨酸(图7), 因此初步推测该基因可能为控制类病斑产生的候选目的基因。根据GRAMENE的预测, 该基因在植株的各个部位均有表达, 其全长7701 bp, 有2个转录, 第一转录本长为2772 bp, 编码1个长为131 aa的蛋白; 第二转录本长为1691 bp, 编码1个长为252 aa的蛋白。
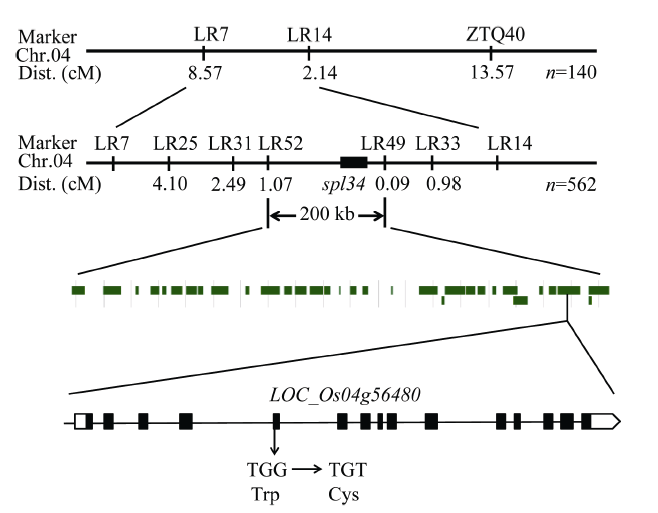 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7突变体spl34的基因定位
-->Fig. 7Gene mapping of the spl34 mutant
-->
2.10 目的基因、病程相关基因和稻瘟病抗性基因的表达分析
利用qRT-PCR对野生型和突变体抽穗期的叶片和叶鞘进行表达分析。结果显示, 与野生型相比, 突变体的LOC_Os04g56480基因在叶片和叶鞘中表达量均降低(图8)。说明突变体spl34类病斑的出现可能是由于该基因的表达量降低引起的。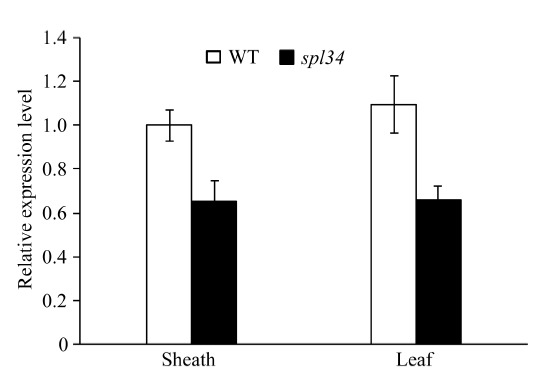 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8目的基因spl34相对表达量分析
-->Fig. 8Relative expression analysis of the target gene spl34
-->
对病程相关基因和稻瘟病抗性基因的表达分析结果(图9)显示, 突变体的病程相关基因PR1a、PR1b和NPR1的表达量显著或极显著高于野生型, 这可能是由于突变体类病斑的产生激发这些病程相关基因的表达量上升。但其余病程相关基因和稻瘟病抗性基因的表达量却均未出现上升, 这也许是突变体的稻瘟病抗性并未增强的原因。
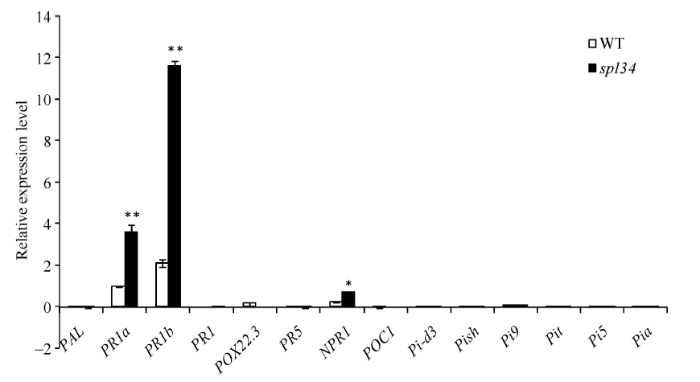 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9病程相关基因和稻瘟病抗性基因的表达分析
病程相关基因为PAL、PR1a、PR1b、POX22.3、PR5、NPR1和POC1; 稻瘟病抗性基因为Pi-d3、Pish、Pi9、Pit、Pi5和Pia。
-->Fig. 9Relative expression analysis of the pathogenesis-related genes and the rice blast resistance genes
The pathogenesis-related genes: PAL, PR1a, PR1b, POX22.3, PR5, NPR1, POC1; the rice blast resistance genes: Pi-d3, Pish, Pi9, Pit, Pi5, Pia.
-->
3 讨论
类病斑突变体是研究植物细胞程序性死亡和植物对环境胁迫、病原菌入侵反应的理想材料。目前已定位的类病斑突变体基因在水稻12条染色体上均有分布。在已报道的类病斑突变基因中主要编码的蛋白有热激转录因子蛋白、U-box/Armadillo 重复蛋白、假定粪卟啉原Ⅲ氧化酶、锌指蛋白、酰基转移酶、RAF-丝裂原活化蛋白激酶、细胞色素P450单加氧酶家族的CYP71P1蛋白等。本研究报道的spl34编码pelota蛋白, 根据NCBI的预测, 它是一个蛋白释放因子(eRF1), 通过识别终止密码和促进肽酰-tRNA键的水解从而终止蛋白质的翻译过程。该蛋白包含3个保守结构域, 其三维结构与tRNA相似。测序结果显示, 在突变体的第5外显子的第9个碱基发生突变, 由原来的G突变为T, 导致该位置的一个氨基酸被替换, 即由原来的色氨酸突变为半胱氨酸, 但LOC_Os04g56480是否就是控制突变体类病斑产生的目的基因还有待进一步的功能互补验证。qRT-PCR结果表明, 与野生型相比, LOC_ Os04g56480在突变体内表达量降低。表型特征方面, 突变体spl34从分蘖后期开始在下部叶片的叶鞘上出现类病斑, 随后先沿着叶片中脉向上扩散, 最后再由中脉向叶片两侧扩散, 至成熟期类病斑分布于整个植株的叶片和叶鞘上。虽然突变体spl34与之前报道的HM47[42]在定位区间上有重叠, 但它们的表型特征及出现时期并不完全相同, HM47在播种后10 d便在第1张叶片的叶尖部位出现类病斑。此外, spl34的分蘖数与野生型相比并没有显著变化, 而HM47的分蘖数与野生型相比极显著地减少, 但在株高、穗长及千粒重方面突变体spl34和HM47一样均较野生型显著降低, 这可能是两个突变体发生突变的位点不同导致的。
类病斑突变体上的类病斑产生受光照、温度和湿度的影响, 且在类病斑产生部位及其周围通常会伴随着细胞程序性死亡。Noutoshi等[43]报道的拟南芥类病斑突变体slh1在低温低湿的条件下才会出现类病斑; Arase等[44]在水稻中发现一类病斑突变体M1009, 该突变体在气温高于25°C时不出现类病斑, 而当气温低于20°C时类病斑明显。Yamanouchi等[19]报道的spl7突变体类病斑的产生与高温和紫外光有关; 邱洁华等[45]通过遮光试验证明水稻类病斑突变体lmm4的褐斑产生受光的诱导。在已报道的类病斑突变体中如OsACDR1[23]、spl1[46]、spl5[12]等, 均出现局部细胞程序性死亡; 而OsLMS[22]、spl28[15]、RLS1[20]等突变体则出现叶片早衰现象。本研究中的类病斑突变体spl34在其类病斑产生部位也存在细
胞程序性死亡。同时遮光试验结果也表明, spl34上的类病斑产生受光照的诱导。此外, 在研究过程中发现spl34上类病斑的产生还可能与温度有关, 当温度低于20°C时类病斑产生的数量急剧减少甚至不产生, 即使有少量类病斑产生, 其产生的时期也有推迟现象, 具体情况还有待进一步的试验验证。
植物的类病斑突变有时还会诱发其抗性的改变。稻瘟病抗性鉴定结果显示, 突变体spl34的稻瘟病抗性并未增强, 抗谱并未拓宽。qRT-PCR结果显示, 突变体spl34中稻瘟病抗性基因的相对表达量与野生型相比并未明显升高, 稻瘟病抗性基因的表达是水稻对稻瘟病抗性的主要影响因素, 虽然在突变体中的PR1a、PR1b和NPR1 3个病程相关基因的相对表达量显著或极显著高于野生型, 但病程相关基因不仅与水稻的稻瘟病抗性有关, 而且还与水稻对其他逆境胁迫的抗性有关, 其相对表达量升高可能诱导突变体对其他逆境胁迫的抗性增强, 而对水稻的稻瘟病抗性增强影响不大或无影响。生理指标测定结果表明, 突变体中的H2O2和O2-含量比野生型高, 且已经产生类病斑部位的H2O2和O2-含量要比未产生类病斑的部位高, 说明这两类活性氧是随着类病斑的产生而积累的。
研究植物类病斑突变体对了解植物的细胞程序性死亡和抗病机理有重要意义, 为育种方面抗病材料的筛选提供理论基础。本研究从农艺性状、生理生化特性以及突变基因的定位和表达等方面对水稻类病斑突变体spl34进行系统地研究, 所得结果可为进一步研究类病斑突变体的产生机制提供理论依据。
4 结论
水稻类病斑突变体spl34表型受1对隐性核基因控制, 苗期和分蘖前期无类病斑, 从分蘖后期开始在其下部叶片的叶鞘上出现类病斑, 随后逐渐扩散, 至成熟期分布于整个植株的叶片和叶鞘上。突变体的株高变矮, 产量降低, 叶绿素的荧光现象减弱, 对稻瘟病的抗性无明显变化或略显降低; 其体内的H2O2和O2-含量在出现类病斑的部位显著升高, 而•OH的含量变化不大; 保护酶CAT、POD和T-SOD的活性较野生型低。spl34被定位于第4染色体LR49和LR52两个分子标记之间, 物理距离为200 kb; 突变体中的LOC_Os04g56480基因的编码框发生单碱基替换突变, 导致编码蛋白的氨基酸被替换, 初步推测该基因可能为候选目的基因。致谢: 重庆市黔江区农业委员会王海翔高级农艺师提供部分穗颈瘟标样, 在此感谢。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | . |
| [2] | . . |
| [3] | . |
| [4] | . . |
| [5] | . |
| [6] | . |
| [7] | . |
| [8] | . |
| [9] | . |
| [10] | . . |
| [11] | . |
| [12] | |
| [13] | . |
| [14] | . |
| [15] | . |
| [16] | . |
| [17] | . |
| [18] | . . |
| [19] | . |
| [20] | . |
| [21] | . |
| [22] | . |
| [23] | . |
| [24] | . |
| [25] | . |
| [26] | . |
| [27] | . |
| [28] | . |
| [29] | . |
| [30] | . |
| [31] | . |
| [32] | . |
| [33] | . |
| [34] | . |
| [35] | . |
| [36] | . |
| [37] | . . |
| [38] | . . |
| [39] | . . |
| [40] | . |
| [41] | . |
| [42] | . |
| [43] | . |
| [44] | . |
| [45] | . . |
| [46] | . |
