
Cloning of BoLH27 Gene from Cabbage and Phenotype Analysis of Transgenic Cabbage
LIANGYun-Fei
通讯作者:
收稿日期:2017-06-6
接受日期:2017-11-21
网络出版日期:2018-03-12
版权声明:2018作物学报编辑部作物学报编辑部
基金资助:
展开
摘要
关键词:
Abstract
Keywords:
-->0
PDF (3429KB)元数据多维度评价相关文章收藏文章
本文引用格式导出EndNoteRisBibtex收藏本文-->
bHLH (basic helix-loop-helix)转录因子家族是植物中最大的转录因子家族之一, 1989年Ludwig等[1]首次从玉米中分离出bHLH类蛋白质Lc (leaf colour), 证明该基因参与调控花青素合成。Ling等[2]在番茄中鉴定出bHLH类基因FER, 发现该基因调控番茄适应缺铁胁迫。Kiribuchi等[3]从水稻中分离出bHLH基因类RERJ1, 发现该基因通过茉莉酸信号途径响应干旱胁迫。拟南芥基因组中经测序鉴定发现的bHLH转录因子已经超过150个[4,5]。bHLH 结构域约含50~60个氨基酸, 由碱性区域(basic region)和α螺旋1-环-α螺旋-2 (helix-loop-helix)组成, 其碱性区域通常能与基因启动子区域的E-Box和G-Box结合[6,7,8], 一些关键氨基酸位点通常保守, 13E-16R是结合下游基因启动子E-box的2个关键位点[9], Leu23是bHLH功能域形成同源或异源二聚体的关键位点[10]。
植物bHLH转录因子家族具有重要的生物学功能, 参与植物一系列的生命活动, 涉及生长发育[11,12]、代谢调控[13,14]以及对非生物胁迫的抗性等[15]。同样, 具有bHLH结构域的转录因子在叶片发育和形态建成中也有重要调控作用。SPATULA (SPT)是一种bHLH转录因子, 拟南芥中SPT功能缺失的突变体具有较大的子叶, 较长的下胚轴和较大的叶片, 而SPT的过表达则导致较小的子叶和叶片[16]。在拟南芥中利用PAtML1启动子超表达表皮细胞中特异表达的ABS5 (bHLH30), 能使植株形成叶片卷曲的表型[17]。金鱼草中发现一种cin突变体, 能编码具有bHLH结构域的TCP蛋白, cin突变体的叶片边缘区域过度生长, 逐渐使原本平展的叶片变得卷曲[18]。拟南芥中下调表达TCP3、TCP4、TCP10、TCP24四个基因能导致叶片变皱[19]。在拟南芥中增强表达TCP4基因会使植株早熟, 细胞增殖减慢, 叶片变小[20]。在拟南芥中下调表达TCP5、TCP13、TCP17三个基因会造成叶片变大, 邻近的叶片会扩张到叶柄区域[21]。2013年莫晓婷[22]在玉米中克隆到转录因子bHLH-4, 在拟南芥中超表达时植株呈现出矮化, 叶片数量增加, 叶片长宽比变大, 叶片及果荚皱缩。
本课题组前期利用转录组测序技术发掘在甘蓝519莲座期和结球期差异表达的基因, 从中选出在结球期上调表达的基因BoLH27。本试验克隆出BoLH27基因的编码序列, 进行了序列生物信息学分析, 通过农杆菌介导转化法将BoLH27转入甘蓝519, 令其超量表达, 并初步分析转基因植株表型, 以期为进一步探讨BoLH27基因在甘蓝叶片发育及形态建成中的调控功能和作用机制提供依据。
1 材料与方法
1.1 材料与载体
中晚熟结球性好的纯合稳定品种甘蓝519, 由西南大学十字花科研究所提供, 2013年9月将幼苗种于重庆歇马试验基地, 2014年9月将T0代幼苗种植在试验基地, 转基因甘蓝开花后, 单株人工自花授粉留种, 2015年9月种植经PCR鉴定的T1代9个株系, 每个株系30个单株, 2016年9月选取3∶1分离的T2代4个株系, 共种40株幼苗。2014年10月选取10株T0代8片叶的幼苗期叶片用于转基因植株的PCR鉴定, 2016年10月随机取3株T2代8叶片幼苗期的叶片(每株3片)用于转基因植株的荧光定量表达鉴定。克隆载体pEASY-Blunt Simple购于北京全式金公司。根癌农杆菌EHA105菌株、载体pBL525和植物表达载体pCAMBIA1300为本实验室保存。
1.2 总RNA的提取与反转录
用植物总RNA提取试剂盒(天根, 北京)提取甘蓝幼嫩茎尖总RNA, 通过1.0%的琼脂糖凝胶电泳检测RNA的完整性, 之后利用反转录试剂盒(宝生物工程(大连)有限公司)将总RNA反转成cDNA用于基因克隆, 荧光定量取材部位为幼苗期叶片, 方法同上。1.3 基因的克隆及序列的生物信息学分析
利用芸薹属数据库(http://brassicadb.org/brad/ index.php)和甘蓝数据库(http://www.ocri-genomics. org/bolbase/)查找同源序列, 结合前期课题组通过转录组测序获得的包含BoLH27的片段, 对比数据库, 得知转录组获得的片段包含完整的BoLH27, 根据序列的保守性运用Primer premier 6.0软件设计特异性扩增引物, 采用高保真酶PrimeSTAR Max DNA Polymerase (宝生物工程(大连)有限公司)从cDNA中扩增基因, 基因扩增所用引物klBoLH27见表1。PCR程序为98°C预变性1 min; 98°C变性20 s, 63°C退火15 s, 72°C延伸60 s, 35个循环; 72°C延伸10 min。将目的片段与克隆载体pEASY连接(全式金生物技术有限公司, 北京), 转化大肠杆菌DH5α感受态细胞, 挑取阳性单克隆委托成都擎科梓熙生物技术有限公司测序。Table 1
表1
表1试验使用的引物
Table 1Primers used in this study
| 引物名称及序列 Primer name and sequence (5°→3°) | 退火温度 Annealing temperature (°C) |
|---|---|
| klBoLH27S: ATGGAAGACCTCGAAGATGAGTACAAG klBoLH27AS: GGTTTTTGGTACAATGAAACAAACTAGAAG | 63 |
| pcBoLH27S: GGATCCATGGAAGACCTCGAAGATGAGTACAAG pcBoLH27AS: GGATCCGGTTTTTGGTACAATGAAACAAACTAGAAG NOS: CCCGATCTAGTAACATAGATGACAC | 62 |
| jcBoLH27S: GGATCCATGGAAGACCTCGAAGATGAGTACAAG jcBoLH27AS: GGATCCGGTTTTTGGTACAATGAAACAAACTAGAAG | 56.8 |
| qBoLH27S: AGATTAGAAGCAGAGATCCAAGAGC qBoLH27AS: GAAGTATTGTAATCCATCTGCCTGAAC | 58 |
新窗口打开
下画线为酶切位点。Sequences underlined indicate enzyme restriction site.
用EditSeq软件推导基因编码的氨基酸序列, 运用ExPASy (http://expasy.org/tools/)分析氨基酸的基本理化性质, 用在线网站Swiss-model (http://swissmodel.expasy.org/)、SMART (http://smart.embl- heidelberg.de/)、PROSITE (http://www.expasy.org/ prosite)预测蛋白质的二级结构、功能位点和保守结构域。在线预测跨膜结构(http://www.cbs.dtu. dk/services/TMHMM/)和信号肽(http://www.cbs.dtu. dk/services/SignalP/), 用在线网站WOLF PSORT (https://wolfpsort.hgc.jp/)进行亚细胞定位预测。用ClustalX软件进行多序列比对分析, MEGA6.0软件的邻接法构建系统进化树。
1.4 植物表达载体的构建及农杆菌介导的甘蓝遗传转化
将酶切位点BamH I引入引物, 载体构建所用引物pcBoLH27见表1。用带有BamH I酶切位点的引物扩增BoLH27, 采用高保真酶PrimeSTAR Max DNA Polymerase (宝生物工程(大连)有限公司)。PCR程序为98°C预变性1 min; 98°C变性20 s, 62°C退火15 s, 72°C延伸60 s, 35个循环; 72°C延伸10 min。将全长BoLH27用BamH I单酶切, 连接载体pBL525同时用BamH I单酶切, 把BoLH27连接到载体pBL525上, 转化DH5α后保存PCR检测正向插入的菌液, 提取质粒后用Hind III和EcoR I双酶切, 同样用Hind III和EcoR I双酶切植物表达载体pCAMBIA1300, 连接后转化DH5α, 双酶切验证后送公司测序进一步验证, 将构建正确的质粒命名为pC35S-BoLH27。采用农杆菌介导甘蓝的遗传转化方法, 利用根癌农杆菌EHA105菌株侵染甘蓝下胚轴。组培所用培养基参考何绍敏等[23]并做了修改, 甘蓝预培养基含MS+3 mg L-1 6-BA+0.25 mg L-1 NAA+3%蔗糖+0.8%琼脂; 甘蓝筛选培养基含MS+3 mg L-1 6-BA+0.25 mg L-1 NAA+5 mg L-1 PPT+500 mg L-1 Carb+3%蔗糖+0.8%琼脂; 甘蓝生根培养基含MS+0.25 mg L-1 NAA+5 mg L-1 PPT+500 mg L-1 Carb+3%蔗糖+0.8%琼脂。筛选抗性植株在育苗室内培养成活后转入室外培养。1.5 转基因甘蓝的PCR检测及荧光定量PCR检测
采用CTAB法提取转基因甘蓝叶片总DNA。采用Taq Master Mix (南京诺唯赞生物科技有限公司)进行PCR检测, 委托成都擎科梓熙生物技术有限公司对PCR产物测序。取3株T2代8叶片幼苗期的超表达转基因植株叶片(每株3片叶作为生物学重复) 提取RNA并反转录cDNA为模板, 参照SYBR Premix Ex Taq II (宝生物工程(大连)有限公司)试剂盒说明书进行荧光定量PCR, 配制20 μL反应体系, 在荧光定量PCR仪CFX96 (Bio-Rad, 美国)上进行, 反应体系为1.6 μL cDNA模板, 10 μL SYBR Premix, 0.8 μL正向引物, 0.8 μL反向引物(表1中的qBoLH27), 加ddH2O至总体积20 μL。定量PCR条件为95°C预变性30 s; 95°C变性5 s, 58°C退火30 s, 40个循环。以上反应每个样品的技术重复3组。采用非转基因甘蓝519作为参照比对超表达植株的BoLH27基因表达情况。1.6 转基因甘蓝的主茎叶间距的测量
随机取T2代生长健壮的3个株系每株系3株24片叶的莲座期超表达转基因甘蓝, 从根部向上数第16片叶的叶柄处开始计数, 向上连续测量5片叶的叶柄长度, 测量这5片叶在主茎的叶柄着生点的间距, 并以同样物候期的未转化甘蓝519为对照。2 结果与分析
2.1 BoLH27基因的序列分析
以甘蓝结球期茎尖cDNA为模板, PCR扩增出约800 bp条带。经测序分析发现该cDNA序列长度为795 bp, 包含一个完整的编码框, 将其命名为BoLH27。推导的氨基酸序列见图1, 分子量为3.0 kDa, 理论等电点为4.82, 编码264个氨基酸。不稳定系数为57.47, 推测为不稳定蛋白, 亲水性为-0.583, 是亲水性蛋白。其二级结构由27.65%的α-螺旋、12.88%的β-折叠和59.47%的无规则卷曲构成。跨膜结构分析表明BoLH27为非跨膜蛋白, SignalP信号肽预测显示该蛋白不含信号肽。亚细胞定位预测结果显示其定位在细胞核。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1甘蓝BoLH27 cDNA及其推导的氨基酸序列
黑色阴影示bHLH结构域; 实线框示N-糖基化位点; 虚线框示cAMP磷酸位点; 下画线示蛋白激酶C磷酸化位点; 波浪线示酪蛋白II磷酸化位点; 椭圆框示N-豆蔻酰化位点。
-->Fig. 1cDNA sequence of Brassica oleracea L. BoLH27 and its deduced amino acid sequence
The black shadow shows bHLH domain; the full line box shows N-glycosylation site; the dotted line box shows cAMP phosphorylation site; the underline shows cGMP-dependent protein kinase phosphorylation site; the wavy line shows casein kinase II phosphorylation site; the oval box shows N-glycosylation site.
-->
通过结构域和功能位点分析发现, BoLH27在50~99氨基酸处有一个典型bHLH结构域, 多序列比对发现, BoLH27所含的bHLH结构域具有保守的氨基酸位点(图2), 分别是13E-16R和Leu23, 13E-16R是结合下游基因启动子E-box的2个关键位点[9], Leu23是bHLH功能域形成二聚体的关键位点[10]收集其他物种BoLH27的同源序列, 通过ClustalX软件进行多序列比对后, 运用Mega6.0进行系统进化树的构建, 从图3可见BoLH27与白菜、萝卜、遏蓝菜bHLH27聚为一类; 醉蝶花、亚麻荠、白菜bHLH35聚为一类。与甘蓝BoLH27亲缘关系近的白菜、萝卜、遏蓝菜均为十字花科植物, 同科植物蛋白同源性较高, 基因很保守, 其中与白菜bHLH27亲缘关系最近, 推测其蛋白质有相似的功能。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2BoLH27及其同源序列bHLH结构域比对分析
星号表示bHLH结构域保守的氨基酸位点; 三角表示参与二聚体形成的位点。
-->Fig. 2bHLH domain alignment among BoLH27 and other homologous proteins
Stars indicate the conserved amino acids of bHLH domain; triangle indicates amino acid involved in dimer formation.
-->
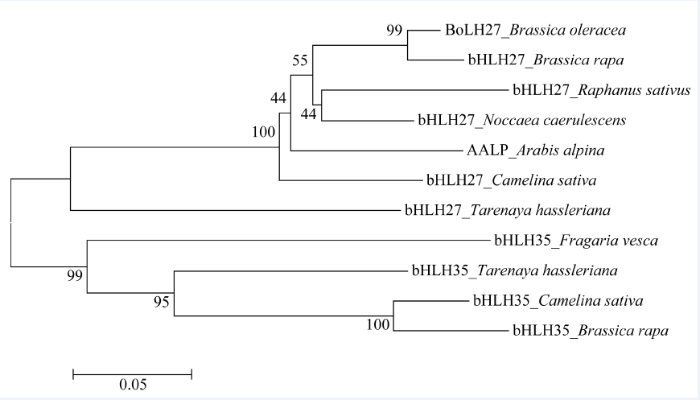 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3BoLH27及其同源氨基酸序列进化分析
-->Fig. 3Phylogenetic relationship of amino acid sequences between Brassica oleracea L. BoLH27 and its homologous proteins
-->
2.2 转基因甘蓝的PCR检测和荧光定量PCR检测
甘蓝下胚轴在筛选培养基上经过3~4周的培养后, 少量获得抗性的下胚轴可以存活, 在切口脱分化形成愈伤组织, 将长出不定芽的材料(图4-A)多次转到新鲜的筛选培养基上继代培养, 直至不定芽长至3 cm时, 切下不定芽转至生根培养基上培养, 4~5周后长出白色的根(图4-B, C)。在育苗室内炼苗4~7 d后转入试验基地隔离网内栽种(图4-D)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4pC35S-BoLH27转基因植株的获得
A: 抗性芽的生长; B、C: 抗性苗生根; D: 抗性植株幼苗。
-->Fig. 4The process of obtaining pC35S-BoLH27 transgenic cabbage plants
A: the growth of resistant bud; B, C: the rooting of resistant seedling; D: the seedling of transgenic cabbage.
-->
通过农杆菌转化法共获得34株BoLH27抗性植株, 在生长到8片叶的幼苗期时随机取10株植株, 以叶片为材料提取基因组DNA, 之后以基因组DNA为模板进行PCR检测, 以构建成功的正义载体作为阳性对照, 非转基因519甘蓝为阴性对照, 野生型中没有下游检测引物的NOS序列, 所以扩增不到产物。图5表明, 10株抗性甘蓝植株中的9株扩增到了预期的约1000 bp的条带, 只有10号和阴性对照没有检测到, 把PCR产物送擎科公司测序, 结果显示扩增序列与Nos和BoLH27基因片段序列完全一致, 说明植物表达载体已成功整合到转基因植株1~9号中。随后我们对目标基因的表达情况进行了荧光定量PCR检测, 从已经鉴定的成功转基因植株的T2代植株中随机选取3株在8片叶的幼苗期叶片进行荧光定量, 从图6看出, 3株超表达植株的BoLH27基因相对表达量均高于野生型, 最高为2.5倍, 平均为2.07倍。
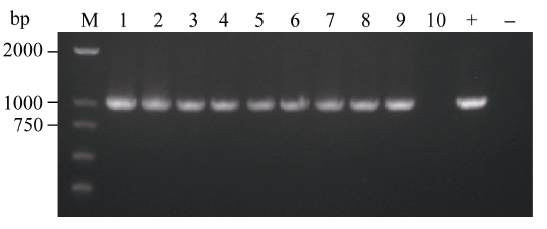 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5转基因植株PCR检测
M: DL2000; 1~10: 转基因甘蓝; +: 阳性对照; -: 非转基因甘蓝。
-->Fig. 5PCR analysis of transgenic plants
M: DL2000; 1-10: transgenic cabbage; +: positive plamid; -: non-transgenic cabbage.
-->
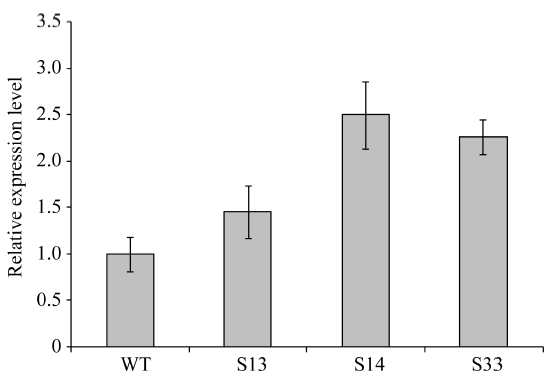 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6BoLH27在野生型和转基因甘蓝中的表达分析
WT: 野生型株系; S13, S14, S33: 超表达株系。
-->Fig. 6Relative expression of BoLH27 in wild-type and transgenic cabbage lines
WT: non-transgenic lines; S13, S14, S33: transgenic lines.
-->
2.3 T2代转基因甘蓝表型分析
在10片叶幼苗期野生型甘蓝519的叶片呈卵圆形, 叶柄较短, 叶柄及叶脉均为白色, 基本没有叶耳(图7-A: WT); BoLH27超表达甘蓝的叶片呈椭圆形, 但具有缺刻, 叶柄明显拉长, 显示轻微的紫色, 叶柄上着生的叶耳明显, 叶耳多数左右对称分布(图7-A: BoLH27)。在24片叶莲座期野生型甘蓝519的叶片呈圆形, 叶片宽大, 叶柄急剧短缩, 几乎无叶柄, 叶脉为白色, 无叶耳(图7-C: WT); 转基因甘蓝的叶片呈椭圆形, 相比野生型更狭长, 叶柄伸长, 叶柄平均长15.5 cm (表2), 叶柄及叶脉明显变紫, 叶柄基部有叶耳及赘生物, 叶片平展(图7-C: BoLH27); 主茎呈紫色, 轮生叶在主茎着生点的间距比野生型明显变大(图7-B: BoLH27), 着生点的间距平均为1.7 cm (表2), 而野生型甘蓝519紧凑, 几乎没有间距(图7-B: WT)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7野生型株系和BoLH27超表达株系表型
A: 10片叶幼苗期; B: 24片叶莲座期侧视图; C: 24片叶莲座期俯视图; WT: 野生型; BoLH27: 超表达株系; partial: 超表达株系局部放大。
-->Fig. 7Phenotypes of non-transgenic lines and BoLH27 overexpressed lines
A: seedling stage with ten leaves; B: side view of rosette stage with twenty-four leaves; C: top view of rosette stage with twenty-four leaves; WT: non-transgenic lines; BoLH27: overexpressed lines; partial: partial enlarged drawing of overexpressed lines.
-->
Table 2
表2
表2超表达株系平均叶柄长度和平均叶间距
Table 2Average petiole length and average leaf spacing in overexpressed lines
| 超表达株系 Overexpressed lines | 平均叶柄长度 Average petiole length (cm) | 平均叶间距 Average leaf spacing (cm) |
|---|---|---|
| 1 | 16.8 | 1.7 |
| 2 | 15.2 | 1.8 |
| 3 | 14.5 | 1.6 |
新窗口打开
3 讨论
截至目前有关bHLH转录因子家族的报道大多集中在拟南芥、玉米、水稻等模式作物上[7,24]。本研究克隆获得了甘蓝BoLH27基因, 其蛋白包含典型的bHLH家族保守序列, 有碱性区域和α螺旋1-环-α螺旋-2, 与前人报道的一致[26,27], 功能域关键氨基酸位点保守, 与前人报道的相同。包括结合下游基因启动子E-box的2个关键位点13E-16R[9], bHLH功能域形成二聚体的关键位点Leu23[10]。在系统进化中, 十字花科植物BoLH27较为保守。研究表明, bHLH类转录因子在叶片发育和形态调控方面具有重要作用。HLH蛋白ILI1和PRE1能与bHLH蛋白IBH1结合, 在水稻中超表达IBH1基因能使叶片竖直生长; 在拟南芥中超表达该基因导致植株矮小[27]。ILI1和PRE1可能通过形成异源二聚体的方式使IBH1转录因子的抑制作用失活, ILI1或者PRE1的超表达能增加细胞的长度和抑制矮小的表型[27]。大豆隐花色素GmCRY2a基因与bHLH类型转录因子GmCIB1在蓝光下发生特异的相互作用, 在大豆中超表达GmCIB1基因使植株叶片早衰, 这种机制是由于GmCIB1能促进衰老相关基因GmWRKY53b的转录[28]。酵母双杂交证实转录因子bHLH048可以与LOB基因启动子区域相互作用[29], LOB蛋白在叶片近-远轴建立中起负调控作用, 超表达LOB基因会使叶形变小, 子叶和叶片向上向内弯曲[30]。TCP蛋白是一种具有bHLH结构域的蛋白, TCP7/23可能通过调控细胞增殖来调控叶片早期的发育, 酵母双杂交证实TCP7和TCP23可以相互作用, 并可强增KNOX1基因的表达, KNOX1基因在植物顶端分生组织的维持上有重要作用[31]。TCP1在拟南芥的超表达造成了叶柄和丛生叶的伸长, TCP1能和油菜素内酯合成的关键酶DWF4基因的启动子相互作用, 此外TCP1能正向调控DWF4的转录丰度[32]。在本研究中, 超表达BoLH27的甘蓝植株在幼苗期和莲座期均观察到了明显的叶柄伸长, 这与在拟南芥中超表达TCP1基因造成叶柄伸长的表型极为类似。在拟南芥中超表达miRJAW会降低TCP2/3/4/ 10/24五个TCP基因的表达, 进而使植株形成卷缩叶[33], 与之相似的是本研究获得的BoLH27基因超表达的甘蓝植株, 在莲座期后期其本应向上向内卷曲的叶片继续平展生长, 由此表明, 在甘蓝中BoLH27可能起到了类似与拟南芥中同为bHLH转录因子TCP2/3/4/10/24的功能, 在叶片卷曲过程中起负调控作用。
bHLH转录因子还可以调节类黄酮生物合成, 而花青素是类黄酮中的一大类。玉米中的Lc同源基因ZmR和ZmB参与紫色花青素合成的调节[34]。矮牵牛花中bHLH基因phan1和phan2能促进花青素合成基因的转录从而调控花的着色[35]。AtTT8是拟南芥中发现的调控类黄酮合成的bHLH转录因子, AtTT8的转录丰度受PAP1蛋白的负调控[36]。拟南芥中bHLH成员AtGL3和AtEGL3相继被发现, 在其双突变体中花青素的合成受到抑制[37]。在杨梅中发现了转录因子MrbHLH1, 通过烟草叶片的异源瞬时表达发现MrMYB1能与MrbHLH1结合从而引起花青素合成的显著增加, 用双荧光素酶报告基因检测的方法揭示了MrMYB1和MrbHLH1能够选择性地激活五种特异的启动子(MrCHI、MrF3’H、MrDFR1、MrANS、MrUFGT)[38]。在十字花科植物花椰菜中发现一种Pr (Purple)突变体, Pr编码一种R2R3-MYB转录因子, 上调表达的Pr能特异地激活bHLH转录因子BobHLH1和几个花青素结构基因, 能在凝乳组织和其他组织中合成大量的青花素, 使突变体呈现显著的紫色表型[39]。与上述报道的情况类似, 本研究中通过在甘蓝519材料中超表达bHLH转录因子BoLH27基因, 使转基因植株的茎和叶脉呈现紫色(图7-B: partial; 图7-C: partial), 表明在甘蓝中BoLH27可能正向调控花青素的积累, 并在多序列比对中BoLH27和BobHLH1两者均具有高度保守的bHLH结构域(图2), 然而是该蛋白直接调控花青素积累相关的结构基因的表达, 还是与其他转录因子一起共同参与调控等问题还有待进一步研究。
4 结论
从甘蓝519材料中克隆了一个bHLH转录因子BoLH27的编码序列, 该蛋白具有典型的bHLH结构域和完全保守的关键位点13E-16R和Leu23。获得了BoLH27超表达转基因植株, 转基因植物茎叶间距变大、叶柄伸长、叶耳明显、叶片平展生长, 且植株茎和叶脉呈现紫色, 推测BoLH27可能在甘蓝形态建成和花青素积累过程中有调控作用, 该研究对于进一步研究植物bHLH转录因子的功能具有一定的科学意义。The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | . |
| [2] | . |
| [3] | . |
| [4] | . |
| [5] | . |
| [6] | . |
| [7] | . |
| [8] | . |
| [9] | . |
| [10] | . |
| [11] | . |
| [12] | . |
| [13] | . |
| [14] | . |
| [15] | |
| [16] | . |
| [17] | . |
| [18] | . |
| [19] | . |
| [20] | . |
| [21] | . |
| [22] | . . |
| [23] | . . |
| [24] | . |
| [25] | . |
| [26] | . |
| [27] | . |
| [28] | . |
| [29] | . |
| [30] | . |
| [31] | . |
| [32] | . |
| [33] | . |
| [34] | . |
| [35] | . |
| [36] | . |
| [37] | . |
| [38] | . |
| [39] | . |
