
Cloning and Expression Analysis of BoSPI Induced by Self-pollination in Brassica oleracea L. var. capitata
PUMin
通讯作者:
收稿日期:2017-05-4
接受日期:2017-09-10
网络出版日期:2018-02-12
版权声明:2018作物学报编辑部作物学报编辑部
基金资助:
作者简介:
-->
展开
摘要
关键词:
Abstract
Keywords:
-->0
PDF (3575KB)元数据多维度评价相关文章收藏文章
本文引用格式导出EndNoteRisBibtex收藏本文-->
自交不亲和反应(self-incompatibility, SI)是植物在长期的进化过程中形成的防止自交衰败、促进杂交优势的一种复杂而完善的遗传机制。甘蓝的自交不亲和性主要是由于柱头识别自花花粉后经复杂的信号传导过程最终阻止花粉萌发及花粉管伸长, 有多种细胞间的信号系统参与[1,2]。目前研究最多的是由SRK-ARC1-Exo70A1等介导的蛋白质泛素化降解途径, 即自花授粉后, 花粉中S-位点半胱氨酸富集蛋白(SCR)与柱头上S-位点受体激酶(SRK)的胞外域结合, 使其释放原本结合在SRK激酶域的类硫氧还蛋白(THL1/THL2), 激活SRK, 活化的SRK磷酸化ARC1, 后者介导并通过泛素化过程降解Exo70A1, 直接或间接导致水孔蛋白(MOD)关闭, 柱头细胞表面缺水,花粉因缺少水分等物质而不能正常萌发, 从而实现SI反应[3,4,5,6]。但是, 深入研究表明, 通过反义抑制琴叶拟南芥(Arabidopsis lyrata)柱头中的ARC1的表达只能部分打破自交不亲和性, 而仅仅在拟南芥中转入SRK和SCR基因后, 也能表现出自交不亲和性, 这表明除ARC1外, 可能还存在其他的元件参与调控甘蓝的自交不亲和反应[7,8]。因此, 发现新的响应该过程的基因对研究甘蓝的自交不亲和性有重要意义。
本研究通过转录组测序分析甘蓝自花和异花授粉后基因的表达情况, 筛选到一个受自花授粉强烈诱导表达的基因, 经生物信息学、组织表达特异性、授粉诱导表达模式等分析, 以期为进一步研究该基因在响应甘蓝自花授粉过程中的作用奠定基础。
1 材料与方法
1.1 材料及取样
以西南大学十字花科蔬菜研究所选育的自交不亲和甘蓝高代自交系A4和F1植株为材料, 于2016年4月在开花前1~2 d将长势相同的A4花蕾人工去雄, 用新鲜F1花粉同时给去雄的A4柱头分别异花授粉0、15、30和60 min精细处理, 简称杂交(CP)组; 用新鲜A4花粉给去雄的A4柱头同时分别自花授粉0、15、30和60 min精细处理, 简称自交(SI)组。到达处理时间后, 快速扫去柱头上的花粉, 取下整个饱和授粉的花柱。选取长势较好的甘蓝植株, 自花授粉30 min后在同一时间段分别取下花瓣、萼片、柱头、叶片、雄蕊, 立即放入液氮中, 于-80ºC保存备用。1.2 转录组测序及自花授粉特异序列的筛选
将自花授粉0、15、30和60 min和异花授粉0、15、30和60 min的甘蓝柱头送北京百迈克生物科技有限公司基于Illumina HiSeq测序技术平台, 测序类型PE150, 构建转录组文库进行建库测序, 获得转录组数据。采用FPKM (Fragments Per Kilobase of transcript per Million fragments mapped)来量化基因的表达水平[9,10], 计算得到的基因表达量可直接用于比较不同样品间的基因差异表达。使用EBSeq进行差异表达分析, 以差异倍数Fold Change≥2或≤0.5及错误发现率(False Discovery Rate) FDR<0.01为筛选标准。根据基因在不同授粉处理后的相对表达量, 筛选在自花授粉后表达差异明显、异花授粉后变化趋势不大的基因。1.3 特异序列基因的克隆
根据目的基因编码区序列和ClonExpress (Vazyme)快速克隆技术原理以及原核表达载体pGEX-4T-1序列设计引物GST-F/GST-R (表1), 以甘蓝A4柱头cDNA和gDNA为模板扩增序列, 在25 μL PCR体系中依次加入7.5 μL ddH2O, 12.5 μL 2× Phanta Max缓冲液, 上、下游引物各1 μL和模板cDNA 2 μL, Phanta Max Super-Fidelity DNA聚合酶0.5 μL; 反应程序为95ºC 3 min; 95ºC 15 s, 58ºC 15 s, 72ºC 40 s, 共35个循环; 72ºC延伸5 min, 回收目的片段, 运用快速克隆技术将目的片段连接到pGEX-4T-1载体上后转化大肠杆菌感受态细胞DH5α, 经菌液PCR筛选阳性克隆后送测序。Table 1
表1
表1基因克隆及定量PCR中的引物
Table 1Primers used in gene cloning and RT-PCR
| 引物 Primer | 引物序列 Primer sequence (5′-3′) | 退火温度 Tm (ºC) | 引物用途 Primer description. |
|---|---|---|---|
| GST | F: GATCTGGTTCCGCGTGGATCCATGGCAAGTGGTAACCCTGTAAC | 60 | 基因的原核表达 Prokaryotic expression |
| R: GATGCGGCCGCTCGAGTCGACCTAGGCCGTCGAACCACCG | |||
| qRP | F: GATCAGGACAAGAACGGGCTC | 60 | qRT-PCR |
| R: GTTGTTGCTGTTAGCGAGGGAG | |||
| Actin3 | F: GGCTGATGGTGAAGATATTCA | 58 | 内参引物 Internal reference |
| R: CAAGCACAATACCAGTAGTAC | |||
| GFP | F: AAGTCCGGAGCTAGCTCTAGAATGGCAAGTGGTAACCCTGTAACC | 63 | 基因亚细胞定位 Subcellular localization of gene |
| R: GCCCTTGCTCACCATGGATCCGGCCGTCGAACCACCGTTC |
新窗口打开
1.4 生物信息学分析
利用Bio-soft (http://www.bio-soft.net/sms/index. html)和DNAMAN8.0软件推导基因编码的氨基酸序列; 利用ExPASy-ProtParam在线工具(https://www. expasy.org/)分析蛋白的理化性质; 在NCBI数据库中通过BlastN比对, 检索BoSPI同源序列, 利用DNAMAN8.0进行多序列比对; 利用SignalP3.0 (http://www.cbs.dtu.dk/services/SignalP-3.0/)进行信号肽分析; 利用TMHMM v2.0在线软件(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析蛋白跨膜域。用Smart (http://smart.embl-heidelberg. de/)、Swiss-model (https://swissmodel.expasy.org/)和InterProScan (http://www.ebi.ac.uk/interpro/)等在线软件共同分析预测蛋白质的功能位点和高级结构域, 用WOLF PSORT (http://www.genscript.com/wolf- psort.html)预测蛋白的亚细胞定位。通过PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子的顺式作用元件。1.5 原核表达
将测序正确的原核表达菌株扩大培养后抽提重组质粒转化表达菌株E. coli BL21(DE3), 用引物GST-F/GST-R进行PCR检测, 将阳性转化子单克隆按1∶100扩大培养, 振荡培养至OD600达到0.6~ 0.8, 加入IPTG至终浓度为0.6 mmol L-1, 28ºC诱导4 h后, 收集诱导的菌体, 超声破碎后离心收集上清液, 经海狸GST融合蛋白纯化磁珠纯化目的蛋白, 用SDS-PAGE 电泳检测, 然后用GST双抗体进行Western-blot定性检测目的蛋白的表达。同时在试验中设置以pGEX-4T-1空载为对照。1.6 亚细胞定位表达分析
根据ClonExpress (Vazyme)快速克隆技术原理以及GFP融合表达载体pCAMBIA1300-GFP序列设计引物GFP-F和GFP-R (表1), 利用PCR技术扩增得到目的基因的片段。将扩增产物与pCAMBIA1300载体连接, 构建GFP融合蛋白的瞬时表达载体后转化大肠杆菌感受态细胞DH5α, 筛选阳性克隆后送测序, 抽提重组质粒后转化农杆菌GV3101, 同时作为空白对照, 注射烟草叶片经24 h暗培养后取侵染部位在激光共聚焦显微镜下观察GFP绿色荧光以研究目的基因的亚细胞定位情况。1.7 组织特异性表达分析
参照RNA提取试剂盒RNAprep Pure Plant Kit说明书提取甘蓝柱头、叶片、雄蕊等组织的RNA, 参照TransScript First-Strand cDNA Synthesis SuperMix说明书反转录合成cDNA, 于-20ºC保存备用。利用半定量PCR技术检测目的基因的组织表达模式, 分别以甘蓝叶片、柱头、萼片、雄蕊和花瓣的cDNA为模板, 以RT-F/RT-R (表1)为引物, 用Phanta Max Super-Fidelity DNA聚合酶25 μL反应体系检测目的基因在上述组织中的表达情况。反应程序为95ºC 3 min; 95ºC 15 s, 60ºC 15 s, 72ºC 30 s, 共30个循环; 72ºC延伸5 min。同时以Actin3为内参基因(表1)。PCR产物经1%琼脂糖电泳检测。1.8 授粉诱导表达分析
以经不同授粉处理的柱头cDNA为模板, 参照SYBR Premix Ex Taq说明书, 以Actin3为内参, RT-F/RT-R (表1)为引物, 用7500型实时荧光定量PCR仪扩增。反应体系为20 μL, 含2×SYBR Premix Ex Taq 10 μL, 引物各1 μL, cDNA模板1 μL, 加超纯水至20 μL。扩增程序为95ºC预变性1 min; 95ºC 15 s, 60ºC 15 s, 72ºC 30 s, 共40个循环。设置每个试验3次重复, 采用2-ΔΔCT法计算目的基因的相对表达水平。2 结果与分析
2.1 转录组数据分析及BoSPI基因的确定
共获得60.25 Gb Clean Data, 各样品的Clean Data均达到7.31 Gb, Q30碱基百分比在93.06%及以上, 可认为测序质量可靠。筛选到一个受自花授粉诱导大量上调表达的基因序列, 其表达量在0 min约为46.5, 在自花授粉30 min后达到544.8, 相差11.7倍多, 而异花授粉后变化不大(图1), 表明该基因的表达可能受自花授粉诱导, 命名为BoSPI。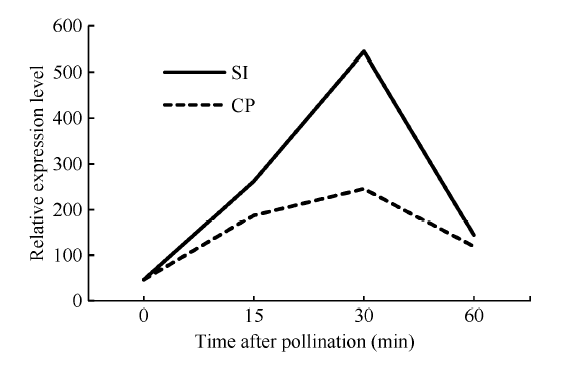 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1经转录组测序分析甘蓝柱头内BoSPI响应自花和异花授粉后的表达情况
SI: 自交组; CP: 杂交组。SI: self-pollination; CP: cross-pollination.
-->Fig. 1Expression pattern of BoSPI in stigma of cabbage in response to self and cross pollination by transcriptome technology
-->
2.2 甘蓝BoSPI基因的克隆与生物信息学分析
以A4柱头cDNA和gDNA为模板, PCR扩增均得到约550 bp的产物(图2), 表明该基因不含内含子。经测序分析得到长度为534 bp的编码阅读框, 与文库所得序列一致, 编码含177个氨基酸残基的蛋白质(图3), 该蛋白质相对分子质量约为17 kD, 理论pI为4.21。带负电荷的氨基酸残基(Asp+Glu)总数为29, 带正电荷的氨基酸残基(Arg+Lys)总数为13; 不稳定系数为39.79, 小于40, 因此为稳定蛋白。平均亲水性系数为-0.37, 推测为亲水性蛋白, BoSPI蛋白可能定位于胞质。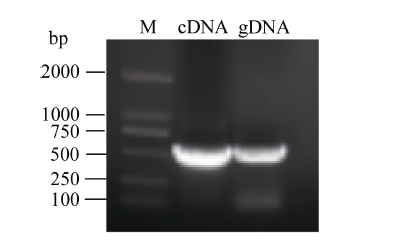 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2甘蓝BoSPI基因cDNA和gDNA序列扩增
-->Fig. 2Amplification of BoSPI gene from cDNA and gDNA of the stigma of cabbage
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3BoSPI基因序列及其推导的氨基酸序列(A)、Ca2+结合核心结构分析(B)和BoSPI蛋白三维结构预测(C)
A图中下画线指示4个EF-hand结构域, 红色字体表示12个氨基酸组成的Ca2+结合的核心区域; B图中下排数字表示对这12个氨基酸残基的编号, 数字0表示该核心区域上游第一个氨基酸残基。
-->Fig. 3BoSPI cDNA sequence and deduced amino acid sequence (A), analysis of the core area of calcium ion binding (B) and predicted three-dimensional structure (C) for BoSPI protein
The underlined sequence means four EF-hand domains and the read marker means the core area of calcium ion binding in Fig. A; the numbers indicate the numbers of the 12 amino acid residues of the core area of calcium ion binding and the digital 0 represents the first amino acid residue upstream of the core region in Fig. B.
-->
BoSPI蛋白含有4个保守的EF-hand结构域, 分别位于第23~51、第59~87、第92~120、第128~156位氨基酸残基位置处(图3); Ca2+结合的核心区域分别位于第32~44、第68~80、第101~113、第137~149位氨基酸残基, 其特点是由12个氨基酸残基组成的α-螺旋环结构, 其中的第1、第3、第6和第12位氨基酸残基较为保守, 且第6位多为Gly, 在这12个残基的前一位氨基酸(第0位氨基酸)为疏水性氨基酸残基, 由第1、第3、第5、第7、第9和第12位氨基酸残基分别按照X、Y、Z、-Y、-X和-Z空间排列形成五边形双锥结构, 第12位保守的Glu或Asp 的2个氧原子与Ca2+以双齿配体的方式结合, 使EF-hand结构域的构象改变, 最终导致靶蛋白的激活或者失活[11,12,13], 说明该基因可能参与Ca2+信号调控。
在NCBI数据库中通过BlastN比对, 发现BoSPI与甘蓝CML27和甘蓝CML26序列同源性分别为96%和72%, BoSPI与CML27共有7个核苷酸位点不同, 其中5个位点又与CML26相同(图4), 最终导致6个氨基酸发生变化, 其中有4个氨基酸残基位于钙离子结合的核心区域。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4BoSPI及其同源序列关系分析
红框表示与CML27不同但与CML26相同的核苷酸位点。
-->Fig. 4Phylogenetic relationship of nucleotide sequence between BoSPI and its homologous genes
The red boxs indicate the nucleotide site that is different from CML27 but identical with CML26.
-->
利用甘蓝基因组(http://brassicadb.org/brad/index. php)及PlantCARE启动子分析软件在位于BoSPI基因起始密码子上游2000 bp的核苷酸序列中预测到真菌诱导响应、代谢调节以及器官形成等多种顺式作用元件(表3), 表明该基因除了能响应授粉刺激, 还可能响应其他多种信号。
Table 3
表3
表3BoSPI基因上游调控区顺式作用元件
Table 3cis-elements in the upstream regulation region of BoSPI gene
| 相关功能预测 Associated putative function | 启动子顺式作用原件 cis-elements in the promoter region |
|---|---|
| Light response | ACE, ATCT-motif, Box 4, Box I, G-Box, GAG-motif, MRE |
| Salicylic acid response | TCA-element |
| MeJA response | CGTCA-motif, GARE-motif |
| Endosperm expression | Skn-1_motif |
| Fungal elicitor response | Box-W1 |
| Gibberellin response | GARE-motif |
| DNA binding protein (ATBP-1) | AT-rich element |
| Anaerobic induction | ARE |
| Abscisic acid response | ABRE |
| Stress responsiveness | HSE, LTR, MBS, TC-rich repeats |
新窗口打开
2.3 甘蓝BoSPI基因的原核表达和原位表达
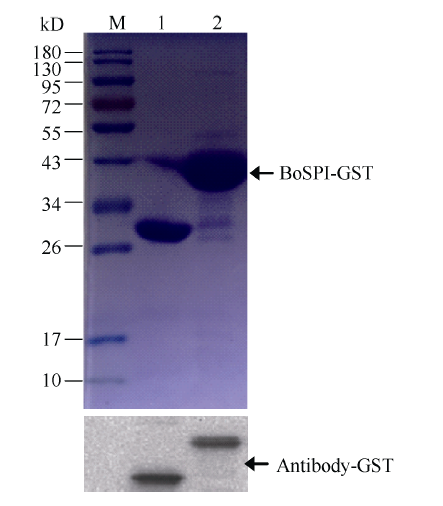
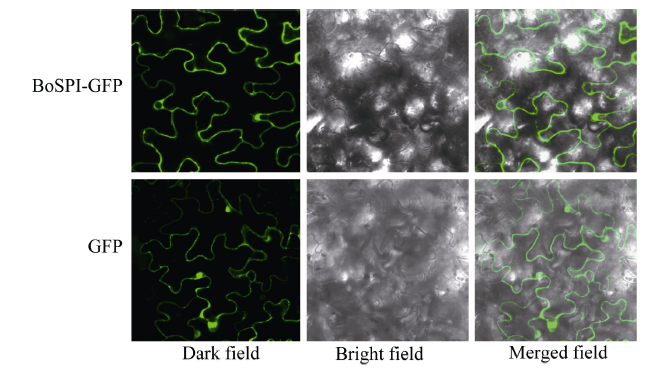
构重组质粒转化大肠杆菌表达菌株E. coli BL21 (DE3), 提取总蛋白后经过海狸GST融合蛋白纯化磁珠纯化, 后经SDS-PAGE电泳和Western-blot GST双抗孵育后显色验证, 得到GST-BoSPI的单一条带, BoSPI原核表达的GST融合蛋白大小约为43 kD, 与BoSPI编码蛋白质的相对分子质量大小一致(图5)。其中pGEX-4T-1空载体表达约26 kD的蛋白, BoSPI预测分子大小约为17 kD, 二者融合约为43 kD的蛋白。将重组质粒BoSPI-GFP转化农杆菌GV3101, 注射烟草后在激光共聚焦显微镜下观察GFP绿色荧光。对照为无定位功能的GFP蛋白, BoSPI-GFP融合蛋白绿色荧光主要出现在细胞膜和细胞质区域(图6)。上述证据表明, BoSPI是一种天然蛋白, 位于细胞膜和细胞质区域。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5BoSPI蛋白的原核表达
M: 蛋白分子量标准; 1: GST蛋白; 2: BoSPI-GST融合蛋白。
-->Fig. 5Prokaryotic expression protein analysis of BoSPI protein
M: marker; 1: GST protein; 2: BoSPI-GST fusion protein.
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6BoSPI-GFP融合蛋白的亚细胞定位
绿色表示GFP蛋白在激光共聚焦显微镜下所发的绿色荧光。
-->Fig. 6Subcellular localization of BoSPI-GFP protein in tobacco cell
Green indicates the green fluorescence of GFP protein under confocal laser scanning microscope.
-->
2.4 甘蓝BoSPI基因的表达分析
甘蓝A4自花30 min授粉后, 叶片、柱头、萼片、雄蕊和花瓣中BoSPI基因均有转录, 其cDNA带谱显示柱头中表达量最高(图7)。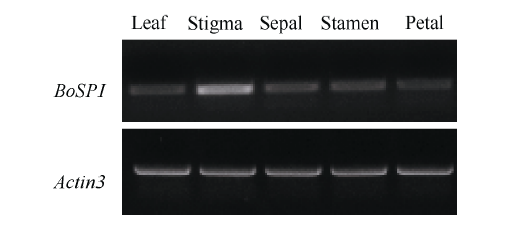 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7 BoSPI基因在甘蓝不同组织中的表达分析
-->Fig. 7Expression analysis of BoSPI in different organs of Brassica oleracea L. var. capitata
-->
利用荧光定量PCR分析了BoSPI基因在不同授粉处理后的柱头中的表达情况, 结果表明, BoSPI基因在经自花和异花授粉后表达趋势均先上调后下调, 在自花授粉后变化更明显, 自花授粉30 min后的相对表达量约为20.07, 异花授粉30 min后的相对表达量约为8.02, 前者明显高于后者而且相差2.5倍(图8), 自花授粉30 min后正是SI反应的关键时期, BoSPI基因在该时间点上对自花授粉发生反应, 且相差2倍以上, 这进一步验证自花授粉能强烈诱导该基因在甘蓝柱头中的表达, 表明BoSPI基因响应甘蓝自花授粉后的反应。
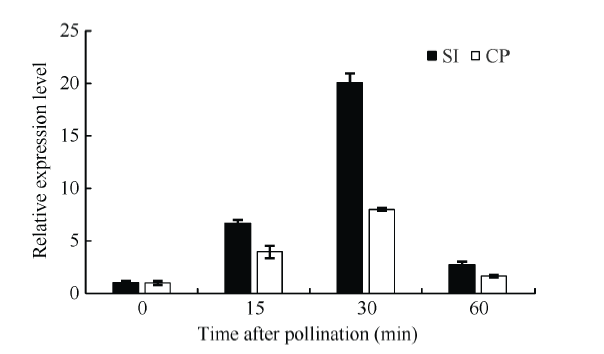 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8BoSPI基因在不同授粉处理中的表达。
SI: 自交组; CP: 杂交组。
-->Fig. 8Expression level of BoSPI in response to self and cross pollination
SI: self-pollination; CP: cross-pollination.
-->
3 讨论
本研究基于以自交不亲和甘蓝经不同授粉处理后的转录组文库, 筛选出一个受自花授粉诱导显著上调表达的基因(BoSPI), 授粉诱导表达分析表明自花授粉30 min后的相对表达量约为20.07, 约为授粉0 min的19倍; 而异花授粉30 min后的相对表达量约为8.02, 前者明显高于后者且相差2.5倍, 说明自花授粉能显著诱导该基因的表达。BoSPI基因在柱头中的表达量明显高于其他部位, 甘蓝自交不亲和反应主要在自花授粉后的柱头中发生, 进一步表明该基因可能参与自花授粉后柱头中的复杂反应过程。BoSPI-GFP融合蛋白绿色荧光主要出现在细胞膜和细胞质区域, 与相关基因的研究结果一致[14,15]。BoSPI基因的启动子区域含有真菌诱导响应、代谢调节以及器官形成等多种顺式作用元件, 表明BoSPI基因可能参与调控复杂的生物反应过程, 特别值得关注的是, 如果真菌诱导响应的最终结果是抑制真菌, 那么SI最终导致自花被抑制的现象就同真菌被抑制存在某种联系。BoSPI蛋白质含有4个保守的EF-hand结构域, 表明该基因可能参与Ca2+信号调控。在植物中, Ca2+信号广泛参与调控花粉管及花的发育、植物应激和肌动蛋白丝的运动等, 这些都可能与植物的自交不亲和反应过程相关[16,17,18,19,20,21]。Dearnaley等[22]发现亲和授粉与不亲和授粉后在柱头乳突细胞的细胞质和细胞壁中的钙离子流与乳突细胞接触花粉粒细胞区域有关。在油菜中发现胞质内的钙峰与后续花粉粒的水合相对应[23,24]。在罂粟的自交不亲和现象中, 花粉与柱头特异性识别后, 大量外源Ca2+流入自交不亲和性花粉管, 扰乱花粉管内Ca2+浓度梯度, 进而抑制花粉管的正常生长, 同时紊乱的Ca2+浓度梯度诱导微丝骨架解聚, 最终导致花粉管的程序性死亡[25,26]。Iwano等[27]观察自交不亲和拟南芥柱头乳突细胞的钙离子浓度发现, 与亲和授粉相比, 在自花授粉后柱头内Ca2+浓度显著上升使花粉管不能正常伸长最终打破自交不亲和性, 这种Ca2+浓度的显著上升与相同单倍型的SRK与SCR/SP11特异识别相关联, 表明Ca2+信号也参与调控甘蓝的自交不亲和性。
BoSPI基因自花授粉后显著的上调表达, 在30 min后达到最高, 而异花授粉变化不大, 且自花、异花倍数相差2倍以上, 自花授粉30 min后正是SI反应的关键时期, BoSPI基因在该时间点上对自花授粉发生反应, 可能跟自花授粉后相同单倍型的SRK与SCR/SP11特异识别后的Ca2+浓度的显著上升有关,推测该基因可能作为Ca2+信号元件参与甘蓝自花授粉后的反应过程。在今后的研究中, 我们将利用超表达和基因沉默等技术进一步验证该基因的功能及其作用机制。
4 结论
从甘蓝转录组文库筛选并克隆一个受自花授粉诱导上调表达的基因BoSPI, 该基因的开放阅读框为534 bp, 编码177个氨基酸, 含有4个保守的EF-hand结构域, 其编码蛋白大小为17 kD。BoSPI蛋白分布于细胞膜和细胞质。BoSPI基因主要在柱头表达, 在花瓣、萼片、叶片和雄蕊中亦有表达。甘蓝自花授粉30 min后, BoSPI基因水平显著上调。初步推断BoSPI参与了柱头响应自花花粉刺激的分子过程, 可能是实现甘蓝自交不亲和性相关的某种新功能基因。The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | . |
| [2] | . |
| [3] | . |
| [4] | . |
| [5] | . |
| [6] | . . |
| [7] | . |
| [8] | . |
| [9] | . . |
| [10] | . |
| [11] | . |
| [12] | . |
| [13] | . |
| [14] | . |
| [15] | . . |
| [16] | . |
| [17] | . |
| [18] | . |
| [19] | . |
| [20] | . |
| [21] | . |
| [22] | . |
| [23] | . |
| [24] | . |
| [25] | . |
| [26] | . |
| [27] | . |
