 , 张秀艳
, 张秀艳 , 陈阳松
, 陈阳松
Genetic Analysis and Molecular Characterization of a New Allelic Mutant of Vp15 Gene in Maize
WANGRui , ZHANGXiu-Yan
, ZHANGXiu-Yan , CHENYang-Song
, CHENYang-Song
通讯作者:
收稿日期:2017-08-7
接受日期:2017-11-21
网络出版日期:2018-03-12
版权声明:2018作物学报编辑部作物学报编辑部
基金资助:
作者简介:
-->
展开
摘要
关键词:
Abstract
Keywords:
-->0
PDF (1593KB)元数据多维度评价相关文章收藏文章
本文引用格式导出EndNoteRisBibtex收藏本文-->
作物种子穗发芽是指在收获前籽粒在母体植株果穗上发芽的现象, 也称为胚萌。穗发芽严重影响小麦、水稻等作物的产量、品质和种子质量, 给作物生产带来严重的经济损失, 因而穗发芽现象一直备受国内外一些植物育种家和生理学家关注。20世纪50年代国际上就已经开始研究穗发芽问题, 培育和筛选抗、耐穗发芽种质资源, 发掘抗穗发芽的重要基因或QTL [1,2,3], 并采取各种措施解决生产上的穗发芽问题。
在玉米中, 主要通过穗发芽突变体(viviparous)较深入研究穗发芽相关基因。从目前已报道的玉米穗发芽基因功能来看, 玉米穗发芽突变体主要通过阻断ABA的生物合成或降低对ABA的感应度而使籽粒在母体果穗上提前萌发[4,5], 大致可将这些突变体分为两大类。第一类是ABA缺陷型, 即ABA合成受阻。这类突变体中目前研究比较清楚的有vp2、vp5、vp7、vp8、vp9、vp10、vp12、vp14、vp15、w2、y9等[6,7,8,9,10,11,12,13], 它们不能正常合成ABA, 导致玉米籽粒中ABA含量较低, 不能抑制种子萌发, 从而表现穗发芽。例如, 玉米vp5和vp7突变体通过阻断类胡萝卜素生物合成途径酶的合成进而影响ABA的合成[6,7]; vp12突变体抑制萜类物质生物合成途径中酶的合成, 从而影响ABA的合成[10]; vp14突变体中ABA生物合成途径的第一个关键步骤被阻断, 即环氧类胡萝卜素裂解为黄质醛的过程被阻断, 导致ABA生物合成受阻[9]; vp10突变体中钼辅因子合成受阻, 使得ABA醛无法氧化成ABA[9]。第二类是ABA钝感型。这类突变体目前研究较清楚的有vp1、vp6等[14], 此类突变体不影响ABA的生物合成或ABA的新陈代谢, 只是改变对ABA的响应, 因此, 具有穗发芽特性但不影响胚乳发育及幼苗颜色, 且外源ABA不能抑制种子萌发。例如, 玉米vp1突变体内源ABA含量并不低, 只是对外源ABA敏感性降低, 进而无法将ABA信号向下游传递[15]。
vp15是玉米穗发芽突变体, 不能正常编码植物钼喋呤(MPT)合酶小亚基, 此酶调控钼辅因子(MoCo)生物合成[16,17,18,19], 而MoCo是参与ABA前体——类胡萝卜素裂解为ABA过程中的酶所必需的辅因子[12]。MoCo广泛存在于原核生物和真核生物中, 而且也是多种酶的辅因子[20]。在植物中, 至少以下4类酶需要钼辅因子才能维持活性, 即乙醛氧化酶、黄嘌呤脱氢酶、硝酸还原酶和亚硫酸氧化酶[20], 突变体vp15就是缺少依赖钼辅因子的乙醛氧化酶、黄嘌呤脱氢酶和亚硫酸氧化酶, 导致不能正常合成ABA, 使籽粒在母体上提前萌发[12]。因此, vp15突变体是研究MPT合成酶小亚基功能的重要材料。
本研究对实验室新发现的一个玉米穗发芽突变体vp-like4进行了遗传分析和基因定位, 最终发现vp-like4是一个新的Vp15基因等位突变体。该研究为进一步深入解析玉米穗发芽的分子机制和基因功能提供了丰富的实验材料。
1 材料与方法
1.1 实验材料
玉米穗发芽突变体(viviparous) vp-like4在授粉后30 d左右, 便可在果穗上观察到明显的穗发芽表型。基因定位群体为vp-like4杂合体与自交系Mo17杂交并自交获得的F2群体。2个vp15基因突变体505G (vp15-DR1126)、505I (vp15-umu1)订购自Maize Genetics Cooperation Stock Center (玉米遗传学合作库存中心, https://maizecoop.cropsci.uiuc.edu/request)。1.2 突变体的表型鉴定和遗传分析
由于穗发芽的籽粒在果穗收获时, 萌发的胚芽已干枯致死, 因此随机选取穗发芽果穗上的正常籽粒种植, 自交后鉴定有穗发芽分离的果穗, 然后再取正常籽粒种植, 以此连续多代自交观察该突变体表型。对于突变体表型的遗传分析, 就在每一世代自交授粉后30 d左右, 剥开苞叶检查穗发芽情况, 选取穗发芽果穗, 脱粒统计正常籽粒与穗发芽籽粒的分离比。1.3 目的基因的初定位
采用BSR-Seq方法[21]对目的基因进行初定位。随机选取有穗发芽表型分离的F2 果穗, 各取40粒正常籽粒和穗发芽籽粒, 分别剥去种皮, 混池为2份实验样品, 液氮研磨, 利用植物总RNA提取试剂盒(北京天根生化科技有限公司, Cat# DP432)提取籽粒总RNA, 在北京贝瑞和康生物技术有限公司利用HiSeq2000仪器完成转录组测序。参考BSR-Seq方法分析流程[21], 对2个样本的测序结果进行分析, 提取2个样本间大量的分子标记, 计算等位基因在2个混合池的分布比例, 分析后得出vp-like4基因的初定位区间。1.4 定位区间基因检索及等位测验
根据vp-like4基因的初定位区间, 在MaizeGDB数据库网站上(http://www.maizegdb.org/)检索区间内的基因注释信息, 发现已经报道的玉米穗发芽Vp15基因位于该区间内[12]。为检测vp-like4和vp15是否等位, 分别从vp-like4、vp15-umu1、vp15-DR1126的杂合体后代中随机挑选正常籽粒种植, 种植vp-like4 3行, vp15-umu1和 vp15-DR1126各2行, 每行25株。开花授粉时, 任选vp-like4中一行进行单株自交, 同时收集这一行单株的花粉进行混粉, 分别授粉杂交vp15-umu1和 vp15-DR1126的其中一行每一个单株。同理, vp15-umu1和 vp15-DR1126的另外一行每个单株自交, 同时分别收集各行的花粉, 混粉分别杂交vp-like4的另外2行每个单株。授粉后30 d, 剥开苞叶, 检查是否有穗发芽的果穗。
1.5 基因组DNA提取、PCR扩增和序列分析
授粉后30 d左右, 分别取突变体vp-like4、vp15-umu1、vp15-DR1126正常籽粒和穗发芽籽粒, 用CTAB法提取玉米基因组DNA[22]。根据Vp15基因组序列, 利用Primer3软件(http://primer3.ut.ee/)在线设计7对引物(VP15-G-F1/R1~VP15-G-F7/R7) (表1), 扩增产物覆盖Vp15基因组序列。以3个突变体(vp-like4、vp15-umu1、vp15-DR1126)基因组DNA为模板, 分别扩增Vp15基因片段, 将PCR产物送北京擎科新业生物技术有限公司测序。使用DNAMAN软件比对分析测序结果, 确定基因突变情况。PCR扩增体系为2 × KOD buffer 25 µL, 引物(10 µmol L-1) 0.75 µL, 模板DNA 2 µL, dNTPs (2.5 µmol L-1) 5 µL, KOD FX酶(1.0 U µL-1) 1 µL, 补超纯水至50 µL。PCR扩增条件为94°C预变性5 min; 94°C变性10 s, 59°C退火30 s, 68°C延伸1 min, 35个循环; 68°C延伸7 min。用1%琼脂糖凝胶电泳检测目的条带。Table 1
表1
表1本研究所用的引物
Table 1Primers used in this study
| 引物 Primer | 正向序列 Forward sequence (5°-3°) | 反向序列 Reverse sequence (5°-3°) |
|---|---|---|
| VP15-G-F1/R1 | AAGGACGCGAGAGTTTTTGA | GGTGAGCGAGTAACCCATGT |
| VP15-G-F2/R2 | ACATGGGTTACTCGCTCACC | CTTCCTGGTAGCGAGACGTG |
| VP15-G-F3/R3 | GCTCGTTCACCATCCAGAAT | AGCAAAGCCCTTTCTGAACA |
| VP15-G-F4/R4 | GGGCTTTGCTAAGATGTCTCC | GGACAATACATAACTGCTCCCTAAA |
| VP15-G-F5/R5 | TCTTCCACTCTTCCTACCAGCTA | AGGAGCCAACAACTGCTGAT |
| VP15-G-F6/R6 | GAACAATCGAGCCTTCTTCG | TCGTCCTCCTTGACCACTTC |
| VP15-G-F7/R7 | CACCAACTGCAAGATCGAAA | CCAACAGACGTCAACACCAG |
| VP15-CDS-F1/R1 | GGAACTCTCTGATACCTGGCTTT | CAGTTCCGTGATTAGCCGC |
| Zm-GAPDH-F/R | CCCTTCATCACCACGGACTAC | AACCTTCTTGGCACCACCCT |
新窗口打开
1.6 vp-like4和vp15再次等位测验
根据测序结果, 针对vp-like4、vp15-umu1、vp15-DR1126 分别用特异引物(VP15-G-F2/R2、VP15-G-F3/R3)准确鉴定其杂合突变体, 并再次进行等位测验。取vp-like4杂合突变体花粉分别杂交vp15-umu1、vp15-DR1126杂合突变体植株; 同样, 分别取vp15-umu1、vp15-DR1126杂合突变体花粉杂交vp-like4杂合突变体植株。授粉后30 d, 剥开苞叶, 检查果穗上穗发芽籽粒情况, 并统计分离比。1.7 RNA的提取及基因表达量分析
将授粉后30 d左右的穗发芽和正常籽粒, 剥去种皮, 用植物总RNA提取试剂盒(同上)提取籽粒RNA。利用反转录试剂盒(北京全式金生物技术有限公司, Cat# AU311-02)反转录为cDNA, 以cDNA为模板, 设计特异引物VP15-CDS-F1/R1, 并以GAPDH为内参引物(表1), 在ABI 7300实时定量PCR仪上进行实时定量分析。PCR体系为dye I 0.4 µL, 10 × qMix 10 µL, 引物(10 µmol L-1) 0.5 µL, 模板cDNA 1 µL, 补超纯水至20 µL。PCR扩增条件为95°C预变性2 min, 95°C变性10 s, 60°C退火15 s, 72°C延伸30 s, 循环数为40, 在72°C延伸30 s收集荧光, 并添加熔解曲线, 按公式2-ΔΔCt计算出正常和穗发芽籽粒中Vp15基因表达量差异。2 结果与分析
2.1 突变体vp-like4的表型和遗传分析
一般情况下, 玉米授粉后30~40 d, 籽粒顶部的胚乳组织开始硬化, 标志着籽粒开始成熟, 授粉后60 d左右籽粒达到完全成熟。但是, 穗发芽突变体vp-like4的杂合体在自交授粉后30 d左右, 就在果穗上明显观察到有穗发芽籽粒的分离(图1-A)。由于穗发芽的籽粒在果穗收获后, 萌发的胚芽已干枯致死(图1-B, C), 因此将同一果穗上的正常籽粒再种植、自交, 观察vp-like4穗发芽的遗传稳定性和分离比例。经过连续自交, 发现vp-like4的突变性状能稳定遗传。如表2所示, 随机选有穗发芽分离的果穗, 统计正常与穗发芽籽粒, 经卡方检验其分离比符合3∶1, 表明vp-like4突变体的穗发芽性状受单个隐性核基因控制。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1vp-like4突变体穗发芽表型
A: vp-like4杂合突变体授粉后30 d果穗上正常籽粒和穗发芽籽粒; B:vp-like4杂合突变体授粉后60 d果穗上正常籽粒和穗发芽籽粒; C: 成熟的正常籽粒(WT)和穗发芽籽粒(vp)。标尺=1 cm。
-->
A: normal and viviparous kernels on a vp-like4 heterozygous ear at 30 days after self-pollination; B: normal and viviparous kernels on a vp-like4 heterozygous ear at 60 days after self-pollination; C: mature normal (WT) and viviparous kernels (vp). Bar = 1 cm.
-->
Table 2
表2
表2vp-like4杂合突变体自交授粉后正常籽粒和穗发芽籽粒的分离情况
Table 2Segregation of normal and viviparous kernels on vp-like4 self-pollinated heterozygous ears
| 年度 Year | 地点 Location | 植株基因型 Plant genotype | 籽粒表型Kernel phenotype | |||
|---|---|---|---|---|---|---|
| 正常籽粒 Normal | 穗发芽籽粒 viviparous | 总数 Total | χ2 (3:1) | |||
| 2014 | 海南Hainan | vp-like4/+ | 355 | 127 | 482 | 0.398 |
| 325 | 111 | 436 | 0.027 | |||
| 2016 | 北京Beijing | vp-like4/+ | 129 | 47 | 176 | 0.189 |
| 225 | 70 | 295 | 0.190 | |||
新窗口打开
2.2 vp-like4基因定位
BSR-Seq基因定位分析表明[21], 在第5染色体上有一个明显的峰, 以P > 0.5为标准, 将vp-like4定位在玉米第5染色体173.8~175.6 Mb区间内(图2)。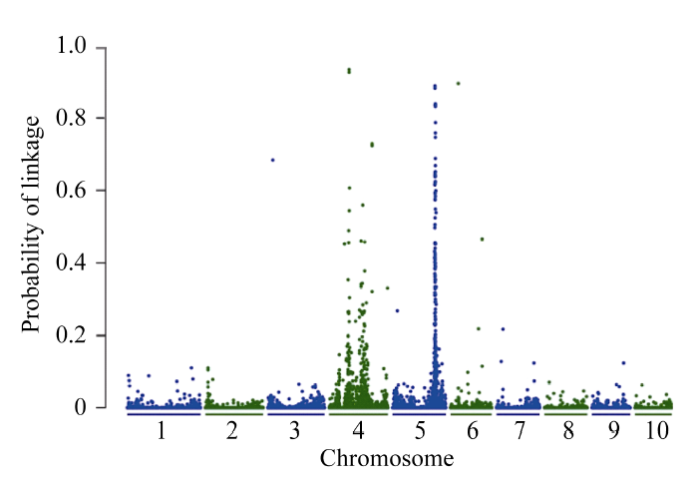 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2利用BSR-Seq方法对vp-like4突变体基因的初定位
-->Fig. 2Gene mapping of the vp-like4 mutant by the BSR-Seq strategy
-->
2.3 vp-like4和vp15等位测验
以vp-like4混粉杂交vp15-umu1和vp15-DR1126的两行中, 有穗发芽分离的果穗(图3-A, B); 同时, vp15-umu1和vp15-DR1126分别混粉杂交vp-like4的两行中, 也有穗发芽的果穗(图3-C, D)。这一结果初步说明, vp-like4突变体很可能就是Vp15基因等位突变体。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3利用杂合突变体对vp-like4和vp15进行等位测验
A, B: 以vp-like4杂合突变体混粉分别杂交vp15-umu1(A)和vp15-DR1126(B)的果穗上有穗发芽籽粒。C, D: 以vp15-umu1(C)、vp15-DR1126(D)分别混粉杂交vp-like4的果穗上有穗发芽籽粒。
-->Fig. 3Allelism test of vp-like4 with vp15 by heterozygous mutants
A, B: viviparous kernels were respectively emerged on vp15-umu1 (A) and vp15-DR1126 (B) heterozygous ear crossed by the mixed pollen of vp-like4 heterozygous plants; C, D: viviparous kernels were emerged on vp-like4 heterozygous ear crossed by the mixed pollens of vp15-umu1 (C) and vp15-DR1126 (D) heterozygous plants.
-->
2.4 vp-like4突变位点鉴定
为进一步验证vp-like4和vp15是等位基因并确认vp-like4的突变位点, 以Vp15基因组序列为参考, 共设计7 对PCR引物(表1), 分别扩增vp-like4、vp15-umu1和vp15-DR1126基因组DNA, 扩增产物从-310 bp到4962 bp瓦片式覆盖了Vp15基因组序列。对扩增产物测序发现, vp-like4突变体中Vp15基因第2外显子末端及3°非翻译区有60 bp碱基缺失; 而vp15-umu1、vp15-DR1126是在第2个外显子不同位置有Mutator转座子插入(图4)。由此说明突变体vp-like4与vp15的Vp15基因突变方式不同, vp-like4是vp15一个新的等位突变基因。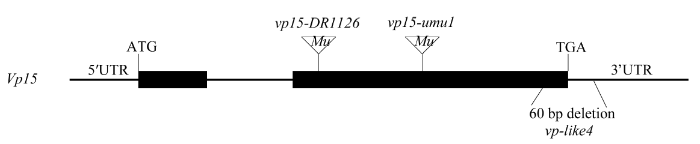 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4Vp15基因结构示意图及3个突变体的突变位置
-->Fig. 4Gene structure of Vp15 and mutation site of three mutants
-->
根据测序结果, 利用特异引物准确鉴定vp-like4、vp15-umu1、vp15-DR1126杂合突变体, 利用杂合突变体再一次进行等位测验(具体操作见材料与方法部分)。授粉后30 d, 剥开苞叶检测穗发芽情况发现, 无论是vp-like4花粉杂交vp15-umu1、vp15-DR1126, 还是vp15-umu1、vp15-DR1126花粉杂交vp-like4果穗, 都出现了穗发芽籽粒的分离, 且统计分析后发现正常籽粒与穗发芽籽粒符合3∶1分离比(表3)。进一步证明vp-like4突变体是Vp15基因等位突变体。
Table 3
表3
表3vp-like4与vp15突变体等位测验
Table 3Allelism test of vp-like4 with vp15
| 父母本基因型 Parental genotype | 籽粒表型 Kernel phenotype | |||
|---|---|---|---|---|
| 正常籽粒Normal | 穗发芽籽粒viviparous | 总数Total | χ2 (3:1) | |
| vp-like4/+ × vp15-umu1/+ | 217 | 68 | 285 | 0.141 |
| vp-like4/+ ×vp15-DR1126/+ | 123 | 40 | 163 | 0.002 |
| vp15-DR1126/+ ×vp-like4/+ | 262 | 83 | 345 | 0.116 |
| vp15-umu1/+ ×vp-like4/+ | 239 | 84 | 323 | 0.124 |
新窗口打开
2.5 Vp15基因在突变体vp-like4中的表达
分别取vp-like4、vp15-umu1、vp15-DR1126杂合突变体果穗上的正常籽粒和穗发芽籽粒, 利用实时定量荧光PCR, 以GAPDH为内参检测Vp15基因的表达量(表1)。结果如图5所示, 无论是在vp-like4还是在vp15-umu1和vp15-DR1126中, 穗发芽籽粒Vp15基因的表达量都显著低于正常籽粒, 表明vp-like4中碱基的缺失, 或者vp15-umu1和vp15-DR1126中Mutator转座子的插入, 都影响了Vp15基因正常表达。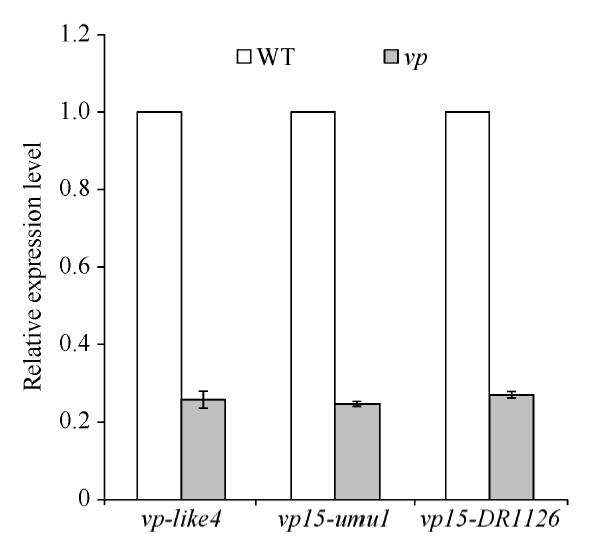 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5实时定量PCR检测Vp15基因分别在3个突变体vp-like4、vp15-umu1、vp15-DR1126中的正常(WT)和穗发芽(vp)籽粒中的表达量
-->Fig. 5Gene expression levels of Vp15 in the normal (WT) and viviparous (vp) kernels of three mutants, vp-like4, vp15-umu1, and vp15-DR1126, by quantitative real-time PCR analysis
-->
3 讨论
近年来, 高通量测序技术的迅速发展也促进了基因定位技术的发展。例如BSR-Seq (Bulked Segregant RNA-seq)技术是混合分离分析(BSA, Bulked Segregant Analysis)技术和RNA测序(RNA-Seq)技术结合发展起来的高效定位基因的新方法。利用BSR-Seq技术, 选择分离群体中具有极端性状的个体分别构建2个混样池, 提取2个样本总RNA进行转录组测序。分析RNA-Seq数据提取大量的分子标记, 对这些分子标记进行等位基因定量分析, 根据等位基因在不同混合池的分布比例, 定位目标基因。同时, 也可以利用RNA-Seq数据进行候选基因的预测[21]。对于像玉米这种基因组较为复杂的物种, BSR-Seq方法更为有效, 因为BSR-Seq只对mRNA测序, 不涉及重复序列和无用序列, 既减少了测序成本, 也提高了效率[23]。本研究鉴定到一个新的穗发芽突变体vp-like4, 受单隐性核基因控制。我们使用BSR-Seq方法对突变体开展基因定位, 并迅速获得定位区间。该技术的使用大大减少了工作量, 缩短了实验周期, 为玉米突变体基因的定位带来极大的方便。众所周知, 等位测验是通过杂交实验对杂交后代性状的分离情况进行分析, 以确定基因的等位性及其遗传距离。一般情况下, 等位测验往往利用两个隐性纯合突变体进行杂交[24,25]。在本研究中, 由于穗发芽纯合突变体提前发芽而导致胚芽在收获时死亡, 另外, 由于在未克隆vp-like4基因之前, 无法准确鉴定其为杂合突变体还是纯合野生型, 因此, 本研究利用混粉的方法进行初步的等位性检测。取花粉混粉的同时也对取粉行中的单株进行自交, 根据自交后检测穗发芽的情况以确证所取花粉包含突变体花粉。反之, 接受花粉的植株除了接受花粉杂交授粉, 也同时保留另一行自交, 并根据自交后检测穗发芽的情况以确证接受花粉单株包含突变体雌穗。本研究采取这样的方法, 初步验证了vp-like4与vp15的等位性。而随后的基因序列验证和准确的杂合体等位杂交, 也证明了vp-like4确实是vp15的等位基因。
已有研究报道显示Vp15基因编码MPT合成酶小亚基, 此酶调控钼辅因子(MoCo)的合成[12], MPT合成酶小亚基广泛存在于真核和原核生物中[26], 在人类中其功能缺失引起多种疾病[27,28,29]。MPT合成酶小亚基的C端有高度保守的结构域, 且C端的甘氨酸在催化反应中作为硫离子共价受体起着至关重要的作用[30]。本研究中vp-like4在第2外显子末端及3°非翻译区缺失60 bp碱基, 破坏VP15蛋白C端保守结构域, 进而使其无法正常调控MoCo合成, 导致不能正常合成ABA, 表现为突变体籽粒在母体上提前萌发。因此, vp-like4突变体中Vp15基因的突变, 与所报道的vp15-umu1、vp15-DR1126突变体分别在第2个外显子有Mutator转座子插入的突变方式不同, 是一个新的未见报道的Vp15基因等位突变方式。此外, vp-like4突变体中Vp15基因60个碱基的缺失, 推测其蛋白序列发生移码突变。我们检测到vp-like4突变体中Vp15基因mRNA的表达量显著降低, 推测可能是由于形成了错误的mRNA从而导致其mRNA稳定性差。总之, 该突变体的鉴定和基因克隆, 为进一步深入研究玉米Vp15基因功能提供了新的实验材料。
4 结论
新发现一个玉米穗发芽突变体vp-like4, 该突变体受隐性单基因控制。通过BSR-Seq基因定位和基因克隆发现, vp-like4中Vp15基因在第2外显子末端及3°非翻译区有60 bp碱基缺失的突变, 是一个新的Vp15基因等位突变体。vp-like4功能突变基因的确认, 为探讨玉米穗发芽的分子机制提供了新的试材。The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | . |
| [2] | . |
| [3] | . |
| [4] | . |
| [5] | . |
| [6] | . |
| [7] | . |
| [8] | . |
| [9] | . |
| [10] | . |
| [11] | . |
| [12] | . |
| [13] | . |
| [14] | . |
| [15] | . |
| [16] | . |
| [17] | . |
| [18] | . |
| [19] | . |
| [20] | . |
| [21] | . |
| [22] | |
| [23] | . |
| [24] | . . |
| [25] | . |
| [26] | . |
| [27] | . |
| [28] | . |
| [29] | . |
| [30] | . |
