 , 罗秋兰
, 罗秋兰
Cloning of the Key Gene ZmCYP90B1 in Brassinosteroids Biosynthesis from Zea mays and Its Response to Adversity Stresses
DUANFang-Meng , LUOQiu-Lan
, LUOQiu-Lan
通讯作者:
收稿日期:2017-07-5
接受日期:2017-11-21
网络出版日期:2018-03-12
版权声明:2018作物学报编辑部作物学报编辑部
基金资助:
作者简介:
-->
展开
摘要
关键词:
Abstract
Keywords:
-->0
PDF (3321KB)元数据多维度评价相关文章收藏文章
本文引用格式导出EndNoteRisBibtex收藏本文-->
油菜素甾醇(brassionsteroids, BRs)是植物体内一类重要的甾醇类激素。BRs不仅在调节植物生长发育中发挥着重要的作用[1,2,3], 同时还参与植物逆境的响应[4]。BRs可以通过改善植物体内的渗透调节、增强植物体内多种保护酶的活性、提高植物光合速率, 以及与其他激素相互作用共同调节植物在非生物胁迫下的抗性[5,6]; 生物胁迫方面, 外施BRs能够诱导水稻对水稻白叶枯病菌、稻瘟病菌以及烟草花叶病毒产生广谱抗性[7], 喷施EBR具有缓解番茄和黄瓜根结线虫病害的效应[8,9]。以上研究都仅限于外源BRs调控植物抗逆性的报道。
内源BRs生物学功能的探索, 主要是通过基因工程技术调控BRs生物合成相关基因的表达量来实现的。在BRs的生物合成途径中, CYP90B1基因编码的酶是BRs整个生物合成途径的关键限速酶[10], 作用于C-22α位点的羟基化, 过量表达该基因可以有效地调控BRs的生物合成量[11,12], 进而改善玉米[13]和拟南芥的产量相关的性状[14,15,16], 并且增强了拟南芥的抗旱性[11]。此外, 高温也可诱导拟南芥CYP90B1基因的上调表达和内源BRs含量的增加[17]。最近研究发现过量表达油菜CYP90B1基因显著增强了拟南芥对干旱和真菌病原物的抗性[11]。上述报道证实了CYP90B1基因通过调控内源BRs的生物合成量, 进而作用于植物的生长发育、抵御非生物胁迫以及病原菌的侵害。
玉米(Zea mays)作为重要的粮食作物和工业原料, 在生长过程中不可避免地遭受逆境胁迫, 影响其产量和品质, 因此明确玉米BRs合成途径关键基因对逆境胁迫的响应具有重要意义。然而, 玉米CYP90B1基因在逆境胁迫下的相关研究还未见报道。因此, 本研究首先采用RT-PCR结合RACE技术, 从玉米中克隆ZmCYP90B1基因全长, 并对其进行生物信息学分析; 通过实时荧光定量PCR, 研究ZmCYP90B1基因在非生物胁迫(干旱、高盐、低温和脱落酸)、虫害(甜菜夜蛾)和茉莉酸甲酯胁迫处理下的表达特性; 并通过检测干旱胁迫前后野生型和过量表达ZmCYP90B1烟草植株的生理指标和下游胁迫响应基因的表达量, 研究其在响应干旱胁迫下的作用机制, 为深入研究玉米ZmCYP90B1基因功能奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 选用玉米自交系LN287。将种子催芽后播种于塑料盆钵(6.7 cm × 7.0 cm)中, 每盆1粒, 置光照培养箱内培养, 温度25°C, 湿度60%, 光照强度36 µmol m-2 s-1, 16 h光照/8 h黑暗; 烟草(Nicotiana tabacum L.)品种为Havana 425。1.1.2 昆虫材料 选用三龄期人工饲料喂养的甜菜夜蛾幼虫。
1.1.3 菌种与质粒 大肠杆菌DH5α、农杆菌LBA4404、植物表达载体pCAMBIA3301 均由本实验室保存。
1.1.4 试剂 RNA提取试剂盒购自OMEGA公司(美国); SMARTer-RACE试剂盒、cDNA Synthesis试剂盒、pMD18T载体、Ex Taq酶、Marker、SYBR Premix Ex Taq荧光定量试剂盒均购自宝生物工程(大连)有限公司。脱落酸(ABA)和茉莉酸甲酯(MeJA)购自Sigma公司(美国)。
1.2 材料处理
1.2.1 玉米不同组织取材 将玉米培养至三叶期, 分别取根、茎和叶, 研究ZmCYP90B1基因在不同组织中的表达情况。1.2.2 非生物胁迫处理 将培养至三叶期的玉米植株分别进行低温(4°C)、干旱(20% PEG-6000)、高盐(250 mmol L-1 NaCl)以及脱落酸(100 µmol L-1 ABA)胁迫处理, 分别于胁迫处理0.5、1、3、6、12、16和24 h取样。
1.2.3 虫害处理 参照徐涛等[18]的虫害处理方法, 在每颗玉米苗的第2片叶上接种三龄期的甜菜夜蛾幼虫3头, 纱网密封并支撑牢固, 防止甜菜夜蛾取食其他叶片。取样时间分别为接种夜蛾后0、3、6、12、24和48 h。
1.2.4 MeJA处理 将待处理的玉米幼苗置密闭容器中, 每颗幼苗中放置一湿润的脱脂棉, 并在其上滴入6 µL的MeJA; 取样时间同处理1.2.3。上述处理均取玉米第3片叶片, 液氮速冻后置-80°C冰箱, 以备RNA提取之用, 以未处理的玉米健康幼苗为对照, 上述的每个处理均设置3次生物学重复。
1.3 ZmCYP90B1基因的克隆
取三叶期玉米叶片约100 mg, 液氮研磨至粉末状, 转至1.5 mL离心管中, 利用试剂盒提取总RNA。根据植物CYP90B1基因的保守序列设计简并引物DP-F和DP-R (表1), 扩增ZmCYP90B1基因的部分片段并测序。根据测序结果设计RACE的“5°和3°”基因特异引物(5°-GSP和3°-GSP)(表1), 参照RACE试剂盒SMART RACE cDNA Amplification Kit (Clontech)说明书进行ZmCYP90B1基因 cDNA的5′和3′末端的快速扩增并分别测序。序列拼接获得ZmCYP90B1基因全长序列, 设计全长引物FP-F和FP-R (表1), 扩增ZmCYP90B1基因的开放阅读框(ORF), 以叶片的cDNA为模板进行PCR扩增, 94°C预变性5 min; 94°C变性30 s, 60°C退火30 s, 72°C延伸2 min, 30个循环; 72°C延伸7 min。以1%琼脂糖凝胶电泳检测扩增结果。Table 1
表1
表1克隆基因所用引物
Table 1Primers used in cloning gene
| 引物 Primer | 序列 Sequence (5°-3°) |
|---|---|
| DP-F | GGCGGCATCCTGGGCAAGT |
| DP-R | CCCGCGAAGAGCAGGCTCA |
| 5°-GSP | TGGACCACTTGCCCAGGATGCC |
| 3°-GSP | GAAGATGGAGGACAGGCTTGAGA |
| FP-F | CTCTCTCCAACCCATCCGTC |
| FP-R | GGGAGGTAATGTTGGGGTTTG |
新窗口打开
1.4 ZmCYP90B1基因的生物信息学分析
将预测的ZmCYP90B1基因利用DNAMAN软件分析该基因开放阅读框, 预测基因产物的长度、分子量、等电点、亲疏水性以及跨膜结构。将所得基因的编码产物在NCBI网站进行BlastP, 下载Subjects氨基酸序列, 应用DNAMAN软件进行多序列比对, 并应用MEGA 7.0的NJ算法生成系统发育树。采用Protparam (http://web.expasy.org/protparam/)在线分析氨基酸序列的理化性质。1.5 ZmCYP90B1基因的表达分析
取胁迫处理前后的样品, 加液氮迅速研磨成粉末, 根据试剂盒的操作步骤从玉米叶片中提取RNA, 反转录为cDNA (统一浓度为100 ng μL-1); 基因特异性引物(表2)由Primer 5.0设计和NCBI验证完成。Table 2
表2
表2荧光定量PCR所需引物信息
Table 2Specific primers used for real-time PCR analysis
| 基因名称 Gene name | GenBank登录号 GenBank number | 引物序列 Primer sequence (5°-3°) | 产物长度 Product size (bp) | 退火温度 Annealing temperature (°C) |
|---|---|---|---|---|
| NtAPX | NM_001324874.1 | F: CAAATGTAAGAGGAAACTCAGAGGA R: AGCAACAACTCCAGCTAATTGATAG | 262 | 60 |
| NtCAT | NM_001326196.1 | F: AGGTACCGCTCATTCACACC R: AAGCAAGCTTTTGACCCAGA | 151 | 60 |
| NtSOD | AF443178.1 | F: CCGTCGCCAAATTGCATAG R: CGATAGCCCAACCAAGAGAAC | 238 | 62 |
| NtNCED1 | NM_001326185.1 | F: CTATTTCCACTTCAAAACCAACCAC R: GGCACTTTCCACGGCATCT | 131 | 62 |
| NtERD10C | AB049337.1 | F: ACGTGGAGGCTACAGATCGTGGTTT R: TCTCCACTGGTACAGCCGTGTCCTCAC | 366 | 70 |
| NtLEA5 | AF053076.1 | F: GAACCCAACAAGAGCGAGAGA R: CGACAGGAAGCATTGACGAG | 350 | 62 |
| Tob103 | U60495.1 | F: CAAGGAAATCACCGCTTTGG R: AAGGGATGCGAGGATGGA | 106 | 60 |
| ZmCYP90B1 | KY242373 | F: GGCTGTGGTCTCGTGTTTTATG R: ACCATCCTCCCCTTTGCTCT | 104 | 62 |
| Actin | NM_00115473.1 | F: CTGAGGTTCTATTCCAGCCATCC R: CCACCACTGAGGACAACATTACC | 133 | 62 |
新窗口打开
使用TaKaRa SYBR Green PCR Master Mix试剂盒, 在德国耶拿的qTOWER实时定量PCR系统中进行荧光定量PCR, PCR体系含5 μL SYBR Premix Ex Taq II (2×)、1 μL上下游引物 (10 μmol L-1)、1 μL cDNA (100 ng μL-1)和2 μL ddH2O。PCR程序为95°C 5 min; 95°C 10 s, 60°C 30 s, 72°C 30 s, 共35个循环。以玉米Actin为内参基因, 每个样品3个平行, 3次生物学重复, 采用2-ΔΔCT法分析实验结果[19]。
1.6 过量表达ZmCYP90B1基因烟草的构建和分子检测
构建植物表达载体pCAMBIA3301-ZmCYP90B1, 转化农杆菌LBA4404, 将重组载体通过烟草叶盘转化方法[20], 获得过量表达ZmCYP90B1基因的烟草植株。利用经典CTAB法提取烟草基因组DNA, 采用GFP基因的特异性引物(正向引物5′-AGCTGAC CCTGAAGTTCATCTG-3′; 反向引物5′-ACTGGGT GCTCAGGTAGTGGTT-3′)进行PCR扩增, 反应条件为95°C 5 min; 95°C 30 s, 62°C 30 s, 72°C 40 s, 共30个循环; 72°C 5 min。以1%琼脂糖凝胶电泳检测目的条带, 筛选出基因组中有ZmCYP90B1基因整合的烟草植株。提取野生型和T2转基因植株的叶片RNA, 进行ZmCYP90B1基因的荧光定量PCR, 检测和计算方法同1.5。1.7 过量表达ZmCYP90B1基因烟草的抗旱性分析
将6周苗龄的野生型和过量表达ZmCYP90B1基因的烟草植株进行20%PEG模拟干旱胁迫, 10 h后测定抗性生理指标。参照Du等[21]的方法测定叶片失水率; 采用SPAD-502 叶绿素仪(Konica Minolta Sensing, Japan)测定叶绿素含量; 采用氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性; 采用可见光分光光度法测定过氧化氢酶(CAT)活性[22]; 采用愈创木酚法测定过氧化物酶(POD)的活性; 采用磺基水杨酸法测定游离脯氨酸(Pro)含量; 采用硫代巴比妥酸法测定丙二醛(MDA)的含量; 采用高效液相色谱法测定脱落酸(ABA)含量。同时采用荧光定量PCR检测干旱胁迫前后野生型和转基因烟草的胁迫相关基因的表达变化, 检测和计算方法同1.5。基因和引物序列详见表2。1.8 数据处理
所有试验数据均由3次重复实验获得, 应用SPSS 16.0软件分析差异显著性, 运用最小显著性差数法(LSD)进行单因素方差分析; Duncan’s多重比对分析, 差异显著性水平均为P<0.05。2 结果与分析
2.1 ZmCYP90B1基因的克隆
通过简并引物扩增得到ZmCYP90B1基因部分片段, 长度为527 bp。再根据NCBI和Primer 5.0软件对克隆得到的ZmCYP90B1基因部分片段设计“5°和3°RACE的基因特异引物, 进行5°-DNA和3°-DNA序列的克隆, 得到片段的长度分别为1311 bp和1009 bp, 二者拼接得到全长基因。根据全长序列设计特异性引物, 克隆得到ZmCYP90B1基因的ORF区, 长度为1843 bp。将扩增得到的ORF区连接到pMD18-T克隆载体上, 酶切鉴定表明ZmCYP90B1已被成功克隆(图1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1ZmCYP90B1基因扩增结果
A: ZmCYP90B1部分片段扩增结果; B: ZmCYP90B1 5´-RACE扩增结果; C: ZmCYP90B1 3´-RACE扩增结果; D: ZmCYP90B1的ORF区扩增结果; E: 重组载体双酶切鉴定结果; M1: DL2000 marker; M2: 15000 marker。
-->Fig. 1PCR amplified products of ZmCYP90B1
A: The part fragment amplification of ZmCYP90B1; B: The 5´-RACE amplification of ZmCYP90B1; C: The 3´-RACE amplification of ZmCYP90B1; D: The ORF amplification of ZmCYP90B1; E: The identification of recombinant vector digested by double enzymes; M1: DL2000 marker; M2: 15000 marker.
-->
2.2 ZmCYP90B1基因的序列分析
经克隆测序得到ZmCYP90B1基因全长为2058bp, GenBank登录号为KY242373。从玉米基因组数据库中查找CYP90B1基因, 该基因只有1个拷贝数, 位于第1染色体, 远离中心粒, 定位于染色体的一端。包含一个1518 bp的开放阅读框, 编码506个氨基酸。该基因编码产物的分子量为57.66 kD, 等电点约为9.54, 有1个跨膜结构域及1个p450保守结构域(图2), 无信号肽。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2ZmCYP90B1基因编码产物的氨基酸序列
下画线部分为跨膜结构域氨基酸位点: 12~31; 灰色阴影部分为p450保守结构域位点: 2~491。
-->Fig. 2Sequence of amino acid encoded by ZmCYP90B1
The underline is the amino acid site of the transmembrane domain: 12-31; The grey shaded part is p450 conserved domain site: 2-491.
-->
2.3 ZmCYP90B1预测的氨基酸亲水性和疏水性分析
如图3所示, 该序列的第21位亮氨酸的疏水性最强, 其次为第20位的亮氨酸、第297位的亮氨酸和第315位的异亮氨酸; 亲水性最强的位点是第43位的谷氨酰胺, 其次是第213位的谷氨酸。结果表明该基因编码的蛋白为疏水性, 与图2预测该蛋白为跨膜蛋白的结果相一致, 进一步推测ZmCYP90B1蛋白可能是一个与信号传导有关的膜受体蛋白。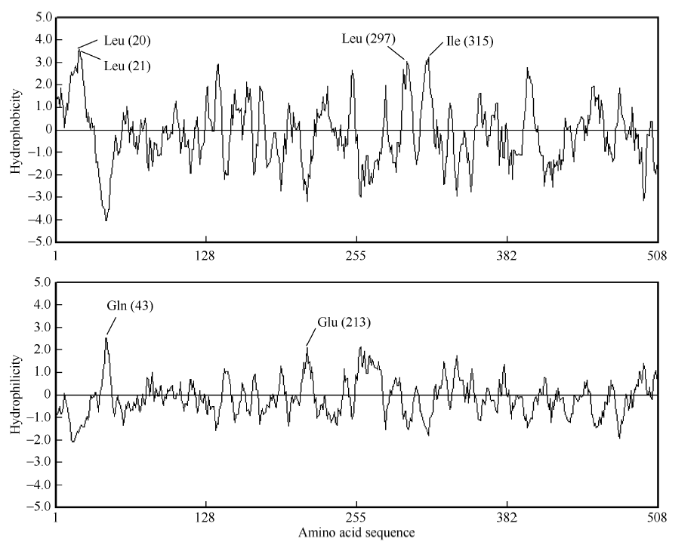 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3ZmCYP90B1预测的氨基酸亲水性和疏水性分析
-->Fig. 3Hydrophilicity and hydrophobicity analysis of predicted amino acid sequence encoded by ZmCYP90B1
-->
2.4 ZmCYP90B1的多序列比对
以ZmCYP90B1基因预测的氨基酸序列为探针, 在GenBank数据库中搜索到拟南芥、小麦、水稻等植物中多个类似的蛋白, 这表明了该基因蛋白普遍存在于高等植物中。利用DNAMAN软件将该序列与稷草(Dichanthelium oligosanthes, OEL34128.1)、水稻(Oryza brachyantha, XP_006649668.1)、小麦(Triticum urartu, EMS59113.1)、拟南芥(Arabidopsis thaliana, AAC05093.1)、大豆(Glycine soja, KHN36124.1)、油菜(Brassica napus, CDY24488.1)、棉花(Gossypium hirsutum, NP_001313765.1)的CYP90B1序列进行多重比对(图4)发现, 玉米ZmCYP90B1与稷草和水稻CYP90B1的同源性较高, 分别达到了94%和88%。由上述植物CYP90B1蛋白的多序列比对图可知, 该基因编码的蛋白与其他物种的CYP90B1蛋白的氨基酸序列具有较高的相似性, 暗示其功能的高度保守。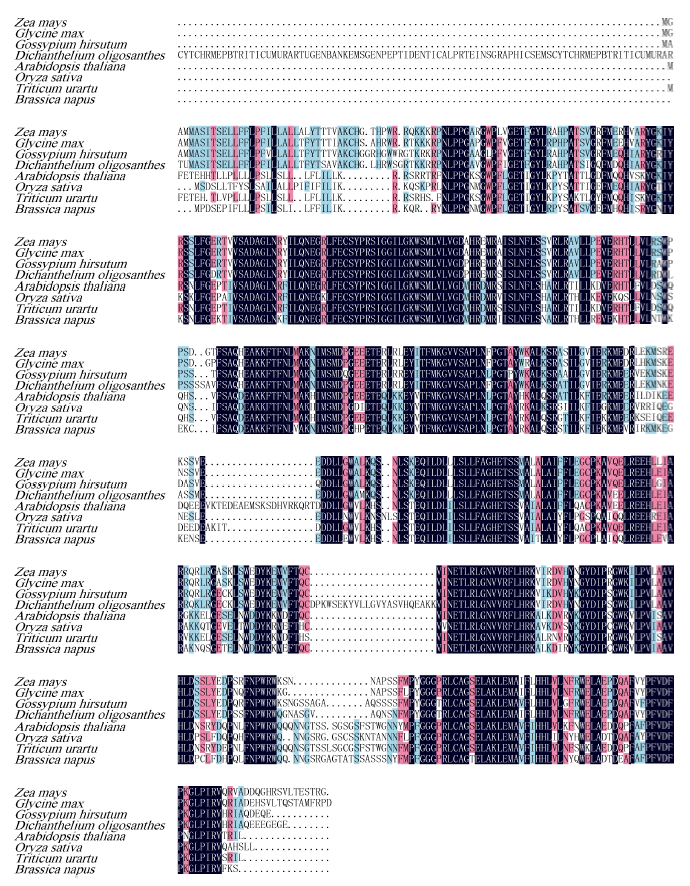 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图48种植物CYP90B1蛋白的多序列比对
-->Fig. 4Multiple sequence-alignments of CYP90B1 proteins from eight plants
-->
2.5 ZmCYP90B1的系统进化分析
从NCBI网站下载10种不同植物的CYP90B1氨基酸序列, 进行CYP90B1的系统进化分析(图5)表明, 单子叶植物和双子叶植物的CYP90B1蛋白分别聚在一起。同为单子叶植物的玉米、稗草、水稻、山羊草和小麦聚在同一大的分支, 而同为双子叶植物的6个蛋白同源物聚在另一大的分支; 在单子叶植物这一分支上, 玉米和稗草的亲缘关系较近, 聚在同一分支上, 而山羊草和小麦亲缘关系较近, 聚在另一分支上, 且分别向2个不同的方向进化; 在双子叶植物这一分支上, 拟南芥和油菜首先分化出来共同进化, 接着烟草、大豆、棉花和可可分成相应的3条分支后也各自进化。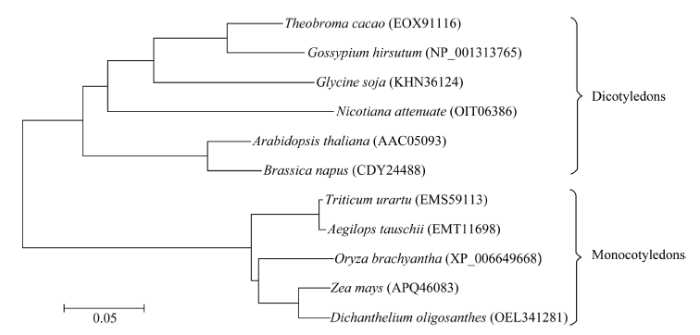 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5ZmCYP90B1与其他植物CYP90B1蛋白的系统发生分析
-->Fig. 5Phylogenetic analysis between ZmCYP90B1 and CYP90B1 proteins from other plant species
-->
2.6 ZmCYP90B1的理化性质分析
利用ExPASy Proteomics在线工具Protparam 分别对上述5个单子叶植物和6个双子叶植物的CYP90B1氨基酸序列进行理化性质分析(表3)显示, 5个单子叶植物的CYP90B1氨基酸残基数均多于双子叶植物同源物的残基数(拟南芥除外); 单子叶植物的CYP90B1相对分子量集中在57~59 kD, 而双子叶植物则分布在55~56 kD (拟南芥除外); 理论等电点最高的是单子叶植物玉米的CYP90B1蛋白(9.54), 最低的是双子叶植物拟南芥的相关蛋白(6.62); 除拟南芥外, 其他植物CYP90B1蛋白的正电荷氨基酸比例均大于负电荷氨基酸比例; 这11种植物CYP90B1蛋白的不稳定系数均大于40, 总平均亲水性均小于1, 说明这11种蛋白均为不稳定的疏水蛋白。Table 3
表3
表3不同植物来源的CYP90B1氨基酸理化性质的比较
Table 3Comparison of physical and chemical characteristics of amino acids of CYP90B1 from different plant species
| 类别 Category | 物种 Species | 氨基酸残基数 Residues | 分子量 Molecular weight (kD) | 等电点pI | 负电荷氨基酸比例 Negatively charged residues (%) | 正电荷氨基酸比例 Positively charged residues (%) | 不稳定 系数 Instability index | 总平均亲水性 Hydropathicity |
|---|---|---|---|---|---|---|---|---|
| 单子叶植物 Monocotyledons | Zea mays | 506 | 57.66 | 9.54 | 10.47 | 13.44 | 46.74 | -0.171 |
| Dichanthelium oligosanthes | 507 | 57.87 | 9.25 | 10.65 | 12.62 | 48.82 | -0.161 | |
| Oryza brachyantha | 504 | 57.12 | 9.27 | 10.52 | 12.70 | 52.69 | -0.138 | |
| Aegilops tauschii | 501 | 57.01 | 8.11 | 11.58 | 11.98 | 52.53 | -0.133 | |
| Triticum urartu | 525 | 59.75 | 8.09 | 11.62 | 12.00 | 51.61 | -0.162 | |
| 双子叶植物 Dicotyledons | Arabidopsis thaliana | 513 | 58.87 | 6.62 | 12.87 | 12.28 | 49.50 | -0.301 |
| Nicotiana attenuata | 491 | 55.78 | 8.89 | 9.98 | 11.41 | 44.36 | -0.166 | |
| Brassica napus | 495 | 56.71 | 8.17 | 11.72 | 12.12 | 48.90 | -0.213 | |
| Glycine soja | 492 | 55.77 | 8.85 | 10.16 | 11.38 | 43.87 | -0.128 | |
| Theobroma cacao | 496 | 56.75 | 8.64 | 10.89 | 11.90 | 46.51 | -0.219 | |
| Gossypium hirsutum | 485 | 55.42 | 8.94 | 10.52 | 12.16 | 44.88 | -0.163 |
新窗口打开
2.7 ZmCYP90B1基因的表达模式分析
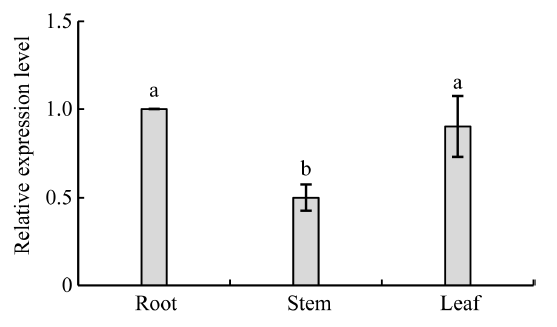
2.7.1 ZmCYP90B1基因在不同组织中的表达通过荧光定量PCR检测表明, CYP90B1基因在不同组织中均表达, 但表达量显著不同。在根和叶片中的表达量较高, 约是茎的2倍(图6)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6ZmCYP90B1基因在不同组织中的相对表达水平
图柱上不同小写字母表示在0.05水平上差异显著。
-->Fig. 6Relative expression levels of ZmCYP90B1 in different tissues
The different lowercase letters in each column indicate significant difference at the 0.05 probability level.
-->
2.7.2 ZmCYP90B1基因在非生物胁迫下的表达模式 低温(4°C)、干旱(20% PEG-6000)、高盐(250 mmol L-1 NaCl)以及脱落酸(100 µmol L-1 ABA)处理均可诱导ZmCYP90B1基因的表达水平发生变化(图7)。低温胁迫导致ZmCYP90B1基因的表达量在前3 h降低, 但在第6 h时显著上调, 随后降低再升高。在PEG-6000胁迫处理0.5 h时, ZmCYP90B1基因的表达量就开始显著升高, 在第3 h达到最大, 随着胁迫时间的延长, 其表达量呈逐渐降低的趋势。ZmCYP90B1基因在ABA胁迫下的表达模式与其在高盐胁迫下类似, 分别在第6和第12 h的表达量升至最高, 之后明显下降。总而言之, ZmCYP90B1基因在不同胁迫条件下的差异表达揭示了该基因以不同的方式响应各种非生物胁迫。
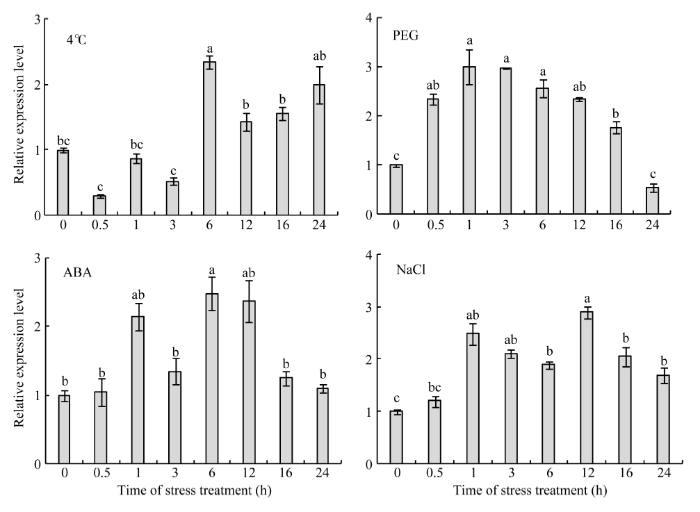 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7ZmCYP90B1在非生物胁迫下的表达模式
图柱上不同小写字母表示在0.05水平上差异显著。
-->Fig. 7Expression profiles of ZmCYP90B1 under abiotic stresses
The different lowercase letters in each column indicate significant difference at the 0.05 probability level.
-->
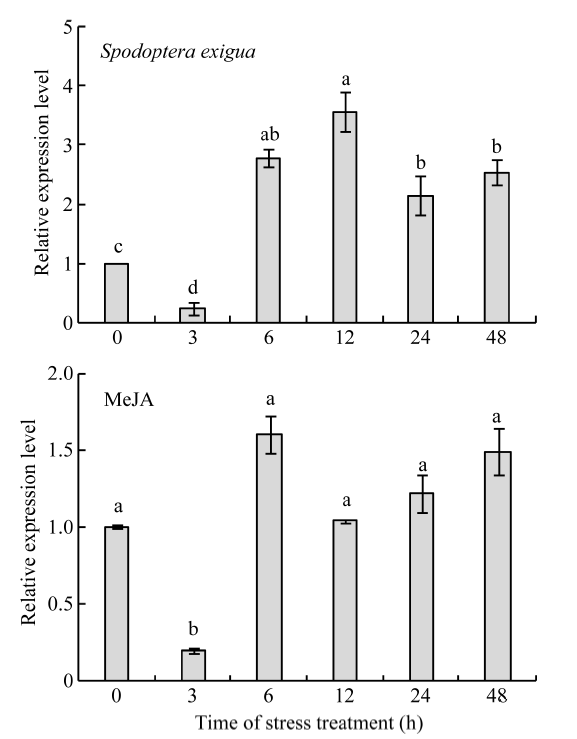 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8ZmCYP90B1在甜菜夜蛾取食和茉莉酸甲酯下的表达模式
图柱上不同小写字母表示在0.05水平上差异显著。
-->Fig. 8Expression profiles of ZmCYP90B1 under Spodoptera exigua and MeJA
The different lowercase letters in each column indicate significant difference at the 0.05 probability level.
-->
2.7.3 ZmCYP90B1基因在虫害和茉莉酸甲酯胁迫下的表达模式 甜菜夜蛾取食和MeJA处理均可诱导玉米叶片ZmCYP90B1基因的表达。甜菜夜蛾取食3 h后, 该基因表达量有所下降, 但变化不明显。随着取食时间的延长, 该基因的表达量显著上升, 到12 h后达到最高, 是对照的3.5倍。随后其表达量逐渐下降, 但都显著高于对照; MeJA处理下ZmCYP90B1基因的表达趋势同甜菜夜蛾危害下的趋势类似, 都是在处理的3 h后表达量下降, 而且MeJA处理下的变化显著。但随着处理时间的延长, MeJA对该基因的表达同对照相比, 无明显的诱导作用。以上结果表明MeJA 处理6 h后对ZmCYP90B1基因表达有一定诱导作用, 但诱导效应没有达到虫害诱导的水平。
2.7.4 转基因烟草的分子检测 剪取烟草叶片, 提取基因组DNA, 采用载体上的GFP基因的特异引物进行PCR扩增, 1%琼脂糖凝胶电泳出现目的条带, 大小为492 bp (图9), 表明ZmCYP90B1基因已经成功整合到烟草基因组中。提取野生型和转基因烟草叶片RNA, 进行ZmCYP90B1基因的RT-PCR检测表明, ZmCYP90B1基因能够在烟草中正常转录。
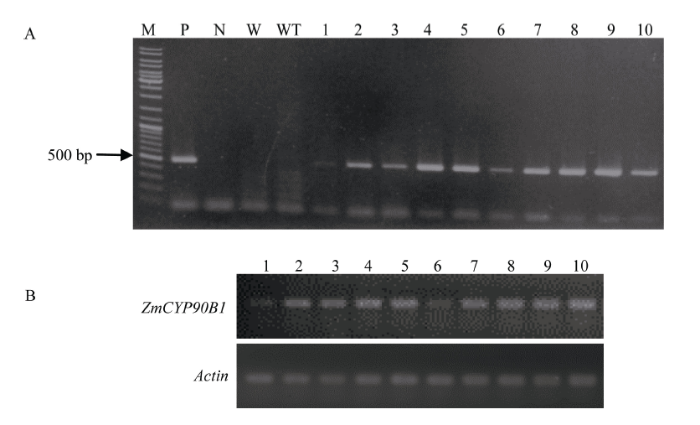 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9转基因烟草植株的分子鉴定
M: marker; P: 阳性质粒; N: 空载体; W: 双蒸水; WT: 野生型; 1~10: 转基因株系。
-->Fig. 9Molecular identification of transgenic tobacco lines
M: marker; P: positive plasmid; N: empty vector; W: double distilled water; WT: wild types; 1-10: transgenic lines.
-->
2.7.5 过量表达ZmCYP90B1基因烟草植株的抗旱性表型鉴定 选取L4和L9这2个转基因株系来进一步分析ZmCYP90B1基因在干旱胁迫下的功能。将6周苗龄的野生型和转基因株系用20% PEG处理10 h, 发现野生型烟草植株叶片严重萎蔫, 而过量表达株系的叶片只出现轻度萎蔫(图10-A)。叶片失水率野生型显著高于过量表达株系(图10-B); 干旱胁迫前, 野生型和过量表达株系的SPAD值差异不明显; 干旱胁迫后, 过量表达株系的SPAD值均显著高于野生型(图10-C)。说明在干旱胁迫下过量表达株系比野生型含有更高的叶绿素。以上结果表明了过量表达ZmCYP90B1基因的烟草植株具有较强的抗旱性。
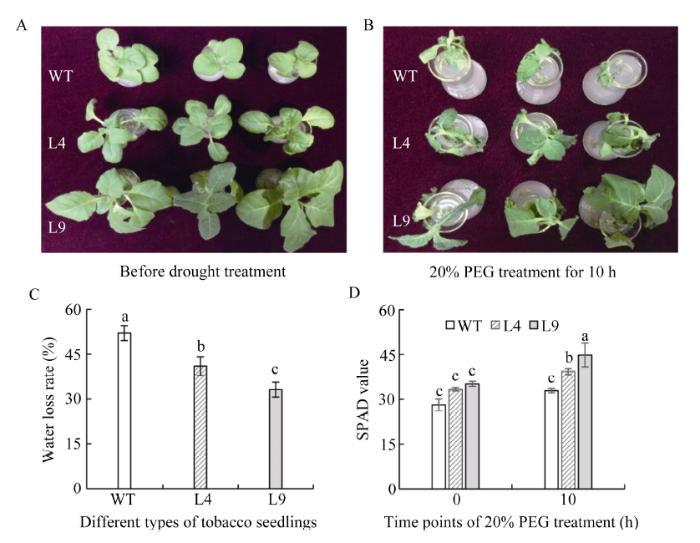 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10野生型和转基因烟草植株在干旱胁迫下的功能鉴定
A: 干旱胁迫前野生型和转基因株系(L4和L9)的表型; B: 20% PEG处理10 h后野生型和转基因株系(L4和L9)的表型; C: 20% PEG处理10 h后野生型和转基因株系(L4和L9)的叶片失水率; D: 20% PEG处理前后野生型和转基因株系(L4和L9)的SPAD值。图柱上不同小写字母表示在0.05水平上差异显著。
-->Fig. 10Functional analysis of wild types and transgenic tobacco seedlings under drought stress
A: The phenotype of WT and transgenic lines (L4 and L9) before drought stress; B: The phenotype of WT and transgenic lines (L4 and L9) after 20% PEG treatment for 10 h; C: The water loss rate of WT and transgenic lines (L4 and L9) after 20% PEG treatment for 10 h; D: The SPAD value of WT and transgenic lines (L4 and L9) before and after 20% PEG treatment. The different lowercase letters in each column indicate significant difference at the 0.05 probability level.
-->
2.7.6 抗性生理指标的检测 野生型和转基因烟草的抗氧化酶SOD、CAT和POD活性在正常浇水条件下差异不明显; 干旱胁迫10 h诱导了转基因烟草的SOD和POD活性显著升高, 两个转基因株系(L4和L9)分别高于野生型SOD活性的41.51%、50.65%, POD活性的24.50%、26.44%; 野生型和转基因烟草的CAT活性在干旱胁迫后均显著下降, 但是转基因烟草的CAT活性明显高于野生型, 是其2倍之多。
干旱胁迫前, Pro、MDA和ABA在野生型和转基因烟草中的含量均无明显差异; 而干旱胁迫10 h后, 野生型和转基因烟草的Pro含量均上升, 但后者显著高于前者38.97%和43.14%; 干旱处理诱导了野生型MDA含量的显著提高, 而转基因株系的MDA含量明显低于野生型; 野生型的ABA含量在干旱胁迫后显著增加, 转基因株系的ABA含量虽略有增加, 但是明显低于野生型的ABA含量(图11)。
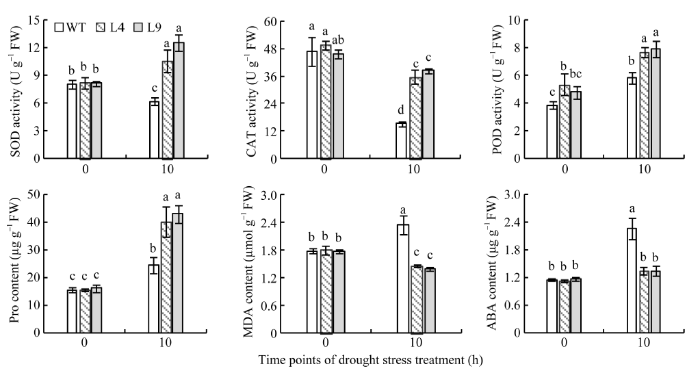 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图11干旱胁迫前后野生型和转基因烟草的生理指标
图柱上不同小写字母表示在0.05水平上差异显著。
-->Fig. 11Physiological indices in both wild types and transgenic tobacco before and after drought stress
The different lowercase letters in each column indicate significant difference at the 0.05 probability level.
-->
2.7.7 下游胁迫响应基因的表达分析 干旱胁迫后, 转基因烟草中的6个胁迫相关基因的表达量均上调。同野生型烟草相比, 转基因烟草中的抗氧化酶基因(APX、CAT和SOD)、逆境响应蛋白关键酶基因(ERD10C和LEA5)的表达倍数显著增加, 而ABA生物合成关键酶基因NCED1的表达水平变化不明显(图12)。
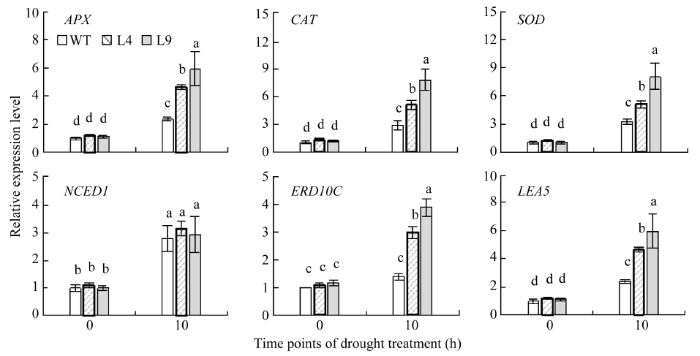 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图12干旱胁迫前后胁迫相关基因的表达
图柱上不同小写字母表示在0.05水平上差异显著。
-->Fig. 12Expression profiles of stress-responsive genes before and after drought stress
The different lowercase letters in each column indicate significant difference at the 0.05 probability level.
-->
3 讨论
BRs在调节植物生长发育和非生物胁迫的响应过程中发挥着重要的作用[1,2,3]。CYP90B1基因又称DWF4基因, 其编码的酶所催化的步骤是BRs整个生物合成途径的限速步骤[11]。已证实CYP90B1基因调控玉米和拟南芥的生长发育, 同时参与拟南芥、油菜等植物对非生物胁迫响应。但是关于玉米CYP90B1基因是否响应非生物胁迫、抵抗虫害胁迫的关系及其依赖的信号通路尚未明确。3.1 获得了更完整的ZmCYP90B1基因5′和3′端序列
本研究从玉米中克隆的ZmCYP90B1基因全长2058 bp, ORF区为1518 bp, 编码506个氨基酸。而申强[13]从玉米中克隆得到ZmCYP90B1基因, 基因片段全长为1634 bp, ORF区为1524 bp, 编码508个氨基酸。Liu等[23]克隆的ZmCYP90B1基因ORF区为1515 bp, 编码505个氨基酸。出现这种差异的原因归结为两点。一是选取的玉米自交系不同, 申强和Liu等选用的自交系分别是玉米自交系319和玉米自交系X178, 本研究选用的是玉米自交系LNH613。选材的不同可能导致不同品种的ORF区大小不一致。二是克隆基因使用的方法不同。申强和Liu等仅仅采用RT-PCR技术; 而本研究利用RT-PCR结合RACE技术, 更完整地获得了该基因的5°和3°端序列; 本次得到的全长基因比申强克隆的ZmCYP90B1 基因多出了5°非编码区126 bp碱基和3°非编码区298 bp碱基, 这为以后深入研究对该基因的转录调控作用奠定基础。系统进化分析表明玉米的ZmCYP90B1与来自稗草、水稻、山羊草、小麦等的单子叶植物的CYP90B1亲缘关系密切, 其次是拟南芥、油菜、大豆、可可、棉花等双子叶植物的CYP90B1, 而单、双子叶植物的CYP90B1蛋白分别聚在一起, 表明CYP90B1蛋白在单子叶作物和双子叶植物的进化上产生了明显差异。
3.2 ZmCYP90B1基因响应多种非生物胁迫并且过量表达该基因显著提高烟草抗旱性
CYP90B1基因在植物抵御非生物胁迫的过程中具有重要的作用[11,24]。但是该基因在玉米中的这一作用尚未明确。本研究发现低温、干旱、ABA和高盐均诱导该基因的表达变化, 尤其以PEG和高盐胁迫下的变化更为明显, 这和王阳等[25]发现拟南芥CYP90B1基因提高烟草植株抗旱和耐盐性的结果一致, 表明该基因可能在参与干旱和高盐的胁迫中起重要作用。玉米ZmCYP90B1基因应答非生物逆境随时间进程多呈双峰曲线, 即低-高-低-高等表达模式, 由此我们可以推测该基因编码的酶和催化合成的产物(油菜素内酯, BL)之间可能存在反馈调节的作用机制。当该基因在最初受到非生物胁迫时, 其表达量逐渐增加(由低到高), 对应的酶活力增强, 使得BL含量升高。然而, 当BL积累到一定程度, 开始负调控该基因的表达, 导致其表达量下降(低)。随着胁迫时间的延长, 植株受到非生物胁迫的影响严重, 体内的BL含量也随之减少, 对该基因的负调控作用减弱, 其表达量再次升高(高)。上述过程循环往复直至基因的转录水平和BL的含量达到动态平衡。这一推测还需要同时对二者进行量化检测来证实。
玉米ZmCYP90B1基因的非生物胁迫结果表明,该基因在干旱胁迫下表达量的改变最为显著, 为了进一步验证该基因的抗旱生理功能, 我们将该基因在烟草中过量表达, 通过检测干旱胁迫前后野生型和过量表达ZmCYP90B1基因烟草植株的生理指标和下游胁迫响应基因的表达变化, 深入探究该基因的作用机制。众所周知, 植物在遭受干旱胁迫的损伤中, 进化出复杂的抗氧化系统, 即SOD、CAT和POD等, 保护细胞免受氧化胁迫[26]。本研究发现, 干旱胁迫下的转基因烟草SOD、CAT和POD活性显著高于野生型, 这一结果同SOD、CAT和APX酶基因的显著上调结果相一致, 表明这3个酶活性的升高是ZmCYP90B1基因在转录水平上调控对应酶基因的表达量而实现的, 从而增强转基因烟草在干旱胁迫下的抗氧化能力。
为了深入揭示ZmCYP90B1基因提高烟草抗旱性的作用途径, 我们检测了干旱胁迫前后野生型和转基因烟草的ABA含量, 值得注意的是转基因烟草的ABA含量在干旱胁迫后虽有增加, 但并不显著, 这同调节ABA生物合成的关键酶基因NCED1的表达水平变化不明显的结果相符合, 表明ZmCYP90B1基因提高烟草抗旱性并不是通过依赖ABA的调节途径实现的, 而CYP90B1基因是BRs生物合成的关键酶基因, 推测ZmCYP90B1基因的过量表达, 提高了烟草的BRs生物合成量, 从而增加了植物的抗旱性。这与Divi等[24]的研究结果相符: ABA不参与BRs调控植物的抗逆性。
3.3 ZmCYP90B1基因响应虫害和茉莉酸甲酯的诱导表达
虫害诱导植物产生防御作用已在双子叶植物及其害虫相互作用的研究中证实[27,28], 同时证实茉莉酸信号途径在其中起信息传递作用[29]。但在单子叶植物玉米中是否具有相似的调控模式尚未明确。而且BRs对植物防御物质的诱导作用是否与茉莉酸信号途径有关还需要证实。本研究通过荧光定量PCR分析表明, 受虫害诱导表达的BRs生物合成关键酶基因ZmCYP90B1同时受MeJA的诱导, 并首次揭示了内源BRs生物合成关键酶基因参与植物对虫害的响应, 可为研究内源BRs抵御虫害这一新功能和MeJA诱导虫害应答的分子机理奠定基础。4 结论
本研究从玉米中克隆了油菜素甾醇生物合成关键基因ZmCYP90B1, 并对其序列进行了生物信息学分析。序列比对表明, ZmCYP90B1在单双子叶植物中进化上具有明显差异。该基因响应多种非生物胁迫, 参与植物对虫害和茉莉酸甲酯的响应。过量表达ZmCYP90B1基因烟草株系的抗旱性增强, 叶片失水率下降, SPAD值增大, SOD、CAT和POD的活性以及游离Pro的积累量均显著高于野生型, MDA和ABA含量明显低于野生型。结合下游胁迫响应基因的差异表达, 表明ZmCYP90B1提高植物抗旱性可能不依赖ABA途径, 而与其对抗氧化途径相关基因的转录调控有关。The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | . |
| [2] | . |
| [3] | . |
| [4] | . |
| [5] | . |
| [6] | . |
| [7] | . |
| [8] | . |
| [9] | . |
| [10] | . . |
| [11] | . |
| [12] | . |
| [13] | . . |
| [14] | . |
| [15] | . . |
| [16] | . |
| [17] | . |
| [18] | . . |
| [19] | . |
| [20] | . |
| [21] | . |
| [22] | |
| [23] | . |
| [24] | . |
| [25] | |
| [26] | . |
| [27] | . |
| [28] | . |
| [29] | . |
