 ,2,*, 于荣
,2,*, 于荣 ,1,*
,1,*Cloning and functional analysis of ZmGRAS31 gene in maize
YIN Long-Fei1,2, WANG Zhao-Yang1, WU Zhong-Yi2, ZHANG Zhong-Bao ,2,*, YU Rong
,2,*, YU Rong ,1,*
,1,*通讯作者:
收稿日期:2018-11-7接受日期:2019-01-19网络出版日期:2019-03-22
| 基金资助: |
Received:2018-11-7Accepted:2019-01-19Online:2019-03-22
| Fund supported: |
作者简介 About authors
E-mail:18810259769@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (3369KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
殷龙飞, 王朝阳, 吴忠义, 张中保, 于荣. 玉米ZmGRAS31基因的克隆及功能研究[J]. 作物学报, 2019, 45(7): 1029-1037. doi:10.3724/SP.J.1006.2019.83070
YIN Long-Fei, WANG Zhao-Yang, WU Zhong-Yi, ZHANG Zhong-Bao, YU Rong.
玉米(Zea mays L.)不仅是重要的粮食和饲料作物, 也是重要的食品工业原料和能源植物[1]。玉米起源于南美洲高温多湿的热带地区, 喜高温、需水较多、耐旱性不强, 对盐胁迫中度敏感, 耐盐性较差[2]。土壤干旱、盐碱化严重影响玉米产量, 随着生态环境的破坏, 如何提高玉米对干旱、高盐等不利因素的抵抗能力越来越受到重视。
转录因子(transcription factor, TF)又称为反式作用因子, 在真核生物细胞中能够结合到靶基因启动子区域激活或抑制其转录表达, 从而实现对靶基因的转录调控[3]。近年来, 研究人员陆续从高等植物体内分离出一些与干旱、高盐碱、低温胁迫以及激素和生长发育相关的转录因子; 主要可分为MYB (V-myb avian myeloblastosis viral oncogene homolog)[4,5,6]、Bzip (Basicreg ion/leuci nezipper)[7,8,9]、CBF/DREB (C-repeat binding factor/dehydration responsive element binding protein)[10,11,12]、NAC (NAM, ATAF1/2, CUC1/2)[13,14,15]、WRKY[16,17]、HD-START (homeodomain-StAR-related lipid transfer)[18]、GRAS (GAI, RGA, SCR)[19,20]等几大类。转录因子通过调控下游逆境应答相关基因的表达从而改善植物非生物胁迫抵抗能力; 因此, 转录因子在抗逆研究中起非常重要的作用。
GRAS家族是近年来在高等植物体内发现的一类转录因子, 广泛存在于植物体内。典型的GRAS蛋白由400~700个氨基酸组成, 高度保守的羧基端含有核心基序VHIID, 存在于所有家族成员中。模式植物拟南芥和水稻GRAS家族成员可分为8个亚族即SCL3 (scarecrow-like 3)、LISCL (SCL9被重命名为LISCL)、SHR (short-root)、PAT1 (phytochrome a signal transduction 1)、DELLA、SCR (scarecrow)、LS (lateral suppressor)和HAM (hairy meristem)[20]。GRAS家族成员功能多样, 调控许多重要的生长发育过程。植物转录因子的研究热点主要集中在抗逆胁迫、信号转导、生长发育、根瘤和菌根的形成等方面。其中, HAM亚家族主要维持茎尖分生组织处于未分化状态; 在矮牵牛ham突变体中, 茎尖分生组织不能保持其未分化的特征[21]。PhHAM 非细胞自主性(non-cell-autonomously)功能来源于侧向器官原基(lateral organ primordial)和茎原维管组织(stem provascular tissue)的L3细胞, 该功能对茎尖分生组织的维持非常重要[22]。但是, 关于HAM亚家族基因在玉米逆境胁迫应答中所起的作用还未见报道, 本研究克隆了玉米HAM亚家族成员ZmGRAS31基因, 研究了该基因的表达模式、亚细胞定位和在高盐、脱水、低温、干旱等胁迫处理下的表达情况; 以及盐、甘露醇处理下对过表达该基因拟南芥根长的影响, 旨在深入了解GRAS蛋白家族的生理功能, 为农作物抵御干旱, 增加产量提供可靠的理论依据。
1 材料与方法
1.1 植物材料及试剂
温室中种植玉米骨干自交系B73, 生长到三叶一心时期进行不同逆境处理; 黑暗条件下种植玉米骨干自交系郑58, 取黄化苗胚芽鞘提取原生质体进行基因亚细胞定位。农杆菌GV3101为本实验室保存, 大肠杆菌Trans1T1 (货号M2650817)、pEASY T5 Zero Clone载体(货号M20801)、RNA提取试剂盒(货号M30902)、逆转录试剂盒(M30919)等均购于北京全式金生物技术有限公司, ExTaq (货号AI12716A)、LA Taq (货号AI10495A)、SYBR Premix ExTaq II (Tli RNaseH Plus)(AI40782A)等购于宝生物工程(大连)有限公司, Nar I (货号R0191L)、Age I (货号R0552L)内切酶购于NEB (北京)公司, EcoR I (1040B)、Kpn I (1068B)内切酶购于宝生物工程(大连)有限公司; 低温台式离心机(型号MUITLFUGE X1R)购于赛默飞公司, 低温台式水平离心机(型号SC-3612)购于中佳公司; PCR仪(型号T100 Thermal Cycler)购于伯乐公司; 应用Image J统计分析拟南芥根长。1.2 玉米总RNA的提取及ZmGRAS31 cDNA的克隆
按照全式金Transzol Up Plus RNA Kit试剂盒的说明提取玉米根组织的总RNA, 逆转录得到cDNA模板。设计引物pZmGRAS31-F、pZmGRAS31-R, 以逆转录的cDNA为模板进行PCR扩增, 反应程序为94°C预变性60 s; 98°C 10 s, 68°C 120 s, 30个循环; 72°C 延伸10 min, 获得ZmGRAS31全长。PCR产物经胶回收后连接至T5 Zero载体, 获得单克隆后送上海生工生物工程技术服务有限公司进行菌落测序。各引物序列见表1。Table 1
表1
表1本实验中所用的引物
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) |
|---|---|
| pZmGRAS31-F | AAAGCCGATGGAGACCATTTCAT |
| pZmGRAS31-R | CTTTCATACAGGAGTCCAAGCA |
| pZmGRAS31SL-F | CATATCGAATTCATGGAGACCATTTCATATCC |
| pZmGRAS31SL-R | CCTAGCGGTACCTACAGGAGTCCAAGCAGATAT |
| pZmGRAS31RT-F | CTTCGACACCATTGCTATTGG |
| pZmGRAS31RT-R | CTTGAATCTCCAGCCTCAAC |
| pGAPDHRT-F | CCCTTCATCACCACGGACTAC |
| pGAPDHRT-R | AACCTTCTTGGCACCACCCT |
| pZmGRAS31At-F | CCTATCGGCGCCATGGAGACCATTTCATATCC |
| pZmGRAS31At-R | CCTAGCACCGGTTCATACAGGAGTCCAAGCAG |
新窗口打开|下载CSV
1.3 玉米ZmGRAS31基因的亚细胞定位
1.3.1 植物表达载体pYBA1132:ZmGRAS31:EGFP的构建 使用引物pZmGRAS31SL-F、pZmGRAS31SL-R扩增获得ZmGRAS31基因含有酶切位点的编码区, PCR产物经EcoR I、Kpn I双酶切连接至PYBA1132表达载体上获得重组载体。将重组载体转化大肠杆菌(Trans1T1)后, 挑取阳性克隆测序验证。1.3.2 玉米原生质体的提取及转化 以玉米自交系郑58黄化苗胚芽鞘为材料, 依据Yoo的方法[23]提取原生质体并转化。配制母液: 0.8 mol L-1甘露醇、0.2 mol L-1 MES-KOH (pH 5.7)、1 mol L-1 KCl、1 mol L-1 CaCl2、1 mol L-1 NaCl、1 mol L-1 MgCl2、0.1 mg mL-1 BAS。使用新鲜酶溶液及PEG-Ca2+(40%, v/v)溶液, WI (0.5 mol L-1甘露醇、4 mol L-1 MES-KOH、20 mmol L-1 KCl )、W5 (154 mmol L-1 NaCl、125 mol L-1 CaCl2、5 mmol L-1 KCl、2 mmol L-1 MES, pH 5.7)、MMG (0.4 mol L-1甘露醇、4 mmol L-1 MES, pH 5.7)溶液均由母液与ddH2O按说明配制。转化后的原生质体室温黑暗孵育16 h加入0.1% Tween 20, 轻轻混匀后再加入终浓度为5 μmol L-1的DAPI (4,6- diamidino-2-phenylindole)染色5 min, 经PBS缓冲液洗涤后于激光共聚焦显微镜(zeiss 780)下观看荧光情况。
1.4 玉米ZmGRAS31基因的抗逆表达及组织差异表达——qPCR分析
挑选饱满的自交系B73种子种植于温室花盆中, 分别设置对照组、脱水处理组、盐(200 mmol L-1 NaCl)处理组、冷(4℃)处理组、干旱处理组, 每组6盆, 每盆2颗, 各设3个生物学重复。玉米幼苗正常生长至三叶一心时期分别进行脱水、高盐、冷、干旱处理, 取脱水、高盐、冷处理0 h、1 h、2 h、5 h、10 h、24 h后的地上部和根, -80℃冻存。干旱组取处理0 d、3 d、7 d、12 d后的地上部和根, -80℃冻存。取组织差异表达材料幼苗的根、叶以及抽雄期的根、茎、叶、雄穗、花丝、幼胚, -80℃冻存。按照试剂盒的说明提取地上部及根RNA, 逆转录后作为qPCR模板。设计特异引物pZmGRAS31RT- F、pZmGRAS31RT-R及内参基因GAPDH特异引物pGAPDHRT-F、pGAPDHRT-R。应用ABI Step One Plus Real-time PCR System进行实时荧光扩增。反应体系10 μL 2×SYBR Premix Ex Taq、0.4 μL GSP (10 μmol L-1)、1 μL cDNA模板、0.4 μL ROX、7.8 μL ddH2O。PCR条件为95℃ 30 s; 95℃ 5 s, 60℃ 34 s, 共40个循环; 融解曲线分析的Step 1: 95℃ 15 s; Step 2: 60℃ 1 min; Step 3: 95℃ 15 s。每组实验设3个生物学样本, 每个生物学样本设3个技术重复, 数据为3个生物学重复平均值±标准误。应用2-??CT方法分析ZmGRAS31在各组织中的相对表达情况[24]。逆境处理实验分别以0 h幼苗的根和地上部中的表达量计为1, 组织差异表达实验中以抽雄期的根组织中的表达量计为1。
1.5 植物过表达载体p4301:ZmGRAS31的构建及拟南芥遗传转化
1.5.1 过表达载体构建 设计引物pZmGRAS31At-F、pZmGRAS31At-R扩增ZmGRAS31的编码区片段。PCR产物经Nar I、Age I酶切消化后连接到TOPO载体上, 产物转化大肠杆菌Trans110 (非甲基化), 经含有壮观霉素抗性固体培养基筛选后, 挑取阳性克隆进行菌体PCR检验及酶切验证, 并送测序。1.5.2 Gateway目的载体(Destination Vector)的构建
按Invitrogen Gateway LR Clonase II Enzyme Mix试剂盒说明, 将TOPO载体上目的基因转移到含有att R1、att R2重组位点的pCAMBIA4301载体上, 构建pCAMBIA4301:ZmGRAS31重组质粒。
1.5.3 转化农杆菌GV3101及侵染拟南芥 将pCAMBIA4301:ZmGRAS31重组质粒转入农杆菌GV3101, 筛选鉴定后通过浸花法侵染拟南芥[25]。单株收取T0代种子, 经卡那霉素抗性筛选后获得T1代转基因拟南芥。提取T1代幼苗叶片基因组DNA为模板进行PCR检测, 扩增引物为pZmGRAS31-F、pZmGRAS31-R, 产物连到T载体后送测序验证。单株收获阳性植株种子并加代获得T3代纯合植株。
1.5.4 转基因拟南芥种子逆境处理 利用含NaCl、甘露醇的1/2 MS培养基对转基因拟南芥分别模拟盐、干旱胁迫。配制梯度浓度的1/2 MS培养基。NaCl浓度梯度为0 mol L-1、0.1 mol L-1、0.15 mol L-1、0.20 mol L-1, 甘露醇浓度梯度为0 mol L-1、0.15 mol L-1、0.30 mmol L-1、0.45 mol L-1, 调pH 5.8。将1/2 MS固体培养基上生长7 d的转基因和野生型拟南芥幼苗(根长相同), 分别移栽到含不同浓度NaCl、甘露醇的1/2 MS固体培养基上。培养基分为两部分, 野生型和转基因拟南芥各移3株, 设3个重复, 垂直放置于恒温培养箱中培养, 7 d后统计根长, 重复3次实验。
2 结果与分析
2.1 玉米转录因子ZmGRAS31基因序列扩增
ZmGRAS31基因编码序列全长1422 bp, 编码473个氨基酸。通过保守结构域分析发现, ZmGRAS31蛋白包含GRAS保守结构域(https:// www.ncbi.nlm.nih.gov/Structure/cdd/docs/cdd_search.html)(图1)。生物信息学分析表明该蛋白分子量为51,700.38 Da, 理论等电点为4.73; 不具跨膜结构, 亲水性较差, ZmGRAS31蛋白二级结构以α螺旋为主(50.32%)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1玉米ZmGRAS31基因保守结构域预测
Fig. 1Conservative domain prediction of maize ZmGRAS31 gene
2.2 玉米原生质体中的亚细胞定位
构建瞬时表达载体pYBA1132:ZmGRAS31: EGFP并转化玉米原生质体, 通过EGFP (Enhanced green fluorescent protein)融合蛋白的荧光显示目的蛋白的亚细胞定位。原生质体经DAPI染色后于激光共聚焦扫描显微镜下观察发现, 带有目的基因ZmGRAS31的GFP融合蛋白绿色荧光只分布在细胞核, 并且与核特异染料DAPI的蓝色荧光完全重合(图2), 表明ZmGRAS31是一个核蛋白。图2
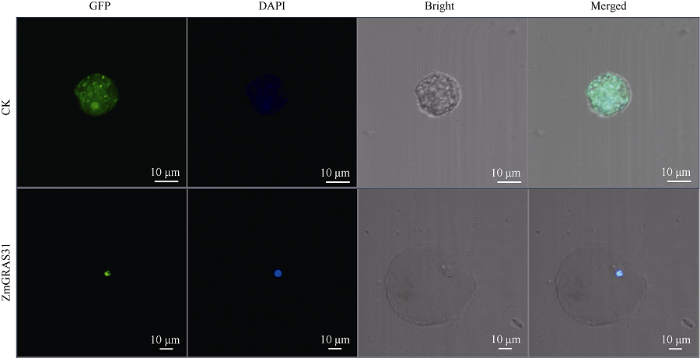 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2玉米ZmGRAS31蛋白在原生质体中的亚细胞定位
GFP: GFP标记的ZmGRAS31基因在玉米原生质体的亚细胞定位; DAPI: DAPI标记的原生质体细胞核; Bright: 同一视野光镜下的原生质体; Merged: 光镜及荧光照片的叠加; CK: 转入空载体的原生质体; ZmGRAS31: 转入目的载体的原生质体。Bar=10 μm。
Fig. 2Subcellular localization of ZmGRAS31 in protoplasts
GFP: subcellular localization of the GFP-ZmGRAS31 fusion protein in maize protoplast; DAPI: DAPI-labeled protoplast nucleus; Bright: protoplast under the same field; Merged: merge of GFP, DAPI, and bright; CK: protoplast with empty vector; ZmGRAS31: protoplast with destination vector. Bar=10 μm.
2.3 玉米ZmGRAS31基因在不同组织中的表达情况
分别提取幼苗的根、叶及抽雄期的根、茎、叶、雄穗、花丝、幼胚组织总RNA, 逆转录获得cDNA后进行qPCR分析表明, ZmGRAS31在不同组织中表达差异较大, 以抽雄期根中的表达量为标准进行比较, 幼根中的表达量最高, 约为成熟根中表达量的17.7倍; 其次是雄穗表达量约为1.6倍; 其他组织的表达量均低于成熟根中, 花丝中的表达量最低(图3)。由此推测ZmGRAS31可能在幼根生长及雄配子形成过程中发挥重要作用。图3
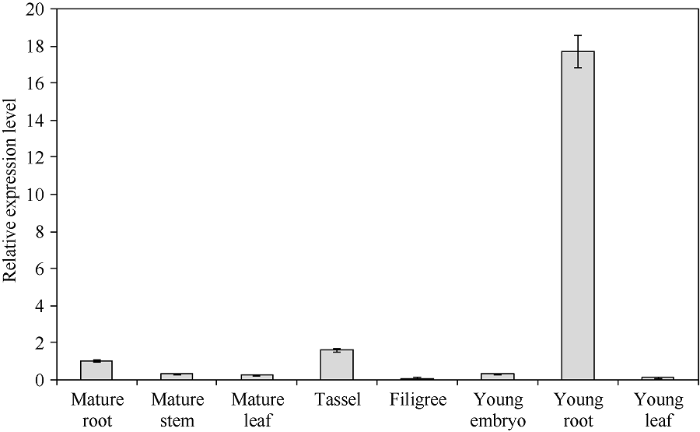 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3ZmGRAS31在玉米不同组织中的相对表达量
Fig. 3Relative expression of ZmGRAS31 in different maize tissues
2.4 不同逆境处理对玉米幼苗ZmGRAS31基因表达的影响
应用2-??CT方法分析各处理下ZmGRAS31的表达情况。脱水处理下, 地上部ZmGRAS31的表达量在5 h内逐渐上调达到峰值, 约为对照的18.7倍, 至24 h表达量约为对照的2.4倍; 根中ZmGRAS31的表达量也是逐步上调并在5 h时到达峰值, 约为对照的7.5倍, 到24 h时约下调至对照水平(0.78倍)(图4-A)。低温处理下, 如图4-B所示, 地上部的表达量先上调然后回落随后又上调, 并在5 h时达到峰值, 约为对照的6.6倍; 5 h后下调明显, 至24 h时约为对照的0.3倍; 根中迅速上调至对照4.0倍左右并维持到5 h, 到24 h时下调至对照0.2倍左右。盐处理下, 地上部迅速上调, 1 h时达到峰值, 约为对照2.5倍, 随后下调至对照0.5倍左右。根中逐渐上调并在5 h时达到峰值, 约为对照1.8倍, 到24 h时下调至对照0.45倍左右(图4-C)。干旱处理下, 地上部分在3 d内呈上调趋势, 3 d时达到峰值, 约为对照11倍, 随后下调至12 d时, ZmGRAS31的表达量约为对照2.5倍; 根中也是在3 d时达到峰值, 约为对照16倍, 随后下调, 至12 d时约为对照0.5倍(图4-D)。图4
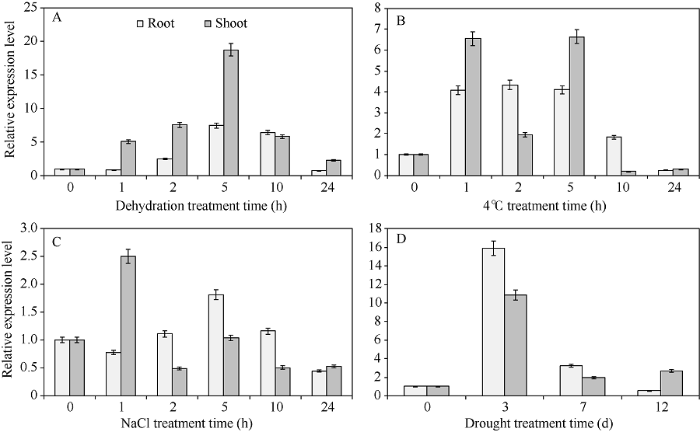 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4实时荧光定量PCR分析不同处理条件下ZmGRAS31基因在地上部和根中的表达情况
A: 脱水处理; B: 低温(4°C)处理; C: 高盐(200 mmol L-1 NaCl); D: 干旱处理。数据为3个生物学重复±标准差。
Fig. 4Real-time quantitative PCR analysis of expression level of ZmGRAS31 gene under different treatments in shoots and roots
A: dehydration treatment; B: cold (4°C) treatment; C: high salt (200 mmol L-1 NaCl) treatment; D: drought treatment. The error bar represents ± SD of triplicate experiments 2.5 转ZmGRAS31基因拟南芥的耐盐性分析
提取具卡那霉素抗性转基因拟南芥叶片DNA进行PCR检测, 鉴定有5株转基因拟南芥含有目的基因, qPCR检测转基因拟南芥株系中ZmGRAS31基因的表达水平, 选取表达量最高的两株系进行转基因拟南芥耐盐、耐甘露醇实验(结果未展示)。0 mol L-1 NaCl浓度时野生型和转基因拟南芥均能正常生长(图5-A), 当NaCl浓度为0.10 mol L-1时, 野生型和转基因拟南芥均能正常生长, 转基因拟南芥主根比野生型长, 差异显著(P<0.05)(图5-B)。当NaCl浓度为0.15 mol L-1时, 野生型和转基因拟南芥均不能正常生长, 整体表现为株型偏小, 叶片发黄, 无或很少侧根但转基因拟南芥的主根比野生型长, 差异显著(P<0.05)(图5-C)。当NaCl浓度升为0.20 mol L-1时, 野生型和转基因拟南芥均不能正常生长, 叶片发黄枯死, 主根不生长, 无侧根(图5-D)。统计分析野生型和转基因拟南芥根长(图5-E)。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5不同盐浓度下转基因拟南芥根长比较
A~D分别为0 mol L-1、0.10 mol L-1、0.15 mol L-1、0.20 mol L-1 NaCl处理的生长情况; E: 不同盐浓度下拟南芥平均主根长度; WT: 野生型拟南芥; OE: 过表达拟南芥。Bar = 1.5 cm。
Fig. 5Root length of transgenic Arabidopsis thaliana under gradient NaCl concentrations
A-D was seedling growth under the NaCl concentrations of 0 mol L-1, 0.10 mol L-1, 0.15 mol L-1, and 0.20 mol L-1; E: the average main root length of Arabidopsis at different NaCl concentrations. WT: wild type; OE: overexpression Arabidopsis thaliana. Bar = 1.5 cm.
2.6 转ZmGRAS31基因拟南芥的耐甘露醇分析
0 mol L-1甘露醇浓度时野生型和转基因拟南芥均能生长(图6-A), 当甘露醇浓度为0.15 mol L-1时, 野生型和转基因拟南芥均能正常生长, 根长没有明显差异, 植株均偏小, 侧根较少(图6-B)。当甘露醇浓度为0.30 mol L-1时, 野生型和转基因拟南芥长势较弱, 转基因拟南芥主根比野生型长, 差异不明显但叶片较黄(图6-C)。当甘露醇浓度为0.45 mol L-1时, 两种拟南芥均不能生长, 植株细小, 叶片均发黄(图6-D)。统计分析野生型和转基因拟南芥根长(图6-E)。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6不同甘露醇浓度下转基因拟南芥根长比较
A~D分别为0 mol L-1、0.15 mol L-1、0.30 mol L-1、0.45 mol L-1甘露醇处理的生长情况; E: 不同甘露醇浓度下拟南芥平均主根长度, WT: 野生型拟南芥; OE: 过表达拟南芥。Bar=1.5 cm。
Fig. 6Root length of transgenic Arabidopsis thaliana under gradient mannitol concentrations
A-D was seedling growth under the mannitol concentrations of 0 mol L-1, 0.15 mol L-1, 0.30 mol L-1, and 0.40 mol L-1; E: the average main root length of Arabidopsis at different mannitol concentrations. WT: wild type; OE: overexpression Arabidopsis thaliana. Bar = 1.5 cm.
3 讨论
转录因子是能与真核基因顺式作用元件相互作用的DNA结合蛋白, 起激活或者抑制转录的作用。GRAS家族是植物所特有的一类转录因子, 得名于最先发现的GAI (gibberellic acid insensitive)、RGA (repressor of GA1-3 mutant) 和SCR (scarecrow)[19]三个成员; 可分为八个亚族。GRAS家族成员众多, 功能各异, 参与调控许多重要的生理途径; 然而玉米中只有D8[26]、D9[27]、SCR[28] 等少数几个成员被报道。本研究克隆了玉米ZmGRAS31基因的cDNA序列, ZmGRAS31蛋白被定位于细胞核, 具有GRAS转录因子家族特有的保守结构域。近年来, 越来越多的研究关注GRAS家族在响应植物胁迫中的作用。Tanabe等[29]发现水稻OsCIGR2基因可以通过调控OsHsf23的表达来抑制病原菌侵染水稻后的死亡率, 提高了水稻对病原菌的抗性。李丽丽等[30]研究表明独行菜LaSCL18基因在低温胁迫下表达量显著升高, 推测该基因与独行菜幼苗耐低温有关。郭华军等[31]利用基因组学和生物信息学分析了拟南芥GRAS家族响应渗透和干旱胁迫的表达模式。马洪双等[32]将胡杨PeSCL7基因转入拟南芥, 显著提高了转基因拟南芥的抗旱和抗盐能力。张焕欣等[33]利用生物信息学手段对辣椒GRAS家族基因进行系统鉴定和进化分析, 发现多数辣椒GRAS基因能响应PEG-6000和盐胁迫。郭鹏等[34]发现转玉米ZmSCL7基因的烟草内叶绿素含量和光合效率均有较大提高, 增强了转基因植株的抗盐能力。李慧聪等[35]发现玉米ZmHSF-Like基因通过 H2O2信号途径实现对42oC热激和ABA胁迫的响应。
本研究表明该基因在不同时期的多种组织中均有表达, 其中以幼根的表达量最高, 其次是雄穗, 因此推测ZmGRAS31可能参与幼根生长和下胚轴伸长, 而在成熟植株雄穗内可能调控雄配子的形成。同时, ZmGRAS31在脱水、低温、高盐、干旱等逆境处理中的表达量均有不同程度上调, 最高分别能达到对照的18.7、6.6、2.5、15.9倍, 推测ZmGRAS31参与植株体内抗旱、抗寒及抗盐等逆境胁迫应答。盐处理下转基因拟南芥的主根比野生型长, 差异显著; 而在甘露醇模拟干旱处理实验中转基因拟南芥与野生型无显著差异。进一步探索ZmGRAS31基因抗逆机制发现, ZmGRAS31转录起始密码子上游2 kb的DNA序列有多个与逆境胁迫、光反应等功能相关的顺式作用元件。如ABRE、C-repeat/DRE、G-box、MBS、HSE、TC-rich repeats, 它们分别响应ABA、冷/脱水、光、干旱、热、防御和应激反应。其中ABRE、MBS分别是与ABA、MYB蛋白相关的顺式作用元件, 而ABA和MYB类转录因子参与调控植物的多种耐盐、耐旱过程[36,37,38]。在MaizeGDB (https://www.maizegdb.org/)中查询结果表明, ZmGRAS31位于第4染色体210 Mbp~220 Mbp之间并且目前还没有相关的QTL数据。Tuberosa[39]等用Lo964× Lo1016群体研究发现, 在第4染色体的umc66A- umc156A区段定位到水分胁迫下产量和主胚根长的QTL。潘清春利用478 X Wu312 重组自交系群体研究发现, 在第5和第6染色体上存在根系与产量性状QTLs连锁, 并且在第5染色体的bnlg1879- umc1447区段, 定位到了低氮下最大根长和产量的位点[40]。ZmGRAS31作为一个转录因子, 其表达产物可能会与玉米根长或抗旱相关的QTL结合, 调控玉米的根系发育进而影响产量。
4 结论
玉米HAM亚族转录因子基因ZmGRAS31的cDNA全长1422 bp, 编码473个氨基酸, 其编码蛋白定位于细胞核。正常生长情况下, 该基因在多个玉米组织器官中表达, 其中在幼根中的表达量最高; 该基因响应脱水、高盐、低温等逆境胁迫并呈现不同的表达模式; 转基因拟南芥根长在含0.10 mol L-1、0.15 mol L-1 NaCl的1/2 MS培养基上与野生型有显著差异; 而在含梯度浓度甘露醇的1/2 MS培养基上与野生型无明显差异。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1002/embj.1991.10.issue-7URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s00438-008-0386-6URL [本文引用: 1]
DOI:10.1104/pp.107.114041URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1186/gb-2004-5-6-r41URL [本文引用: 1]
[本文引用: 2]
DOI:10.4161/psb.4.8.9176URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1006/meth.2001.1262URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/pcp/pcq153URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1093/jxb/erq151URL [本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.15.00298URL [本文引用: 1]
DOI:10.1023/A:1014897607670URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
