 ,1,2,3,*, 段美娟
,1,2,3,*, 段美娟 ,1,*
,1,*Genetic analysis and fine mapping of white stripe leaf mutant wsl1 in rice
MO Yi1,2,**, SUN Zhi-Zhong2,**, DING Jia2, YU Dong2, SUN Xue-Wu2, SHENG Xia-Bing2, TAN Yan-Ning2, YUAN Gui-Long2, YUAN Ding-Yang ,1,2,3,*, DUAN Mei-Juan
,1,2,3,*, DUAN Mei-Juan ,1,*
,1,*通讯作者:
第一联系人:
收稿日期:2018-11-8接受日期:2019-01-19网络出版日期:2019-03-01
| 基金资助: |
Received:2018-11-8Accepted:2019-01-19Online:2019-03-01
| Fund supported: |
作者简介 About authors
莫祎,E-mail:759447001@qq.com。
孙志忠,E-mail:szznihaoa@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (4658KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
莫祎, 孙志忠, 丁佳, 余东, 孙学武, 盛夏冰, 谭炎宁, 袁贵龙, 袁定阳, 段美娟. 水稻白条纹叶突变体wsl1的遗传分析及基因精细定位[J]. 作物学报, 2019, 45(7): 1050-1058. doi:10.3724/SP.J.1006.2019.82054
MO Yi, SUN Zhi-Zhong, DING Jia, YU Dong, SUN Xue-Wu, SHENG Xia-Bing, TAN Yan-Ning, YUAN Gui-Long, YUAN Ding-Yang, DUAN Mei-Juan.
植物通过叶绿体进行光合作用、合成有机物并贮藏能量, 实现了光能到化学能的转换[1]。叶绿体发育缺陷、叶绿素代谢紊乱都有可能影响植物光合作用效率, 导致叶色突变。叶色突变体不仅可以作为作物育种的筛选标记, 也有利于光合作用、叶绿素的新陈代谢和叶绿体的发育等代谢过程的研究, 具有重要的理论和应用价值[2]。
水稻白化(albino)现象是常见的突变类型, 严重影响了叶片的光合效率, 造成植物的减产甚至死亡。水稻白化突变体可以分成白化型、条纹叶型和斑点型3种[3]。Nagamatsu等[4]在1962年首次发现了白条纹突变体, 此类突变体一般由核基因或质体基因突变引起, 是研究核质互作模式的理想材料[5]。近年来, 鉴定了越来越多的水稻白条纹叶突变体, 并对其分子机制进行了深入研究[6]。ST13位于第3染色体上, 突变体st13在苗期表现为叶片白条纹, 分蘖期转绿, 影响植株的株高、穗长、产量等重要农艺性状。在st13突变体中rbcL (核酮糖-1,5-二磷酸羧化酶)、ndhB (NADH脱氢酶第2亚基)和ndhD (NADH脱氢酶第4亚基)等基因表达量均下调, 叶绿体内能量代谢失衡, 叶绿体发育受损, 色素含量降低[7]。wp(t)突变体在成熟后的植株基部有少数叶片的中脉出现白色条斑, 成熟植株抽出的穗呈白色, 推测WP(T)基因可能参与调节叶绿体发育过程[8]。GWS是白条纹叶基因 ST1的等位基因, 是一个低温敏感型条纹叶突变体。基因组序列分析发现, gws突变体在核糖核苷二磷酸还原酶小亚基编码区第314~315碱基缺失, 第316~317碱基由GC变为TT, 导致该基因阅读框移码突变, 蛋白质翻译提前终止, 编码一个核糖核苷酸还原酶小亚基[9]。OsPDS (八氢番茄红素脱氢酶)、OsZDS (ζ-胡萝卜素脱氢酶)、OsCRTISO (胡萝卜素异构酶)、β-OsLCY (番茄红素β-羟化酶)这4个酶都参与类胡萝卜素前体-ABA的合成, 任何一个突变均可能导致突变体中ABA含量下降, 引起穗萌和白化[10]。李娜等[11]将白色中脉基因OWSM定位在第4染色体CH413和CH415之间约122 kb范围内, oswm突变性状主要表现为叶的近轴面中脉白化, 远轴面及其他部位正常。由电镜结果表明oswm叶片位于白色中脉部位的叶绿体不能正常发育, 但其他性状并没有明显异常。突变体wfsl1的白条纹表型出现在分蘖期, 是因为在蛋白编码区域的一个碱基由A突变为T, 并且在N端编码一个与HD结构域相关的金属依赖磷酸水解酶。导致突变体wfsl1的叶绿体结构异常, 性状比野生型的叶绿体小, 内囊体结构受损, 减弱了光合效率, 从而降低水稻的结实率和千粒重[12]。OsCAO1和OsCAO2是2个同源基因, 编码叶绿素a氧合酶, 该酶能催化叶绿素a转换为叶绿素b, 导致突变体出现淡绿叶的表型[13]。突变体val1显现了淡绿条纹窄叶的表型, 在突变体中叶绿体发育受阻, 色素含量降低, 细胞分裂受损, 是因为VAL1编码磷酸核糖胺甘氨酸连接酶, 是嘌呤合成途径的第2种酶, 亚细胞定位表明VAL蛋白在叶绿体表达。VAL1是嘌呤合成途径中有关键作用的酶, 能够调节水稻叶片发育期间的叶绿体发育、叶绿素代谢以及细胞分裂[14]。因此叶绿素代谢和叶绿体发育相关的基因突变会导致突变体植株出现不正常的叶色表型。
由于白条纹叶形成机制复杂, 需要更多的突变体研究才能全面理解其分子机制。本研究考查白条纹叶突变体wsl1的株高、穗粒数等相关农艺的性状变化, 测量wsl1叶绿素含量, 电镜观察突变体的叶绿体及叶脉结构, 并开展WSL1基因的遗传分析和精细定位, 为进一步克隆WSL1奠定了基础。
1 材料与方法
1.1 供试材料
水稻白条纹叶突变体wsl1来源于粳稻日本晴与籼稻R1128构建的重组自交系群体, 世代为F10。2017年在湖南杂交水稻研究中心试验田种植白条纹突变体wsl1和亲本。5月10日播种, 四叶期移栽, 单本栽插, 移栽密度20 cm × 20 cm。突变体和野生型均设3次重复, 每重复40株, 待植株成熟后, 选择亲本和突变体中长势一致的单株各10株, 考察株高、有效穗数、穗粒数、结实率、千粒重等主要农艺性状, 用Microsoft Excel软件整理数据, 利用统计软件SPSS进行t测验分析。1.2 叶绿素和类胡萝卜素含量的测定
在分蘖期选取突变体wsl1和亲本R1128各5株, 3次重复, 测定植株叶片的叶绿素和类胡萝卜素含量。从主茎的最上部叶、倒二叶和倒三叶上混合取0.2 g叶片, 剪碎浸泡在15 mL 80%丙酮溶液中, 于4℃避光浸提48 h, 中间振荡数次, 最后定容至 25 mL。用紫外分光光度计(UV-1700)测定提取液在663 nm、643 nm和470 nm 波长下的吸光值。按照Arnon的方法计算叶片中总叶绿素(Chl, chlorophyll)、叶绿素a (Chl a)、叶绿素b (Chl b)和类胡萝卜素(Caro)的含量。Chl a含量(mg g-1) = (12.72 OD663-2.59 OD645) V/1000W;
Chl b含量(mg g-1) = (22.88 OD645-4.67 OD663) V/1000W;
Caro含量(mg g-1) = (1000 OD470-3.27 Chl a-104 Chl b)V/(1000W*229);
Chl含量(mg g-1) = Chl a+Chl b = (20.29 OD645+ 8.05 OD663) V/l000W
式中, OD指测定波长下的吸光值; V指叶绿素提取液总体积(mL); W指材料鲜重(g)。
1.3 叶绿体电镜样品的制备与观察
取5周龄的植株, 分别取突变体的全白部位、绿转白部位、全绿部位及亲本R1128的相应部位的叶片, 用电镜观察突变体和野生型叶片的细胞结构。以戊二醛和锇酸双重固定后, 利用不同梯度的乙醇逐级脱水, 再置换和包埋, 制超薄切片, 以醋酸双氧铀和柠檬酸铅液双重染色, 用Hitachi公司的H-7650透射电镜观察和照相。1.4 叶片横切面样品的制备与观察
分别取亲本R1128及突变体wsl1的5周龄植株叶片, 用显微镜观察横切面结构。以戊二醛和锇酸双重固定后, 利用不同梯度的乙醇逐级脱水, 再置换和包埋, 制半薄切片, 以甲苯胺蓝作为染色剂染色, 用显微镜观察和照相。1.5 wsl1的遗传分析
2016年长沙正季, 将突变体wsl1分别与野生型R1128、日本晴正反交得到F1, 其中R1128/wsl1、wsl1/日本晴2个组合同年冬季在海南三亚加代获得F2。2017年在湖南杂交水稻研究中心试验基地同时种植F1、F2, 5月10日播种, 5月30日移栽。当植株长至五至六叶期, 观察各植株的叶色, 同时统计2个组合 F2 群体中突变表型和正常表型的植株数, 计算分离比, 并进行χ2测验, 推断wsl1的遗传模式。1.6 基因定位及候选基因分析
利用水稻公共数据库中的SSR引物, 对定位亲本日本晴和wsl1进行多态性筛选; 分别选取F2定位群体的10株正常和突变株构建基因池, 利用BSA法(集团分离分析法)筛选目标基因连锁标记[15], 初步确定所在染色体位置。再依据数据库(采用CTAB法[13]提取亲本、F1及F2植株的基因组DNA, 用于PCR扩增实验。PCR总体积10 μL, 含 5.0 μL 10×Mix, 0.2 μL前引物加0.2 μL后引物, 0.6 μL DNA, 4.0 μL dd H2O。PCR程序为94℃预变性5 min; 94℃变性30 s、55℃退火30 s、72℃延伸45 s, 35个循环; 72℃延伸5 min。在8%聚丙烯酰胺凝胶上电泳分离PCR产物。
2 结果与分析
2.1 突变体wsl1及亲本的表型分析
对wsl1观察发现, 自苗期开始(图1-A), 其叶色由正常绿色转变成白化叶色, 每片叶都从叶脉开始变白, 然后向两边扩展, 最后形成不规则的白条纹叶表型。突变体wsl1在三亚(图1-C)种植发现叶边缘和叶中脉白化现象突出, 在长沙(图1-B)种植发现叶片中脉白化严重, 边缘白化没有三亚种植的植株明显, 推测突变体wsl1的白条纹性状可能受到温度和光照强度的影响。与R1128相比(表1), 突变体wsl1显著增加了株高、每穗总粒数和剑叶长, 而结实率却下降了18.5%。同时wsl1比R1128晚了15 d抽穗。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1野生型R1128和突变体wsl1在苗期、分蘖期和抽穗期的表型
A: 五叶期幼苗, 左为野生型, 右为wsl1; B: 长沙突变体分蘖期; C: 三亚突变体分蘖期; D: 长沙突变体孕穗期。
Fig. 1Phenotype of wild type (WT) R1128 and mutant wsl1 at seedling, tillering, and booting stages
A: five-leaf stage. Left: WT; Right: wsl1. B-D: the mutant wsl1 at tillering stage in Changsha (B), tillering stage in Sanya (C), and booting stage in Changsha (D).
Table 1
表1
表1野生型R1128和突变体wsl1农艺性状
Table 1
| 农艺性状Agronomic trait | R1128 | wsl1 |
|---|---|---|
| 有效穗数 No. of effective panicles | 6.25±2.3 | 5.9±1.9 |
| 穗长 Panicle length (cm) | 29.8±1.0 | 32.9±2.8 |
| 千粒重 1000-grain weight (g) | 23.3±1.5 | 22.6±1.1 |
| 一次枝梗数 No. of primary branch | 19.8±2.4 | 21.1±1.9 |
| 二次枝梗数 No. of secondary branch | 49.5±6.8 | 68.7±8.7** |
| 剑叶宽 Flag leaf width (cm) | 3.0±0.4 | 3.0±0.4 |
| 株高 Plant height (cm) | 121.9±5.8 | 181.6±6.9** |
| 每穗总粒数 No. of spikelets per panicle | 342.0±61.5 | 447.1±85.9** |
| 结实率 Seed setting rate (%) | 76.3±0.9 | 57.8±0.9** |
| 剑叶长 Flag leaf length (cm) | 40.8±7.7 | 55.1±9.6** |
| 抽穗期 Heading date (d) | 87.0±2.5 | 102±2.1** |
新窗口打开|下载CSV
2.2 突变体与野生型叶绿素含量的测定
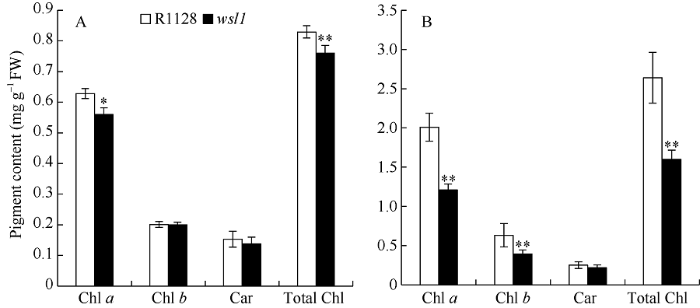
突变体wsl1苗期叶绿素a的含量与亲本R1128相比显著性降低(图2), 总叶绿素含量极显著降低, 而叶绿素b和类胡萝卜素差异均不显著; 而分蘖期wsl1叶绿素a、叶绿素b和总叶绿素的含量与野生型相比都极显著下降, 突变体苗期和分蘖期的叶绿素总含量的增长幅度远低于亲本R1128, 表明WSL1对叶片色素的合成具有重要的调控作用。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2野生型R1128和突变体wsl1苗期和分蘖期叶绿素的含量比较
A: 苗期光合色素含量比较; B: 分蘖期光合色素含量比较。Chl a: 叶绿素a; Chl b: 叶绿素b; Total Chl: 叶绿素a+叶绿素b; Car: 类胡萝卜素。*表示野生型与突变体在0.05水平差异显著; **表示野生型与突变体在0.01水平差异显著。
Fig. 2Comparison of photosynthetic pigments at seedling stage and tillering stage in the mutant wsl1 and wild type R1128
A: comparison of photosynthetic pigments of the seeding stage; B: comparison of photosynthetic pigments of the tillering stage; Chl a: chlorophyll a; Chl b: chlorophyll b; Total Chl: content of chlorophyll a and chlorophyll b; Car: carotenoids. * represents significant difference between the wsl1 mutant and wild type at the 0.05 probability level; ** represents significant difference between the wsl1 mutant and wild type at the 0.01 probability level.
2.3 突变体叶绿体超微结构观察
超微结构观察显示, 野生型叶肉细胞中叶绿体形状规则, 均匀分布在液泡周围, 基质浓厚, 基粒丰富, 片层排列紧密(图3-A)。wsl1突变体叶肉细胞中叶绿体形状不规则, 呈现多种形态, 大小不一(图3-B); 叶绿体性状呈现降解趋势, 形态进一步多样化, 并出现一定的叶绿体的空泡化, 片层开始降解, 叶绿体数量进一步减少(图3-C); 多数叶绿体类囊体膜系统退化和分解严重, 类囊体基粒片层数量明显减少, 片层间距拉大, 排列疏松, 叶绿体体积进一步减少, 体积和数量都远小于正常叶片的叶绿体(图3-D)。说明WSL1在水稻的生长过程中调节叶绿体的结构及叶绿体的降解过程。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3突变体wsl1和野生型R1128叶肉细胞中叶绿体显微结构
A: 野生型叶肉细胞; B: wsl1 白条纹叶绿区叶肉细胞; C: wsl1白条纹叶绿转白区叶肉细胞; D: wsl1白条纹叶白区叶肉细胞。c: 叶绿体; v: 液泡。
Fig. 3Ultrastructures of chloroplasts in the mesophyll cell of the wsl1 mutant and wild type R1128
A: mesophyll cell of the wild type; B: mesophyll cell of the wsl1 mutant’s green leaf; C: mesophyll cell of the wsl1 mutant’s leaf regions with color change from green to white; D: mesophyll cell of the wsl1 mutant’s white leaf. c: chloroplast; v: vacuole.
2.4 叶横切面图
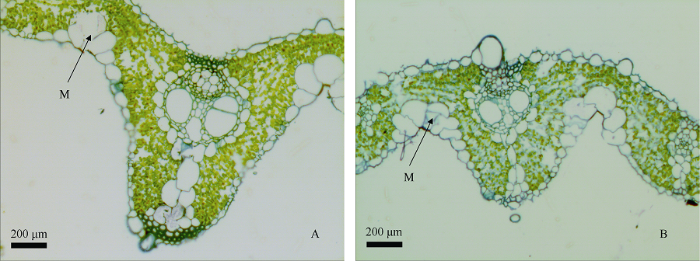
叶片横切面图(图4)显示野生型的叶绿素含量高于突变体wsl1。图4-A的色素更集中, 排列紧密, 颜色鲜艳, 而图4-B颜色较淡, 色素分布散落, 呈现一定降解趋势。但在叶片结构上, 突变体的规则化凸起较野生型更加突出, 从实际叶片触摸感也能感受到颗粒感更为明显, 叶片较野生型更加坚硬。从图4-A可看出野生型叶片的运动细胞排列规则, 呈正常扇面, 而图4-B突变体的运动细胞排列疏松, 形状各异, 无扇面型; 表明突变体wsl1 不仅会改变水稻叶片叶绿体的含量, 也能一定程度上改变水稻叶片的叶表结构。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4野生型和突变体wsl1分蘖期的叶片横切面图
A: 野生型叶片横切面; B: wsl1白条纹叶片横切面。M: 运动细胞。
Fig. 4Cross-section of wild type R1128 and wsl1 mutant leaf at tillering stage
A: cross section of wild type leaf; B: cross section of wsl1 mutant’s leaf. M: motor cell.
2.5 wsl1的遗传分析
正常叶色的粳稻品种日本晴、籼稻品种R1128分别与突变体wsl1的2个正反杂交F1都表现为正常叶色, 组合R1128/wsl1与wsl1/日本晴的F2后代中分离出了正常叶色和白条纹叶2种类型单株, 二者分离比与理论值没有显著差异, 符合3:1, 表明wsl1受1对隐性核基因独立控制(表2)。Table 2
表2
表2突变体wsl1的遗传分析
Table 2
| 杂交组合 Cross | 正常植株数 Number of green plant | 白化叶植株数 Number of albino plant | F2群体总株数 Total number of F2 plants | 分离比 Theoretical segregation ratio | χ2 (χ20.05=3.84) |
|---|---|---|---|---|---|
| wsl1/Nipponbare | 1247 | 390 | 1637 | 3.20 | 1.301 |
| R1128/wsl1 | 2702 | 878 | 3580 | 308 | 0.431 |
新窗口打开|下载CSV
2.6 WSL1的基因定位及候选基因预测
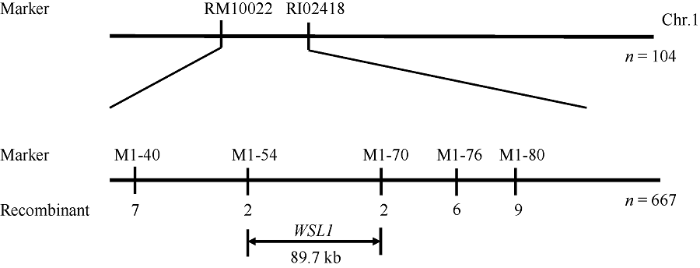
利用308对SSR引物对突变体wsl1和日本晴进行多态性分析, 筛选到109对多态性良好的标记。采用BSA法构建表型基因池, 发现白化突变体wsl1初步定位在第1染色体短臂; 随后用104个隐性单株验证, 将wsl1初定位在标记RM10022与RI02428之间; F2:3群体分离的白条纹单株667株作为精细定位群体, 利用新开发的5对多态性标记(表3), 最终将基因定位在标记M1-54与标记M1-70之间, 两者相距89.7 kb (图5)。利用水稻表达谱数据库(图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5WSL1的精细定位
n: 群体大小; recombinant: 重组单株数。
Fig. 5Fine mapping of WSL1 gene
n: number of group; recombinant: number of recombinant.
Table 3
表3
表3WSL1 基因的连锁标记
Table 3
| 标记 Marker | 正向引物 Forward primer (5′-3′) | 反向引物 Reverse primer (5′-3′) |
|---|---|---|
| RM10022 | CCTCCATAGAGTAAGGTTTGCATGG | CCTCCTCCTCTGTCTTTCTCTGC |
| M1-40 | GACGACGCCCGGTGGCTGTG | GCAGTATCACCATGGATCCA |
| M1-54 | ACATAAGTATCATGGGCTTA | CCGAAGTTGCGTACTAACCG |
| M1-70 | GTTGCCGCGAAGTTTCACGC | ACCACCACCCAAAATGAGCT |
| M1-76 | ACCTGGAGGAGCAAATTAGG | CGTCCATTCCAATGATTTCC |
| M1-80 | AAGTTATCTTTGTGACTGCT | AGAAATGCGGCAGGAACGAC |
| RI02428 | CTTCGTCACCGCAGATGG | CTGTTTCTTTGGACCGGTGT |
新窗口打开|下载CSV
Table 4
表4
表4 WSL1 定位区域内基因信息
Table 4
| 基因位点 Gene locus | 基因表达产物 Gene product |
|---|---|
| LOC_Os01g02000 | phosphate transporter 1, putative, expressed |
| LOC_Os01g02010 | expressed protein |
| LOC_Os01g02020 | acetyl-CoA acetyltransferase, cytosolic, putative, expressed |
| LOC_Os01g02040 | retrotransposon protein, putative, unclassified, expressed |
| LOC_Os01g02050 | phosphoenolpyruvate carboxylase, putative, expressed |
| LOC_Os01g02060 | TOO MANY MOUTHS precursor, putative, expressed |
| LOC_Os01g02070 | invertase/pectin methylesterase inhibitor family protein, putative, expressed |
| LOC_Os01g02080 | peptidyl-prolyl cis-trans isomerase, putative, expressed |
新窗口打开|下载CSV
3 讨论
根据突变性状对个体生长发育的影响, 水稻叶色突变可分为致死突变(如ALI[16]、OsPPR1[17])和非致死突变(如YSA[18]、MAL[19])。一般情况下, 因为白化苗缺乏叶绿素, 不能正常进行光合作用, 只能依靠种子中的胚乳营养而生长, 当胚乳耗尽时植株就会死亡, 表现出苗期致死效应[20]。但是一些白化相关突变体的突变性状只在苗期表达, 生长后期叶片可以转绿, 恢复正常叶色, 光合色素含量的变化和叶色变化相一致, 因此这类突变对主要农艺性状无显著影响[21]。本文研究的wsl1属条纹型非致死突变, 为自然发生突变, 且wsl1突变体整个生育期叶片都表现白条纹形状, 突变体苗期叶绿素a含量显著低于野生型, 总叶绿素含量极显著低于野生型, 分蘖期突变体叶绿素a、叶绿素b和总叶绿素均显著低于野生型, 叶绿素的变化直接导致叶片呈现白化现象。现在已发现的多个叶脉白化突变体(virescent-1 (v1)、wp(t)、oswm、oswm2)均属于中脉白化突变体, 即仅在主叶脉处白化, 其他部分正常。而wpsm与它们不同, 除中脉白化外, 次级叶脉也褪绿白化[22]。本文研究的突变体wsl1与突变体wpsm呈现类似的突变性状, 除主叶脉白化外, 次级叶脉也会有一定程度的白化现象。但不同的是, 突变体wsl1的叶缘部分也会有白化现象, 且WPSM位于第6染色体上, 异于本文的突变体材料。突变体slwp自苗期到抽穗期出现条纹性状, 并伴随有白穗现象, 会影响突变体的产量, 抽穗期加长, 株高、穗长和千粒重降低[23]。但是突变体wsl1叶片绿色部分细胞结构完整, 叶绿体发育完全, 绿转白部分细胞中的叶绿素开始呈现降解趋势, 当其完全转白后, 白化部分细胞中空, 叶绿体内部几乎完全降解, 叶肉细胞及其叶绿体发育严重受阻, 最终导致植株生长缓慢, 生育期延长。
水稻中已克隆14个白条纹或白化基因, 有的表现出白化致死, 如OsBE1[24]、OsPPR1[25]、ASL2[26]、AL1[27]、WP1[28]; 有的属于温度依赖型, 如V2[29]、V3[30]、ST1、TCD5[31]、WSL3[32]等; 有的表现出白化转绿, 如YSA[33]等。而本文所研究的白化突变体wsl1, 与已发现的其他突变体的基因位置及生理表型都不一样。WSL1与STL1[34]同处于第1染色体, 突变体wsl1的白条纹表型出现在苗期, 而突变体stl1的白条纹表型出现在分蘖期; 且STL1的预测区间也不同于WSL1。在WSL1的预测基因范围内, LOC_ Os01g02000的表达产物是磷酸盐转运蛋白, LOC_ Os01g02020的表达产物是乙酰辅酶a, LOC_ Os01g02040的表达产物是逆转录子蛋白, LOC_ Os01g02050的表达产物是磷酸烯醇丙酮酸羧化酶, LOC_Os01g02060与大多数的前体合成有关, LOC_ Os01g02070的表达产物是果胶甲酯酶抑制剂家族蛋白, LOC_Os01g02080与肽基脯氨酰顺反异构酶的形成有关; Go分类分析显示LOC_Os01g02000编码磷酸盐转运蛋白, 通过整合磷酸盐(Pi)和锌(Zn)缺陷信号, 调控铁(Fe)运输, 此基因已被克隆, 暂时没有发现与叶绿体发育相关。LOC_Os01g02060调节植物体的生物学进程、信号转导以及质体的组成。LOC_Os01g02080参与生物的多个生命活动, 包括类囊体结构的形成。类囊体膜上含有光合色素和电子传递链组分, 光能向活跃的化学能的转化在类囊体膜上进行。有文献表明突变体gars在苗期就显现白化性状, GARS基因编码能催化嘌呤核苷合成过程中的第2步需要用到的甘氨酰胺核苷酸合成酶, 因此突变体gars白化部分的类囊体膜变少, 导致突变体中的叶绿素合成和光合作用异常, GARS通过影响质粒编码基因的表达而影响叶片早期发育中叶绿体发育的过程[35]。
4 结论
从日本晴和R1128的重组自交系中获得1个白条纹叶色突变体wsl1, 此突变体在苗期开始表现白化叶性状, 突变性状贯穿全生育期, 成熟期的株高、每穗总粒数和剑叶长相较生育期亲本R1128都显著增加, 而结实率却显著性下降, 但每穗实粒数、有效穗等其他农艺性状没有显著差异。苗期突变体与野生型相比叶绿素a和总叶绿素含量显著下降, 成熟期突变体与野生型相比叶绿素a、叶绿素b和总叶绿素都极显著下降, 突变体的叶绿体形状不规则, 结构异常, 呈现提前降解趋势。突变体由1对隐形核基因控制, 位于第1染色体短臂, 限定在89.7 kb的物理区间内, 暂未在此区段发现叶色突变体的报道, GO (Gene Ontology)分类显示其可能与类囊体形成有关。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1111/tpj.2009.59.issue-6URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1270/jsbbs1951.12.231URL [本文引用: 1]
[本文引用: 1]
DOI:10.1111/ppl.2004.120.issue-1URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/j.1365-313X.2008.03411.xURL [本文引用: 1]
[本文引用: 1]
DOI:10.1038/s41598-017-03327-2URL [本文引用: 1]
DOI:10.1007/s11103-005-2066-9URL [本文引用: 2]
[本文引用: 1]
DOI:10.1007/BF00020088URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11103-005-5702-5URL [本文引用: 1]
DOI:10.1104/pp.112.195081URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11103-005-5702-5URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.15.01949URL [本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.109.136648URL [本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11103-016-0533-0URL [本文引用: 1]
DOI:10.1104/pp.112.195081URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
