
*通讯作者(Corresponding author): 王西瑶, E-mail:wxyrtl@163.com 收稿日期:2016-10-06 接受日期:2017-01-21网络出版日期:2017-02-17基金:
摘要
关键词:马铃薯; 块茎萌芽; 油菜素内酯; 基因表达
Expression Changes of Genes Related to Brassinosteroid Biosynthesis and Signal Transduction during Potato Storage and Its Effect on Tuber Sprouting
ZOU Xue

Fund:
Abstract
Keyword:Potato; Tuber sprouting; Brassinosteroid; Gene expression
Show Figures
Show Figures















马铃薯(Solanum tuberosum L.)具有稳产高产、生育期短、适应性强等特点, 是我国第四大粮食作物之一。马铃薯通常以块茎无性繁殖, 块茎具休眠期, 且不同基因型间的休眠期存在较大差异, 同时受种植季节等环境因素影响[1, 2]。处于休眠期的种薯播种后出苗不齐或烂薯, 发芽过久的老化种薯则导致减产10%~30%[3], 所以种薯在播种前能整齐萌芽, 达到最佳生理状态, 是保证产量的关键, 特别是在春、秋、冬三季能够种植马铃薯的西南地区, 其对种薯萌芽时间的要求更为灵活。
内源激素是调控块茎从休眠向萌芽状态转变的重要物质, 各激素间存在复杂互作。Aksenova等[4]认为脱落酸(ABA)、乙烯(Eth)、油菜素内酯(BR)促进块茎休眠, 生长素、细胞分裂素(CTK)和赤霉素(GA)解除休眠促进萌芽, CTK和GA促进芽生长, 其中GA3是生产上常用的马铃薯种薯催芽剂。Hartmann等[5]通过转基因技术降低马铃薯的CTK含量能延长块茎休眠并且对外源施加GA3无反应, 证实两者对解除块茎休眠同等重要并相互影响。Korableva等[6]用人工合成的BR类似物24-表油菜素内酯(24-epibrassinolide, 24-eBL)约21 nmol L-1处理块茎可延迟萌芽36~38 d, 增加乙烯形成及ABA的含量, 使分生组织各细胞体积缩小, 并增加液泡数目, 认为BR促进休眠。
BR是一类甾醇类植物激素, 参与调控多种生理过程, 如气孔形成、植株形态建成、开花、维管束发育、种子萌发, 外源BR能提高胁迫抗性[7, 8, 9]。对拟南芥和水稻BR的合成和信号转导过程已有较为深入的研究。BR合成酶基因的缺失突变体大多矮化、生长缓慢, 如Δ (7)-甾醇-5-脱氢酶(delta (7)- sterol-c5(6)-desaturase, SC5DL或STE1或ERG3)、Δ 24-甾醇还原酶1 (delta24-sterol reductase, DWF1)、BR-6-氧化酶1/2 (brassinosteroid-6-oxidase1/2, BR6OX1/2或cytochrome, P45085A1/2 CYP85A1/2)的突变体[10, 11, 12]。如图1所示, BR受体为BRI1 (protein brassinosteroid insensitive 1), 此外还有共受体BAK1及其同源蛋白SERKs家族, 在这些共受体的配合下, BRI1感知BR信号, 并激活激酶BSK (BR-signaling kinase)来启动信号转导过程, 通过一系列磷酸化和去磷酸化激活细胞核内的转录因子, 活化的转录因子BZR1/2可促进与细胞分裂及生长相关的基因表达, 而在调节叶片角度方面, 活化的转录因子LIC则对BZR1/2起拮抗作用[13, 14, 15]。CYCD3编码细胞周期蛋白(D-type cyclin family 3)参与细胞分裂调控, 基因TCH4编码木葡聚糖糖基转移酶(xyloglucan endotransglycosylase, XTH)能松弛细胞壁使细胞得以伸长, 已知这2个基因都受BR信号激活表达[16, 17]。
前期分析休眠和萌芽块茎的基因表达谱, 发现BR合成及信号转导途径中的大多数基因表达量在萌芽块茎中显著升高, 这与Korableva认为BR促进块茎休眠的结论不同[6]。同时, 生产上常用的催芽剂GA3存在对中、长休眠期品种的催芽效果弱且处理浓度和时间不易掌控, 造成芽细弱等问题。为进一步确认BR在块茎休眠、萌芽中的作用, 评价其调节种薯萌芽的潜力, 寻找更为有效的催芽方法。本研究选择休眠期不同的3个品种为材料, 以qRT-PCR检测与BR合成和信号转导相关的9个基因的表达量在块茎贮藏期间以及抑芽物质处理下的变化特点。这9个基因分别是与BR合成相关的SMO1、ERG3、DWF1、BR6OX1, BR信号转导成员BRI1、BSK、BZR1, 信号激活的基因TCH4、CYCD3(图1中的实心框)。同时, 比较24-eBL及其与GA3配合处理对块茎萌芽和后期生长的影响。
1 材料与方法1.1 试验材料和试剂短休眠期品种费乌瑞它(Favorita, FR)、中等休眠期品种米拉(Mira, MR)、长休眠期品种坝薯10号(Bashu 10, BS)的脱毒薯, 由四川农业大学农学院马铃薯研究开发中心提供。
TRIzol、焦碳酸二乙酯(DEPC)购自Invitrogen, 反转录试剂盒RevertAid First Strand cDNA Synthesis购自Thermo, 引物及荧光染料SGExcel FastSYBR Mixture购自上海生工。24-eBL、油菜素内酯专一性抑制剂芸苔吡咯(Brassinazole, BRZ)购自Sigma- Aldrich。其他常规试剂如氯仿、乙醇、赤霉素(GA3)等购自成都科龙化工试剂厂。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 本试验选择的基因在BR合成和信号转导中的作用模型Fig. 1 Acting model of genes selected in this study in BR synthesis and signal transduction |
1.2 块茎贮藏和取样分别挑选3个品种的新收原原种(约7~10 g 粒-1), 常温下愈伤化14 d后装入密封硬纸盒贮藏, 每盒约80~100粒, 各5盒。另选费乌瑞它, 装盒后加入前期项目组筛选的挥发性抑芽物质A和B处理。在(23± 2)℃室内贮藏以上样品。另选费乌瑞它放于4℃冷库贮藏。取样时间如表1所示, 在萌芽(芽长2~3 mm, 块茎解除休眠)时间点取样后即结束该品种的贮藏, 3个品种约在49、70和98 d结束贮藏。以顶部芽眼为中心, 用直径3 mm, 高5 mm圆管打孔取圆柱体, 用液氮速冻后保存于-80℃用于RNA提取。
表1
Table 1
表1(Table 1)
| 表1 各处理在贮藏期间的取样时间 Table 1 Sampling time for different treatments during storage |
1.3 用qRT-PCR测定基因表达变化用TRIzol法提取RNA并用低浓度乙醇、高盐、冻融等方式去除多糖。将RNA反转录成cDNA, 在20 μ L体系中依次加入Oligo dT 1 μ L、RNA 3 μ L、DEPC处理水8 μ L, 65℃ 5 min, 冰上急冷2 min; 再按序加入5× 反应缓冲液4 μ L、RNase抑制剂 (20 U μ L-1) 1 μ L、10 mmol L-1 dNTPs混合物2 μ L、Reverse Transcriptase ( 200 U μ L-1) 1 μ L。42℃ 60 min, 72℃ 10 min终止反应。参考http://solanaceae.plantbiology. msu.edu/cgi-bin/annotation_report.cgi基因序列, 利用Oligo 6.0软件设计各基因的特异性引物(表2)。根据基因表达谱, 选择表达量在休眠、萌芽和抑芽3种状态下都稳定的基因EF1α L作内参。
荧光定量PCR体系25 µ L, 含RNase-Free ddH2O 10.5 µ L、2× SGExcel FastSYBR混合物12.5 µ L、上下游引物各0.5 µ L、cDNA 1.0 µ L。反应程序为95℃ 20 s; 40循环, 95℃ 3 s, 退火/延伸58~60℃ 30 s。熔解曲线分析为95℃ 10 s, 65℃ 5 s, 95℃ 5 s。Bio-Rad CFX Connect荧光定量PCR仪检测, 采用2-Δ Δ Ct法计算相对表达量[18], 以贮藏0 d时费乌瑞它的Δ Ct值为对照。将3次试验重复所提的3管RNA混合后反转录所得cDNA作3次荧光定量技术重复。由于一些基因的相对表达量在品种间的变化幅度大(如0.10~229.11), 为同时反映低数值间的高幅度变化, 在品种间比较时将相对表达量换算成以10为底的对数值, 以体现贮藏初、中期表达量数值低时的变化趋势。
表2
Table 2
表2(Table 2)
| 表2 用于qRT-PCR检测的基因引物序列 Table 2 Primer sequences of genes for qRT-PCR test |
1.4 用24-eBL和BRZ处理块茎离体芽眼部位以费乌瑞它原原种的芽眼为中心, 取直径4 mm, 高5 mm的圆柱体, 分别用500 nmol L-1 24-eBL、60 μ mol L-1 GA3、24-eBL+GA3、100 μ mol L-1 BRZ+GA3浸泡20 min, 以蒸馏水为对照, 放入培养皿中于黑暗(22± 2)℃下离体保湿培养3 d后在体视镜下观察萌动情况。
1.5 24-eBL及其与GA3互配对块茎萌芽和植株生长的影响 取费乌瑞它、米拉的原原种和费乌瑞它的原种, 用GA3、24-eBL和24-eBL+GA3浸泡种薯, 浓度同1.4, 每处理3盒, 在(23± 2)℃下放置, 统计发芽率、芽长、芽直径。待对照芽长约2~5 mm时将薯块露天盆栽, 生育期为9月初至12月初, 测定单株结薯重量。另取费乌瑞它原原种用相同溶液浸泡后于(10± 2)℃黑暗贮藏60 d, 散射光下放置约10 d, 比较芽的萌发情况。
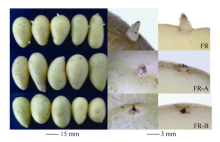
2 结果与分析2.1 品种萌芽比较和BR合成基因表达量变化3个品种的休眠期明显不同, 费乌瑞它在50 d时有70%左右薯块萌芽, 多数芽长为1~3 mm, 而此时另2个品种没有萌动迹象。70 d时费乌瑞它芽长已有7~8 mm, 米拉可见明显的芽萌发, 坝薯10号部分薯块的芽眼开始露白(图2)。
如图3所示, 4个基因的表达量在品种间的变化趋势一致, 均随时间升高, 只是升高的时间点和幅度不同。短休眠品种费乌瑞它在7 d时就开始升高, 21 d时非常明显, 为0 d的3~7倍。中、长休眠品种米拉和坝薯10号的这4个基因表达量直到49 d 时才开始有2~5倍的小幅上升。费乌瑞它的这4个基因表达量在萌芽时(49 d)均达到最高, 米拉和坝薯10号则在63 d后才大幅上升。推测BR合成与块茎由休眠状态向萌芽转变密切相关, 中、长休眠品种的BR合成明显晚于短休眠品种。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 贮藏70 d时各品种萌芽对比Fig. 2 Sprouting comparison of different varieties at 70 days |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 在3个品种中基因表达量随贮藏时间的变化模式Fig. 3 Gene expression patterns in three varieties during storage FR: 费乌瑞它; MR: 米拉; BS: 坝薯10号。FR: Favorita; MR: Mira; BS: Bashu 10. |
同时可以看出参与BR前体物质菜油甾醇(Campesterol)合成的基因SMO1、ERG3和DWF1变化模式相似。费乌瑞它和坝薯10号萌芽前, 3个基因的表达均存在平台期或小幅下滑, 到萌芽时又迅速升高; 而米拉则是在萌芽前达到最高, 到萌芽时反而略有下降。参与BR合成最后几步反应的BR6OX1在米拉中的相对表达水平明显低于另2个品种, 由此推测米拉萌芽所需的BR水平可能低于另2个品种, 所以即使坝薯10号的基因转录升高的时间点略早于米拉, 但萌芽时间仍晚于米拉。
2.2 信号转导及调控基因的表达变化信号转导及调控的5个基因中, BRI1和CYCD3在品种间均呈升高的趋势, 而BSK和TCH4在费乌瑞它中变幅大, 在另2个品种中变化小(图4)。BRI1在费乌瑞它和坝薯10号萌芽前有小幅下滑, 短休眠品种的转录本积累早于中、长休眠品种, 这同BR合成基因的变化相似; 并且BRI1从初始到萌芽升高倍数在品种间相似。BSK变化具有很强的品种特异性, 在费乌瑞它中呈线性升高, 萌芽时为初始的70倍; 而另2个品种的转录本在整个贮藏期间均保持较恒定水平。贮藏期间BZR1在3个品种中的变化均较小, 费乌瑞它萌芽与初始相比也仅提高2倍(图未列出)。可能该转录因子已存在于分生组织中, 只是处于非活性状态, 合成BR后通过信号转导让其活化进而调控下游基因表达。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 BR信号转导和调控基因在贮藏期间的表达变化Fig. 4 Expression characteristics of genes involved in BR signal transduction and regulation during storage |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 50 d时抑芽物质对块茎萌芽的影响Fig. 5 Effects of sprouting-inhibitors on tuber germination at 50 days |
TCH4表达变化的规律性差, 在费乌瑞它中呈N字型, 在米拉和坝薯10号中表达量低, 除萌芽前有明显下降, 其余时间保持恒定水平。贮藏21 d前, 费乌瑞它的CYCD3低于米拉和坝薯10号, 但之后三者的表达量呈近乎一致的升高, 在费乌瑞它萌芽后, 米拉和坝薯10号的表达量继续上升, 但费乌瑞它的升幅最大, 为59倍。
2.3 抑芽处理对基因表达的影响如图5所示, 贮藏50 d时CK有1~3 mm完整小芽, 处理A使芽畸形, 且顶端有坏死, 处理B的芽组织此时已完全坏死, 即抑芽物质B的抑芽能力明显强于A。图6列出了4种典型的基因表达变化模式, SMO1在早期便受物质A刺激, 到7 d时达到最高值并高于同期CK值, 之后一直处于低水平; 抑芽能力更强的物质B处理则使该基因的转录本在整个贮藏期间都保持极低水平(0.16~1.70)。其他3个涉及BR合成的基因表达模式与之相似。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 抑芽物质对基因表达的影响Fig. 6 Effects of sprouting-inhibitors on gene expression during storage FR: 马铃薯品种费乌瑞它; A和B为不同的抑芽物质。 FR: potato variety Favorita; A and B represent different sprouting-inhibitor. |
BRI1和BSK变化相似, 在贮藏早期均受2种抑芽物质的诱导, 在7 d或21 d达到最高值, 并高于同期CK, 之后下降并一直处于低水平, 远低于同期CK。物质A处理极大地刺激TCH4表达, 在整个贮藏期间都高于CK, 甚至70 d时仍高于CK萌芽时的表达量; B处理则在7 d时达到最高, 为同期CK的7倍, 之后一直处于低水平。物质A处理似乎对CYCD3的转录影响较小, 它的表达量在各时间点与CK的几乎一致, 只是在70 d时显著下降到49 d的27.66%, 这与该处理能观察到畸形芽形成, 但后期死亡的情况相符; 物质B刺激该基因表达升高, 在21 d最大, 是同期CK的3倍, 之后迅速下降并维持在低水平。与BR合成基因的表达一直受到物质B较强的抑制作用不同, 信号转导和响应基因的表达被刺激升高, 且升高的时间点早于物质A处理; 同时, 下游响应基因受2种物质刺激升高的倍数远大于合成和信号转导基因。除BZR1外, 其余基因的表达在4℃低温下明显受抑, 49 d时表达量只有同期CK的0.64%~13.73%。BZR1的表达量在各抑芽处理下仍然没有明显变化。
2.4 BR处理对块茎萌芽和生长的影响上述结果表明BR合成、信号转导及调控活动在块茎从休眠到萌芽过程中呈增强趋势, 抑芽处理在贮藏中、后期显著抑制这些生理过程, 那么外源BR对块茎萌芽是否有促进作用?试验用24-eBL处理不同品种、不同级别的种薯, 以探明BR在块茎萌芽中的作用及其对植株后续生长的影响。
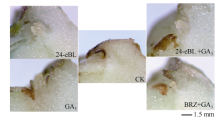
2.4.1 对块茎离体芽眼部位萌芽的影响 在预试验中用5、50、500、5000 nmol L-1 24-eBL处理薯块, 发现5 nmol L-1对块茎休眠影响不大, 而50 nmol L-1和500 nmol L-1均有促进块茎解除休眠的作用, 并且后者的效果和整齐度更好, 而5000 nmol L-1可能因浓度过高造成内源BR的代谢紊乱而表现出抑制作用, 所以本试验选择500 nmol L-1。离体培养费乌瑞它的芽眼部位, 3 d后如图7, 24-eBL和GA3都能解除芽眼部位的休眠状态, 促进萌芽。在GA3中添加BRZ则减弱了前者促芽生长的作用。24-eBL和GA3配合处理在此时看不到与单独使用时的差异。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 芽眼部位离体培养的萌芽对比Fig. 7 Sprouting comparison of sprout eye part tissue in vitro culture |
2.4.2 对块茎萌芽和芽生长的影响 表3列出在(23± 2)℃贮藏, 费乌瑞它原原种的发芽率、芽长和直径在各自差异最明显时期的对比。各处理都能促进块茎解除休眠, 在35 d时的发芽率均极显著高于CK, 24-eBL+GA3配合处理的效率最高。GA3不仅利于解除休眠还促进芽生长, 55 d时长度约为CK的5倍, 但CK和GA3均有芽长不整齐的问题。24-eBL处理的长度与CK相似, 但表现更整齐, 对比发芽率和芽长可以看出24-eBL虽促进休眠解除但不支持芽的伸长生长。24-eBL+GA3的芽长介于单独处理之间, 芽最为健壮, 整齐性较好。
表3
Table 3
表3(Table 3)
| 表3 各处理的原原种发芽情况对比 Table 3 Sprouting comparison of pre-basic seed potato in different treatments |
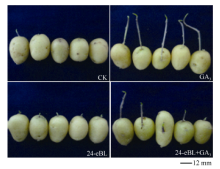
在(10± 2)℃贮藏60 d后于散射光下放置10 d, 也得到了与上述相似的结果, 且芽长和整齐度对比更为明显(图8)。CK有72.97%的薯块发芽, 但芽长不整齐。24-eBL使所有薯块解除休眠, 84.61%的芽长在5 mm左右, 生长整齐。GA3处理芽细长, 超过40 mm。24-eBL+GA3的芽长仍然介于单独处理之间。
2.4.3 对植株生长和产量的影响 无论是费乌瑞它不同级别的种薯, 还是同一级别费乌瑞它和米拉2个品种, 各处理均使结薯提前。图9所示为米拉原原种植株的生长情况, 可看到各处理均有匍匐茎和其顶端膨大形成的薯块, 而CK还未形成匍匐茎或匍匐茎还未膨大结薯。各处理的结薯情况与其芽健壮程度密切相关, 24-eBL+GA3处理的芽最为健壮, 其植株长势和结薯也最佳; GA3处理的植株地上部虽然比24-eBL的茂盛, 但结薯整齐性不如后者; CK萌芽时间和芽长不整齐, 植株间的差异也非常明显。各处理单株薯块重量均高于CK, 在不同级别和不同品种中24-eBL+GA3的薯块重量均最高, 相对于CK分别高75.20%、37.92%和98.41% (表4)。结薯增幅如此明显除有激素处理影响块茎形成外, 可能也与CK出苗晚结薯迟, 而秋季生长季节偏短有关。24-eBL的产量与GA3的差异不显著, 但各单株产量的整齐度高于GA3。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 70 d后的发芽对比(散射光下10 d)Fig. 8 Shoot growth comparison of tuber after 70 days (10 days under scattered light) CK: 发芽不整齐, 其中27.03%未萌芽; 24-eBL: 薯块整齐萌芽; GA3: 芽徒长超过40 mm; 24-eBL +GA3: 芽更为健壮, 长度介于GA3和24-eBL之间。 CK: irregular germination, 27.03% tuber was not germinated; 24-eBL: sprouting uniformly; GA3: shoot length was over 40 mm; 24-eBL+GA3: the bud grew stronger and the shoot length was between those of GA3 treatment and 24-eBL treatment. |
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 盆栽60 d的植株形态比较Fig. 9 Comparison of plant morphology after planting 60 days 箭头示匍匐茎顶端形成的膨大块茎。 Arrows show enlarging tuber on the top of stolon. |
表4
Table 4
表4(Table 4)
| 表4 不同品种和级别的种薯收获的单株薯块重量比较 Table 4 Comparison of tuber weight per plant in different varieties and levels of potato seeds (g) |
3 讨论研究表明BR参与多种生理过程特别是生长发育, 拟南芥ERG3缺失突变体矮化, 转入酵母的ERG3基因能使其恢复生长[19]。Δ 24-甾醇还原酶(DWF1)催化合成BR前体油菜甾醇, 是BR合成中的关键酶, 拟南芥中其编码基因突变体dwarf1的BR含量降低且植株矮化[11]。BR6OX (亦写作CYP85A)催化合成BR, 拟南芥的CYP85A1和CYP85A2双突变体表现出矮化表型[12]。本试验中参与BR合成的4个基因StSMO1、StERG3、StDWF1和StBR6OX1表达量均随贮藏时间延长而升高, 抑制它们表达造成块茎萌芽受阻, 说明BR是块茎解除休眠和萌芽所必需的信号物质。信号转导及调控基因中BRI1和CYCD3的表达模式在3个品种中相似, BSK和TCH4则在品种间有明显差异。在块茎由休眠向萌芽转变中, 品种间以及抑芽处理下BZR1表达量均无明显变化, 推测它编码的蛋白可能已随块茎膨大而积累, 只是处于磷酸化失活状态, BR信号激活蛋白而不是刺激转录, 来调控块茎生理状态的转变。对比这9个基因变化的幅度、品种间的规律性, 认为在调控块茎生理状态上, 改变BR合成可能比调节信号因子和下游基因更直接有效。
抑芽物质在贮藏期间极大地刺激了受BR调控的下游基因TCH4和CYCD3的表达, 它们的变幅远高于BR合成和信号转导基因, 这反映出下游基因受到除BR外的其他响应胁迫因子的调控。已知TCH4编码木葡聚糖糖基转移酶, 能松弛细胞壁, 这不仅关乎生长发育所涉及的细胞分裂, 同时也与防御胁迫相关。通过TCH4的启动子驱动GUS表达, 发现该基因不仅受BR调控, 冷、热、黑暗等均可刺激它表达, 并且在BR合成或信号转导突变体中也能表达[20]。本试验中两种抑芽物均可刺激TCH4升高, 并且它本身的变化在品种间的规律性不强, 说明该基因可能参与多个生理过程, 导致转录变化复杂。
种子萌发、植株生长都离不开内源激素的调控, BR与ABA、GA互作共同调控上述生理过程。转入BR合成关键酶基因DWF4的拟南芥克服了ABA对种子萌发的抑制作用[21], 同时外源BR处理还能提高番茄种子在胁迫下的萌发能力[22], 进一步研究揭示BRASSINOSTEROID INSENSITIVE2 和 ABSCISIC ACID INSENSITIVE5的互作, 使得BR在ABA抑制种子萌芽中起重要的拮抗作用[23]。除此以外, BR和GA在代谢和信号转导等过程中存在多方面的互作, GA信号中的DELLAs 能直接结合BR信号的转录因子BZR1并抑制其DNA结合活性, GA信号能降解DELLAs, 解除其对BZR1的抑制作用使BR信号通路运行[24, 25]; 水稻中的BZR1能结合合成GA的重要基因的启动子, 促进或抑制GA合成从而调节细胞伸长; 同时GA能够反馈抑制BR的生物合成和响应[26]。已知ABA促进马铃薯块茎休眠, GA3则促进萌芽, 块茎从休眠向萌芽的转变中ABA含量下降、GA3含量升高。本试验发现BR在块茎生理状态转变中扮演重要角色, 不仅其合成基因的表达量随时间升高, 外源BR处理能促进休眠解除和萌芽; 同时BR与GA3互配处理的发芽率高于单独处理。BR促进块茎休眠解除是否是它对ABA有拮抗作用, 与GA在促进萌芽方面有怎样的特殊互作机制, 这些问题都还需进一步研究。Korableva等[6]用21 nmol L-1 24-eBL处理完整块茎可延迟萌芽36~38 d, 与本试验BR处理所表现出的解除休眠作用相反, 两者的差异可能是不同品种对外源24-eBL浓度响应不同造成。
在水稻中的研究表明0.1 nmol L-124-eBL促进单个悬浮细胞伸长, 而1000 nmol L-1抑制细胞伸长, 但明显促进细胞和微丝骨架分裂[27], 这与本试验500 nmol L-1 24-eBL促进块茎解除休眠而萌芽, 但抑制芽的伸长生长相似。此外, 24-eBL还能抑制GA3处理造成的芽徒长现象, 两者互配作用使芽长介于单独处理之间。Zullo和Adam发现24-eBL喷施植株可使单株水稻种子鲜重增加22.0%, 干重增加31.5%[28]。在小麦花期外施24-eBL能提高籽粒的腺苷二磷酸葡萄糖焦磷酸化酶、可溶性淀粉合成酶、淀粉分支酶活性, 提高淀粉含量和品质[29]。改变内源BR含量或信号转导活性可以获得更高的产量并且植株表现更为整齐[30]。通过转入DWF4基因提高BR含量, 可使水稻单株粒重增加15%~44%, 进一步研究表明增加BR促进了葡萄糖向淀粉的同化作用[31]。Schrö der等[32]通过分析BRZ处理和BR缺乏突变体, 认为BR促进生长是靠增加碳源、能量的供应和利用。上述研究结果与本试验24-eBL处理明显促进结薯提前, 增加单株薯块重量相似, 推测BR可能促进叶片中合成的蔗糖向块茎转运以及向淀粉的同化、积累。
4 结论BR是块茎解除休眠和萌芽所必需的信号物质, 抑制它的合成基因表达会造成块茎萌芽受阻, 而它的信号转导和调控则是块茎生理状态转变所必经的过程。外源24-eBL具有解除块茎休眠作用, 但不促进芽的伸长生长。24-eBL与GA3存在互作效应, 两者配合处理可改变常规GA3单独处理造成的种薯特别是原原种萌芽不整齐、芽徒长问题, 使块茎达到更佳生理状态, 获得更高产量。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] |
