 , 陈新龙
, 陈新龙
* 通讯作者(Corresponding author): 何光华, E-mail: hegh@swu.edu.cn 第一作者联系方式: E-mail: xyhua0625@163.com
收稿日期:2016-09-11 接受日期:2017-01-21网络出版日期:2017-02-17基金:
摘要
关键词:水稻( Oryza sativa L .); 早衰; 淀粉积累; 遗传分析; 基因定位
Identification and Gene Mapping of Starch Accumulation and Early Senescence Leaf Mutant esl9 in Rice
XIAO Yan-Hua
 , CHEN Xin-Long
, CHEN Xin-Long
Fund:
Abstract
Keyword:Rice ( Oryza sativa L.); Early senescence; Starch accumulation; Genetic analysis; Gene mapping
Show Figures
Show Figures












衰老是植物生命活动自然结束的衰退过程, 是植物发育过程中必然经历的生命现象, 在农业生产中, 早衰现象普遍存在, 给农作物生物产量和经济产量都造成重大损失。植物早衰主要表现为叶片黄化、枯萎、籽粒灌浆不足、千粒重下降及结实率降低等[1]。水稻是重要的粮食作物及单子叶模式植物, 因此, 对其叶片衰老的物质形态、生理生化及基因克隆的研究在水稻的遗传改良和衰老机制调控等方面都有着十分重要的意义。
克隆衰老相关基因(senescence-associated genes, SAG)对通过分子育种手段提高水稻品质和产量至关重要, 采用图位克隆、抑制差减杂交等方法, 已经获得了大量的SAGs。Osh69编码碱性半乳糖苷酶, 对α -1, 6半乳糖和双半乳糖二酰基甘油都有很好的水解性, 在叶绿体半乳糖脂降解过程中起重要作用[2]; OsDOS编码一个CCCH-Type锌指蛋白, 其功能丧失可促进叶片衰老, 过量表达则延缓叶片衰老[3]。目前, 水稻中已经鉴定出不少的早衰突变体, 已完成分子定位的有psl1[4]、pgl2[5]、psl3[6]、esl2[7]、esl3[8]、esl4[9]、esl5[10]、esl6[11]、lad[12]等。但通过图位克隆得到的早衰基因并不多, OsDMI3编码一个Ca2+/CaM依赖型蛋白激酶, 参与叶片中ABA诱导的抗氧化防护过程, 其功能缺失会引起H2O2过量积累, 导致叶片衰老[13]; RLS1编码一个具有NB-ARM结构域的蛋白, 参与叶绿体的降解, 引发快速衰老[14]; LTN1编码一个包含泛素结合结构域的蛋白, 其功能缺失促进植株对磷酸盐(Pi)的吸收和转运, 导致地上部Pi的过量积累, 致使叶尖枯死, 植株衰老[15]; NOE1编码一个过氧化氢酶OsCATC, 其功能缺失会引起植株体内H2O2大量积累, 激活硝酸还原酶并促发一氧化氮(NO)的产生, 诱导叶片细胞死亡, 引起衰老[16]; SPL28编码一个网格相关受体蛋白复合体亚基(AP1M1), 定位于高尔基体, 参与调控高尔基体的物质运输途径和囊泡运输, 功能缺陷造成水稻过敏性反应, 叶片表现出类病斑, 植株早衰[17]。
目前已报道的早衰突变体均未发现叶片淀粉大量积累的现象, 也未发现由于叶片淀粉积累导致植株衰老。在植物中, 淀粉存在两种形式: 储藏型淀粉和过渡型淀粉, 叶片淀粉属于过渡型淀粉。植物白天光合作用剩余磷酸丙糖以过渡型淀粉暂时储存在叶片的叶绿体中, 夜晚则分解为葡萄糖和麦芽糖, 从叶绿体运输到细胞质基质, 用于合成蔗糖及维持植物的代谢生长[18]。如果淀粉代谢过程出现问题, 便会导致叶片中过渡型淀粉积累, 破坏类囊体结构, 光合作用受阻, 直接影响光合作用[19], 引起叶片衰老。目前, 对拟南芥淀粉代谢途径研究得较为透彻, 水稻中也已克隆一些淀粉降解相关基因, OsGWD1[20]编码葡聚糖水合双激酶, 是叶片淀粉降解途径的第一个关键酶, 作用于淀粉使其磷酸化, 其突变会导致叶片中淀粉过量积累; OsISA3[21]编码异淀粉酶, 用于水解支链淀粉的α -1, 6糖苷键, 在叶片淀粉降解过程中位于OsGWD的下游, 作用于磷酸化的淀粉, 释放出磷酸葡聚糖, 其功能缺陷会引起淀粉积累。
本研究通过EMS诱变保持系西农1B, 获得了一个新的早衰突变体esl9, 定位于第11染色体, 与已经报道的衰老基因均不等位。该突变体苗期叶片呈淡绿色, 分蘖期开始叶尖变黄, 黄化逐渐扩展至叶中上部, 但基部仍保持绿色, 该性状一直持续到成熟期, 直至生理衰老整个叶片变黄。与已往报道的早衰突变体不同的是, esl9叶片中积累了大量的淀粉颗粒, 推测由于淀粉积累导致叶片衰老。本研究对该突变体进行了表型鉴定、生理生化及组织化学分析、相关基因表达分析、基因初步和精细定位, 为该衰老基因的克隆及其调控机制的研究奠定基础。
1 材料与方法1.1 试验材料用EMS诱变籼型保持系西农1B, 从诱变群体中鉴定出一个叶片淀粉积累及早衰突变体esl9, 经过连续多代自交, 突变性状稳定遗传。56S是一个表型正常的籼型低温敏两系不育系, 以56S为母本, esl9为父本, 配制杂交组合, 利用其F1和F2分离群体进行遗传分析, 并用F2中的隐性单株进行基因定位。
1.2 农艺性状调查田间种植野生型及esl9各30株, 株行距25 cm × 30 cm, 重复3次, 成熟期分别随机取野生型和esl9各10株, 考查株高、穗长、有效穗、每穗粒数、每穗实粒数、千粒重、结实率、一次枝梗数等主要农艺性状。
1.3 光合色素含量及生理指标测定分别在苗期和分蘖期测定光合色素含量。由于突变体esl9苗期表型不明显, 测定时将倒一至倒四叶混合称量; 分蘖期分别测定倒一叶、倒二叶、倒三叶、倒四叶。参照文献[22], 将0.1 g左右的待测样品剪成2~3 mm的小块, 浸于25 mL丙酮:乙醇(1:1, v/v)混合液中, 黑暗处理24~48 h。用BECKMAN COULTER-DU720型分光光度计测定萃取液在663 nm、645 nm和470 nm波长下的吸光值, 每组取3份样品, 每份样品重复测量3次。最后, 按Lichtenthaler等修正的Arnon法[23]计算叶片光合色素含量, 并取其平均值。
分蘖期分别取野生型和突变体esl9新鲜叶片, 用南京建成科技有限公司生产的试剂盒, 参考其说明书, 测定过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性及过氧化氢(H2O2)、超氧阴离子(O2 ̄)和羟自由基(· OH)含量, 每个指标分别测定3次, 取其平均值。
1.4 细胞学观察分蘖期取野生型和突变体esl9倒二叶制作冷冻切片, 利用Nikon DS-Fi1c荧光显微镜, 分别在白光和488 nm紫外光条件下观察横切面结构。
同时期, 参照文献[24], 通过透射电镜观察野生型和突变体esl9的叶肉细胞结构, 先用戊二醛和锇酸双重固定, 后用不同浓度的乙醇逐级脱水, 再置换和包埋, 制作超薄切片, 最后用醋酸双氧铀和柠檬酸铅液双重染色, 利用H600型透射电镜观察并照相。
1.5 叶片碘-碘化钾染色及淀粉含量测定参照文献[25], 将8.8 g碘化钾加入30 mL预热的双蒸水, 缓慢搅拌, 待溶解后加入2.2 g结晶碘, 充分振荡至完全溶解, 再用双蒸水定容到1 L。从大田取回的材料放在丙酮:乙醇(1:1, v/v)混合液中24~48 h, 待完全脱色后, 用I2-KI染色, 约20 min后取出观察照相。
同时期先将叶片剪碎并研磨至粉末, 参照BioAssay Systems公司生产的试剂盒ESTA-100说明书, 称量0.03 g左右, 测定野生型和突变体esl9的叶片淀粉含量, 每个样品重复5次。
1.6 DNA、总RNA的提取及quantitative Real- time PCR采用改良的CTAB法[26]提取亲本、基因池及F2群体DNA。
使用天根生化科技(北京)有限公司植物总RNA提取纯化试剂盒提取分蘖期野生型和esl9相同部位叶片组织总RNA。反转录试剂盒(PrimeScript 1st Strand cDNA Synthesis Kit)由TaKaRa生物公司生产。以ACTIN基因为内参基因, 在Applied Biosystems公司7500 Real-time PCR仪上扩增, 按2-Δ Δ CT方法分析基因的相对表达量, 重复3次。
1.7 遗传分析及分子标记分析将籼型不育系56S与esl9杂交, F1自交得F2分离群体, 根据F1和F2表型进行遗传分析。选择F2中的隐性群体进行基因定位。采用BSA法[27], 分别取F2中正常表型株和突变表型株各10株的DNA等量混合, 构成正常基因池和突变基因池。参照http://www.gramene.org/microsat设计SSR和InDel分子标记序列, 对两个供试亲本(56S和esl9)进行多态性分析, 然后利用多态性标记分析两池间的多态性, 找出可能与目标基因连锁的标记。引物均由上海英骏生物技术有限公司合成。PCR体系为12.5 μ L, 包括1.0 μ L模板DNA、1.0 μ L 10 μ mol L-1引物、0.5 μ L 2.5 mmol L-1 dNTPs、1.25 μ L 10× PCR buffer、0.75 μ L 25 mmol L-1 MgCl2、7.9 μ L ddH2O和0.1 μ L 5 U μ L-1 rTaq DNA聚合酶。PCR程序为94℃预变性5 min; 94℃ 30 s, 55℃ 30 s, 72℃ 30 s, 35个循环; 再72℃延伸10 min。PCR产物经10%非变性聚丙烯酰胺凝胶电泳[28], 银染显色后, 观察记录扩增条带并照相。
1.8 遗传图谱的构建在F2定位群体中, 将具有56S带型的单株记为A, 具有esl9带型的单株记为B, 具有56S/esl9F1杂合带型的单株记为H。利用软件MapMaker 3.0, 对定位群体进行连锁数据分析, 绘制遗传图谱。
2 结果与分析2.1 形态及农艺性状在自然生理衰老前, 野生型西农1B的叶片一直保持绿色。esl9的叶片在苗期呈淡绿色(图1-A), 分蘖期除心叶外的叶片逐渐从叶尖开始黄化衰老(图1-B), 并逐渐扩展至叶中上部, 基部保持绿色(图1-C), 该性状一直持续到成熟, 并且分蘖数减少(图1-D), 成熟时一次枝梗数减少(图1-E), 结实率明显降低。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 野生型(WT)与突变体esl9的表型 A: 苗期野生型(WT)和突变体esl9植株; B: 分蘖期野生型(WT)和突变体esl9植株; C: 分蘖期野生型倒二叶(W2)和突变体esl9倒二叶(e2); D: 成熟期野生型(WT)和突变体esl9植株; E: 成熟期野生型(WT)和突变体esl9主穗。Fig. 1 Phenotypes of wild-type (WT) and esl9 A: plants of wild-type (WT) and esl9at seedling stage; B: plants of wild-type (WT) and esl9at tillering stage; C: the second upper leaves of wild-type (WT) and esl9at tillering stage; D: plants of wild-type (WT) and esl9 at maturity; E: main panicles of wild-type (WT) and esl9 at maturity. |
esl9的株高、穗长、有效穗数、每穗粒数、每穗实粒数、千粒重、结实率及一次枝梗数均有所降低, 除株高、穗长和千粒重显著下降外, 其余均极显著下降, 尤其是每穗实粒数, 仅为野生型的17.35% (表1)。表明叶片早衰对突变体农艺性状特别是产量性状有消极影响。
表1
Table 1
表1(Table 1)
| 表1 野生型(WT)和突变体esl9农艺性状 Table 1 Agronomic traits of wild-type (WT) and esl9 |
2.2 光合色素含量与野生型相比, 在苗期, esl9除类胡萝卜素含量极显著降低外, 叶绿素a和叶绿素b均显著降低(图2-A); 在分蘖期, 野生型与突变体不同部位叶片色素含量差异不一致, 新生叶片和最老的叶片差异较小, 而刚成熟叶片差异较大, esl9倒一叶的叶绿素b含量及倒四叶各项光合色素含量显著降低, 其余部位各种色素含量均极显著降低(图2-B), 其中倒二叶的下降幅度最大, 其叶绿素a、叶绿素b、类胡萝卜素及总叶绿素含量分别仅为野生型的43.75%、48.75%、44.36%和44.32%。倒一叶、倒三叶和倒四叶的叶绿素a含量分别为野生型的60.72%、55.68%和74.20%, 叶绿素b含量分别为野生型的82.07%、60.36%和75.91%, 类胡萝卜素含量分别是野生型的57.81%、59.15%和72.85%。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 野生型(WT)和突变体esl9的光合色素含量 A: 苗期野生型(WT)和突变体esl9的光合色素含量; B: 分蘖期野生型(WT)和突变体esl9倒一至倒四叶的光合色素含量。* 表示在0.05水平差异显著; * * 表示在0.01水平差异显著。Fig. 2 Photosynthetic pigment contents of wild-type (WT) and esl9 A: photosynthetic pigment contents of wild-type (WT) and esl9 at seedling stage; B: photosynthetic pigment contents of the first, second, third and fourth leaves of wild-type (WT) and esl9 at tillering stage. * Significant difference atP< 0.05 by t-test; * * significant difference atP< 0.01 by t-test. |
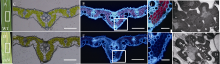
2.3 细胞学观察采用冷冻切片技术, 对野生型和突变体的相同对应部位叶片的叶肉细胞结构进行观察(图3-A, B)。在白光条件下, 野生型呈嫩绿色, 而esl9呈棕黄色(图3-C, D), 表明突变体中叶绿体结构已破坏。在488 nm紫外条件下, 野生型叶肉细胞呈红色(图3-E, G), 这是由于叶绿体不吸收红光, 反射后即呈红色荧光; 而esl9不呈红色(图3-F, H), 表明esl9叶肉细胞中叶绿体破坏, 光合色素降解, 这与光合色素含量测定结果相符。同时, 透射电镜结果显示, 与野生型相比, 突变体esl9的叶肉细胞内充斥着过多的淀粉颗粒。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 分蘖期野生型(WT)和突变体esl9的叶肉细胞结构 A, B: 野生型(WT)和突变体esl9倒二叶; C, D: 白光下野生型(WT)和突变体esl9叶片横切面(A和B中白框部位); E, F: 488 nm紫外光下野生型(WT)和突变体esl9叶片横切面; G, H: 488 nm紫外光下野生型(WT)和突变体esl9局部(E和F中白框部位)放大横切面; I, J: 透射电镜下野生型(WT)和突变体esl9叶片细胞结构(箭头所指表示淀粉颗粒, Bar=2 μ m)。C、E、G和I代表野生型(WT); D、F、H和J代表突变体esl9。图C、D、E和F中, Bar=10 μ m; 图G和H中, Bar=25 μ m。Fig. 3 Mesophyll cell structure of wild-type (WT) and esl9at tillering stage A, B: the second leaves of wild-type (WT) and esl9; C, D: transverse sections of leaves in wild-type (WT) and esl9 under white light (the white boxes of A and B); E, F: transverse sections of leaves in wild-type (WT) and esl9 under UV light at 488 nm; G, H: magnified view of boxed area of E and F, respectively; I, J: cell structure of leaves in wild-type (WT) and esl9 under transmission electron microscope(starch granules showed by the arrow, bar=2 μ m). The cell structures of wild-type (WT) and esl9 were showed in Figs. C, E, G, I, and in Figs. D, F, H, J, respectively. Bar=10 μ m in the Figs. C, D, E, and F; bar=25 μ m in the Figs. G and H. |
2.4 生理指标CAT、SOD和POD是植物细胞膜酶促防御系统的重要保护酶, 用于清除活性氧自由基。植物叶片在衰老过程中, 保护酶活性的改变引起细胞内活性氧代谢平衡破坏。细胞内过多的活性氧可直接破坏细胞膜结构, 引起细胞死亡, 导致衰老。因此, 这些保护酶的活性及活性氧的含量变化常被作为植物衰老的判断依据[29]。
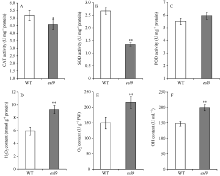
与野生型相比, esl9中CAT和SOD活力均不同程度降低, CAT活力显著降低(图4-A), SOD极显著降低(图4-B), 仅为野生型的48.25%。POD活性在esl9中略微升高, 但未达到显著水平(图4-C)。esl9的活性氧H2O2、O2 ̄和· OH含量分别是9.26 mmol g-1protein、216.72 U g-1FW和199.17 U mL-1, 与野生型的5.91 mmol g-1protein、150.18 U g-1FW和147.20 U mL-1相比, 均极显著升高, 分别上升了56%、44%和35% (图4-D~F)。说明突变体由于保护酶活力的降低, 导致细胞内活性氧不能及时被清除, 从而加剧叶片的衰老。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 分蘖期野生型(WT)和突变体esl9的生理特性 A: 过氧化氢酶(CAT)活力变化; B: 超氧化物歧化酶(SOD)活力变化; C:过氧化物酶(POD)活力变化; D: 过氧化氢(H2O2)含量变化; E: 超氧阴离子(O2 ̄)含量变化; F: 羟自由基(· OH)含量变化。* 表示在0.05水平差异显著; * * 表示在0.01水平差异显著。Fig. 4 Physiological characteristics of the wild-type (WT) and esl9at tillering stage A: activity of catalase (CAT); B: activity of superoxide dismutase (SOD); C: activity of peroxidase (POD); D: content of H2O2; E: content of superoxide anion (O2 ̄); F: content of hydroxylradical (· OH). * Significant difference atP< 0.05 by t-test; * * significant difference atP< 0.01 by t-test. |
2.5 淀粉含量分蘖期分别对野生型和esl9叶片进行碘-碘化钾染色, 野生型和esl9经过白天光合作用, 18:00时多余的磷酸丙糖合成淀粉储存在叶片, 均被染成蓝色(图5-A); 6:00时野生型的叶片淀粉经过一夜几乎完全分解, 而esl9中不同部位叶片的淀粉分解情况不同, 倒二叶中还有大量淀粉积累, 倒三叶中也有少量积累, 但心叶则没有淀粉积累(图5-B)。进一步测定倒二叶淀粉含量表明, esl9叶片晚上和早上淀粉含量均极显著高于野生型, 但突变体早上含量低于晚上, 说明该部位叶片的淀粉存在一个积累过程, 晚上也能分解, 但不能完全分解, 多余的淀粉逐渐积累并最终导致过度积累(图5-C)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 分蘖期野生型(WT)和突变体esl9的碘-碘化钾染色和淀粉含量测定 A: 分蘖期晚上野生型(WT)和突变体esl9碘-碘化钾染色(ED: end of day); B: 分蘖期早上野生型(WT)和突变体esl9心叶至倒三叶碘-碘化钾染色(EN: end of night); C: 分蘖期野生型(WT)和突变体esl9倒二叶淀粉含量测定。* 表示在0.05水平差异显著; * * 表示在0.01水平上异显著。Fig. 5 Iodine-iodide kalium dyeing and determination of starch contents of wild-type (WT) and esl9 at tillering stage A: iodine-iodide kalium dyeing of wild-type (WT) and esl9in the evening at tillering stage; B: iodine-iodide kalium dyeing of wild-type (WT) and esl9in the morning at tillering stage; C: determination of starch contents of the second leaves of wild-type (WT) and esl9at tillering stage. * Significant difference atP< 0.05 by t-test; * * significant difference atP< 0.01 by t-test. |
2.6 淀粉代谢相关基因的表达叶片淀粉代谢途径相关基因定量分析表明, 与野生型相比, esl9中编码ADP-葡萄糖焦磷酸化酶(AGPase)的几个同工酶AGPS1、AGPL1、AGPL2和AGPL3表达量均不同程度上调, 其中AGPS1、AGPL1和AGPL2达到极显著水平, AGPL3达到显著水平; 磷酸丙糖转运途径基因OsTPT1和OsTPT2 (均编码磷酸丙糖转运载体)表达量均极显著下调; 淀粉分解途径基因OsGWD (编码葡聚糖水合二激酶)、OsISA3 (编码异淀粉酶)表达量上调(图6), 引物序列见表2。说明光合初级产物磷酸丙糖(TP)的分配途径可能发生了改变, 在水稻中, 多数TP是通过位于叶绿体膜上的TPT转运到细胞质合成蔗糖, 多余的TP才在叶绿体中合成淀粉, 但在esl9中, TP更多被用于合成淀粉, 虽然过多淀粉促进淀粉分解基因的表达, 但不足以完全分解淀粉, 结果造成淀粉的日积月累, 最终淀粉积累过多而破坏了叶绿体。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 野生型(WT)和突变体esl9的淀粉代谢相关基因的定量分析 * 表示在0.05水平差异显著; * * 表示在0.01水平差异显著。Fig. 6 Quantitative real-time PCR analysis of starch metabolism-related genes of wild-type (WT) and esl9 * Significant difference atP< 0.05 by t-test; * * significant difference atP< 0.01 by t-test. |
表2
Table 2
表2(Table 2)
| 表2 淀粉代谢相关基因的定量引物 Table 2 Primers of starch metabolism-related genes used for quantitative real-time PCR |
2.7 遗传分析与基因定位以56S和esl9配制杂交组合, F1群体叶片均表现早衰黄化, F2群体中表现出明显的性状分离, 其中突变植株1941株, 正常植株596株, 经卡方测验, 其分离比例符合3:1 (χ 2=3.076 < χ 20.05, 1=3.84), 表明esl9受一对显性核基因的控制。
以F2中的596株隐性单株作为定位群体。选用平均分布于水稻12对染色体上的400对SSR引物对两个亲本进行多态性分析, 其中有80对表现出多态性。将这80对具有多态性的标记进一步对正常基因池和突变基因池进行连锁分析, 位于第11染色体上的RM6440和S11-26在2个基因池之间表现出多态性。利用F2群体中70株隐性单株进行验证, 表明这2个标记与突变位点连锁, 并将目的基因初步定位在RM6440和S11-26之间, 遗传距离分别为25.35 cM和26.49 cM。在初步定位区间内进一步开发SSR标记和InDel标记, 共筛出6对标记在亲本间呈现多态性, 分别是S11-32、S11-90、S11-110、ind11-1、S11-81、S11-87 (表3)。利用F2群体所有单株精细定位表明, S11-32处有12个交换株, S11-90处有4个, S11-110处有2个, ind11-1和S11-81处没有交换株, S11-87处有3个, 其中, S11-110处的2个交换株包含在S11-90处的4个之中, 而这4个又包含在S11-32处的12个交换株中, 并且两端标记S11-32和S11-87处的交换株之间不存在交叉。因此, 将ESL9最终定位在标记S11-110和S11-87之间, 物理距离为304.9 kb (图7)。通过gramene和ricedata等网站预测, 该区间共有41个开放阅读框, 其中14个编码转座子蛋白, 11个编码逆转座子蛋白, 9个编码表达蛋白, 2个编码托品酮还原酶II, 4个编码富含亮氨酸重复家族蛋白, 1个编码假定蛋白。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 ESL9基因在第11染色体上的分子定位 n=70: 初步定位群体数目; n=596: 精细定位群体数目。Fig. 7 Molecular mapping of ESL9 on rice chromosome 11 n=70: number of colony in primary mapping; n=596: number of colony in fine mapping. |
表3
Table 3
表3(Table 3)
| 表3 新开发的SSR和InDel标记 Table 3 Newly designed SSR and InDel markers |
3 讨论植物衰老是其生长发育必然经历的普遍现象, 是植物器官和个体生理机能自然衰退的过程。影响植物衰老的因素很多, 如外界环境中温度、水分、空气、光照及矿质营养的变化和激素的诱导均会加速或延缓衰老。从分子水平来看, 衰老相关基因的变异引起表达量的变化, 从而影响植物衰老[30]。
本研究中的突变体esl9是一个新型的叶片淀粉积累及早衰突变体, 与已往报道的突变体有所不同。psl1苗期黄化衰老; pgl2从抽穗前期到灌浆期结束, 倒四至心叶依次黄化衰老死亡; esl2孕穗期叶尖和叶边缘黄化衰老; esl3苗期褐化衰老, 一直持续到成熟期; esl4拔节期叶尖和叶边缘黄化衰老; esl5苗期叶片表现正常, 分蘖期呈黄绿色, 孕穗期开始叶中上部出现黄化; esl6四叶期待心叶全展时叶尖开始黄化, 并逐渐扩展[4, 5, 7, 8, 9, 10, 11]。这些衰老突变体中均未发现或未报道叶片有过多淀粉积累的现象, 本研究中, esl9苗期叶片呈淡绿色, 分蘖期除心叶外的叶片从叶尖开始黄化加深衰老, 逐渐扩展至叶中上部, 分蘖数减少, 植株矮化, 并且叶片中有大量淀粉积累。
叶片中的淀粉只是光合产物的一种暂时性储存形式, 晚上不进行光合作用时便会分解[31]。然而, 在突变体esl9中, 早上叶片中仍有大量淀粉积累。为了解淀粉在叶片中过多积累的原因, 我们对淀粉代谢相关基因作了定量分析, 发现淀粉合成基因在esl9中过量表达, 分解基因的表达量也不同程度地升高。由此推测, 可能由于叶片中淀粉合成增加, 促进淀粉分解, 但是, 促进作用有限, 分解速率不及合成速率, 导致叶片中合成的淀粉仍不能完全降解, 故引起叶绿体中淀粉颗粒积累。过多的淀粉粒堆积在叶绿体内, 不仅会压迫甚至损伤类囊体, 而且, 对光照会有遮挡作用, 直接阻碍光合膜对光的吸收, 导致光合系统受阻[32]。心叶由于光合作用较弱, 没有形成过多的淀粉积累或者积累不足以破坏叶绿体, 而老叶片由于叶绿体已破坏导致光合产物减少、淀粉合成减少, 其余叶片特别是倒二叶光合作用最强, 淀粉合成大于分解, 因此, 这可能是倒二叶染色最深、其余叶片染色较浅的原因。
植物中, 叶绿体内光合作用电子传递链是活性氧产生的主要场所之一, 活性氧的爆发会导致叶片衰老[33]。本研究中, esl9的活性氧O2 ̄、H2O2和· OH含量均显著高于野生型。SOD作为O2 ̄的清除因子, 可以通过歧化作用将O2 ̄转化为H2O2, 过多的H2O2被POD立即分解为完全无害的水[34]。然而, 与野生型相比, esl9中SOD极显著降低, 由此导致O2 ̄和H2O2不能被清除。同时, 过多的O2 ̄和H2O2可以反应生成· OH, 从而引起· OH在突变体中含量升高。细胞内CAT存在于线粒体和过氧化物酶体, 叶绿体中没有CAT[35], esl9中细胞CAT活性降低, 表明活性氧的积累也影响了细胞内呼吸作用等其他代谢过程。由此推测, esl9由于叶片中过多的淀粉积累, 破坏了叶绿体结构, 导致植株吸收光能的效率降低, CO2固定途径受阻, 此时, O2等便被作为电子受体, 形成O2 ̄, O2 ̄接着引发一系列的链式反应产生更多的H2O2和· OH[36]。这些活性氧的过多积累对植物有很大的毒害作用, 影响细胞内代谢过程, 引起膜脂过氧化作用, 导致细胞膜以及内膜系统损伤, 进一步引起细胞死亡[29], 导致植物衰老。
通过分子标记方法, 将ESL9基因定位在第11染色体上标记S11-110和S11-87之间, 该区间内包含41个注释基因, 有9个编码表达蛋白, 4个编码富含亮氨酸重复家族蛋白, 2个编码托品酮还原酶II, 1个编码假定蛋白, 其他编码转座子或反转座子蛋白。没有在该区间发现已报道的衰老相关基因, 编码富含亮氨酸蛋白的这4个基因几乎都含有NB-ARC结构域, 该结构域多存在于抗病蛋白中, 同时参与细胞程序性死亡, 引起衰老[37], 但是基因测序并未发现这4个基因在野生型和突变体中存在差异。由于该突变体与已往报道的有所不同, 其叶片中有大量淀粉积累, 我们推测其衰老是由叶片中淀粉积累所致。突变体ltn1的衰老是由于植株对Pi的吸收和转运增强, 引起叶片中Pi过量积累而导致叶尖枯死[15], Pi的吸收和转运与淀粉代谢存在一定关系, 但在我们的定位区间内并未发现Pi代谢相关基因, 说明两者衰老机制可能并不相同, 还需通过基因克隆及功能分析来进一步研究衰老机制。
4 结论esl9是一个新型的因叶片淀粉积累而导致的早衰突变体, 苗期叶片呈淡绿色, 分蘖期开始叶尖黄化, 随后逐渐扩展至叶中上部, 分蘖数减少, 植株矮化, 结实率降低。叶片中由于淀粉颗粒积累而破坏了叶绿体结构, 光合色素含量降低。esl9中保护酶SOD和CAT活性极显著降低, 活性氧O2 ̄、H2O2和· OH含量升高。该突变体受一对显性基因控制, 该基因被定位于第11染色体物理范围为304.9 kb的区间内。本研究结果为下一步的基因克隆和功能分析奠定了基础。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] | |
| [37] |
