 , 刘长英, 赵爱春, 王传宏, 蔡雨翔, 余茂德
, 刘长英, 赵爱春, 王传宏, 蔡雨翔, 余茂德
* 通讯作者(Corresponding author): 余茂德, E-mail:yumd@163.com, Tel: 023-68250191 第一作者联系方式: E-mail:yujian1949@163.com, Tel: 13251385318
收稿日期:2016-07-25 接受日期:2017-01-21网络出版日期:2017-02-17基金:
摘要
关键词:桑树; 乙烯; ACO; 启动子; GUS; 功能分析
Functional Analysis of 1-Aminocyclopropane-1-carboxylate Oxidase Gene’s Promoter in Mulberry
YU Jian
 , LIU Chang-Ying, ZHAO Ai-Chun, WANG Chuan-Hong, CAI Yu-Xiang, YU Mao-De
, LIU Chang-Ying, ZHAO Ai-Chun, WANG Chuan-Hong, CAI Yu-Xiang, YU Mao-De
Fund:
Abstract
Keyword:Mulberry; Ethylene; ACO; Promoter; GUS; Functional Analysis
Show Figures
Show Figures















乙烯是一种结构简单的植物气体激素, 在植物整个生命周期中调控多种生长发育和胁迫应激反应[1], 包括种子萌发、细胞伸长、下胚轴增粗、性别决定、果实成熟、叶片脱落、花的衰老、抵御病原体、机械创伤反应、盐胁迫和寒冷胁迫等[2, 3]。同时, 乙烯与其他多种内源激素也存在着紧密联系[4]。
ACO (1-Aminocyclopropane-1-carboxylate Oxidase, 1-氨基环丙烷羧酸氧化酶)是乙烯生物合成途径中的关键酶, 能够催化ACC (1-氨基环丙烷-1-羧酸, 1-Aminocyclopropane-1-carboxylic acid)形成乙烯, 最早被Yang等[5]****发现并命名为乙烯形成酶, 后来证实, ACO需要抗坏血酸和氧作为辅助底物, 且需要 Fe2+和CO2作为辅助因子, 因此称为ACC氧化酶[6]。ACO基因最先从番茄中克隆出来[7], 在黄瓜[8]、桃[9]、苹果[10, 11]等多种物种中也已被克隆获得, 且对其基因的表达也有一定研究。ACO基因可受激素、外界环境胁迫和植物发育等刺激而诱导表达, 甜瓜CmACO1基因的表达受乙烯诱导[12], 而黄瓜CsACO基因的表达则由IAA诱导[8]。外界刺激(如机械损伤)可诱导桃、番茄ACO基因的表达[9, 13]。
启动子是一段位于结构基因5° 端上游的DNA序列, 能够活化RNA聚合酶, 使之与模板DNA准确结合并具有转录起始的特异性, 是基因准确和有效转录所必需的结构[14]。近年来, 对ACO基因启动子的研究取得了很大进展, 已在甜瓜[15]、番茄[16]、桃[17]等物种中克隆到ACO基因启动子并对其功能进行了分析。毛娟等[18]发现甜瓜CmACO1启动子能调控GUS 基因在转基因甜瓜花药和成熟果实果皮中表达, 在根、茎、叶、幼果中不表达, 而在转基因烟草花瓣、花托、花梗、柱头以及3 d苗龄的幼苗中明显表达, 在其他组织都不表达[15]。桃PpACO1基因启动子导入番茄, 在叶片、子房、叶和果实中均有表达, 且受到丙烯和机械损伤正调节[17]。
桑树(Morus alba)是一种经济价值较高的木本植物, 不仅作为家蚕的饲料被大面积种植, 而且能结果, 生产桑椹。桑树适应很多逆境胁迫, 如寒冷、水淹、干旱以及盐碱环境[19]。本课题组在前期工作中, 从桑树中克隆了2个参与桑树乙烯生物合成的MaACO基因, 并对其功能初步分析, 证实其在桑椹发育中扮演着重要的角色[20, 21]。为进一步探究ACO基因在桑树生长发育和抵御外界胁迫中的作用模式, 本文对川桑MnACO基因的启动子序列进行克隆以及生物信息学分析, 构建pMnACO:GUS的植物表达载体, 通过农杆菌介导法转化拟南芥, 对阳性转基因植株进行非生物胁迫处理及GUS组织化学分析, 旨在探究桑树MnACO基因启动子在逆境中的作用, 为改良桑树品种奠定分子生物学基础。
1 材料与方法1.1 试验材料野生型拟南芥(Arabidopsis thaliana, 哥伦比亚型)、桑树品种川桑(Morus notobilis Scheneid), 及大肠杆菌DH5α 、农杆菌GV3101、植物表达载体pCAMBIA1301均由本实验室保存。
1.2MnACO基因启动子搜索与PCR扩增将川桑MnACO1 (Morus004820)和MnACO2 (Morus014137)基因CDS序列与川桑基因组比对, 查找其所在位置, 并通过川桑基因组数据库(http:// morus.swu.edu.cn/morusdb)调取CDS区域上游约1500 bp的序列, 设计PCR扩增引物(表1), 以川桑基因组DNA为模板进行PCR扩增, 反应程序为94℃预变性4 min; 94℃变性45 s, 51℃退火45 s, 72℃延伸60 s, 35个循环; 结束后72℃延伸10 min。扩增产物连接pMD19-T载体并转化大肠杆菌DH5α 感受态细胞, 筛选阳性单克隆并送南京华大科技公司测序。以plantcare (http://bioinforMntics.psb.ugent.be/webtools/ plantcare/html/)在线网站分析测序正确的启动子序列中的功能元件, 利用BDGP (eukaryotic sequencey, http://www.fruitfly.org/)预测转录起始位点。
1.3MnACO基因启动子表达载体的构建及拟南芥遗传转化根据克隆用到的启动子引物序列, 分别加上酶切位点EcoR I和Nco I (TaKaRa)作为新的克隆引物, 分别以1.2中测序正确的MnACO1、MnACO2基因启动子转化大肠杆菌DH5α 的菌液为扩增模板, 扩增程序为94℃预变性4 min; 94℃变性45 s, 58℃退火45 s, 72℃延伸60 s, 35个循环; 结束后72℃延伸10 min。分别用EcoR I和Nco I双酶切扩增产物和植物表达载体pCAMBIA1301, 回收启动子片段和表达载体片段, 将这些启动子片段替换pCAMBIA1301载体上启动GUS 基因表达的CaMV35S启动子, 与GUS基因融合构建植物表达载体并双酶切鉴定, 鉴定正确的重组表达载体被命名为pMnACO1::GUS和pMnACO2::GUS。以构建好的表达载体转化农杆菌菌株GV3101, 利用农杆菌介导的花序浸染法转化拟南芥[22, 23], 同时以pCAMBIA1301载体转化拟南芥作为阳性对照。
1.4 转基因拟南芥阳性植株的分子检测T0代种子分别经75%酒精清洗1~2 min, 无菌ddH2O清洗3次, 0.1% HgCl2清洗2 min, 无菌ddH2O清洗3次, 点播于含有20 mg L-1潮霉素和1%琼脂的1/2MS培养基上, 于室温25℃光照培养, 观察其生长情况。2周后, 将生长正常的拟南芥转移至灭菌土中。分别以转化植物表达载体pCAMBIA1301质粒的拟南芥和野生型拟南芥作阳性和阴性对照, 采用2× CTAB法[24](略有改动), 提取T1代植株基因组DNA, 利用1.2中引物和扩增程序, 筛选阳性植株。设计pCAMBIA1301载体中LB序列的2对反向的巢式引物(表1), 用反向PCR[24]技术检测其插入位点。
1.5 GUS组织化学染色及活性分析将PCR验证正确及确定插入位点的单拷贝T2代种子按1.4中方法消毒播种, 1周后转移至铺消毒脱脂棉和滤纸的培养皿中, 生长至2周时, 分别用0.3 mol L-1 NaCl、100 μ mol L-1ABA、500 μ mol L-1SA处理拟南芥, 用镊子夹伤叶片模拟机械损伤, 并设置阴性和阳性对照。于处理后的3、12和24 h对整个植株进行GUS染色[23], 利用体式显微镜观察和照相。参考雷建峰等[25]的方法测定GUS活性, 取每种处理的GUS染液上清液, 以现配制的GUS染液为对照, 在其最大光吸收波长620 nm处测定其光吸收值, 测定3次, 并用SPSS分析显著性差异。另在拟南芥播种后的1、2、4周和花序轴开始生长期, 以及成熟期进行GUS组织化学染色分析, 观察其不同生长阶段GUS的表达活性。
1.6 胁迫处理对桑幼苗MaACO基因表达的影响 1.6.1 桑幼苗胁迫处理 以桂优62为试验材料, 播种于铺消毒脱脂棉和滤纸的培养皿中, 2周后的幼苗分别经NaCl、损伤、ABA和SA处理, 于3、12和24 h取样, 以未处理的桑幼苗为对照, 按照北京全式金公司TransZol Plant RNA抽提试剂盒说明书提取总RNA。分别取适量体积RNA用1%的琼脂糖凝胶电泳检测, 并用紫外分光光度计检测总RNA的浓度。以总RNA为模板, 参照TaKaRa公司反转录酶M-MLV说明书合成cDNA第1链, 存于-20℃备用。
1.6.2 实时荧光定量PCR分析 以MaACO基因全长设计定量PCR引物[20](表1), 对胁迫后桑幼苗中MaACO1和MaACO2基因进行qRT-PCR分析。定量PCR试剂为SYBR Premix Ex TaqII (TaKaRa), 反应体系为Premix Ex Taq II (2× ) 10 μ L, 10 μ mol L-1上下游引物各0.8 μ L, 50× ROX Reference Dye (50× ) 0.4 μ L, cDNA 2 μ L和DEPC水6 μ L。参照TaKaRa公司的SYBR Premix Ex Taq试剂盒操作说明书进行Real-time PCR分析, 热启动程序为95℃ 30 s, 95℃ 5 s, 60℃ 30 s, 共40个循环, 对每个样品设3次重复取其平均值, 并以MaACTIN3 (HQ163775.1)[26]作为内参基因。用2-Δ Δ CT法计算基因的相对表达量, 以SPSS分析显著性差异。
表1
Table 1
表1(Table 1)
| 表1 本研究所用引物 Table 1 Primers sequences used in this study | ||||||||||||||||||||||||||||
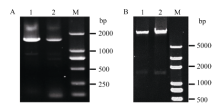
2 结果与分析2.1 MnACO基因启动子的克隆与序列分析通过PCR扩增获得MnACO1和MnACO2基因启动子序列, 它们分别为1518 bp和1429 bp (图1)。通过对启动子序列分析(图2和图3), 发现MnACO1和MnACO2启动子区域有较多的功能元件, 预测的转录起始位点分别在起始密码子上游-101 bp处和-106 bp处。在启动子区域含有大量的TATA-box和CAAT-box, 这些都是启动子发挥作用的重要元件。此外, 两者都含有响应外界环境刺激的TC-rich repeats 和响应赤霉素的GARE-motif, 含有响应外界热刺激的元件, MnACO1为MBS, 而MnACO2为HSE。MnACO1含有响应植物激素的AuxRE元件, MnACO2含有响应水杨酸的TCA-element元件。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 MnACO启动子序列扩增及重组质粒酶切鉴定Fig. 1 Amplification of promoters of MnACOand enzyme digestion of the recombinant plasmid A:MnACO启动子序列; 1:MnACO1启动子序列1518 bp: 2:MnACO2启动子序列1429 bp; M: Trans 5000; B: pMnACO::GUS重组表达载体双酶切; 1: pMnACO1::GUS; 2: pMnACO2::GUS; M: Trans 5000。 A: promoter sequences of MnACO; 1: promoter of MnACO1, 1518 bp; 2: promoter of MnACO2, 1429 bp; M: Trans 5000; B: enzyme digestion of recombinant plasmid pMnACO::GUS; 1: pMnACO1::GUS; 2: pMnACO2::GUS; M: Trans 5000. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 MnACO1启动子序列及主要顺式作用元件Fig. 2 Promoter sequence and major cis-acting elements of MnACO1 方框内为TATA-box; 阴影部分为CAAT-box; ↓ 处为转录起始位点; 其余元件均用下画线标出。 The boxes showed TATA-box; the shadows showed CAAT-box; ↓ is transcription start site; other elements were underlined. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 MnACO2启动子序列及主要顺式作用元件Fig. 3 Promoter sequence and major cis-acting elements of MnACO1 方框内为TATA-box; 阴影部分为CAAT-box; ↓ 处为转录起始位点; 其余元件均用下画线标出。 The boxes showed TATA-box; the shadows showed CAAT-box; ↓ is transcription start site; other elements were underlined. |
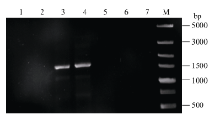
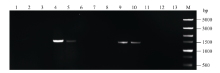
2.2 转基因拟南芥的分子检测将转化的T0代植株种子消毒后播于含20 mg L-1潮霉素的1/2MS培养基上, 大部分能正常萌发, 但根系不能正常生长, 一段时间后植株无法继续生长而死亡。经过初步筛选, 获得能正常生长的4株(编号1-1至1-4) pMnACO1::GUS和10株(编号2-1至2-10) pMnACO2::GUS以及2株转pCAMBIA1301载体的转基因拟南芥植株。提取拟南芥基因组并通过PCR检测(图4和图5), 分别进一步确定了2株(编号为1-3, 1-4)和4株(编号为2-4, 2-5, 2-9, 2-10)阳性转基因植株。反向PCR分析发现, 在编号为2-9的拟南芥中检测到2个插入位点, 其余株系中均只有1个插入位点。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 pMnACO1::GUS转基因拟南芥PCR检测Fig. 4 PCR amplification of transgenic Arabidopsis plants with pMnACO1::GUS 泳道1~4分别表示编号为1-1至1-4的转基因株系, 泳道5~6表示转pCAMBIA1301的转基因珠系, 泳道7表示野生型拟南芥, M: Trans 5000。 Lanes 1-4: the transgenic plants from number 1-1 to 1-4, Lanes 5-6: the pCAMBIA1301 transgenic plant, Lane 7: the wild typeArabidopsis, M: Trans 5000. |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 pMnACO2::GUS转基因拟南芥PCR检测Fig. 5 PCR amplification of transgenic Arabidopsis plants with pMnACO2::GUS 泳道1~10分别表示编号为2-1至2-10的转基因株系, 泳道11和泳道12表示转pCAMBIA1301的转基因珠系, 泳道13表示野生型拟南芥, M: Trans 5000。 Lanes 1-10: the transgenic plants from number 2-1 to 2-10, Lanes 11 and 12: the pCAMBIA1301 transgenic plant, Lane 13: the wild type Arabidopsis, M: Trans 5000. |
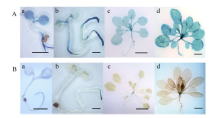
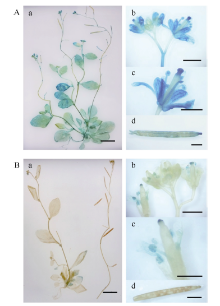
2.3 转基因拟南芥的GUS活性检测转基因拟南芥不同生长阶段GUS表达部位及表达活性不同。pMnACO1::GUS植株生长发育的各时期均能检测到GUS活性(图6-A), 且较pMnACO2:: GUS植株高。生长1周和2周的pMnACO2::GUS植株, 根尖中GUS活性较叶片高, 生长至4周时, 在根尖和莲座叶片中均没有检测到明显GUS活性, 仅莲座叶丛的中心有少量GUS活性(图6-B)。在pMnACO1::GUS植株的花瓣、花药、花丝以及柱头中有较高GUS活性, 花柱和花序轴中的活性较低; pMnACO2::GUS植株的花瓣、花药、花丝、柱头和茎生叶中, 能检测到GUS活性, 但花柱和花序轴中无GUS活性(图7-A)。pMnACO1::GUS果柄以及果荚中有少量GUS活性, 但pMnACO2::GUS的果荚和果柄中无GUS活性(图8-B)。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 pMnACO1::GUS(A)和pMnACO2::GUS(B)转基因植株不同生长阶段GUS活性Fig. 6 GUS activities during the development of pMnACO1::GUS (A) and pMnACO2::GUS (B) transgenic plants a: 幼苗生长1周; b: 幼苗生长2周; c: 幼苗生长4周; d: 幼苗花序轴开始生长。a, b的比例尺为1 mm; c, d的比例尺为1 cm。 a: one-week-old seedling; b: two-week-old seedling; c: four-week-old seedling; d: inflorescence start growing. Bars = 1 mm in a and b, Bars = 1 cm in c and d. |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 pMnACO1::GUS (A)和pMnACO2::GUS (B)转基因植株成熟期GUS活性Fig. 7 GUS activities in the adult plant of pMnACO1::GUS (A) and pMnACO2::GUS (B) a: 成熟期拟南芥整株中GUS活性检测; b, c: 花GUS活性检测; d: 果荚GUS活性检测; a比例尺为1 cm; b~d比例尺为1 mm。a: GUS activities in the whole adult plant; b, c: GUS activities in the inflorescence and flowers; d: GUS activities in the siliques; bars = 1 cm in a, bars = 1 mm in b-d. |
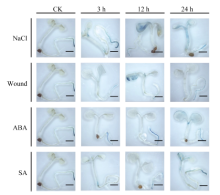
2.4 胁迫处理对MnACO启动子活性的影响 对单拷贝的T3代转基因拟南芥进行不同胁迫处理, 组织化学染色后发现, 阴性和阳性对照植株在处理前后均没有颜色改变, MnACO1和MnACO2启动子对不同胁迫呈现不同的响应模式, 且MnACO1启动子在经胁迫处理后GUS活性变化更明显(图8)。pMnACO1::GUS植株在经过300 mol L-1的NaCl处理后, 染色较其他处理深, 且随处理时间的延长而加深, 而对ABA的响应与NaCl相反, 在处理3 h后染色最深, 且随处理时间延长而变浅。经过损伤处理和SA处理3 h后的拟南芥染色比对照深, 随后颜色变化不明显。结合对每种处理GUS染色上清液光吸收值的测定发现, 总体而言, 转pMnACO1::GUS拟南芥植株中的GUS活性随处理时间延长而减弱, 而转pMnACO2::GUS拟南芥植株中的GUS活性随处理时间延长而增加(图10)。经NaCl处理后, 吸光值显著上升, 24 h最高。经ABA处理3 h后, 吸光值达到最高, 随后吸光值下降并保持平稳。植株经损伤处理和SA处理后, 吸光值的变化与GUS染色情况有差异, 经损伤处理12 h后, 吸光值显著上升, 随后下降。SA处理植株的前12 h, 吸光值无显著性差异, 处理后24 h, 吸光值显著上升。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 不同胁迫处理对pMnACO1::GUS植株GUS活性的影响Fig. 8 Effect of various stresses on the GUS activities of pMnACO1::GUS 比例尺为2 mm。Bars = 2 mm. |
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 不同胁迫处理对pMnACO2::GUS植株GUS活性的影响Fig. 9 Effect of various stresses on the GUS activities of pMnACO2::GUS 比例尺为2 mm。Bars = 2 mm. |
图10
| Figure OptionViewDownloadNew Window | |
 | 图10 pMnACO::GUS植株胁迫处理后GUS染液光吸收值 Fig. 10 Light absorption value at 620 nm of staining solution after stress treatment of pMnACO::GUS * 为差异性显著(P< 0.05)。* indicates significant difference (P < 0.05). |
MnACO2启动子经处理后其活性提高, 在根和叶片都有不同程度的表达(图9)。pMnACO2::GUS植株叶片经损伤12 h染色明显, 经NaCl、ABA和SA处理24 h, 叶片出现蓝色。GUS染色上清液光吸收值随NaCl处理时间的延长不断上升, 损伤处理后, 吸光值随时间先升高再降低, 12 h吸光值最高, 而经过ABA处理后吸光值在3 h急剧上升, 随后缓慢上升, 经SA处理3 h和12 h时的吸光值下降, 在24 h骤然升高。
2.5 桑幼苗中MaACO基因在逆境胁迫下的表达 为探究MnACO基因启动子与该基因表达之间的关系, 采用qRT-PCR检测2周苗龄的桑幼苗在经过胁迫处理后MaACO1和MaACO2的基因表达量。MaACO基因的表达模式与启动子GUS染液吸收值变化趋势一致(图10和图11), NaCl处理上调了MaACO1基因的表达, 3 h基因的表达量显著上调, 然后继续上调; 损伤处理上调MaACO1基因的表达, 12 h时表达量最高, 但是变化幅度较小; ABA处理3 h, MaACO1表达量迅速上调, 随后表达量下降; SA处理后, MaACO1表达量在24 h显著上升。MaACO2基因的表达也被NaCl上调; MaACO2基因表达量经ABA处理3 h显著上升, 随后上升趋势缓慢; SA处理桑幼苗3 h和12 h, MaACO2基因表达量都下降, 但在处理24 h升高。
图11
Fig. 11
| Figure OptionViewDownloadNew Window | |
 | 图11 桑幼苗胁迫处理后MaACO基因的相对表达量Fig. 11 Effect of various stresses on the MaACOexpression levels in mulberry seedlings * 为差异性显著(P< 0.05)。* indicates significant difference (P < 0.05). |
3 讨论根据启动子在植物生长发育中的作用和功能, 通常将其分为组成型启动子、诱导型启动子、组织特异型启动子以及双向和可变启动子, 一种类型的启动子同时兼具其他类型启动子的特性[27]。MnACO1和MnACO2基因及启动子在不同条件诱导后, 其表达水平都被上调, 由此可以证明, MnACO为诱导型启动子。同时, MnACO1启动子在转基因拟南芥生长发育的各时期和各组织中均能驱动GUS基因表达, MnACO2只驱动GUS基因在转基因拟南芥根尖和花中的表达, 因此, MnACO1具有组成型启动子特性, MnACO2启动子具有组织特异型启动子特性。MnACO1和MnACO2 启动子含有大量TATA- box、CAAT-box以及1个GARE-motif元件, 其最大的差异在于MnACO1启动子含有1个响应外界环境刺激的TC-rich repeats (图2), MnACO2却含有7个TC-rich repeats (图3), 这很可能是造成pMnACO1:: GUS和pMnACO2::GUS转基因植株中GUS活性随处理时间延长而出现差异的原因之一。
ACO基因的表达受多种环境因子的影响。损伤诱导植物产生大量乙烯[28]; ABA通常会下调ACO基因的表达[29, 30], 但在甜菜种子萌发[31]和番茄果实成熟[32]的过程中, ACO基因的表达受ABA上调; SA主要是通过抑制ACC合酶(ACS, 1-Aminocyclopropane-1-carboxylate synthase)的转录及其活性[33], 或抑制ACO活性[34], 或通过抑制组织中LOX活性来降低O2?速率[35], 从而抑制ACC向乙烯的转化, 也有报道称低浓度SA可以促使乙烯的生物合成[36]。桑树ACO基因及启动子的表达都能被NaCl、ABA处理上调, SA处理24 h以及损伤叶片也能一定程度上调其启动子和基因的表达, 且MnACO1对胁迫响应能力更强, 由此说明, 桑树在逆境胁迫时, MnACO启动子可能启动相关的应答机制, 进而调控基因的表达, 且MnACO1启动子发挥更重要的作用, 预示着可将其用来调控改良桑树品种抗逆性靶基因, 进而提高桑树的抗逆性, 充分发挥其经济价值。
植物中ACO基因是一个多基因家族, 其家族中的不同成员在转录水平和翻译水平、器官表达特异性、时空表达方面均存在差异。甜瓜CmACO1基因的转录水平高于家族中的其他成员[37], 猕猴桃ACO基因在花柱组织中的表达量高于内果皮[38], 白三叶草ACO基因家族中的不同基因可在不同器官组织中表达[39]。本实验发现, MnACO启动子的表达在各方面也存在差异, MnACO1启动子能驱动GUS在拟南芥的根、叶片、花瓣、花药、花丝、柱头以及果荚中表达, 且活性较MnACO2强, MnACO2启动子具组织特异性, 不能驱动GUS在转基因果荚中表达。先前研究也表明[20], MaACO1和 MaACO2基因在桑椹中的表达同其他组织相差无几或更低, 由此推测, MaACO2与果实成熟有关, 为将其启动子作为果实特异性启动子对桑椹品质改良提供有利证据。本实验仅将MnACO1和MnACO2基因启动子全长转化拟南芥, 对其功能进行初步分析, 关于MnACO1和MnACO2基因启动子结构差异及其在组织中的表达差异还有待进一步诱导处理和启动子缺失实验的验证。
4 结论桑树中MnACO1和MnACO2基因的启动子能够驱动GUS在转基因拟南芥中表达。MnACO1启动子在转基因拟南芥的根、叶片、花瓣、花药、花丝、柱头以及果荚中均有表达, 且启动活性较MnACO2强。胁迫处理能诱导转基因拟南芥中MnACO启动子活性增强, MnACO为诱导型启动子。MnACO1在转基因植株生长发育中可能发挥关键作用, 且对胁迫响应能力更强, 预示着可将其用来调控改良桑树品种抗逆性靶基因。MaACO2可能与果实成熟有关, 可将其启动子作为果实特异性启动子对桑椹品质进行合理改良。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] | |
| [37] | |
| [38] | |
| [39] |
