 , 陈应娟, 魏旭, 童华荣
, 陈应娟, 魏旭, 童华荣
*通讯作者(Corresponding author): 童华荣, E-mail:huart@swu.edu.cn, Tel: 023-68251298 第一作者联系方式: E-mail:yuanlianyu88@163.com, Tel: 18324183687
收稿日期:2016-08-23 接受日期:2017-01-21网络出版日期:2017-02-17基金:
摘要
关键词:茶树; 重金属耐受蛋白; 基因克隆; 锰
Cloning and Function Analysis of Metal Tolerance Gene ( CsMTP11) in Tea Plant ( Camellia sinensisL. O. Kuntze)
YUAN Lian-Yu
 , CHEN Ying-Juan, WEI Xu, TONG Hua-Rong
, CHEN Ying-Juan, WEI Xu, TONG Hua-Rong
Fund:
Abstract
Keyword: Camellia sinensis; Heavy metal tolerance; Gene clone; Mn
Show Figures
Show Figures


















茶是世界公认的三大天然饮料之一, 具有多项保健及药理功能。除了富含茶氨酸、茶多酚、咖啡碱等重要功能化合物外, 茶还含有硒、锌、锰等人体所必需的微量元素, 因此适量饮茶对人体健康是有非常有益的[1, 2]。人体内的锰元素可以参与许多酶的合成与激活, 能够加速脂肪氧化过程, 有利于保护心脑血管。但如果长期饮用含过量锰元素的茶也会导致慢性神经中毒[3, 4]。近年来, 工业“ 三废” 的超标排放、汽车尾气等有毒气体的排放、农药和化肥等的不合理施用等都严重地影响了土壤环境, 使土壤中重金属含量超标, 直接威胁到了茶叶的安全生产。也有研究表明部分茶园存在本身成土母质的重金属超标问题[5]。目前, 越来越多的研究开始关注茶叶的重金属含量及其对人类健康的影响。
茶树是一种“ 聚锰植物” , 其体内锰含量可高达1000 mg kg-1以上, 是其他植物的10倍左右[6]。对植物、动物和人来说, 锰均为必需的微量元素, 成年人一般一天需要通过饮食等摄入2.5~7.0 mg锰元素来满足身体新陈代谢的需要[7], 茶叶中30%的活性锰可以浸入到茶水中, 所以人们可以通过每天饮用一定数量的茶来补充Mn的摄入量[8, 9]。
锰是影响茶叶品质的重要微量元素, 是茶树呼吸作用和光合作用关键酶和激活剂的组成部分, 缺锰会严重影响茶树的光合作用, 进而影响茶叶的产量和质量。适量施加锰肥可以提高茶叶中赖氨酸、组氨酸等氨基酸的含量, 影响茶多酚和总氨基酸含量及比值, 提高绿茶的品质[6, 7, 8, 9, 10]。但土壤中锰元素过量也会对茶树造成毒害, 如日本茶园中锰元素过量导致茶树“ 黄化网斑病” , 呈现嫩叶焦尖、焦边, 叶片失绿变薄, 叶绿素含量降低等症状[10, 11]; 土壤中锰元素过量也会影响茶树对铁等其他矿质元素的吸收, 出现相应元素缺失的表型, 进而可能造成茶树矿质元素吸收利用的代谢紊乱[8, 9, 10, 11, 12]。
植物体细胞内重金属离子浓度的平衡主要由4类蛋白参与调控, 分别为ZIP蛋白(ZRT-IRT-like protein)、Nramp蛋白(natural resistance-associated macrophage protein)、HMA蛋白(P1B-ATPase or CPx-type ATPase)和CDF蛋白(cation diffusion facilitator)[13, 14]。其中CDF家族由400多个成员组成, 这类蛋白可将细胞内的重金属元素转到细胞外, 也可将细胞质中的重金属离子转入细胞器, 使之区室化, 从而降低重金属对细胞的毒害。这类蛋白的结构中具有高度保守的CDF序列, 包含4~6个跨膜结构域, 其N端和C端通常位于细胞质内; 这类蛋白通常还包含一个组氨酸富集区, 位于第4或第5个跨膜区或N端和C端[15, 16]。目前, 多种生物的CDF家族成员被克隆。系统进化和功能分析表明, 该类蛋白可分为Zn-CDF、Fe/Zn-CDF和Mn-CDF亚家族[17]。在植物中, CDF蛋白又被称为金属耐受蛋白(metal tolerance protein, MTP)。全基因组研究表明, 拟南芥基因组中包含12个编码MTP蛋白的基因, 其中对AtMTP1、AtMTP3、AtMTP4、AtMTP8、AtMTP1和AtMTP11研究得比较多[18, 19]; 水稻OsMTP1和OsMTP8、杨树PtMTP1、黄瓜CuMTP8等也被报道与重金属离子的转运相关[13, 20, 21, 22, 23]。拟南芥AtMTP1和AtMTP3分别被定位于质膜和液泡膜, 均参与锌离子的转运机调控过程[24, 25]; AtMTP11被定位于液泡膜前体组分, 与重金属锰的转运有关[26]; ShMTP1被定位于液泡膜, 可以将细胞中的锰离子转运入液泡, 从而降低细胞质中的重金属浓度, 达到耐受的效果[27]。
目前关于茶树重金属的研究主要关注于成品茶重金属含量及重金属对茶树生长发育等代谢过程的影响, 均为生化和生理方面的研究, 基本没有涉及分子水平的调控。本研究成功克隆茶树的重金属耐受蛋白基因CsMTP11, 并初步分析和验证了该基因的功能, 推测其在茶树重金属锰的转运过程中发挥重要作用。
1 材料与方法1.1 试验材料选用2年生中茶108扦插苗, 种植于西南大学试验基地。试剂主要有EASYspin Plus多糖多酚植物RNA提取试剂盒, 购自北京艾德莱生物科技有限公司; EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix、TransStart Taq DNA Polymerase, 购自北京全式金生物技术有限公司; SMARTer RACE 5′ /3′ Kit、克隆载体pMD18-T和大肠杆菌JM109感受态细胞, 购自TaKaRa公司(大连); DNA切胶回收试剂盒、Golden Easy PCR System、DNA Marker购自天根生化科技(北京)有限公司; SsoFastEvaGreen超混液购自Bio-Rad公司。YNB培养基及氨基酸购自Sigma公司; 引物合成和基因测序由英潍捷基(上海)贸易有限公司完成。
1.2 总RNA的提取及cDNA的合成分别取茶树的芽、茎、嫩叶、老叶、根、花、果等器官组织2 g, 锡箔纸包好, 液氮速冻后用于总RNA的提取, 提取参照艾德莱EASYspin Plus多糖多酚植物RNA提取试剂盒说明书步骤, DNase I (RNase free)消化所提取的总RNA中的基因组DNA, 纯化后的总RNA分别用于MTP11基因的克隆和表达分析。用于MTP11基因片段扩增和表达分析的总RNA参照全式金公司EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒说明书建立反转录体系, 利用42℃ 1 h; 85℃ 5 s的程序反转录成cDNA后作为模板。
1.3 茶树CsMTP11基因的克隆 从NCBI数据库下载已知植物的MTP11基因序列, 并进行多序列比对, 获得该类基因的保守序列, 并据此设计简并引物MTP11-280-L: TYCCYGGAA TGTCARAGGARGA和MTP11-1150-R: TCRTAATC DAGATGVACAAARGC, 用茶树不同组织的总RNA反转录的cDNA为模板, 克隆基因的保守片段, 并据此设计扩增5′ 和3′ 端的基因特异性引物GSP1- MTP11: CCAATGGCTGCATGCGTTTCTTTCC和GSP2-MTP11: GTTGGCTAGAAGTGAAACAACAG CC; 按照SMARTer RACE 5′ /3′ Kit试剂盒说明书, 分别合成5'-RACE-Ready cDNA和3'-RACE-Ready cDNA第一链作为模板, 分别用通用引物UPM和基因特异性引物MTP11-GSP1和MTP11-GSP2分别扩增基因5′ 和3′ 端序列, 所使用的扩增程序为94℃ 3 min; 94℃ 30 s, 68℃ 30 s, 72℃, 2 min; 34个循环后, 72℃再保温5 min, 琼脂糖电泳, 切胶回收, 连接pMD18-T载体测序, 分析测序结果, 获得该基因的5′ 和3′ 端序列, 并用Seqman软件拼接基因全长, 获得CsMTP11基因cDNA全长, 并据此设计引物MTP11- F: ATGGTGGAGCCGGTGGAGGGTACGA和MTP11- R: CTAAGAGTGTGACTGTGCGTGCTC, 进行PCR扩增验证CsMTP11基因cDNA全长。将PCR产物切胶回收后, 连接pMD18-T载体, 转化大肠杆菌JM109, 进行菌落PCR鉴定后选3个阳性克隆测序。
1.4 生物信息学分析利用Seqman软件对CsMTP11基因全长进行拼接, 用Editseq软件进行ORF查询; 在NCBI数据库中分别用Blast N和Blast X对核酸序列和氨基酸序列进行同源性分析; 用ClustalX1.8、DNAMAN和MEGA4.0进行多序列比对并构建系统进化树。用TMHMMServer v.2.0进行蛋白的跨膜结构预测。
1.5 CsMTP11基因表达模式分析在茶树开花的季节(2015年10月), 从茶园中选大小和长势基本一致的二年生中茶108扦插苗, 分别取茶树一芽二叶、根、茎、老叶、花等, 立即用铝箔纸包好, 液氮速冻后, -80℃冰箱保存, 用于qRT-PCR试验。重金属逆境胁迫处理时, 选取大小和生长势基本一致的二年生中茶108扦插苗, MS培养基水培1周后, 分别加入10 mmol L-1 MnSO4(T1处理)和1 mmol L-1 CoCl2 (T2处理), 与对照组(CK)一起继续培养3 d后, 取相同部位的叶片1 g作为qRT-PCR材料, 液氮速冻后, -80℃冰箱保存。荧光定量反应体系为SYBR Premix 10 μ L、上下游引物(10 μ mol L-1)各1 μ L、cDNA 2 μ L, 加水至终体积20 μ L, 充分混匀离心, 于Bio-Rad CFX96实时定量PCR仪上扩增, 反应程序为95℃ 30 s; 95℃ 5 s, 56℃ 5 s进行40个循环后增加熔解曲线。每个样品进行3次生物学重复和试验重复, 采用2-Δ Δ CT法分析结果, 用SigmaPlot软件分析差异显著性并绘图。
1.6 CsMTP11亚细胞定位分析将CsMTP11基因序列去掉终止子后, 克隆到pSAT6-EYFP载体上(酶切位点为EcoR I和BamH I), 形成CsMTP11-pSAT6-EYFP重组质粒, 用PEG法转入拟南芥原生质体并融合表达, 共定位Maker为质膜定位蛋白OsMCA1, 用激光共聚焦显微镜观察黄色荧光来确定CsMTP11-YFP融合蛋白的定位。
1.7 CsMTP11蛋白酵母突变株互补试验分析构建CsMTP11-pYES2重组质粒, 并采用PEG转化法将其转入酿酒酵母BY4741及其突变体cot1Δ (Y01613)和pmr1Δ (Y04534)(由中国科学院华南植物园植物表观遗传学实验室张美副研究员提供)中进行金属耐受性分析。获得阳性克隆后, 用液体SD培养基培养, 当菌液浓度均达到OD660=1.0时, 取出菌液, 分别稀释10、100和1000倍, 吸取2 μ L的原液及各稀释液点在空白及含重金属(200 μ mol L-1 Co和3 mmol L-1 Mn)的SD培养基上, 30℃培养6 d后, 记录其生长状况。接种相同浓度的菌株到新液体SD培养基及含有相应重金属(200 μ mol L-1 Co和1 mmol L-1 Mn)的液体SD培养基中继续培养, 每隔10 h测量一次菌液的吸光度值, 记录数据并绘制生长曲线图, 每个试验重复3次以上。
1.8 茶树叶片中锰元素含量的测定取不同品种的茶树相同位置的叶片, 冲洗去粘附泥土、尘土等杂质, 再用蒸馏水冲洗1~2次, 在室温下晾干并在90℃环境下30 min至烘干状态, 用粉碎机将样品粉碎至20~40目, 硝酸-H2O2(5:1)消解法分解, 火焰原子吸收光谱法测定茶树叶片中的锰元素含量。每个样品进行3次生物学重复和试验重复, 采用2-Δ Δ CT法分析结果, SigmaPlot软件分析差异显著性并绘图。
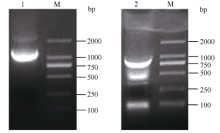
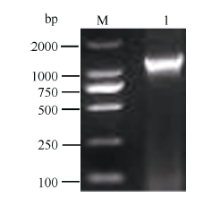
2 结果与分析2.1 CsMTP11基因全长序列的克隆及生物信息学分析根据GenBank已登录植物的MTP11核苷酸序列进行多序列比对, 发现该类基因在不同植物中高度保守, 且含有多个保守序列及结构域, 根据距离3′ 端约280 bp和距离5′ 端约100 bp的保守序列设计简并引物, 扩增茶树MTP11基因。利用不同组合的简并引物扩增, 获得长度为870 bp的单一片段, 与预期基本相符。在NCBI数据库中进行Blast比对, 发现该片段的序列与葡萄VvMTP11、柑橘CisMTP11和棉花GhMTP11基因的序列高度保守, 同源性90%以上, 将其初步命名为CsMTP11。根据该保守片段设计扩增其全长cDNA的引物。如图1所示, 克隆到CsMTP11基因的3′ 端和5′ 端序列, 大小分别为780 bp和1100 bp; 利用Seqman软件进行全长拼接, Editseq进行ORF查询, 并设计引物进行克隆验证(图2), 获得CsMTP11基因cDNA全长为1197 bp, 编码398个氨基酸残基, 且其序列已提交GenBank, 登录号为KX450265, 其编码蛋白分子量为44.85 kD, 等电点为5.34。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 茶树重金属耐受蛋白基因CsMTP11的5′ 端和3′ 端扩增产物电泳结果1: CsMTP11基因5′ 端RACE扩增产物; 2: CsMTP11基因3′ 端RACE扩增产物; M: DL2000。Fig. 1 Electrophoresis result of the amplification product for metal tolerance gene CsMTP115′ and 3′ sequence in tea plant1: 5′ -RACE amplification products of CsMTP11gene; 2: 3′ -RACE amplification products of CsMTP11gene; M: DL2000. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 茶树重金属耐受蛋白基因CsMTP11基因cDNA全长电泳结果1: CsMTP11基因cDNA全长扩增条带; M: DL2000。Fig. 2 Electrophoresis result of cDNA for metal tolerance gene CsMTP11in tea plant1: products of CsMTP11 gene cDNA; M: DL2000. |
2.2 茶树CsMTP11蛋白系统进化分析将推导的CsMTP11蛋白的氨基酸序列与16种已知植物MTP11进行多序列比对, 并采用NJ法进行CsMTP11氨基酸序列系统进化树分析。如图3所示, 在已知的16种植物金属耐受蛋白中, 茶树CsMTP11与葡萄VvMTP11的进化同源性最近, 其序列相似度高达90%。将与茶树进化同源性近的葡萄、甜橙及模式植物拟南芥的MTP11与CsMTP11 进行多序列比对, 如图4所示, 4种植物的MTP11蛋白质序列中均含有5个跨膜结构域和保守序列ASGLNTI-(X)20-G-XX-KNQRSY-X-DEGLNPQRST (第120~第172位氨基酸), 且第123位L, 第153位G, 第167、第168位的NP等位置的氨基酸高度保守。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 CsMTP11与其他物种MTP11氨基酸序列的系统进化树● 代表CsMTP11基因编码的氨基酸序列。Fig. 3 Phylogenetic tree of CsMTP11 and MTP11 amino acid sequence in other species● stands for amino acid sequence coded by CsMTP11 gene. |
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 茶树CsMTP11与其他植物的MTP11氨基酸序列比对黑色: 氨基酸一致性为100%; 深灰色: 氨基酸一致性为75%; 浅灰色: 氨基酸一致性为50%; 参与同源比对的蛋白为: VvMTP11(XP_002282508.1), AtMTP11(818530), CisMTP11(XM_006485959.2); ? : 跨膜结构域; □: 保守结构域; ▼: 高度保守的氨基酸。Fig. 4 Multiple alignment of deduced amino acid sequence of CsMTP11 with MTP11 proteins of other speciesBlack: amino acid identity is 100%; Dark grey: amino acid identity is 75%; Light grey: amino acid identity is 50%. The homologous sequences include VvMTP11 (XP_002282508.1), AtMTP11 (818530), CisMTP11 (XM_006485959.2). ? indicates predicted transmenbrane domains TMD1-TMD5; □ indicates conserved region; ▼ indicates conserved amino acid. |
2.3 CsMTP11蛋白的跨膜结构图5所示, 在线TMHMM Server v. 2.0软件分析CsMTP11氨基酸序列发现, 该蛋白含5个跨膜结构域, 即TMD1 (第112~第132位氨基酸, 长度为21个氨基酸残基)、TMD2 (第139~第159位氨基酸, 长度为21个氨基酸残基)、TMD3 (第174~第202位氨基酸残基, 长度为29个氨基酸残基)、TMD4 (第218~第239位氨基酸, 长度为22个氨基酸残基)和TMD5 (第258~第286位氨基酸, 长度为29个氨基酸残基)。如图4所示, 拟南芥、甜橙、葡萄的MTP11蛋白也含有相同的跨膜结构域, 这也是Mn-CDF亚家族蛋白的特有属性之一。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 CsMTP11蛋白跨膜区预测Fig. 5 Prediction of transmenbrane domains of CsMTP11 protein |
2.4 CsMTP11基因组织表达特异性分析用荧光定量PCR方法检测CsMTP11基因组织表达特异性, 结果表明, CsMTP11基因在不同茶树品种和茶树不同组织中的表达均存在较明显差异。如图6所示, 黄山苦茶叶片中CsMTP11基因的表达量高于中茶108、碧香早、黄山苦茶、蜀永1号和福鼎大白茶。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 CsMTP11基因在不同品种茶树叶片中的相对表达水平茶树品种为ZH108 (中茶108)、BXZ (碧香早)、HK (黄山苦茶)、SY (蜀永1号)、FD (福鼎大白茶); “ * ” 表示差异显著水平(P< 0.05)。Fig. 6 Relative expression level of CsMTP11gene in leaves of various tea plantsTea varieties are ZH108 (Zhongcha 108), BXZ (Bixiangzao), HK (Huangshankucha), SY (Shuyong 1), FD (Fudingdabaicha). “ * ” represents the significant difference (P< 0.05). |
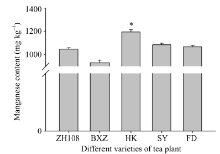
如图7所示, 黄山苦茶叶片中锰元素的含量低于中茶108、碧香早、黄山苦茶、蜀永1号和福鼎大白茶, 且不同茶树品种片叶中锰元素的含量与其CsMTP11基因的表达量成正比。如图8所示, CsMTP11基因在茶树老叶中的表达量最高, 是表达量最低的根部该基因表达量的10倍。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 不同品种茶树叶片中的锰含量图中用到的茶树品种为ZH108 (中茶108)、BXZ (碧香早)、HK (黄山苦茶)、SY (蜀永1号)、FD (福鼎大白茶); “ * ” 表示差异显著水平(P< 0.05)。Fig. 7 Manganese content in leaves of different varieties of tea plantsTea varieties are ZH108 (Zhongcha108), BXZ (Bixiangzao), HK (Huangshankucha), SY (Shuyong 1), FD (Fudingdabaicha). “ * ” represents the significant difference (P< 0.05). |
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 CsMTP11基因在茶树不同组织器官中的相对表达水平R: 根; St: 茎; OL: 老叶; YL: 嫩叶; B: 芽; Fl: 花; Fr: 茶果。“ * ” 表示差异显著水平(P< 0.05), “ * * ” 表示差异极显著水平(P< 0.01)。Fig. 8 Relative expression level of CsMTP11gene in various tea plant organsR: root; St: stem; OL: old leaf; YL: young leaf; B: bud; Fl: flower; Fr: fruit. “ * ” represents significant difference (P < 0.05), “ * * ” represents significant difference (P < 0.01). |
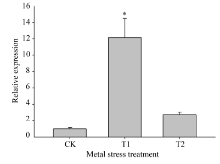
如图9所示, 与对照(MS培养液培养)相比, 在对茶苗进行10 mmol L-1 Mn离子胁迫处理条件下(T1处理), CsMTP11基因在茶树叶片中的表达量上调10倍以上; 在对茶苗进行1 mmol L-1 Co离子胁迫处理条件下(T2处理), CsMTP11基因在茶树叶片中的表达量增加2倍左右。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 CsMTP11基因在不同重金属胁迫条件下的相对表达水平CK: 对照MS培养基; T1: 10 mmol L-1 Mn离子胁迫处理; T2: 1 mmol L-1Co离子胁迫处理。在同一处理时间内, “ * ” 表示差异显著水平(P< 0.05)。Fig. 9 Relative expression level of CsMTP11gene under heavy metal stressCK: no metal contrast; T1: 10 mmol L-1Mn; T2: 1 mmol L-1 Co. “ * ” represent significant difference at the same treatment(P < 0.05). |
2.5 CsMTP11亚细胞定位分析在线软件(http://www.csbio.sjtu.edu.cn/bioinf/Cell- PLoc/)预测CsMTP11定位于质膜, 用CsMTP11-YFP融合蛋白在拟南芥原生质体中的融合表达验证了该预测结果。图10所示, 与YFP空载体对照相比, CsMTP11-YFP融合蛋白的黄色荧光信号分布在质膜中, 且与质膜共定位阳性对照信号的位置完全吻合, 由此可见, 茶树CsMTP11蛋白定位于细胞质膜。
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 CsMTP11蛋白在拟南芥原生质体中的亚细胞定位Marker: 定位于细胞质膜的共定位标记。Fig. 10 Subcellular localization of CsMTP11 protein in Arabidopsis protoplastMarker: that localized in the plasma membranes. |
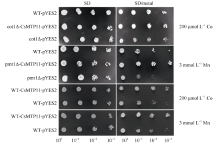
2.6 CsMTP11蛋白在酿酒酵母及其突变株中的功能互补将CsMTP11基因异源表达于酿酒酵母及其突变体中, 来验证其重金属转运功能及转运的重金属种类。如图11所示, 在SD培养基上, 空载体菌株与异源表达CsMTP11的菌株的生长速度并无明显差异。但在SD/3 mmol L-1 Mn离子胁迫的培养基上, 与空载体对照pmr1Δ -pYES2菌株相比, pmr1Δ - CsMTP11-pYES2菌株的生长状态更好, 生长速度更快; 同样, 与空载体对照菌株cot1Δ -pYES2相比, cot1Δ -CsMTP11-pYES2菌株在SD/200 μ mol L-1 Co离子的培养基上生长状态更好, 生长速度更快。另外, 在野生型酿酒酵母中异源表达CsMTP11基因, 也可以显著提高其对重金属Co和Mn胁迫的耐受性。
图11
Fig. 11
| Figure OptionViewDownloadNew Window | |
 | 图11 CsMTP11基因在酿酒酵母及其突变株中的异源表达用液体培养基培养已转入pYES2或pYES2-CsMTP11的酵母突变株和野生型酵母菌培养至OD660=0.8, 并进行稀释。分别取2 μ L原液和稀释液滴加在SD和SD/metal固体培养基上, 30℃恒温培养6 d后观察。Fig. 11 Heterologous complementation of CsMTP11 gene in S. cerevisiae wild type and its mutantsS. cerevisiae wild type (WT) and mutant strains were transformed with pYES2 or pYES2-CsMTP11. Yeast cultures were adjusted to OD660 = 0.8, and 2 μ L serial dilutions were spotted on SD medium or SD with different heavy metals. Plates were incubated for six days at 30° C. |
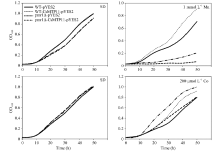
为验证酵母及其突变株的生长速度, 本研究分析了其在不同培养基中的生长曲线。如图12所示, 在液体SD培养基培养时, 菌株WT-CsMTP11- pYES2与WT-pYES2菌株、cot1Δ -CsMTP11-pYES2与cot1Δ -pYES2菌株、pmr1Δ -CsMTP11-pYES2与pmr1Δ -pYES2菌株的生长速度均比较一致。但在含有重金属元素的(200 μ mol L-1 Co和1 mmol L-1 Mn)液体SD培养基中培养时, 在相同时间内, 异源表达CsMTP11蛋白的WT-CsMTP11-pYES2、cot1Δ - CsMTP11-pYES2、pmr1Δ -CsMTP11-pYES2菌株的生长速度也分别快于其空载体对照菌株, 结果与固体SD培养基上培养的结果一致。由此可知在酵母及其突变株中异源表达CsMTP11基因可以提高其对重金属锰和钴的耐受性。
图12
Fig. 12
| Figure OptionViewDownloadNew Window | |
 | 图12 异源表达CsMTP11基因的酿酒酵母及其突变株的生长曲线Fig. 12 Growth curves of S. cerevisiae wild type (WT) and mutant strains transformed withCsMTP11 gene |
3 讨论重金属耐受蛋白MTP是植物中的CDF, 是植物中最早被报道的重金属转运蛋白之一, 广泛存在于细菌、真菌、植物、动物体内, 在植物细胞维持重金属浓度平衡过程中发挥重要作用[28]。本研究克隆的茶树CsMTP11基因cDNA, 全长为1197 bp, 编码398个氨基酸残基, 编码蛋白的等电点为5.34, 分子量为44.85 kD。茶树CsMTP11与葡萄VvMTP11具有高度的保守性, 其氨基酸序列相似度高达90%; 与拟南芥中AtMTP11的相似度也高达81%。虽然MTP蛋白通常具有4~6个跨膜结构域, 但Mn-CDF亚家族成员只有4~5个, 一部分人类和酵母的CDF成员有12~15个[20, 27, 28, 29]。本研究发现CsMTP11蛋白序列中具有5个跨膜结构域(图4和图5), 且含有保守序列ASGLNTI-(X)20-G-XX-KNQRSY-X-DEGLNP QRST (第120~第172位氨基酸)和特定位点的保守氨基酸, 这些均为Mn-CDF亚家族的属性。由此我们推测CsMTP11也属于Mn-CDF亚家族, 可能与AtMTP11具有类似的转运锰的功能。
锰是比较难转移的金属元素, 在茶树不同器官和组织中的含量存在明显差异, 一般衰老组织中的含量高于幼嫩组织, 且叶片中的含量高于芽、茎和根[10]。本研究表明, CsMTP11基因在老叶中的表达量远高于嫩叶, 且在叶片中的表达量高于芽、茎和根, 这与茶树中的锰离子分布的部位也是吻合的; 黄山苦茶叶片中锰元素的含量低于中茶108、碧香早、黄山苦茶、蜀永1号及福鼎大白茶叶片中的锰含量, 且不同茶树品种片叶中锰元素的含量与其CsMTP11基因的表达量成正比; 锰和钴等重金属逆境胁迫可以诱导CsMTP11基因的上调表达, 尤其是锰胁迫处理, 可以使CsMTP11基因的表达提高10倍以上(图9)。综上所述CsMTP11基因是参与重金属锰的转运过程的。
植物在进化中形成了多种耐受重金属毒害的机制: (1)位于质膜的转运蛋白将进入细胞的重金属离子排出细胞; (2)位于液泡等细胞器膜的转运蛋白将进入细胞内的金属离子转入细胞器等结构, 使之区室化, 降低细胞质中金属离子浓度; (3)细胞质内的生物大分子等与金属离子形成稳定的螯合态[30]。本研究发现茶树CsMTP11定位于质膜(图10), 推测其功能是将进入茶树细胞的重金属离子转运到细胞外, 降低茶树细胞中重金属离子的浓度, 从而达到“ 耐受” 的效果, 与其他已知的Mn-CDF亚家族成员的定位和功能类似。
酿酒酵母一直是研究重金属转运功能的重要材料, 例如, 杨树PtMTP1基因在酿酒酵母突变株中异源表达可以互补其对Zn离子的敏感性, 水稻OsMTP1基因的异源表达可以提高酵母突变株对Ni和Cd离子的耐受性[13]。植物体内重金属离子的转运过程是个复杂的网络, 转运时没有严格的特异性, 转运蛋白在转运某一种重金属离子时, 可能会提高结构或密度等相似的离子的转运效率。与此同时, 可能有多种转运蛋白参与同一种金属离子的转运过程。例如, 拟南芥AtMTP1和AtMTP3都属于Zn-CDF亚家族, 均定位于液泡膜, 且同时参与锌和钴的转运过程[24, 31, 32]。本研究表明, CsMTP11基因的异源表达虽然不能完全互补突变株pmr1Δ 对Mn离子的敏感性, 但可显著提高其对Mn离子的耐受性; 且可提高突变株cot1Δ 对Co离子的耐受性。与此同时, CsMTP11基因的异源表达也可以提高野生型酿酒酵母对Mn和Co离子的耐受性。据此, 我们推测茶树CsMTP11蛋白参与Mn离子的转运过程, 可以将进入细胞的锰离子转运出细胞, 同时也提高了Co离子的转运效率, 从而同时提高了酿酒酵母及其突变株对重金属Mn和Co离子的耐受性。但茶树中可能存在多个MTP蛋白, 其中有多个成员参与Mn和Co离子的转运调控过程, 且不同成员之间是
协同关系, 而不是冗余关系, 所以CsMTP11基因的异源表达并不能完全互补酵母突变株对重金属Mn和Co敏感的表型。也就是说茶树体内锰离子的转运过程可能是由多个基因协同调控。
本研究初步分析了茶树重金属转运蛋白CsMTP11的功能, 我们将做更多深入研究来解释茶树体内重金属转运的机制, 为茶树遗传育种及茶园的科学施肥提供参考。
4 结论从茶树品种中茶108中克隆到一个全长cDNA, 为1197 bp, 编码398个氨基酸残基的重金属耐受蛋白基因, 并命名为CsMTP11 (metal tolrance protein 11 in Camellia sinensis), 该基因的表达存在组织特异性, 且受重金属胁迫诱导, 其编码的蛋白属于CDF家族的Mn-CDF亚家族, 定位于质膜, 具有重金属锰的转运功能。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] |
