 , 钟理
, 钟理 , 张小红
, 张小红
* 通讯作者(Corresponding authors): 陈明, E-mail:chenming02@caas.cn, Tel: 010-82108750; 张小红, E-mail:zhxh2493@126.com, Tel: 13572869993 第一作者联系方式: E-mail:fenglu063925@126.com, Tel: 010-82108750
收稿日期:2015-02-11 接受日期:2015-06-01网络出版日期:2015-06-29基金:
摘要
关键词:谷子; V-H+-ATPase E亚基基因; 耐盐性; 作用机制
Overexpression of Vacuole H+-ATPase E Subunit Gene SiVHA-Efrom Foxtail Millet Enhances Salt Resistance in Transgenic Arabidopsis thaliana
FENG Lu
 , ZHONG Li
, ZHONG Li , ZHANG Xiao-Hong
, ZHANG Xiao-Hong
Abstract
Keyword: Foxtail millet; V-type H+-ATPase E subunit gene; Salt stress tolerance; Mechanism
Show Figures
Show Figures





















土壤盐碱化是影响植物生长发育和制约农业生产最主要的非生物胁迫之一[1]。盐胁迫通过破坏植物细胞膜, 从而破坏细胞内离子平衡[2]。以植物通过限制Na+的吸收, 加速Na+排出或将Na+隔离至液泡中3种方式来减缓Na+的毒害[3, 4]。植物液泡H+-ATPase是一类膜结合转运蛋白, 能够利用水解ATP产生的能量将质子泵入膜内, 产生维持离子转运的驱动力, 在维持植物体内离子平衡中发挥重要功能。V-H+-ATPase是由13个亚基组成的一个蛋白质复合体, 包括V1(640 kD)和V0(260 kD) 2个亚蛋白复合体。V1在液泡膜外, 由A~H 8个亚基组成, 呈球茎状, 属于催化区域。V0在液泡膜内, 由a、c、c'、c''和d 5个亚基组成, 呈柄状, 属于质子传导区[5, 6, 7]。
在拟南芥中有E1、E2、E3三个VHA-E亚基, 其中E1在植物的生长过程中作为持家基因存在, E3在外围组织表达, E2是花粉特异表达基因。系统发育分析表明VHA-E2是进化比较古老的一个分支, 其序列保守, 且限制雄性配子体的发育, 被独立进化出来[8]。Zhang等[13]报道小麦VHA-E定位于胞质内。Detmer等[9]研究发现, 冰叶日中花V-H+-ATPase的A、B、E、c亚基受盐胁迫诱导表达。盐地碱蓬在盐胁迫条件下, 叶片V-H+-ATPase水解活性增加[10]。当植物处于逆境时, V-H+-ATPase能够通过结构、状态以及体内数量的改变减小逆境对植物造成的伤害[11]。He等[12]和Zhang等[13]研究表明, 过表达V-H+- ATPase的A、a、C、c、D、d、F、G、H、E亚基都可以提高植物的耐盐性, 其中c亚基可能对V-H+-ATPase的功能起重要调控作用。然而, 对于这些亚基的耐盐机制研究甚少。
谷子在8000多年以前在中国北部已经被驯化[14]。由于谷子具备优良的耐逆性, 至今仍被广泛种植于世界的干旱和半干旱地区, 特别是在中国和印度[15]。除此以外, 谷子基因组小(约510 Mb), 近亲繁殖率高, 与几种重要的禾本科作物、饲料、燃料和生物能源草类亲缘关系近, 因此, 谷子是一种理想的禾本科作物抗逆性研究的模式植物[16, 17, 18, 19]。
本试验从谷子中克隆到V-H+-ATPase E亚基基因SiVHA-E, 拟通过遗传转化及生物信息手段, 了解该基因的功能及亲缘关系, 为作物耐盐遗传改良提供新的候选基因, 并为了解V-H+-ATPase的耐盐机制提供新的线索。
1 材料与方法1.1 试验材料野生型拟南芥(Ecotype Columbia, Col-0)由本实验室保存, 谷子种子由中国农业科学院作物科学研究所刁现民课题组提供。在温室中培养谷子和拟南芥幼苗, 培养室温度为22℃, 湿度65%, 光照周期为16 h/8 h。农杆菌菌株GV3101, GFP质粒及pBI121质粒由本实验室保存。
1.2 SiVHA-E基因进化树分析使用NCBI Blast (http://blast.ncbi.nlm.nih.gov/Blast. cgi)查找V-H+-ATPaseE亚基序列, 采用ClustalX (1.83)进行序列比对, 采用MEGA绘制进化树。
1.3 SiVHA-E基因的表达分析及盐害胁迫相关基因的表达分析将谷子在温室中培养10 d后, 取长势一致的植株, 用含150 mmol L-1 NaCl和0.05 mmol L-1总氮的培养基处理, 表达谱分析取样时间点为处理后0、1、6、12、24和48 h; 其他胁迫处理的条件为低温(4℃), ABA (100 µ mol L-1)、MeJA (50 µ mol L-1)和SA (50 µ mol L-1), 分别在处理后0、1、6、12和24 h取样, 样品经液氮速冻后, -80℃保存。以谷子SiACTIN(Si001873m.g)基因为内参基因。Real-time PCR反应条件为95℃预变性15 min; 95℃ 10 s, 60℃ 20 s, 72℃ 32 s, 40个循环(表1)。
将野生型(WT)和转基因株系7 (在幼苗盐胁迫处理条件下, 转基因株系7的耐盐性较株系3、4更强, 因此选择转基因株系7进行基因的表达检测)在MS上培养2周, 用含120 mmol L-1 NaCl的液体MS培养基培养24 h。样品经液氮速冻, -80℃保存。使用RT-PCR方法检测盐胁迫相关基因AVP1(At1g15690)及AVA-P2(At1g19910)。以拟南芥AtActin(At3g18780)基因为内参基因。Real-time PCR反应条件同上(表1)。
1.4 SiVHA-E的亚细胞定位分析将SiVHA-E和GFP融合表达, 构建35S:: SiVHA-E-GFP定位载体, 原生质体以生长3周的拟南芥叶片为材料, 制备及转化参考Yoo等方法[20], 转化时, 每100 μ L原生质体加入10 µ g目标质粒, 转入10 µ g GFP空载体作为对照, 使用PEG-4000诱导转化, 过夜培养16 h, 在激光共聚焦显微镜下观察。
表1
Table 1
表1(Table 1)
| 表1 引物序列 Table 1 Primers sequence |
1.5 SiVHA-E基因的拟南芥转化及阳性鉴定参考Xu等方法[21], 将SiVHA-E基因插入植物表达载体pBI121, 载体启动子为CaMV 35S。将转基因拟南芥在含有25 µ g L-1卡那抗生素的MS培养基培养, 4℃春化3 d后, 光照培养14 d, 样品经液氮冷冻, 置-80℃保存, 用于提取RNA。以拟南芥AtACTIN基因为内参基因。使用半定量方法检测转基因植株的基因表达量。
1.6 SiVHA-E转基因拟南芥的耐盐性鉴定1.6.1 种子萌发期 SiVHA-E转基因株系及野生型拟南芥种子经过NaClO消毒后, 播于MS、60、90、120 mmol L-1 NaCl培养基上(每种处理3次重复, 每个材料每个皿点64粒种子), 4℃春化4 d后, 将其放在光照培养室培养(22℃, 光照16 h/8 h黑暗), 从第2天开始统计萌发率, 连续统计5 d。
1.6.2 幼苗期 SiVHA-E转基因株系及野生型拟南芥种子经过NaClO消毒后, 播于MS培养基, 4℃春化3 d后, 将其放在光照培养室培养, 4 d后转移至含有60、90和120 mmol L-1 NaCl培养基上, 竖直放置培养7 d后照相, 测量植物根长及鲜重, 每个试验3次重复。
1.6.3 成苗期 SiVHA-E转基因株系及野生型拟南芥种子经消毒后, 种于MS培养基上, 春化3 d后放在光照培养室培养, 1周后移栽土里生长, 4周后用120 mmol L-1 NaCl盐溶液处理16 d, 照相, 同时测定生理指标。
1.7 转基因植株体内Na+含量、叶绿素含量、相对含水量的测定 转基因拟南芥在土里生长3周后, 用120 mmol L-1 NaCl溶液处理15 d, 然后将植物地上部分取下清洗干净, 105℃高温处理10 min, 80℃烘箱烘48 h。参照Ding和Zhu[22]的方法检测Na+ 含量。将SiVHA-E转基因株系及野生型拟南芥培养7 d后移至含90 mmol L-1 NaCl培养基上培养10 d, 按照李合生[23]的方法检测叶绿素含量。测定鲜重, 在105℃杀青30 min, 70℃烘干, 称重。相对含水量=(鲜重-干重) / 鲜重× 100%
1.8 SiVHA-E转基因拟南芥ABA敏感性鉴定将转基因株系及野生型拟南芥种子分别播于MS和含1 µ mol L-1、2 µ mol L-1 ABA的培养基上, 4℃春化3 d, 转至光照培养室(22℃, 光照16 h / 8 h黑暗)培养, 从第2天开始统计萌发率, 连续统计9 d。
1.9 统计分析用Microsoft Excel、Prism 5软件处理数据和绘图, 用SPSS软件进行方差分析, 用t检验进行显著性分析(P< 0.05)。
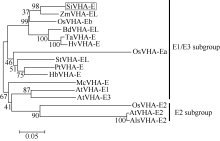
2 结果与分析2.1 SiVHA-E基因的克隆及进化树分析参考已报道的小麦V-H+-ATPase E基因TaVH+- ATPase E的序列[24], 与谷子基因组数据库(phytozome v9.1:home)比对, 搜索到谷子V-H+-ATPase E基因, 命名为SiVHA-E。SiVHA-E的序列全长为696 bp, 编码231个氨基酸。氨基酸序列比对分析表明, V-H+- ATPase E亚基类基因在N端很保守, 在C端序列变异较大(图1)。采用邻接法构建进化树(图2), 可以看出V-H+-ATPase E亚基包含E1、E2、E3三种类型, 其中E1和E3同源关系较近, 形成1个亚族, E2独立分化形成单独亚族。谷子的SiVHA-E属于E1和E3亚族, 与玉米的ZmVHA-EL亲缘关系最近。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 不同物种来源的V-H+-ATPase E亚基基因氨基酸序列比对分析水稻: OsVHA-E2, NP_001055857.1, OsVHA-Ea, NP_001042437.1, OsVHA-Eb, NP_001043767.1; 拟南芥: AtVHA-E1, NM_117185.4, AtVHA-E2, NM_111690.1, AtVHA-E3, NM_105094.2; 小麦: TaVHA-E, DQ272489.1; 大麦: HvVHA-E, U84269.1; 玉米: ZmVHA-EL, NM_001147854.1; 二穗短柄草: BdVHA-EL, XM_003569441.1; 毛果杨: PtVHA-E, XM_006371074.1; 橡胶树: HbVHA-E, KC509435.1; 冰叶日中花: McVHA-E, X92118.1; 马铃薯: StVHA-EL, XM_006352196.1; 琴叶拟南芥: AlVHA-E, XM_002882525.1。Fig. 1 Amino acid sequence alignment of the V-H+-ATPase E subunit genes in foxtail millet and other speciesGenBank accession number of each genes: Oryza sativa: OsVHA-E2, NP_001055857.1, OsVHA-Ea, NP_001042437.1, OsVHA-Eb, NP_001043767.1; Arabidopsis thaliana: AtVHA-E1, NM_117185.4, AtVHA-E2, NM_111690.1, AtVHA-E3, NM_105094.2; Triticum aestivum: TaVHA-E, DQ272489.1, Hordeum vulgare: HvVHA-E, U84269.1; Zea mays: ZmVHA-EL, NM_001147854.1; Brachypodium distachyon: BdVHA-EL, XM_003569441.1; Populus trichocarpa: PtVHA-E, XM_006371074.1; Hevea brasiliensis: HbVHA-E, KC509435.1; Mesembryanthemum crystallinum: McVHA-E, X92118.1; Solanum tuberosum: StVHA-EL, XM_006352196.1; Arabidopsis lyrata: AlVHA-E, XM_002882525.1. |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 不同物种来源的V-H+-ATPase E亚基进化树Fig. 2 Phylogenetic tree of the V-H+-ATPase E subunit genes in foxtail millet and other species |
2.2 SiVHA-E基因的表达特性及亚细胞定位分析表达特性分析结果表明, SiVHA-E的表达受盐胁迫诱导, 在48 h表达量达到最高, 约为对照的2.8倍(图3); 在4℃低温处理下, 该基因表达量呈现下调趋势; 在低氮(0.05 mmol L-1) 处理下, 在24 h达到最低值, 约下降至完全培养基上培养的2.5倍; 在ABA (100 µ mol L-1) 处理下, SiVHA-E的表达量先上升后下降, 并在1 h达到最大值, 约是完全培养基上培养的2.5倍左右; 在MeJA (50 µ mol L-1)处理下, SiVHA-E表达量上升, 在24 h约为完全培养基上培养的7.5倍; 在SA处理下, SiVHA-E的表达量先上升后下降, 并在6 h达到最大值, 约是完全培养基上培养的7倍左右。由上述试验证明, SiVHA-E基因除受高盐等胁迫处理的诱导表达外, 还参与ABA等激素的响应过程。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 不同处理条件下谷子SiVHA-E基因的表达标以不同小写字母的柱值差异显著(P< 0.05); 标以不同大写字母的柱值差异极显著(P< 0.01)。Fig. 3 Expression of SiVHA-E in foxtail millet under various stress conditionsBars superscripted by different lowercase letters are significantly different at P< 0.05 and those by different capital letters are significantly different atP< 0.01. |
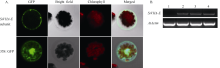
拟南芥原生质体亚细胞定位分析结果表明, SiVHA-E蛋白定位于液泡膜上(图4-A)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 SiVHA-E蛋白亚细胞定位分析及转基因拟南芥的阳性检测结果A: SiVHA-E subunit, SiVHA-E蛋白定位; 35::GFP, GFP对照载体; B: 转基因拟南芥的阳性检测(1, WT; 2~4, 转基因株系3, 4, 7)。Fig. 4 Subcellular localization of SiVHA-E in plant cells and positive detection of transgenic Arabidopsis thalianaA: SiVHA-E subunit, the subcellular localization of the SiVHA-E; 35::GFP, the GFP control vector; B: transgenic Arabidopsis thaliana positive detection (1, WT; 2-4, transgenic plants 3, 4, 7). |
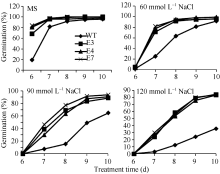
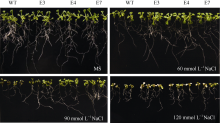
2.3 SiVHA-E转基因拟南芥的耐盐性鉴定将SiVHA-E在拟南芥中过表达, 获得8个转基因株系, 选择其中SiVHA-E基因表达较高的3个株系(E3、E4和E7)进行耐盐性鉴定, 3个株系目标基因表达情况见图4-B。耐盐性鉴定结果表明, 在种子萌发期, 在60 mmol L-1 NaCl处理条件下, SiVHA-E过表达植株的萌发率与野生型拟南芥(WT)无明显差异, 而在90 mmol L-1 NaCl和120 mmol L-1 NaCl处理条件下, SiVHA-E过表达株系E3、E4和E7的萌发率显著高于对照(图5和图6); 在苗期, SiVHA-E过表达株系E3、E4、E7在60 mmol L-1 NaCl、90 mmol L-1 NaCl、120 mmol L-1 NaCl处理条件下, 主根长显著高于WT, 在90 mmol L-1 NaCl处理条件下, SiVHA-E过表达株系E3、E4、E7的整株鲜重显著高于WT (图7和图8); 在成苗期, SiVHA-E过表达株系E3、E4、E7的耐盐性优于WT (图9)。以上实验结果表明, 过表达SiVHA-E基因的转基因拟南芥在萌发期、苗期以及成苗期均比WT耐盐性显著提高。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 SiVHA-E转基因株系在种子萌发期耐盐性鉴定Fig. 5 Salt tolerance analysis of SiVHA-E transgenic plants during seed germination stage |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 SiVHA-E转基因株系在种子萌发期耐盐性萌发率Fig. 6 Salt tolerant germination rate of SiVHA-E transgenic plants during seed germination stage |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 SiVHA-E转基因株系在幼苗期耐盐性表型Fig. 7 Phenotype of SiVHA-Etransgenic plants on salt medium during seedling stage |
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 SiVHA-E转基因株系在幼苗期盐胁迫下的根长及鲜重* 表示差异达0.05显著水平, * * 表示差异达0.01显著水平。Fig. 8 Root length and fresh weight of transgenic plants under high salt stress condition during seedling stage* Significantly different at the 0.05 probability level. * * Significantly different at the 0.01 probability level. |
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 SiVHA-E转基因株系成苗期耐盐性表型Fig. 9 Phenotype of SiVHA-Etransgenic plants on salt medium during mature period |
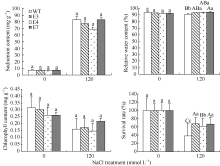
2.4 SiVHA-E转基因植株中Na+含量、相对含水量、存活率及叶绿素含量图10表明, E3、E4、E7的存活率显著高于WT, 分别高29.3%、23.6%、28.9%; 转基因植株E3、E4、E7的相对含水量显著高于WT, 分别高3.0%、3.0%、3.7%; E3和E7的叶绿素含量高于WT; E3和E4的体内钠离子含量低于WT。
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 高盐胁迫处理下SiVHA-E转基因株系的部分生理指标标以不同小写字母的柱值差异显著(P< 0.05); 标以不同大写字母的柱值差异极显著(P< 0.01)。Fig. 10 Part physiological indices of transgenic lines under high salt stressBars superscripted by different lowercase letters are significantly different at P< 0.05 and those by different capital letters are significantly different atP< 0.01. |
2.5 SiVHA-E转基因拟南芥对ABA敏感性在含有ABA的培养基上, 随着ABA浓度的增加转基因拟南芥相对于WT表现变绿率更低, 表明SiVHA-E转基因拟南芥对ABA的敏感性比WT更高(图11和图12)。
图11
Fig. 11
| Figure OptionViewDownloadNew Window | |
 | 图11 SiVHA-E转基因株系在ABA处理下种子萌发表型Fig. 11 Phenotype of SiVHA-Etransgenic plants on ABA medium during seed germination stage |
图12
Fig. 12
| Figure OptionViewDownloadNew Window | |
 | 图12 SiVHA-E转基因株系(E3, E4, E7)在ABA处理条件下的种子萌发率分析Fig. 12 Germination rate of SiVHA-E transgenic lines (E3, E4, and E7) under ABA treatment |
2.6 盐胁迫相关基因在SiVHA-E转基因植物中的表达 120 mmol L-1 NaCl处理下, 在SiVHA-E转基因株系E7中, 检测了盐胁迫相关基因氢离子焦磷酸化酶基因AVP1及V-H+-ATPase c亚基基因AVA-P2的表达量。结果显示, 在盐胁迫条件下, 在转基因植物中, 这2个基因的表达比野生型拟南芥都增加(图13), 证明SiVHA-E转基因植物耐盐性提高可能与这2个盐胁迫相关基因的上调表达相关。
图13
Fig. 13
| Figure OptionViewDownloadNew Window | |
 | 图13 在NaCl处理下盐胁迫相关基因AVP1和AVA-P2在SiVHA-E转基因植物中的表达Fig. 13 Expression of salt stress related genes AVP1 and AVA-P2 in SiVHA-E transgenic plants under NaCl stress condition |
3 讨论质子泵是一种推动质子跨膜运输的转运系统, 在植物生长发育及细胞信号转导过程中起重要的作用。目前已知的膜质子泵有H+-ATPase和H+-PPase两类。而H+-ATPase又分为3类, 分别为质膜上的P-H+-ATPase (plasma membrane H+-ATPase), 叶绿体和线粒体上的F-H+-ATPase (F-type ATP synthase)以及液泡膜上的V-H+-ATPase (vacuolar H+-ATPase)。V-ATPase是一类持家基因及胁迫响应的酶[25]。该酶在植物的生长发育及胁迫响应中具有非常重要的作用。本实验表达谱分析表明, SiVHA-E基因能够不同程度地响应盐和冷胁迫以及植物激素ABA、SA、MeJA等, 而这些植物激素与植物抵御外界胁迫有关, 表明该基因在逆境胁迫应答中起重要的作用。
高盐胁迫主要通过Na+毒害、渗透胁迫等方式影响植物的生长发育。SOS信号途径是植物响应高盐胁迫的主要信号途径, V-H+-ATPase参与SOS信号途径[26]。盐胁迫造成Na+大量进入细胞, 刺激胞内Ca2+浓度升高, SOS3接受Ca2+信号而激活SOS2, 活化的SOS2一方面可以激活质膜上的SOS1向胞外泵Na+, 另一方面可激活液泡膜上的Na+/H+反转蛋白、V-H+-ATPase等实现Na+在液泡中的贮藏[26]。将Na+隔离进液泡是植物增加耐盐性的三大手段之一[27]。本研究表明过表达H+-ATPase E亚基基因SiVHA-E可以显著提高植物的耐盐性(图4~图9), 转基因植物相对于野生型拟南芥在高盐胁迫下存活率显著提高, 但是体内的Na+略有降低(图10)。因此, 推测SiVHA-E转基因植物可能是通过SiVHA-E介导的信号途径激活V-H+-ATPase将Na+贮藏在液泡中, 减少Na+毒害, 从而提高耐盐性。
Barkla等[28]、Janicka-Russak等[29]、Zhi等[30]和Kasai等[31]报道, 在盐胁迫下V-H+-ATPase活性增加, 内源ABA水平也显著提高, 而且外源ABA能增加V-H+-ATPase的活性。本研究发现ABA处理能引起SiVHA-E转录水平增加, 而且在种子萌发期SiVHA- E过表达株系对ABA更敏感(图11和图12), 证明过表达SiVHA-E基因正向调控植物ABA信号途径。ABA可以促进植物气孔关闭, 减少水分蒸腾[32, 33]。本研究结果显示, 在盐胁迫下, 转基因株系的相对含水量显著高于野生型拟南芥, 证明SiVHA-E基因过表达可能通过增强ABA信号途径介导的植物气孔关闭, 减少体内水分的流失, 减弱转基因植物渗透胁迫作用, 从而增强植物的耐盐性。
本研究结果显示在SiVHA-E转基因拟南芥中, 在盐胁迫下, 另一个重要的质子泵氢离子焦磷酸化酶基因AVP1和V-H+-ATPase c亚基基因AVA-P2的表达相比于野生型拟南芥都上调(图13)。在植物中过表达AVP1基因可以增强植物的耐盐性, V-H+-ATPase活性的提高也可以提高植物的耐盐性[26, 34, 35]。由此推测SiVHA-E转基因植物耐盐性提高可能与这2个盐胁迫相关基因的上调表达相关。
4 结论从谷子中克隆到液泡H+-ATPase E亚基基因SiVHA-E, SiVHA-E蛋白定位于液泡膜, 并可被NaCl、MeJA、SA、ABA等胁迫诱导表达。SiVHA-E过表达株系在种子萌发期、幼苗期以及成苗期的耐盐性均高于野生型拟南芥, 这些结果表明SiVHA-E基因在植物的耐盐胁迫调控过程中发挥重要作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] |
