 , 陈如凯
, 陈如凯* 通讯作者(Corresponding authors): 阙友雄, E-mail: queyouxiong@126.com; 陈如凯, E-mail: fafu948@126.com 收稿日期:2014-12-19 基金:
摘要
关键词:甘蔗; CIPK基因; 同源克隆; 生物信息学; 实时定量PCR
Cloning and Expression Analysis of CIPK Gene in Sugarcane
HUANG Long, SU Wei-Hua, ZHANG Yu-Ye, HUANG Ning, LING Hui, XIAO Xin-Huan, QUE You-Xiong
 , CHEN Ru-Kai
, CHEN Ru-KaiAbstract
Keyword:Sugarcane;
Show Figures
Show Figures









在适应复杂多变自然环境的进化中, 植物已形成了完善的信号转导网络。Ca+是植物信号转导网络中不可或缺的第二信使, 在介导植物生长发育的生理生化过程中起着关键作用[1]。高等植物在响应外界的各种信号和胁迫(光、干旱、激素等)时, 细胞内Ca+水平会发生相应的变化。前人研究发现, 植物体内存在钙调素CaM (Calmodulin)及其相关蛋白、钙依赖性蛋白激酶(Ca2+- dependent protein kinases, CDPK)、钙调磷酸酶B类蛋白(calcineurin B-like protein, CBL) 3种Ca+结合蛋白[2]。CBL本身没有活性, 在识别钙信号后, 必须和靶蛋白CIPK (CBL-interacting protein kinase)结合形成复合体才能发挥作用[3]。CIPK是植物特有的一类丝氨酸/苏氨酸蛋白激酶, 属于第3类的SnRK3激酶(SNF1-related protein kinase3, SnRK3)[4]。对模式植物拟南芥CIPK蛋白的结构分析表明, 所有的CIPK蛋白含有N-端的激酶蛋白域和C-端的调节域, 后者为CBL特异接合的NAF结构域[4]和能与PP2C相互作用的PPI结构域[5]。这2个结构域的结构特性使得CIPK成为一个连接CBL蛋白和PP2C蛋白传导信号途径的重要分子开关, 从而能更好地发挥其信号调控作用[6]。
甘蔗不仅是最重要的糖类作物, 还是高生物量的能源作物。蔗糖约占我国食糖总产的92%。我国甘蔗85%种植于盐碱地及旱地。近年频发的干旱、寒害和日趋严重的病虫害等, 对甘蔗生产造成极大的危害。因此, 挖掘甘蔗抗逆基因以及解析甘蔗抗逆的分子机制是甘蔗抗逆育种的重要基础工作[7]。前人研究表明, CIPK在植物响应逆境胁迫中发挥着重要的作用, 该基因与非生物逆境胁迫(干旱、高盐、ABA等)的信号传导密切相关[8]。迄今, 在拟南芥和水稻中已克隆鉴定出25个CIPK基因和30个CIPK基因[9], 从杨树中鉴定了27个CIPK基因[9], 从玉米中克隆得到了43个CIPK基因[2], 从油菜中克隆获得了23个CIPK基因[10], 从高粱中鉴定出了32个CIPK基因[11]。同一植物的不同CIPK基因以及不同植物相同的CIPK基因在定位和功能上都有较大的差异。Priji和Hemaprabha[12]研究表明甘蔗在ABA信号通路上存在一个CIPK14基因可以响应干旱胁迫。邓小敏[13]揭示了小麦的TaCIPK14基因受冷、渗透胁迫和盐胁迫等非生物胁迫以及相关信号分子ABA、乙烯和H2O2的诱导。Kim等[9]研究揭示, AtCIPK3在拟南芥中的过量表达可以提高其对盐胁迫的忍耐力。Chen等[14]研究结果表明拟南芥中AtCIPK6在响应干旱胁迫的ABA通路上发挥关键作用。Zhao和Su[2]认为ZmCIPK16与PEG、NaCl、ABA、干旱胁迫有很大的关系。边鸣镝等[15]在对玉米CIPK的研究中发现, 该基因在甘露醇、氯化钠、ABA和4℃低温诱导时, 在玉米幼苗叶片中表达量明显上升。但是, 国内外尚未见甘蔗中有关CIPK基因克隆和功能研究的报道。
本研究分析该基因在不同组织及各种外源胁迫下的表达特性, 以期进一步揭示该其的功能和作用模式。
1 材料与方法1.1 试验材料甘蔗品种崖城05-179由福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室提供。PrimeScript RT- PCR Kit反转录试剂盒, SYBR Green PCR Master Mix Kit (Roche), 购买自TaKaRa公司(中国大连)。
1.2 材料处理在大田中随机选取生长健壮并且长势一致的崖城05-179蔗茎, 并砍成单芽茎段, 洗净后放入50℃水浴锅, 100 mg L-1多菌灵(福瑞得, 中国河南郑州)水溶液中温育40 min, 随后将单芽茎段种到高压无菌土中(16 h/8 h, 光/暗, 28℃)培养至长出蔗苗, 切下蔗苗用于无菌苗的诱导、扩繁以及生根。将组培苗放入蒸馏水中预培养10 d, 随后选取生长一致的小苗用于处理, 根据预备实验结果确定取样时间点。每个处理分别设3个生物学重复, 在平底试管中培养, 胁迫组处理条件为水杨酸(5 mmol L-1SA水溶液)、茉莉酸甲酯(100 μ mol L-1 MeJA水溶液)、脱落酸(100 μ mol L-1 ABA)水溶液, 分别于6、12和24 h各取3棵蔗苗的蔗叶; PEG-8000水溶液(25.0%)和250 mmol L-1 NaCl水溶液培养, 分别于12、24和48 h各取3棵蔗苗的蔗叶; 0 h未处理的蔗叶作为对照。以上所有植物材料均被立即投入-80℃液氮中保存至RNA提取。
1.3 同源克隆以玉米CIPK15基因(EU957447.1, 2247 bp)核酸序列作为探针, 运行NCBI的BlastN工具检索甘蔗EST数据库, 获得2条同源的EST序列(CF577339.1, 568 bp; DN236273.1, 303 bp), 用BioEdit中的Contig Assembly Program (CAP) (http://pbil.univ-lyon1.fr/cap3.php)软件无法将这2条甘蔗EST序列拼接组装获得全长cDNA序列。经序列分析, 直接根据NCBI上玉米CIPK15基因的全长cDNA序列(EU957447.1, 2247 bp)保守区域设计引物, 以甘蔗品种崖城05-179的cDNA为模板, RT-PCR扩增获得甘蔗中CIPK基因序列。
1.4 甘蔗CIPK基因的RT-PCR及测序 采用TRIzol法提取叶片的总RNA。用反转录试剂盒合成cDNA, 作为PCR的模板。以上述玉米CIPK15基因的cDNA序列(EU957447.1)为基础, 设计1对特异性的RT-PCR扩增引物, 5'端5'-TCACCTTGGAGACGACG-3'和3'端5'-ACTGCAGAAATGCCATGTATTCCAG-3'。PCR体系25 μ L, 含10× GC buffer 2.5 μ L、10 mmol L-1 dNTPs 2 μ L、20 μ mol L-1 5' Primer 1.0 μ L、20 μ mol L-1 3' Primer 1.0 μ L、Ex Taq酶0.125 μ L、cDNA模板1.0 μ L、ddH2O 17.375 μ L。PCR程序为94℃预变性4 min; 94℃变性1 min, 50℃退火30 s, 72℃延伸2 min, 35个循环; 72℃延伸10 min。使用Gel Extracti on Kit (TianGen Biotech Co., Ltd., Beijing)纯化回收扩增产物, 并与pMD-19T载体连接转化到大肠杆菌DH5α 感受态细胞中, 在抗性Amp的LB平板上筛选阳性克隆, 随机挑取单菌落进行PCR鉴定, 将阳性单菌落菌液送至上海生工生物工程技术服务有限公司测序, 测序获得的甘蔗CIPK基因cDNA序列经NCBI的ORF finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)服务器, 进行开放阅读框分析并翻译。
1.5 甘蔗CIPK基因序列的生物信息学分析 利用ExPASy中ProtParam pI/Mw (http://web.expasy.org/compute_pi/)在线工具对序列的理化性质、氨基酸组成等一级结构进行预测, 利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析、ProtScale (http://web.expasy.org/protscale/)进行疏水性/亲水性预测、Profun 2.2 Server (http://www.cbs.dtu.dk/services/ProtFun/)进行功能预测、编码蛋白亚细胞定位用Psort (http://www.psort.org/)在线工具预测、GOR IV (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)进行二级结构预测、SWISSMODEL (http://swissmodel.expasy.org/)进行蛋白质三级结构预测; 使用Blast工具在NCBI上查找氨基酸同源性序列。
1.6 甘蔗CIPK基因的实时定量PCR 采用TRIzol法提取叶片、叶鞘、侧芽、蔗皮、蔗髓、根及经SA、MeJA、ABA、PEG、NaCl胁迫处理和对照组ROC22叶片的总RNA, 用反转录试剂盒合成cDNA, 作为实时定量PCR模板, 以GAPDH作为内参基因[13]。ScCIPK定量引物为: 5'端(5'-ACCACCGGAGACACAGGA TG-3')和3'端(5'-CTGGAGCGATTGGCGTTTGC-3'), 内参基因GAPDH定量引物为: 5'端(5'-CACGGCCACTGGAAG CA-3')和3'端(5'-TCCTCAGGGTTCCTGATGCC-3')[16]。按照SYBR R Green PCR Master Mix Kit (Roche)说明书配置定量反应体系。实时定量PCR扩增程序为: 50℃ 2 min; 95℃ 10 min; 95℃ 15 s、60℃ 1 min, 45个循环; 增加熔解曲线; 反应时设置3次技术重复。
1.7 数据处理使用DNAMAN软件, 将重组质粒序列与玉米CIPK基因序列进行同源性比对。并用DNAMAN软件分析氨基酸同源性及多序列比对, 完成并构建系统进化树。在Microsoft Excel工作表种采用2-Δ Δ CT算法[17]分析实时定量PCR实验结果, 画图并计算3次重复数据的标准误。
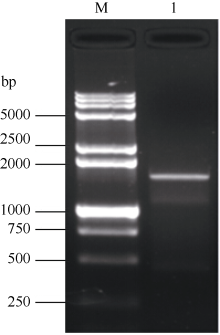
2 结果与分析2.1 甘蔗CIPK基因序列的获得 以玉米CIPK15基因(EU957447.1, 2247 bp)核酸序列设计1对同源克隆PCR引物, 以甘蔗的cDNA为模板, 经过RT-PCR扩增获得约1782 bp的单一条带(图1), 经过胶回收、连接转化、菌落PCR鉴定、菌液测序得到图2。经序列比对, 甘蔗CIPK基因的开放读码框序列与玉米CIPK15全长的mRNA序列有较高的同源性, 达94.50%, 具有完整的开放读码框, 被命名为ScCIPK (GenBank登录号为KM114052)。此外, 甘蔗ScCIPK蛋白包含PKc-like superfamily和AMPKA-C-like superfamily保守结构域, 一个CBL interaction结合位点和一个潜在的PP2C结合位点。因此, 推测同源克隆所获得的甘蔗ScCIPK基因序列是正确的。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 甘蔗ScCIPK基因的RT-PCR扩增 M: DNA marker 15000+2000 bp; 1: RT-PCR产物。Fig. 1 RT-PCR amplification ofScCIPKgene in sugarcane M: DNA marker 15000+2000 bp; 1: RT-PCR product. |
2.2 甘蔗ScCIPK基因的生物信息学分析 2.2.1 甘蔗ScCIPK基因编码氨基酸的一级结构预测
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 同源克隆获得的甘蔗ScCIPK基因的cDNA序列及其推导的氨基酸序列(* 终止密码子) 下画线部分为特异性引物在基因序列中的位置。Fig. 2 Nucleotide acid sequence and deduced amino acid sequence of sugarcane ScCIPK gene obtained by homology cloning (* stop codon) The sequence fragment complementary to primer is underlined. |
该蛋白分子式C2586H4138N700O772S16, 分子量Mw为5.79 kD, 编码了513个氨基酸。等电点(pI) 7.58, 负电荷残基(Asp+Glu) 69, 正电荷残基(Arg+Lys) 70, 不稳定系数(II) 43.91, 平均疏水性(GRAVY) -0.477, 脂肪系数(AI) 87.45。
2.2.2 甘蔗ScCIPK蛋白二级结构预测和分析 根据GOR IV软件预测, 甘蔗ScCIPK蛋白无规则卷曲所占的比例最高为45.61%, 其次是α -螺旋占41.52%, 延伸链所占比例是12.87%, β -螺旋的比例为0。
2.2.3 甘蔗ScCIPK蛋白信号肽预测和分析 根据SignalP 4.1 Server软件预测可知, 第25位赖氨酸残基具有最高的原始剪切位点分值0.132和最高的信号肽分值0.130, 第39位丙氨酸残基具有最高的综合剪切位点分值0.139。由于最后算得氨基酸残基的加权平均值较小, 为0.105 (远远小于0.5), 因此推测ScCIPK基因所编码的蛋白不存在信号肽, 而为非分泌蛋白, 说明该蛋白在细胞质中合成后不能被转运。
2.2.4 甘蔗ScCIPK蛋白疏水性/亲水性的预测和分析
根据ProtScale软件预测, 第203位具有最高分值, 为3.289, 疏水性最强; 第440位具有最低分值, 为-3.100, 亲水性最强。整条多肽链表现为亲水性, 没有明显的疏水区, 故推测甘蔗ScCIPK蛋白是一种亲水蛋白。
2.2.5 甘蔗ScCIPK蛋白质三级结构预测 根据SWISSMODEL软件预测, ScCIPK蛋白的空间结构以无规则卷曲和螺旋为主。比较甘蔗、高粱、玉米和水稻中CIPK蛋白的三级空间结构虚拟图结果显示, 甘蔗的三级空间结构与玉米高度相似, 而水稻和高粱与甘蔗的三级结果存在一定的差异。
2.2.6 甘蔗ScCIPK蛋白的功能预测 根据Profun 2.2 Server软件预测, 该蛋白主要参与中间代谢, 可能性为2.252, 其次也可能参与翻译、嘌呤和嘧啶类合成及脂肪酸代谢。可能性依次为1.990、1.675和1.265。
2.2.7 甘蔗ScCIPK蛋白的亚细胞定位预测 根据Psort软件预测, 甘蔗ScCIPK蛋白可能被定位于内质网(膜)(85.0%), 其次是原生质膜(79.0%), 再次是细胞核(60.0%)。
2.2.8 甘蔗ScCIPK蛋白的保守结构域分析 如图3所示, 甘蔗ScCIPK蛋白包含2个保守结构域, 分别为PKc-like superfamily和AMPKA-C-like superfamily, 有一个CBL interaction结合位点, 一个潜在的PP2C结合位点。这和上述提到的所有CIPK蛋白含有2个结构域N端和C端的结构特征相符[4, 5]。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 甘蔗ScCIPK蛋白的保守结构域分析Fig. 3 Conserved domain prediction of ScCIPK protein |
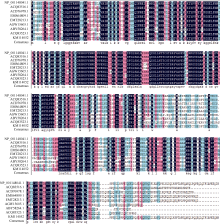
2.2.9 甘蔗ScCIPK蛋白的氨基酸同源性分析 以玉米(Zea mays_gb|NP_001148041.1|)、高粱(Sorghum bicolor_ gb|ACQ83516.1|)、水稻(Oryza sativa japonica Group_gb| ACD76978.1|)、小麦(Triticum urartu_gb_gb|EMS 64809.1|)、山羊草(Aegilops tauschii_gb|EMT28213.1|)、毛白杨(Populus tomentosa_gb|AGW15605.1|)、鳄梨(Persea americana_gb|ABY58264.1|)、葡萄(Vitis vinifera_gb| ACQ83523.1|)氨基酸残基序列以及甘蔗ScCIPK氨基酸残基序列进行氨基酸同源性分析。结果如图4所示甘蔗CIPK蛋白的氨基酸残基序列与近缘物种玉米、高粱、水稻、小麦、山羊草、毛白杨、鳄梨、葡萄相似性分别为93%、89%、79%、77%、77%、57%、57%和58%。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 甘蔗ScCIPK蛋白与其他植物种蛋白的氨基酸序列比对Fig. 4 Homology analysis of sequences from sugarcane ScCIPK and those of other plant species |
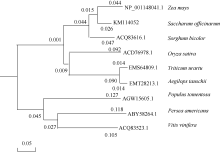
从图5可以看出, 同属单子叶植物的甘蔗和玉米同源性最高。系统进化树显示(图5), 单子叶植物甘蔗、玉米、水稻和高粱等为一分支, 同属双子叶植物的毛白杨、鳄梨和葡萄为另一分支。因此, 该基因在不同物种间具有很强的保守性, 它们对应的蛋白属于同一个家族。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 8个物种基于CIPK氨基酸序列的系统进化树Fig. 5 Phylogenetic tree of eight plant species based on CIPK protein sequences |
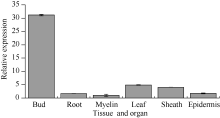
2.3 甘蔗ScCIPK基因的组织特异性表达分析 图6所示, 该基因的表达具有组织特异性, 在不同组织中均有表达, 其中在蔗髓中表达量最少, 侧芽中表达量最高, 是蔗髓中的30.8倍, 其次是在根中的表达量, 为蔗髓中的18.6倍。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 甘蔗ScCIPK基因在不同组织中的表达 误差线为每组处理的标准误差(n=3)。Fig. 6 The relative expression of ScCIPK gene in different sugarcane tissues and organ The error bars represent the standard error of each treating group (n=3). |
2.4 甘蔗ScCIPK基因在不同外源胁迫下的表达特性分析 图7所示, 外源SA处理在3个时间点(6、12和24 h)抑制了甘蔗ScCIPK基因的表达, 表现为在处理24 h达到最低, 约为对照的0.4倍。与SA的应答模式相反, 该基因的表达受到PEG强烈诱导, 在处理12 h的相对表达量达到最高, 为对照的4.6倍; 并且在整个处理周期(24 h和48 h)内均维持在3倍以上的较高水平。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 甘蔗ScCIPK基因在不同外源胁迫下的表达 误差线为每组处理的标准误差(n=3)。Fig. 7 ScCIPK gene expression of sugarcane under different exogenous stress The error bars represent the standard error of each treating group (n=3). |
从总体上看, ScCIPK的表达对外源MeJA、ABA、NaCl的应答呈现出上调和恢复2个阶段的模式。ScCIPK的相对表达量在MeJA、ABA处理12 h后均达最大, 其中MeJA在6 h后下调表达, 但在12 h时表达量增加, 为对照的4.1倍; ABA诱导时, ScCIPK在各个时点(6、12和24 h)都是上调表达, 6 h开始上调, 到12 h达最高, 约为对照的5倍; 在NaCl的处理下, 24 h时表达量达最高, 约为对照的3.1倍, 在48 h, ScCIPK的表达水平迅速恢复到与对照相当的水平(图7-E)。
3 讨论干旱和低温等逆境条件严重危害甘蔗生产, 造成蔗茎产量与蔗糖分损失。近年来, 随着生物技术的迅速发展, 利用基因工程技术对甘蔗品种进行定向遗传改良, 已经被证明是一种甘蔗育种的有效新途径[18]。在已有的研究中, 我们得知CIPK基因家族是一个较大的家族, 家族内不同的CIPK成员的功能存在特异性, 可以响应一种或多种胁迫。与甘蔗近缘的玉米、高粱等作物中均已克隆到多个CIPK家族基因, 这为我们探究该基因提供一定的理论基础。
本研究利用与甘蔗同源性较高的玉米CIPK15基因(EU957447.1, 2247 bp)的核酸序列保守区域, 设计1对同源克隆PCR引物, 而后以崖城05-179为材料, 成功克隆获得甘蔗ScCIPK基因。该基因与玉米CIPK15全长的mRNA全长序列的同源性达94.5%, 具有完整的开放读码框, 且在甘蔗ScCIPK蛋白中包含2个CIPK基因典型保守结构域, 分别为PKc-like superfamily和AMPKA-C-like superfamily, 这说明同源克隆所获得的甘蔗ScCIPK基因序列是正确的。甘蔗ScCIPK基因在不同物种间的保守性一般, 亲缘关系较近的物种(如玉米、高粱和水稻)其蛋白同源序列均达到80%左右, 亲缘关系较远的物种间相应的蛋白同源序列只有50%左右。所编码的蛋白位于内质膜(85%)和原生质膜(79%)上, 这与已报道的一些物种的CIPK基因定位存在一定差异, 如在拟南芥中, 已报道AtCIPK24和AtCIPK1分布在细胞膜、细胞核和细胞质中[19, 20, 21]; 在玉米中, ZmCIPK16则分布在细胞核和原生质膜上[19]。导致这种结果的主要原因可能在于CIPK本身不具有已知定位信号, 因此每个CIPK的亚细胞定位最终可能取决于与其相互作用的CBL[22]。在进一步的蛋白预测中, ScCIPK基因编码的蛋白为亲水、非分泌酸性蛋白, 在调控中间代谢中发挥关键的作用。
前人研究表明, CIPK基因在植物逆境应答信号中发挥极其重要的作用, 该蛋白与其上游CBL蛋白组成的CBL-CIPK信号系统参与了植物多种逆境应答信号途径[23]。Zhao和Sun[2]研究结果显示, 玉米CIPK16基因在NaCl、ABA、PEG胁迫下表达量均会被调节, 在250 mmol L-1 NaCl胁迫下, 该基因表达呈上升趋势, 在12 h时其表达量达到最大; 同时, 在100 μ mol L-1的ABA处理下, 均显示为上调表达, 在6 h时表达量达到最大; 在干旱胁迫下, 其表达量在6 h的时候是最高的, 这与本研究中甘蔗ScCIPK基因的表达趋势是相似的。此外, 有文献报道, 干旱或者高盐引起的胁迫信号的转导至少通过ABA依赖和ABA不依赖的2条途经[20]。在本试验中, 甘蔗ScCIPK的表达不仅受到外源NaCl和PEG的诱导, 而且受到外源ABA的强烈诱导, 说明该基因很可能与干旱或渗透胁迫响应有关。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] |
