 , 周燕
, 周燕第一作者联系方式: 朱利泉, E-mail:zhuliquan@swu.edu.cn, Tel: 023-68250794
收稿日期:2014-11-05 基金:
摘要
关键词:甘蓝; SI; S位点; 信号传导
Protein Elements and Signal Transduction Process of Self-Incompatibility in Brassica oleracea
ZHU Li-Quan
 , ZHOU Yan
, ZHOU YanAbstract
Keyword:
Show Figures
Show Figures





自交不亲和性(self-incompatibility, SI)是指可育的雌雄同株植物柱头乳突细胞识别“ 自花” 和“ 异花” 花粉, 并特异地拒绝“ 自花” 花粉, 不产生或不能产生足量合子的现象, “ 自花” 花粉, 既指同株花粉, 也指不同株但具有相同S单倍型的花粉。因此, SI的概念相近于“ 自交不育” , 但却进一步承认了自交不育的程度。SI是在长期进化过程中形成的一种更为复杂而完善的重要遗传机制以更有效地限制自交衰败和促进杂交优势。甘蓝自交不亲和性在遗传上受具有多态性的S位点基因所控制, 是迄今为止研究最多、机理也最为清楚的自交不亲和性作物[1]。
在经典遗传学上, 甘蓝S等位基因最初被假想为定位于染色体上的一个未知的遗传学位点, 称为S位点(S-locus)。对甘蓝S等位基因的分离鉴定从20世纪70年代初开始, 所采用的方法包括生物化学方法、分子遗传学方法和现代生物技术方法等。1985年Nasrallah等[2]采用生物化学方法分离了其含量与SI反应相连锁的S位点糖蛋白(S-locus glycoprotein, SLG)的编码基因。1991年Stein等[3]利用分子杂交法, 即同时采用SLG编码序列和激酶结构域编码序列为探针, 在甘蓝乳突细胞的cDNA文库中筛选克隆了S受体激酶(S-locus receptor kinase, SRK)的编码基因, SRK也是在S位点上分离到的第2个S等位基因。模仿分离SRK的方法, Schopfer等[4]1999年以双酶切SLG8-SRK8基因间序列得到的400 bp片段为探针, 在甘蓝花粉cDNA中克隆了第3个S位点基因S半胱氨酸富集蛋白(S-locus cystine-rich protein, SCR)的编码基因。这3个S位点基因的克隆促进了乳突细胞外的SI相关分子研究, 也促进了乳突细胞内的SI相关分子鉴定。采用酵母双杂交法先后从甘蓝柱头细胞的cDNA文库中筛选克隆了THL (thioredoxin-h-like)[5]、ARC1 (armadillo-repeat containing protein 1)[6]和Exo70A1 (exocyst 70A1)[7]的编码基因。2004年Murase等[8]利用图位克隆法(map based cloning, MBC)在甘蓝材料中克隆了M位点蛋白激酶(M-locus protein kinase, MLPK)的编码基因。Hinata等[9]结合差别显示和反转录PCR (differential display combined with reverse transcription-polymerase chain reaction analysis, DDRT-PCR)等技术, 从油菜变种Brassica campestrisvar. yellow sarson柱头细胞的cDNA文库中克隆了类水孔蛋白的编码基因, 命名为MOD (modifier)。THL、MLPK、ARC1、Exo70A1和MOD等S位点相关基因不同于SLG、SRK和SCR基因, 后三者真正位于S位点上, 而前五者只是在功能上与S位点相关, 对它们成功的分离克隆使经典遗传学上的S位点具有了新的内容。
1 甘蓝S位点基因及其编码元件 从甘蓝的S位点上已成功分离了SLG、SRK和SCR这3个基因, 它们的共同特点是序列的高度多态性, 以及由这些多态性产生的蛋白质元件在甘蓝乳突细胞外发生特异的相互作用: “ 自花” 授粉时, SCR在SLG的协助下特异结合SRK胞外域(SRK extracellular domain, eSRK), 并在柱头表皮乳突细胞内引发SRK胞内激酶域的磷酸化级联反应, 最终导致“ 自花” 花粉不能生长。
1.1 SLGNasrallah等[2]1985年采用生物化学方法, 在甘蓝柱头上分离到一种未知糖蛋白质, 其表达量与SI反应完全连锁, 最高表达量可以达到柱头总蛋白的5%, 称为S位点糖蛋白。进一步的免疫化学和原位杂交实验证明, SLG主要分布在甘蓝等芸薹属植物柱头的乳突区[10], 并进一步分泌到乳突细胞的细胞壁和胞间区, 而不存在于近乳突细胞的花柱、子房和远乳突细胞的营养组织, 如叶、根和苗, 这一特点可能与它的功能密切相关。1987年Nasrallah等[11]利用甘蓝中SLG相应的cDNA序列首先推导得到SLG的序列, 发现白菜(Brassica campestrisL.) SLG6为单链蛋白质[12], 总长436个氨基酸残基, 从N端到C端包括信号肽、LLD1 (lectin-like domain 1)和LLD2 (lectin-like domain 2)、EGF-like (epidermal growth factor like domain)、PAN (PAN_APPLE), N端具高度疏水性和较高的序列保守性, 中间区和C端序列变异幅度较大。通过比较分析成熟SLG与原初SLG的氨基酸组成(约405个氨基酸残基), 发现前者并没有包含后者N端约30个氨基酸残基的疏水区, 而这段消失的疏水区氨基酸序列具有典型的信号肽特征[13], 其作用极有可能是指令SLG泊位到柱头乳突细胞壁外。Kandasamy等[10]进一步用金粒子标记含该信号肽的SLG抗原决定簇特异性单克隆抗体检测发现, 从蕾期至花期期间SLG从近细胞壁的质膜上泊位到乳突细胞壁上, 并最终在乳突细胞的细胞壁和胞间区分泌, 证明了这一过程由信号肽指引完成。LLD1和LLD2由12个N连接的糖基化位点组成, EGF-like、PAN分别包括6个完全保守的半胱氨酸残基, 突变研究表明PAN的6个Cys残基通常为SLG与其他蛋白质的互作区域[14]。
最初认为, 甘蓝SLG符合柱头SI反应决定因子的3种特性[15], 即编码序列与S位点连锁、具有S等位基因特异多态性[3]和参与SI反应。但深入研究后发现, 小部分芸薹属和萝卜属的SLG并不完全具有以上特性, 如在某些芸薹属甘蓝植株[16]和自交亲和系拟南芥A. lyrata[17]、荠属C. grandiflora[18]植株中SLG基因不表达; 在甘蓝自交不亲和系S18和S60单倍型中[19], 因SLG23 bp的缺失导致移码突变而最终不能正常转录和翻译, 由以上两点表明SLG在自交不亲和中并不是完全必需[20]。同一S单倍型中SLG与eSRK在核酸序列上相似性程度达到85%~ 98%, 这种高度同源性表明二者具有类似的功能, 且这种高度同源得以保持可能与进化过程中二者发生高频率的基因转换(gene conversion)有关[21], 因为这既有助于产生新型SRK, 也为其特异识别新型SCR提供了更好的突变累积。Fujimoto等[21]研究白菜型油菜时, 通过序列比对亲和/不亲和SLG-54与亲和eSRK-54, 发现它们的高变区内存在4~5个不同的氨基酸残基, 前者SLG-54中的Asp/Ile/Trp/Pro在后者eSRK-54中依次变为His/Thr/Ser/Ala, 而恰巧这些突变致使eSRK-54不能识别同单倍型的SCR蛋白而发生自交亲和反应, 揭示了SLG与eSRK基因之间的转换引起的氨基酸的突变会导致植物从SI转变为自交亲和, 也进一步说明这种基因转换为识别新型SCR提供了累积突变。在白菜型油菜B. rapa scf1突变体中, 尽管突变体SRK转录水平正常, 但SRK、SLG表达量同时缺乏或急剧降低, 这2种蛋白表达水平同比降低暗示很可能存在一种典型的基因
转换中间体, 该中间体的翻译产物可能形成SLG和eSRK嵌合体[22], 嵌合体减少, SI反应降低。2011年Nasrallah等[23]也提出SLG可能在稳定SRK的构象中起作用, 而稳定的SRK构象使其形成二聚体处于非活性状态[24, 25]。
1.2 SRKSRK (S-locus receptor kinase)是由S基因编码、在柱头乳突细胞中单次跨膜的蛋白激酶, 为PKC类超家族(protein kinase C-like superfamily)的成员。Stein等[3]同时采用SLG编码序列和激酶结构域编码序列为探针, 在甘蓝基因组文库中分离克隆了SRK基因, 该基因与SLG在S位点上连锁, 并在柱头中特异表达。甘蓝SRK6基因序列分析表明[26], SRK基因组DNA包含7个外显子和6个内含子, 内含子大小为76~896 bp不等, SRK cDNA长度为2832 bp, 编码含857个氨基酸残基的肽链, 该肽链包括胞外结构域、跨膜结构域和激酶结构域。第1个外显子编码信号肽(signal peptide, SP)和eSRK , 其中SP在N端, 由32个疏水氨基酸残基组成, eSRK与SLG有很高的同源性, 被认为是花粉配体SCR结合位点[27]。Naithani等[14]通过序列比对, 发现eSRK6的N端到C端包括类凝集素LLD1 (lectin-like domain 1)、类凝集素LLD2 (lectin-like domain 2)、EGF-like (epidermal growth factor like domain)、PAN (PAN_ APPLE domain) 4个区域。LLD1/LLD2为D-甘露糖结合的类凝集素, 二者的功能可能是结合单糖。EGF-like和PAN中各包含6个半胱氨酸残基, 酵母表面展示技术研究结果表明这2个区域可表现自凝集现象, 推测其为二聚体的发生区域。进一步分析发现, C末端仅包含PAN这一区域, 且PAN引起自凝集的效率可等同于eSRK6全长引起的效率, 由此证实了PAN是引发eSRK二聚体的关键, 而其他的区域只是增强凝集的作用[14]。第2个外显子编码跨膜域(transmembrane domain, TM), 含20个疏水氨基酸残基, 在细胞膜上形成单次的跨膜螺旋。Mazzurco等[28]点突变跨膜区C末端的一个Cys残基后, 植株不能顺利完成SI反应, 序列比对发现这个Cys存在于所有自交不亲和的SRK序列中, 推测该Cys为SRK与THL1/THL2相互作用所必需, 也为SRK与SI反应之间的特异关联。第3至第7个外显子编码SRK激酶域(SRK kinase domain, KD), KD具有Ser/Thr蛋白激酶活性[29], 特异催化蛋白质丝氨酸和苏氨酸残基的磷酸化反应。
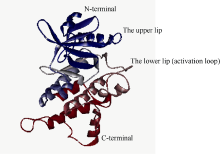
自Gu等[6]在油菜中发现SRK激酶域是下游底物ARC1的C端臂重复区的结合区后, SRK激酶域成为进一步研究SI信号传导的关键。1994年Walker[30]研究了包括SRK6在内的多个类受体激酶, 首次将SRK激酶域分为12亚结构域(I、II、III、IV、V、VI、VIIa、VIIb、VIII、X、XI和IX), 并在此基础上提出了6个关键亚结构域(I、II、VI、VII、VIII、IX), 包含一些保守性较强的基序(motif), 如GxGxxG、AxK、HRDLKxxN、DFG、APE等。Walker等[30]分析的关键亚结构域符合Hanks等[31]在研究cAPK-α 蛋白激酶时提出蛋白激酶催化域的相似轮廓图, 如图1[31], 进一步表明蛋白激酶域由12亚结构域组成, 含6个氨基酸序列相似性高的关键亚结构域, 轮廓图中的横、纵坐标分别为每个氨基酸在序列中的位置、每个氨基酸序列比对的相似性矩阵打分。关键亚结构域的保守性强, 可能是蛋白激酶功能域中心, 且其中的motif极可能是与下游蛋白互作的区域。2003年Takaaki等[32]研究PKCζ (protein kinase C ζ )激酶时, 提到了将激酶域从N端到C端分为4个基序: ATP结合域(ATP binding region)、活性环(activation loop)、转角模体(turn motif)、疏水基序(hydrophobic motif)。ATP结合域主要在激酶域的N端, 其作用是以ATP为磷酸供体磷酸化激酶域使其活化。多序列比对十字花科SRK胞内激酶域序列, 发现其中就包含类受体激酶所特有的活性环, 其序列即为Walker、Hanks等提出的基序之一(DFG... APE), 二级结构预测此活性环为无规则卷曲, 模型分析(图2)表明其处于“ 瓣唇” (lip)的下片, 可能是结合下游蛋白的区域[32, 33]。2008年Samule等[34]酵母双杂交进一步验证了Gu等[6]提出的SRK激酶域与臂重复区ARC1 (arm repeat containing protein 1)相互作用, 并推测这种相互作用依赖于被磷酸化而活化的SRK激酶域磷酸化臂重复区, 进而向胞内进一步传导传递来自胞外的信号。利用酵母双杂交技术还鉴定了其他与SRK胞内激酶域相互作用的蛋白, 包括2种负调节SRK活性的类硫氧还蛋白(thioredoxin- h-like, THL) THL1 (thioredoxin h-like proteins 1)和THL2 (thioredoxin h-like proteins 2)[5], 这种负调控作用是THL在缺乏相同单倍型配体SCR时, 通过某种作用使SRK之间自身磷酸化后形成二聚体而保持无活性[35]。配体激活受体激酶通常是在无配体存在时, 受体单体而处于非活化, 仅当配体诱导受体形成二聚体后被活化[36], 但某些动物[37]和植物[24, 25]中的受体激酶在无配体时, 形成二聚体而处于非活性状态, 活化时则是由配体诱导超级二聚体形成或构象发生改变[36]。SRK与后一种受体激酶相似[14], 在未授粉的柱头上形成二聚体。转基因植株中共表达SLG与SRK发现SRK蛋白构象更稳定, 但也有研究证明相同单倍型SRK之间形成二聚体而使SRK胞内激酶域保持无活性的稳定状态[6, 35], 所以目前尚不清楚形成该二聚体的是SRK-SRK还是SRK-SLG, 或是2种二聚体皆有。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 蛋白激酶域相似性轮廓图[31]Fig. 1 Similarity profile of protein kinase catalytic domains[31] |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 甘蓝受体激酶激酶域模型Fig. 2 Model of Brassica oleracea L. SRK |
以SRK为中心的SI反应主要依靠SCR单倍型特异识别eSRK而激活SRK胞内激酶域, 通过特异地催化蛋白质的丝氨酸和苏氨酸残基磷酸化传递来自胞外的信号至下游底物蛋白— — ARC1的臂重复区。SRK蛋白的磷酸化作用在信号传递中, 一方面可以对来自花粉的SCR做出迅速、持续的反应, 直到被蛋白磷酸化酶脱去磷酸为止; 另一方面可以将信号传递、放大。SRK作用机制的研究将是解释SI反应的关键入口, 也是进而探索它所引起的蛋白质磷酸化级联反应、信号转导途径以及相关的基因表达与调控机制的重要依据, 并将可能为利用植物雄性不育和植物自交不亲和性进行杂交种子生产的基因工程奠定基础。
1.3 SCRS位点富含半胱氨酸蛋白SCR (S-locus cystine- rich protein)是一种花粉胞被蛋白(pollen coat protein, PCP), 且在白菜型油菜中确定的22个SCR等位基因编码的蛋白均具有花粉外壳蛋白家族的特性[27]。如前所述, Schopfer等[4]在分析SLG8与SRK8之间13 kb的序列时, Hind III和Xba I双酶切得到400 bp的片段, 以该片段为探针, RNA杂交分析证实其为某基因的一部分。接着, 在筛选S8花粉cDNA文库时分离到一个全长约450 bp cDNA的克隆, 序列比对该克隆与SLG8-SRK8基因间片段, 发现该基因包含2个外显子和一个长达1.4 kb的内含子, 由此鉴定S位点上第3个多态性S等位基因, S位点编码基因SCR (S-locus cysteine rich protein gene)[2], 体外授粉试验有力说明该基因编码的蛋白SCR是SI反应的雄性专一性决定因子[15]。RNA杂交、免疫组织化学分析表明SCR蛋白主要积累于花粉外壳, 在花药中特异表达[4], 分子量为8.4~8.6 kD, 其编码基因约400 bp, 在所包含的2个外显子中, 一个编码形成信号肽SP, 另一个编码约50个氨基酸残基的蛋白质分子。SCR氨基酸序列保守性很低, 但预测的三级结构却很相似, 序列比对芸薹属中所有的SCR序列, 发现均富含8个半胱氨酸残基[38], 在分子内相互形成3~4个二硫键[39], 正是这些二硫键稳定了SCR相似的三级结构[40]。
2001年Cabrillac等[35]通过体内、体外的磷酸化试验, 发现甘蓝SRK3分子在离体细胞中磷酸化不需要配体, 而在活体细胞中的磷酸化需要额外的蛋白, 说明SCR在柱头上可能需要和其他蛋白形成复合物而启动自交不亲和信号传导过程。同年, Takayama等[41]在油菜中进一步说明SCR8能特异地与相同单倍型的SRK8结合。2007年Shimosato等[27]通过免疫沉淀法也检测到SCR8能高亲和地结合SRK8或一个60 kD的蛋白, 但与仅仅包含胞外域的SRK却无高亲和结合, 免疫沉淀鉴定和生化特性分析该60 kD蛋白为缩短的SRK8 (truncated SRK8, tSRK8), 包括SRK8的胞外域、跨膜域及近膜区的激酶域。由以上三点可知, SCR与SRK的结合具有单倍型特异性, 使后者在胞内发生磷酸化反应。究竟是SCR中的哪些氨基酸残基决定了SCR-SRK单倍型互作的特异性呢?芸薹属SCR6和SCR13的8个保守半胱氨酸残基(Cys)之间的结构域交换(domain swapping)实验表明, SCR6的第5个与第6个Cys之间的VPTGR序列被SCR13中对应区域的TDTQ取代形成SCR6变体后, SCR6可表现SCR13的功能, 即特异结合eSRK13, 由此可知少数连续的氨基酸残基可决定SCR13的特异性[39]。进一步利用生物信息学分析SCR13模型[39], 发现TDTQ这几个残基刚好定位于模型表面暴露的环上, 而一般暴露于表面的残基具有特殊的活性, 比如能与底物结合, 由此进一步验证了这4个氨基酸残基的功能。
SCR特异性研究是分析SCR-SRK互作的基础。Goh等[42, 43]2000年和2002年相继提出相互作用的蛋白质通常具有相似的进化关系, 表现为互作区段的相似进化树。Sato等[16]在芜菁和萝卜中也发现有相似的SRK等位基因就有高度相似的SCR等位基因[44], 揭示了种间SRK与SCR以成对方式构成的S单倍型, 再联系SCR作为配体具有与SRK特异识别并启动信号传导过程的作用, 故推测SCR编码基因的突变必须与SRK编码序列的突变相协调, 即SCR和SRK胞外域两者编码区的序列之间进行着趋异的协同进化。
在授粉过程中, 落到柱头乳突细胞表面的“ 自花” 花粉分泌的特异单倍型SCR配体, 由分泌到乳突细胞的细胞壁上的SLG的信号肽引导[10], 从细胞壁经历胞间区最终定位于SRK锚定的细胞膜附近, 由此引发SCR与eSRK相互作用[45], 完成信号从胞外到胞内的传递。
1.4 SRK、SLG和SCR三者的关系SI研究 经历了从最初对各个S位点基因的分离鉴定到现在各个基因间的协同进化。协同进化主要指功能所要求的构象稳定性所限制的突变方向和突变率累计。SLG、SCR和eSRK三者的序列在甘蓝和芜菁中呈现明显的协同进化[16], 如相同S单倍型的SLG、SRK聚类于一个进化分支, 同时, 在一些物种上找到了基因从SLG转换到eSRK及从eSRK转换到SLG[46], 暗示相同单倍型的SLG与SRK胞外域经常发生基因转换。结合SLG可利用自身的信号肽引导SCR到乳突细胞外侧与eSRK相互作用, 由此推测SLG的突变可能为形成新SRK单倍型提供新的变异序列[47], 二者曾进行着趋同的协同进化。Sato等[16]在芜菁及萝卜中发现有相似的SRK等位基因就有高度相似的SCR等位基因[44], 揭示SCR和eSRK两者编码区的序列之间曾进行着趋异的协同进化。
此外, 遗传学、生物化学和系统发育分析表明, SCR、SRK及SLG三者存在连锁关系。SLG和SRK界定了S位点的范围, 雄蕊决定因子SCR处于SLG和SRK之间, 进一步用脉冲场凝胶电泳、DNA位点分析发现SLG与SRK分别在S2和S6中处于完全连锁[48], 在其他S等位基因系中, 虽然SCR也位于SLG和SRK之间, 但与SLG、SRK的相对距离却因S基因型的不同而有明显差异。
虽然SRK-SCR特异互作及SRK激酶域引发的级联反应等后续过程是SI信号传导过程的主要部分, 但SLG最初所起的辅助受体作用也是很重要的。SRK是锚定在膜上的蛋白, 若仅由SCR“ 自主” 到细胞膜上与同单倍型的SRK激酶域作用, 这一反应速率满足不了这类信号传导迅速、持续的要求, 而与eSRK高度同源的SLG似乎就是为了提高这一反应速率而存在的。目前研究认为, SLG信号肽引导SCR穿过乳突细胞壁、间质至膜上与eSRK相互作用, 这一过程得以实现, 极有可能是因为与eSRK高度同源的SLG通过某些SCR-eSRK互作类似的位点, 如PAN_APPLE区的6个半胱氨酸残基, 打开SCR分子内的二硫键而形成了SLG-SCR复合物。单倍型SRK8和SLG8形成的受体复合物与SCR8高亲和结合[46], 这很可能是SLG引导SCR到达膜上时信号肽还未解离的一种中间态, 待信号肽解离时, 引起SLG从中间态复合物中解离, 整个构象改变, 同时释放SCR, 与此时膜上存在的SLG-SRK受体复合物高亲和结合, 由于eSRK包含比较多的底物结合位点更能“ 抢占” SCR半胱氨酸, 发生SCR与SRK特异结合, 二者互作基序可能是暴露在模型SCR13表面的环, 该环包括TDTQ四个残基, 并决定了SCR的识别具有特异性和稳定性。
2 甘蓝S位点相关基因及其编码元件 2.1 THL1/THL2THL (thioredoxin-h-like)类似于硫氧还蛋白(thioredoxin, Trx)家族I六大类(h、f、m、o、x和v)[49]中的h类, 主要大量分布于高等植物中, 在拟南芥中已发现了至少20个Trx基因的完全序列。Bower等[5]利用酵母双杂交系统在自交不亲和甘蓝中检测到硫氧还蛋白h— — THL1/THL2, 它们是硫氧还蛋白h家族的2个成员, 在许多植物组织中表达, 其中, THL2大量表达于花组织。2003年刘东等[50]采用PCR和RT-PCR技术从甘蓝基因组和柱头总RNA中扩增, 得到硫氧还蛋白(THL1)的全长基因序列, 序列分析表明该基因719 bp, 包含2个内含子, cDNA为430 bp, 编码117个氨基酸, 不含信号肽, 说明存在于细胞质中。虽然Trx蛋白在不同种属的生物体中结构有所不同, 但因共有一个保守序列-Cys-Pro- Pro-Cys-, 即CPPC, 故可通过这段序列上的2个半胱氨酸残基的-S-S-之间的变换而发挥作用。在缺少配体SCR时, 采用Ser取代该保守序列中的2个Cys[28]或缺失第一个Cys均可导致SRK与THL1/ THL2特异结合作用的消失[51], 表明保守序列中第一个Cys是SRK与THL1/THL2相互作用的必需氨基酸。
在自交亲和系油菜B. napusSRK910[52]中, 以B. napusSRK910为诱饵, 通过酵母双杂交检测到SRK与THL1的相互作用, 且抑制THL1/THL2基因的表达导致自交亲和植株表现为自交不亲和。当SCR与相同单倍型eSRK结合时, SRK构象改变而挣脱负调节的THL1/THL2, 激活SRK激酶域, 发生自体磷酸化, 暗示这2种硫氧还蛋白在自交不亲和中的功能是在缺乏配体SCR时与SRK激酶域在保守序列CPPC处特异结合[35], 致使SRK之间形成二聚体或自身磷酸化而保持无活性, 最终导致自交亲和反应。但是, 在自交亲和系油菜中, THL负调节SRK激酶域这一结论在拟南芥研究中受到了质疑。2013年Yamamoto等[53]将自交不亲和系A. lyrata成对的SRKb-SCRb基因共转化入模式植物拟南芥A. thaliana中, 转基因植株A. thaliana可正常表现SI, 进一步或移码突变SRKb, 使其为缺少一个被认为是SRK与THL互作关键的Cys氨基酸残基, 或插入突变THL1/THL2, 授粉实验表明均没有观察到SRKb与亲和或不亲和的花粉配体结合。因此, THL可能只是SRK的一种负调节因子, 而不是唯一的负调节因子, 在十字花科自交不亲和系及亲和系的转变中, 是否还存在其他调节因子, 或THL是否还调节其他信号传导元件, 还有待进一步的研究。
2.2 MLPKM位点蛋白激酶(M-locus protein kinase, MLPK)是一种膜锚定蛋白, 属于胞质类受体激酶(receptor- like cytoplasmic kinase, RLCK)VII亚家族成员。Murase等[8]采用图位克隆方法鉴定了甘蓝MLPK基因全序列, 序列分析表明, 该基因包含8个外显子和7个内含子, 编码含404个氨基酸残基的蛋白。序列比对MLPK发现其包括Ser/Thr蛋白激酶活性位点、蛋白激酶磷酸化位点、cAMP磷酸化位点及典型的植物N-豆寇酰化(N-myristoylation)序列。Northern杂交显示, MLPK主要在柱头中表达, 在授粉初期表达量较低, 开花后2~3 d表达量达到最高, 推测MLPK参与了自交不亲和信号传导过程。进一步在芜菁B. rapa材料自交亲和突变体中瞬间表达MLPK, 结果柱头乳突细胞恢复抑制“ 自花” 授粉的能力, 从而证明SI信号传导途径还受M基因座的控制。遗传分析[9]则表明, M位点与S位点独立, 与SRK共区域化, 对S位点起隐性上位作用。
Takada等[54]在分析sui和mlpk表型的后代分离比率后, 发现了一条依赖MLPK参与花粉与柱头识别的路径, 暗示MLPK参与了并在一定程度上影响着以SRK为柱头决定因子的反应, 因MLPK也存在于柱头, 故该路径被命名为“ 柱头单侧调节不亲和反应” , 它是单侧不亲和(unilateral incompatibility, UI)中的一种。单侧不亲和分为柱头和花粉两方面, 分别由2个很相似的位点控制, 分别命名为柱头单侧不亲和(stigmatic unilateral incompatibility, SUI)位点和花粉单侧不亲和(pollen unilateral incompatibility, PUI)位点, 这2个位点之间紧密连锁但均不与S位点连锁。MLPK选择不同起始位置转录和翻译得到MLPKf1和MLPKf2, 二者在柱头乳突细胞中表达, 仅在N端不同, 依次靠甲基化和疏水残基定位于细胞膜, 双分子荧光互补分析实验表明MLPK的这2种同型物(MLPKf1和MLPKf2)可与SRK直接相互作用来传导SI信号[55], 但MLPK本身不同于这2种亚型, 其功能有待进一步探索。
烟草原生质体内发现SRK与MLPK复杂的相互作用[14], 但酵母双杂交系统却没有检测到二者直接相互作用[55, 56], 据此认为, 可能是在SCR激活SRK前MLPK与未活化的SRK在质膜上发生了短暂相互作用。点突变油菜变种Brassica rapa var. yellow sarson MLPK中的核酸序列, 使一个氨基酸残基被替换, 结果MLPK自磷酸化活性丧失[56], 自交不亲和性也随之丧失, 这既意味着MLPK参与了SRK调控的信号途径, 也支撑着MLPK与SRK形成信号复合物共同调控自交不亲和反应的假设。体外磷酸化试验[57]发现, SRK激酶域能有效地磷酸化MLPK, 这很可能是因为二者均拥有Ser/Thr激酶活性, 活化的SRK激酶域首先磷酸化MLPK, 磷酸化的二者再同时与ARC1结合。但是, 目前还不确定MLPK是否在抑制花粉管生长中起作用[58]。
2.3 ARC1ARC1 (armadillo-repeat containing protein 1) 是一类具有E3泛素化酶活性的蛋白, 含有U-box及C末端臂重复区(ARM)等重要区域, 主要在芸薹属柱头中表达。Gu等[6]在筛选自交不亲和性油菜开花前1~2 d花蕾柱头cDNA文库时发现了ARC1基因, 刘东等[59]利用PCR和RT-PCR技术分别克隆了高度自交不亲和性的甘蓝和油菜中ARC1的基因组DNA和cDNA, ARC1编码基因只包含一个开放阅读框, 无内含子存在, 全长2073 bp, 编码663个氨基酸残基, 其高级结构也含有几个基序集结区[60], 即N端亮氨酸拉链、卷曲结构、核定位信号、2个核输出信号、U-box、C末端臂重复(ARM)。亮氨酸拉链(leu zipper)和卷曲结构域(coiled-coil domain)是ARC1的N端假设的2个蛋白质相互作用区域, 这2个区域将促进U-box和E2泛素连接酶(E2 ubiquitin-conjugating enzyme)同底物的结合[61]。
ARM及U-box这2个区域在ARC1同上下游底物结合中具有相当重要的作用。酵母双杂交系统及体外实验证实了ARC1通过C末端的臂重复区ARM与SRK激酶结构域相互作用, 且两者的相互作用依赖于磷酸化作用[62]。ARM由约40氨基酸组成, 在不同ARM蛋白中, 甚至在同一蛋白中ARM氨基酸序列保守性都很低, 但在空间结构上具有高度的保守性。ARC1约含有3~8个ARM串联组成的超螺旋结构, 这就使本身并不具功能的ARM通过相互衔接形成了一个特异的超螺旋结构, 提供了与蛋白相互作用的独特区域[63]。该独特区域由3个α 螺旋(Helix 1、Helix 2和Helix 3)组成, 其中2个较长的α 螺旋(Helix 2和Helix 3)紧密相互作用形成一个反向平行排列的发卡结构, 而较短的α 螺旋(Helix 1)通常垂直于发卡结构[64, 65], 构成三联体。三联体重复紧密的组装形成一右手α 超螺旋结构, 该结构形成的ARM功能域是一个连续的疏水中心。此外, 在超螺旋的表面还形成一条大沟, 提供了与靶蛋白结合的区域[64, 66]。
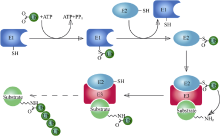
U-box是真核生物体内广泛存在的一种高度保守的基序, 约由70个氨基酸残基组成, 发挥泛素连接酶E3作用, 促进下游底物蛋白的泛素化降解[67]。U-box与典型ring-finger具有相似的氨基酸序列和β β α β 折叠构象, 且在相同的部位暴露出疏水氨基酸和芳香族氨基酸残基[60], 但不同的是U-box功能域主要依靠盐键和氢键来稳定其结构, 而非典型的螯合“ Zn” [68]。2003年Stone等[69]研究认为, ARC1具有E3连接酶的活性, 它和泛素激活酶(Ub-activation enzymes, E1)、泛素结合酶(Ub-conjugating enzymes, E2)参与的泛素化反应能够使底物蛋白泛素化。Newhigin等[70]则进一步确定了该泛素化反应过程, 即E1+Ub+ATP→ E1-Ub+AMP+PPi; E2+E1-Ub→ E2-Ub+E1; E2-Ub+E3+Substrate→ Substrate-Ub+E3+E2, 反应过程如图3[71]。Samuel等[72]酵母双杂交技术表明ARC1的N端与外分泌蛋白Exo70A1结合。这些研究表明, 具有E3连接酶活性的U-box与下游底物Exo70A1结合, 在E1与E2协助下完成对底物的泛素化。亚细胞定位研究[60]表明, ARC1在细胞核、细胞质和26S蛋白酶体/CSN (COP9 signalosome)之间穿梭, 26S蛋白酶体/CSN是泛素化蛋白降解的主要场所。删除全部或部分U-box功能域, 或点突变U-box功能域中保守的脯氨酸(Pro)残基为丙氨酸(Ala)残基, 均可导致ARC1不能定位到26S蛋白酶体/CSN上, 底物蛋白Exo70A1也不能被泛素化, 证明U-box功能域对于ARC1定位到26S蛋白酶体/CSN上是必需的[60], 且被ARC1泛素化标记的蛋白只能通过26S蛋白酶体/CSN的作用才能被降解。进一步推测SRK激酶域磷酸化ARC1的C端臂重复区后, ARC1 N端与胞质内的靶蛋白Exo70A1结合, 在E1与E2的共同协助下, 促使Exo70A1经泛素化作用形成蛋白复合体, 泛素化的Exo70A1在ARC1 U-box功能域作用下定位于26S蛋白酶体/CSN, 导致Exo70A1被降解。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 泛素化系统示意图(Dodd R B作图; Deshaies等[71])Fig. 3 Schematic diagram of the ubiquitination system (Created by Dodd R B, from http://en.wikipedia.org/; Deshaies et al.[71]) |
2.4 Exo70A1Exo70类蛋白质首先发现于酵母[72, 73], 在酵母、果蝇、线虫及动物细胞中仅发现Exo70家族的一个成员, 而在拟南芥和水稻等[74, 75]植物细胞中, Exo70却是由23个成员组成的大家族。这23种拟南芥中的Exo70基因的分子量差异不大, 序列一致性较低, 在15.8%到76.5%之间变化, 系统发育分析发现, 23种Exo70基因可分为3个进化主枝及9个亚枝, 可知Exo70家族成员的功能差异很大。RT-PCR及半定量RT-PCR分析[75]表明, Exo70家族在拟南芥不同器官中存在表达差异, 且只有Exo70A1、Exo70D2、Exo70H4、Exo70H5和Exo70H7这5个成员在十字花科自交不亲和的雌蕊柱头中表达, 这意味着该5个成员不同于Exo70家族的其他成员, 可能在植物体发育过程中发挥特殊功能。而其中通过Synek[75]克隆的Exo70A1是Exo70家族中唯一通过GUS表达分析、基因敲除和RNA原位杂交技术研究的基因, 揭示它不仅在胚轴和根毛伸长及柱头与花粉识别中均有重要作用[74, 75], 还作为植物胞外泌复合体(exocyst)的一个组分调节植物生殖器官的发育。Samuel等[74]推测Exo70A1很可能是SI反应中ARC1的一个下游底物分子, 甘蓝型油菜的转基因柱头中Exo70A1蛋白超量表达, 结果该油菜植株由自交不亲和变为亲和, 相反, 抑制Exo70A1基因表达却导致甘蓝柱头表面的花粉粒萌发与花粉管伸长进程受到抑制。遗传、生理、嫁接等实验也表明Exo70A1在生长中的导管处表达, 并介导细胞次生壁加厚过程中的囊泡运输[76], 而加厚的次生壁锁住柱头表面的水, 使柱头逐渐变干燥而不适合“ 自花” 花粉的萌发。
Samuel等[74]虽然运用Northern杂交技术对Exo70A1在甘蓝型油菜花期的雄蕊、雌蕊和叶片中的表达进行了分析, 然而并未阐述其在不同发育时期的各个器官中的表达量变化, 所以探索该家族的其他同源蛋白的生理作用也是进一步丰富整个SSI (sporophytic self-incompatibility)途径所要求的。Exo70A1作为一类新的SI信号传导元件, 涉及的功能包括水合和根毛的伸长、植物生长素根中的极性运输等[75], 这些可能与花粉管被抑制时生长物质运输相关。
拟南芥其他的Exo70家族成员也一直是研究热点。Li等[76]发现Exo70A1的一种同源蛋白Exo70C1在成熟花粉和萌发的花粉管中特异表达; 除了Exo70B2没有GUS表达外, 其他22种基因在潜在的胞外分泌活性的细胞中都有GUS表达; 利用拟南芥Exo70E2和GFP作为探针, 发现一类新的双膜细胞器EXPO (exocyst-positive organelle)[77], Exo70E2表达受抑制时, 拟南芥原生质体中短暂表达的胞外分泌蛋白亚基无法聚集形成EXPO, 而这一过程不能由Exo70A1替代。荧光共振能量转移及双分子荧光互补方法验证了Exo70E2与其他分泌蛋白相互作用, 在动物细胞中电镜检测也确认了EXPO类似物需要Exo70E2的参与, 其作用与聚集胞外分泌亚基形成EXPO有关[77]。23种Exo70基因中某些成员截然不同的表达模式在一定程度上暗示了这些基因功能的多样性和特异性, 这意味着Exo70在植物体发育过程中可能发挥着许多重要功能。
Exo70A1参与SI反应是当Exo70A1泛素化水平达到一定程度时, 蛋白复合体(E2/ARC1/Exo70A1)中泛素结合酶E2脱落, ARC1引导泛素化的Exo70A1移至蛋白酶体/CSN, 并在蛋白酶体处诱导自交亲和蛋白质Exo70A1的降解, 继而引发级联反应, 致使“ 自花” 花粉的萌发与花粉管的生长被抑制[78]。
2.5 MOD/MIP-MOD水孔蛋白(aquaporin, AQP)是指在细胞膜上能选择性地高效转运水分子的膜内在蛋白, 以四聚体形式存在, 每个单体均含有5个短环相连、6个跨膜α 螺旋, 形成了独特的水通道, 属于MIP (major intrinsic protein )超家族。根据氨基酸序列同源性和结构特征, AQP可分为5类, 其中, 质膜内在蛋白PIPs (plasma membrane intrinsic proteins, PIPs)位于质膜上, 分为PIP1、PIP2和PIP3亚类。1983年, Hinata等[9]首次在芸薹属植物中克隆了一种类似水孔蛋白AQP的编码基因MOD。进一步遗传位点鉴定表明, MOD在柱头中表达和发挥作用[79], 但其编码基因与S位点不存在连锁关系, 这是首次将MOD与SI联系在一起。Ikeda等[79]通过隐性突变mod, 致使植株从自交不亲和变为亲和, 扫描电子显微观察芸薹属自交亲和授粉表明, 在授粉初期水孔蛋白将柱头的水或者其他物质运至花粉, 说明MOD可能在芸薹属自交不亲和中是不可或缺的, 它所含有的4个可能的磷酸化位点暗示MOD可能以磷酸化方式调控水分的运输, 实现芸薹属孢子体自交不亲和的分子过程[80]。Dixit等[81]2001年发现了一类编码定位质膜的类水孔蛋白的基因, 命名为MIP-MOD(major intrinsic protein associated with the MODlocus)。氨基酸序列比对发现MIP-MOD与Arabidopsis PIP1相似性超过90%, 且研究已证实Arabidopsis PIP1蛋白与爪蟾卵母细胞Xenopus oocytes水运输活性[82]及水穿梭植物细胞相关[83], 揭示MIP-MOD编码蛋白属于MIP超级族AQP中的亚类PIP1家族。RNA凝胶图谱分析[79](RNA gel plot ananlysis)野生型MIP-MOD/突变体MIP-mod、报告基因(reporter gene)结合uidA基因导入芸薹属植株表达[81], uidA基因编码融合MIP-MOD5° 端1.7 kb片段的β -葡萄糖醛酸酶GUS (β -glucuronidase), 结果表明MIP-MOD在芸薹属柱头乳突细胞及植物营养组织中表达。利用自交不亲和B. rapa S8/自交亲和B. rapavar. Yellow Sarson F2代158植株进行限制性片段长度多态性(restricted fragment length polymorphisms, RFLP)分析, 揭示了MIP-MOD不同于MOD[79], 但二者在膜上的位点连锁紧密。2001年Fukai等发现MIP-MOD是一类MOD候补基因, 进一步命名为MLM(for MIP gene linked to MOD)[84], 分析其他自交不亲和的白菜B. rapa中MIP-MOD核酸序列可知, 若MIP-MOD基因与自交亲和B. rapavar. Yellow Sarson MIP- MODYS为纯合子等位基因, 即使该基因高表达也不是自交不亲和反应的关键, 推测MIP-MOD蛋白可能联合某些目前还未鉴定的PIP家族蛋白调节水的跨膜运输, 参与自交不亲和。由此, MIP-MOD蛋白的功能有待进一步研究。
在“ 自花” 授粉时, 磷酸化的SRK通过信号传导途径, 激活MOD及其它候补基因, 如MIP-MOD蛋白, 活化的MOD和结合其他PIP家族蛋白的MIP-MOD可能通过潜在的磷酸化位点来调节花粉与柱头之间的水分或者某些小分子的分配来调控水通道开关, 降低“ 自花” 花粉吸水速率, 致使水分从花粉中流失转移至乳突细胞, 花粉因缺水不能萌发而发生SI反应; 或阻止乳突细胞分泌水分子, 从而在芸薹属植物干性柱头的表面发生SI反应, 由于花粉附着于比较缺水的环境, 缺乏表面分泌物而停止生长, 反之, 亲和花粉能凭借分泌水或者小分子物质粘附在柱头的乳突细胞上而继续生长。
3 甘蓝自交不亲和性信号传导的分子过程包括甘蓝在内的十字花科SRK信号传导途径中的蛋白元件已经被确定。目前研究认为SLG可同时与eSRK和SCR相互作用, 而SLG与SCR结合极有可能是通过某些SCR与eSRK相互作用类似的位点, 再利用SLG的信号肽一起泊位到乳突细胞壁上, 信号肽解离后, 导致复合物构象改变, 实现了SCR与SRK结合。SCR与SRK结合的特异性同时受正调节元件及负调节元件共同调控。2种与SRK作用的负调节物是硫氧还蛋白(thioredoxin-h-like, THL)蛋白THLl和THL2, 当配体SCR不存在时, THL1和THL2使SRK之间形成二聚体或自身磷酸化, 这种负调控只在部分十字花科植物中出现。2种与SRK作用的正调节物分别是MLPK (M-locus protein kinase)和ARC1 (arm repeat containing1) E3泛素连接酶, 酵母双杂交系统没有检测到MLPK与SRK的直接相互作用, 而体外磷酸化试验表明, SRK激酶域能有效地磷酸化MLPK[51], 可能是SRK激酶域磷酸化MLPK, 促进了MLPK和SRK共同与ACR1作用[55, 56]。酵母双杂交实验则表明, ARC1的C端臂重复区ARM、N端分别与SRK激酶域、胞外分泌蛋白Exo70A1相互作用[[15, 74]。其中, ARC1的C端臂重复区ARM被SRK激酶域磷酸化, 而ARC1 N端引导泛素化的Exo70A1移至蛋白酶体/CSN, 在蛋白酶体处诱导其降解, 继而引发自体花粉的萌发与花粉管生长的被抑制[78]。
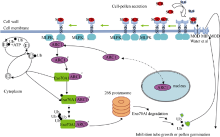
前述各个蛋白元件的功能形成了一个框架上完整地、涉及胞外和胞内的自交不亲和分子过程, 如图4。“ 自花” 授粉前, 未被SCR激活的部分物种中的SRK激酶在THL1和THL2的负调控下形成二聚体复合物, 当柱头乳突细胞表面的“ 自花” 花粉分泌的配体SCR落到柱头时, 分泌到乳突细胞的细胞壁上的SLG与SCR识别后形成二硫键复合物, 复合物再利用SLG的信号肽经细胞壁、胞间区, 并最终定位到SRK锚定的细胞膜附近, 信号肽解离导致复合物构象改变, SRK释放THLI/THL2、解除抑制并被磷酸化, 由磷酸化活化的SRK激酶域再瞬间磷酸化MLPK[51], 磷酸化的MLPK、SRK可能通过某些基序与ARC1相互作用[55, 56], 引发ARC1的磷酸化, 继而改变细胞质定位。活化的具有E3连接酶酶活性的ARC1与胞质中一潜在的靶蛋白— — Exo70A1结合, 在泛素活化酶E1与泛素接合酶E2的共同协助下, Exo70A1经“ 泛素化— 蛋白酶体途径” 而降解, 当Exo70A1数量减少到不能直接或间接与MOD及其候补基因蛋白MIP-MOD相互作用时, 柱头细胞不再将水或者其他物质运至乳突细胞表面, 从而降低甚至阻止花粉水合的速率, 最终导致“ 自花” 花粉管不能萌发或即使萌发也没有足够的能力到达子房完成受精, 致使发生自交不亲和反应。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 甘蓝柱头乳突细胞拒绝“ 自花” 花粉的自交不亲和分子过程(Newbigin等[70], Deshaies等[85])“Fig. 4 Brassica oleracea L. self-incompatible molecular process that papilla cell rejects self-pollen |
4 展望自交不亲和性一般表现为4种情况[86]: 第一, 花粉落到雌蕊的柱头上后花粉粒并没有萌发; 第二, 花粉落到柱头上时花粉粒可以萌发但花粉管不能进入柱头; 第三, 花粉管不能在柱头中正常伸长, 不能到达胚囊; 第四, 到达胚囊的花粉管释放的精子不能与卵子正常结合形成受精卵。根据这4种情况, 可以对整个自交不亲和信号传导可能涉及的元件及可能的反应途径深入探究。
甘蓝中已发现有50多种S等位基因, 至今已分离到SCR、SLG和SRK三类与该位点连锁的基因。根据Goh等2000年[42]和2002年[43]提出相互作用的蛋白质通常具有相似的进化关系, 表现为互作区域相似的进化树, 对SCR/SLG/SRK三种蛋白进行序列上进化分析, 可能从进化的角度诠释蛋白相互作用。酵母双杂交等技术揭示的SRK激酶域与ARC1臂重复蛋白区等相互作用[87]又从构象上研究和发现SI蛋白元件相互作用基序奠定了基础。随着甘蓝基因组框架图的完成[88]和精细测序的逐步完成, 以及对SI机理的深入研究, 可能还会发现更多的S位点基因或S位点相关基因, 这方面是值得期待的。
此外, 还有一些甘蓝SI信号传导元件的分子功能还需进一步明确。THL是SRK负调节因子, 这一结果只在自交亲和系油菜B. napus中被发现[52], 将自交不亲和系拟南芥A. lyrata中成对的SRKb-SCRb基因共转化拟南芥A. thaliana, 突变SRKb基因, 授粉试验表明THL的作用与这一结论完全相反[53]。MLPK具有Ser/Thr蛋白激酶的功能, 目前还没有完全弄清MLPK与SRK激酶域之间的关系, 对其深入研究将进一步解释MLPK在胞内SI中的作用。ARC1作为胞内重要的信号传导分子, 其C端臂重复区与SRK激酶域结合, N端在E1和E2协助下泛素化Exo70A1; Exo70A1参与自交不亲和反应, 其泛素化后被蛋白酶体降解, 致使“ 自花” 花粉的萌发受阻及抑制花粉管的生长, 但不清楚Exo70A1是ARC1的唯一底物还是底物之一。Exo70A1的同源蛋白Exo70C1的突变导致拟南芥柱头中花粉管伸长减缓, 说明其在一定程度上与SI反应相关; Exo70E2蛋白也被发现可在胞外分泌蛋白亚对基聚集形成EXPO细胞器有关键作用[77]。对Exo70A1、Exo70C1和Exo70E2这3个Exo70家族成员的深入研究, 是探索Exo70家族其他20多种同源蛋白生理作用的基础与先导, 完全有可能将SI信号传导分子过程, 同更为广泛的诸如植物对环境响应的分子生理过程联系起来。
甘蓝SI信号传导过程还涉及很多其他的功能分子[89], 如KAPP (kinase-associated protein phosphatase)、钙调蛋白、微管连接蛋白等。KAPP是一种蛋白磷酸化酶, 酵母双杂交实验证明甘蓝的KAPP在体外与SRK激酶域相互作用并被磷酸化, 同时使SRK去磷酸化。SRK作为SI反应雌蕊中的决定因子, 无论其与MLPK、KAPP的互作, 还是与下游的ARC1的互作, 都离不开磷酸化的作用, SRK磷酸化与否直接将决定下游SI信号传导, 但KAPP与MLPK是否共同调节SRK的磷酸化, 从而达到调节其与ARC1的相互作用的机理还需要进一步明确。钙调蛋白广泛参与酶与功能蛋白的活性调节, 钙调蛋白的活性调节与细胞内Ca离子浓度水平有关, 而花粉的萌发和花粉管的伸长对Ca离子变化非常敏感, 自花授粉后, 刚萌发的花粉管与柱头的乳突细胞接触数分钟后, 花粉管呈螺旋状, 不能侵入乳突细胞, 而此时钙浓度却上升了65% [89], 但目前基于钙离子相关信号传导途径与SI信号传导途径的关系还不十分清楚, 可能钙离子作为植物细胞的第二信使对花粉和花粉管的生长进行调节。微管连接蛋白也与花粉管萌发有关, 推测其可能在SI反应信号传导中也有一定作用。
The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] | |
| [37] | |
| [38] | |
| [39] | |
| [40] | |
| [41] | |
| [42] | |
| [43] | |
| [44] | |
| [45] | |
| [46] | |
| [47] | |
| [48] | |
| [49] | |
| [50] | |
| [51] | |
| [52] | |
| [53] | |
| [54] | |
| [55] | |
| [56] | |
| [57] | |
| [58] | |
| [59] | |
| [60] | |
| [61] | |
| [62] | |
| [63] | |
| [64] | |
| [65] | |
| [66] | |
| [67] | |
| [68] | |
| [69] | |
| [70] | |
| [71] | |
| [72] | |
| [73] | |
| [74] | |
| [75] | |
| [76] | |
| [77] | |
| [78] | |
| [79] | |
| [80] | |
| [81] | |
| [82] | |
| [83] | |
| [84] | |
| [85] | |
| [86] | |
| [87] | |
| [88] | |
| [89] |
