 , 周春菊
, 周春菊* 通讯作者(Corresponding authors): 吕维涛, E-mail:wtlv@ibcas.ac.cn, Tel: 13811773675; 周春菊, Tel: 029-87092262 收稿日期:2014-06-16 基金:
摘要
关键词:玉米; bZIP转录因子; A亚族; ABA; 逆境胁迫
Cloning, Expression, and Functional Analysis of an A Subfamily bZIP Transcription Factor Gene
WANG Ce
 , ZHOU Chun-Ju
, ZHOU Chun-JuFund:
Abstract
Keyword:Maize; bZIP transcription factor; A subfamily; ABA; Abiotic stress
Show Figures
Show Figures











bZIP转录因子广泛存在于动植物和微生物中, 参与多种生物学过程。它是转录因子中一个较大的家族, 所有成员均由一个起二聚体化作用的亮氨酸拉链结构域和一个结合DNA的碱性结构域组成[ 1]。亮氨酸拉链结构域能够形成一个具有两亲性的α螺旋, 通过形成二聚体与DNA结合。DNA结合结构域再通过一个固定的N-x7-R/K结构专一性地识别并结合启动子上的顺式作用元件。此外, bZIP转录因子一般还含有一个或多个转录激活结构域, 当转录因子与DNA结合后起加强转录的作用[ 2]。研究表明, 植物bZIP转录因子通过参与ABA信号转导响应多种非生物胁迫, 如盐胁迫、干旱胁迫、热胁迫等[ 3]。拟南芥 ( Arabidopsis thaliana) 中的bZIP转录因子家族共有75个成员, 可以根据其碱性亮氨酸拉链的同源性和其他保守域的序列特征的不同分为10个亚族, A亚族bZIPs主要在种子和植物组织对ABA和逆境胁迫的响应信号网络中发挥重要作用[ 4, 5]。如ABI5蛋白是ABA抑制种子萌发和幼苗生长过程中的重要信号组分, 受ABA、干旱和高盐胁迫诱导表达, 能提高植物对外源ABA的敏感性, 在干旱条件下参与靶基因的转录调控, 对植物抗逆性起重要作用[ 6]。与拟南芥ABI5相似, 水稻( Oryza sativa L.)中的OsABI5能抑制种子萌发和幼苗生长, 可以与G-box元件结合并激活抗逆基因的表达[ 7]。在种子发育期, AtABI5和OsABI5均可通过对ABA的感知诱导胚胎发育晚期丰富蛋白基因的表达[ 7]。
玉米( Zea mays L.)是重要的粮食作物。然而随着生态环境的不断恶化, 土壤盐渍化已成为影响玉米生长发育和结实的一大危害, 严重制约了作物产量[ 8]。在一些盐渍化地区种植的玉米往往表现为出苗时间延迟、发芽率降低、光合作用受抑并导致产量降低[ 9]。因此, 提高植物的抗盐性、增加盐胁迫下作物产量成为备受人们关注的课题。bZIP转录因子对植物逆境基因表达调控具有重要作用, 已在玉米研究中受到关注。Wei等[ 10]利用玉米基因组数据库鉴定出125个 bZIP基因, 编码170种蛋白, 通过序列分析将其划分为11个亚族, 并按染色体中的定位顺序将其命名。Ying等[ 11]和Yan等[ 12]对玉米A亚族bZIP转录因子ZmABI5和ZmbZIP72的研究表明, 它们的基因表达均受ABA与逆境胁迫诱导上调, 过表达 ZmbZIP72使拟南芥转基因株系对ABA的敏感性增强, 且抗旱、抗盐; 但过表达 ZmABI5却导致拟南芥转基因株系对盐、旱、高温和低温胁迫更为敏感。A亚族中bZIP转录因子从系统进化关系上可被进一步分为3个分支, ZmbZIP72与ABI5和OsbZIP72等构建在同一个系统进化分支上[ 11], 而另外两个分支上的bZIP13/GBF4、bZIP14/27等在玉米中的同源基因功能尚未见报道。为进一步探究玉米A亚族bZIP转录因子在ABA信号途径与逆境胁迫响应中的作用, 本文对从ZmGDB (http://www.plantgdb.org/ ZmGDB/)数据库搜索到的一个与拟南芥 GBF4和 AtbZIP13基因有较高同源性的、被Wei等[ 10]命名为 ZmbZIP81的基因进行克隆, 利用实时定量PCR技术分析了 ZmbZIP81在玉米中的胁迫诱导表达模式, 并通过分析过表达该基因的拟南芥植物表型探讨了ZmbZIP81在ABA信号途径和逆境胁迫抗性中的作用。本研究结果对于研究玉米响应外界环境胁迫的机制、培育抗盐玉米新品种具有参考价值。
1 材料与方法1.1 玉米材料及处理将玉米B73自交系种子置蒸馏水浸湿的纱布上, 于28℃暗培养2 d后, 种植于盛有搅拌均匀的花土和蛭石的小花盆中, 在28℃、12 h/12 h光周期条件下培养。参考Ying等[ 11]的ABA、NaCl和干旱处理方法并加以改进: 取三叶一心期的幼苗, 将根部浸没在100 μmol L-1 ABA和150 mmol L-1 NaCl溶液中, 并以溶剂浸根为对照, 分别于处理0、2、6和12 h后取样; 另从土中取出同时期幼苗, 在室温下自然干燥, 分别于植株失水量达到鲜重的20%、40%和60%时取样, 并取土壤中正常生长的植株叶片为对照。将各组样品立即用液氮冷冻并于-70℃保存。
1.2 RNA提取及第一链cDNA的合成用总RNA提取试剂盒(TRIzol Reagent, TaKaRa)提取样品总RNA, 并用DNase I (TaKaRa)纯化。按照SuperScript III反转录酶(Invitrogen)说明书合成第一链cDNA, 作为基因扩增及荧光定量PCR (Real-time quantitative PCR, qRT-PCR)的模板。
1.3 ZmbZIP81基因的克隆 以正常条件下生长的三叶一心期B73自交系玉米幼苗的cDNA为材料, 用基因特异性引物ZmbZIP81-F和ZmbZIP81-R (表1)和高保真的Phusion High-Fidelity DNA聚合酶(NEB)进行基因扩增, 反应程序为98℃预变性30 s, 之后进入循环程序98℃ 10 s, 62℃ 20 s, 72℃ 45 s, 退火温度每隔一个循环降低1℃, 至49℃, 最后72℃延伸10 min的Touchdown程序。PCR产物经1%琼脂糖凝胶电泳检测, 并回收目的条带。产物连接Gateway载体pENTR/ D-TOPO (Invitrogen), 转化大肠杆菌感受态TOP10, 经菌液PCR筛选阳性克隆, 测序验证。测序正确的中间载体通过LR反应(LR克隆酶, Invitrogen)将扩增片段连入植物表达载体pLeela (Invitrogen), 测序验证。
表1
Table 1
表1(Table 1)
| 表1 所用引物 Table 1 Primers used in this study |
1.4 DNA与蛋白质序列的生物信息学分析利用ZmGDB (http://www.plantgdb.org/ZmGDB/)数据库搜索 ZmbZIP81基因及其所编码的蛋白序列, 并通过PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线服务器查找并分析其启动子区ABA与胁迫相关信号响应元件。利用TAIR (http://www.arabidopsis.org/)数据库查找拟南芥中A亚族bZIP转录因子蛋白序列。使用ClustalX 2.0对ZmbZIP81和拟南芥A亚族bZIP蛋白进行多重序列比对[ 13], 用GeneDoc对比对结果进行保守序列分析, 用MEGA5构建由Bootstrap检测(1000次抽样)的系统发育树[ 14]。利用MEME (http://meme.nbcr.net/meme/cgi-bin/meme.cgi)在线服务器分析保守结构域[ 15]。
1.5 玉米苗期 ZmbZIP81基因在胁迫条件下的表达 以ABA、NaCl和干旱处理条件下的三叶一心期B73自交系玉米幼苗和对照组的cDNA为材料, 采用Toyobo公司SYBR Green Master Mix进行qRT-PCR扩增, 反应体系含cDNA 1 μL、2×SYBR Green Master Mix 7.5 μL、引物(10 pmol μL-1)各0.3 μL、ddH2O 5.9 μL。以玉米 β-tubulin为内参, 以qRT- ZmbZIP81-F和qRT-ZmbZIP81-R, qRT-β-tubulin-F和qRT-β-tubulin-R (表1)为引物, 用Eppendorf公司Realplex PCR仪实时定量检测基因表达。反应程序为94℃预变性30 s, 之后94℃ 5 s, 55℃ 30 s, 72℃ 20 s, 共40个循环。采用2-ΔΔCt法分析基因相对表达量[ 16]。
1.6 ZmbZIP81转基因拟南芥纯合株系的获得与验证 将植物表达载体转化农杆菌菌株GV3101 (pMP90RK), 得到的阳性菌克隆经PCR验证后采用浸花法侵染野生型拟南芥(Col)植株, 收获成熟T0代种子。T0代种子经消毒后, 点播在MS选择培养基(含100 μg mL-1草甘膦)上筛选抗性植株, 种植收种。在相同选择培养基上筛选T1代种子抗性与非抗性植株符合3∶1分离比例的单株, 经一代种植后选择在相同选择培养基上不发生分离的T2代抗性株系种子进行进一步分析。
为分析转基因株系中 ZmbZIP81的表达量, 将各转基因株系与野生型种子播于MS培养基上, 4℃春化3 d后, 在22℃、16 h/8 h光周期条件下培养10 d, 取整株幼苗如前述方法提取总RNA, 并合成第一链cDNA, 进行RT-PCR扩增, 反应体系为cDNA 1 μL、2× Taq Mix 5 μL、引物 (10 pmol μL-1) 各0.5 μL、ddH2O 3 μL。以拟南芥 Actin7为内参, 用引物qRT-ZmbZIP81-F和qRT-ZmbZIP81-R、RT-actin7-F和RT-actin7-R (表1)分别扩增 ZmbZIP81基因序列和内参序列, 反应程序为94℃预变性30 s, 之后94℃ 10 s, 55℃ 30 s, 72℃ 20 s, 共25个循环。对PCR产物进行切胶回收与测序验证。
1.7 ZmbZIP81转基因拟南芥ABA敏感性和抗盐性分析 参考Ying等[ 11]的ABA和NaCl处理方法并加以改进。将T2代转 ZmbZIP81基因的拟南芥与野生型种子以70%酒精30 s、7% NaClO 15 min消毒后分别播于含5 μmol L-1 ABA及200 mmol L-1 NaCl的MS培养基上, 以未加ABA和NaCl的MS培养基为对照, 4℃春化3 d后, 在22℃、16 h/8 h光周期条件下培养并于每24 h统计萌发率, 总共统计7 d。另将转基因拟南芥与野生型种子经同样方法消毒后播于MS培养基上, 4℃春化3 d后, 在22℃、16 h/8 h光周期条件下培养3 d, 选取长势相同的幼苗分别移至含有50 μmol L-1 ABA及150 mmol L-1 NaCl的MS培养基上, 以未加ABA和NaCl的MS培养基为对照, 生长一段时间后观察转基因植株和野生型植株的表型差异。
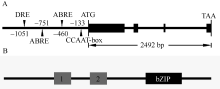
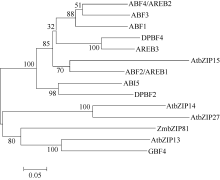
2 结果与分析2.1 ZmbZIP81序列分析 ZmbZIP81基因位于玉米第6染色体, 编码区全长2492 bp, 具有4段外显子区和3段内含子区, 编码254个氨基酸(图1-A)。除亮氨酸拉链结构域外, ZmbZIP81蛋白还包含2个保守域Motif 1和Motif 2 (图1-B), 它们是一些蛋白激酶的结合位点。2个保守域中各自包含钙依赖的蛋白激酶(CDPK)等的结合位点R-X-X-S/T, 以及酪蛋白激酶II (CK II)的结合位点S/T-X-X-E/D。此外, 对 ZmbZIP81基因的启动子区分析发现2个分别位于-751 bp和-460 bp的ABRE元件、1个位于-1051 bp的干旱胁迫信号响应的DRE元件和1个位于-133 bp的MYB类转录因子特异性识别的CCAAT-box元件(图1-A), 表明该基因的表达可能受ABA与胁迫信号的调控。将ZmbZIP81的氨基酸序列与拟南芥中A亚族bZIPs进行多重序列比对(图2), 发现它们具有高度保守的序列和结构域。系统发育分析表明, ZmbZIP81与拟南芥中GBF4和bZIP13亲缘关系最近(图3), 且序列相似性最高, 均为42%, 而与ZmABI5和ZmbZIP72亲缘关系相对较远(未列出)。GBF4是一种能与基因启动子区G-box结合的转录因子[ 4], 但其具体功能还未见报道。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 ZmbZIP81基因(A)与编码蛋白(B)结构示意图Fig. 1 Gene structure of ZmbZIP81 (A) and conserved domains of the protein encoded (B) |
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 ZmbZIP81和拟南芥A亚族bZIP转录因子的多重序列比对Fig. 2 Alignment of ZmbZIP81 and A subfamily bZIP transcription factors in Arabidopsis |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 ZmbZIP81和拟南芥A亚族bZIP转录因子的系统发育树Fig. 3 Phylogenetic tree of ZmbZIP81 and A subfamily bZIPs in Arabidopsis |
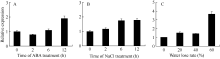
2.2 玉米苗期 ZmbZIP81基因在胁迫条件下的表达 以三叶一心期玉米幼苗为材料, 分析 ZmbZIP81基因对ABA、NaCl和干旱处理的应答表明, 上述处理均可诱导 ZmbZIP81的表达, 并且随处理时间的延长和程度的加重表达量逐渐升高(图4)。经ABA和NaCl分别处理12 h和6 h后, ZmbZIP81基因表达开始明显上调, 且两种胁迫处理12 h后, ZmbZIP81表达量达到对照组的近2倍(图4-A, B)。ABA处理2 h时表达量虽有下降, 经分析与对照组无显著性差异。干旱处理下, 当叶片失水率达到20%和40%时, ZmbZIP81表达量上调约1.5倍; 而失水率达到60%时, 表达量可达初始水平的3.65倍(图4-C)。说明 ZmbZIP 81基因的表达受ABA、NaCl和干旱胁迫的诱导。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 ZmbZIP81基因在ABA、NaCl和干旱处理条件下的表达A: ABA处理(100 μmol L-1); B: NaCl处理(150 mmol L-1); C: 干旱处理。各处理条件下, ZmbZIP81基因的相对表达量是对照的倍数。Fig. 4 Expression of ZmbZIP81 in maize under ABA, salt, and drought treatmentsA: Treatment of MS+ABA (100 μmol L-1); B: Treatment of MS+NaCl (150 mmol L-1); C: Drought treatment. The relative expression level of ZmbZIP81 under each treatment represents fold change towards the control. |
2.3 植物表达载体构建、拟南芥遗传转化与验证为进一步研究ZmbZIP81转录因子的功能, 构建了 35SS::ZmbZIP81的植物表达载体, 其结构如图5-A所示, 并采用农杆菌介导法转化拟南芥, 经抗生素筛选与基因组PCR验证获得了纯合单拷贝T2代过表达拟南芥株系OE-5、OE-9和OE-11。半定量RT-PCR验证结果如图5-B所示, 在3个过表达株系中检测到特异目的条带, 而在野生型拟南芥中未检测到。所用引物的特异性已通过对PCR产物的切胶回收与测序进行验证。以上结果表明 ZmbZIP81确已转化成功并获得稳定遗传的株系。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 ZmbZIP81过表达载体示意图(A)和 35SS::ZmbZIP81转基因株系的RT-PCR结果(B) p35SS: ZmbZIP81基因启动子; pA35S: ZmbZIP81基因终止子; Pat: 草甘膦抗性基因; Nos-p: 草甘膦抗性基因启动子; Nos-T: 草甘膦抗性基因终止子; attB1和attB2: LR反应重组位点; LB: 载体左边界; RB: 载体右边界。Fig. 5 Structure of ZmbZIP81-overexpressed vector (A) and analysis of 35SS::ZmbZIP81 transgenic lines (B) p35SS: promoter of ZmbZIP81; pA35S: terminator of ZmbZIP81; Pat: glyphosate resistance gene; Nos-p: promoter of glyphosate resistance gene; Nos-T: terminator of glyphosate resistance gene; attB1 and attB2: LR recombination sites; LB: left border; RB: right border. |
2.4 过表达拟南芥对ABA的敏感性反应在B73自交系中, ZmbZIP81基因表达显示出受ABA诱导上调的特性(图4)。为验证ZmbZIP81的功能是否与ABA敏感性存在关联, 分析了过表达 ZmbZIP81的拟南芥株系的ABA敏感性。如图6-A, B所示, 在5 μmol L-1 ABA处理下, 3个过表达株系种子萌发率均显著高于野生型, 如OE-5、OE-9和OE-11转基因株系在第7天的萌发率分别为56.5%、36.6%和56.9%, 而野生型只有14.0%; 在对照组培养基上生长的3个转基因株系与野生型种子萌发率基本一致, 表明过表达株系种子萌发对ABA的敏感性降低。另外, 当3 d苗龄的拟南芥幼苗移至含有50 μmol L-1 ABA的MS培养基上25 d后, 野生型拟南芥黄化较明显, 且部分植株已死亡, 其平均根长为2.8 cm, 存活率为61.9%; 而3个转基因株系叶片相对大而绿, 几乎全部存活, 平均根长分别为2.9、3.9和4.5 cm, 分析表明OE-9和OE-11两株系根显著长于野生型, 3个株系的存活率分别为95.2%、100%和100%, 同期的对照组幼苗长势始终一致(图7-A, B)。以上结果说明, 在种子萌发期与幼苗期, 与野生型相比, ZmbZIP81过表达拟南芥的ABA敏感性降低。因此推测ZmbZIP81可能作为ABA信号途径的负调控因子参与植物抗逆调控网络。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 ABA和NaCl处理条件下 35SS::ZmbZIP81转基因拟南芥种子萌发率统计A: MS培养基; B: ABA处理 (5 μmol L-1); C: NaCl处理 (200 mmol L-1)。Fig. 6 Germination assays of 35SS::ZmbZIP81 transgenic lines of Arabidopsis under ABA and salt treatmentsA: MS medium; B: MS+ABA (5 μmol L-1); C: MS+NaCl (200 mmol L-1). |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 ABA和NaCl处理条件下 35SS::ZmbZIP81转基因拟南芥幼苗期生长表型A: MS培养基; B: ABA处理 (50 μmol L-1); C: NaCl处理 (150 mmol L-1)。Fig. 7 Photographs of 35SS::ZmbZIP81 transgenic lines in seedling stage under ABA and salt treatmentsA: MS medium; B: MS+ABA (50 μmol L-1); C: MS+NaCl (150 mmol L-1). |
2.5 过表达拟南芥的抗逆性植物的抗逆性与ABA信号途径密切相关。在逆境胁迫下, 植物体可以通过改变内源ABA水平调控逆境胁迫相关基因的表达, 从而提高对逆境胁迫的适应性。种子萌发期耐盐性分析表明, 在含有200 mmol L-1 NaCl的MS培养基上, 各植物株系的萌发率在第7天均可达到100%, 但过表达株系种子萌发明显快于野生型, 如第4天OE-5、OE-9和OE-11三个株系萌发率分别为68.4%、84.9%和75.0%, 而野生型只有54.2%, 经检测差异达到显著水平; 在只含有MS的对照组培养基上生长的3个转基因株系与野生型种子萌发率基本一致, 第2天即可达近100% (图6-A, C)。而对过表达株系的幼苗期抗盐胁迫能力检测表明, 在150 mmol L-1 NaCl处理30 d后, 各转基因株系拟南芥幼苗长势与野生型无明显差异, 抗盐性基本一致(图7-A, C)。以上结果说明, 与野生型相比, ZmbZIP81过表达拟南芥对盐胁迫的抗性有一定程度的提高, 而这种抗性的提高只体现在种子萌发期, 不体现于幼苗期。因此推测 ZmbZIP81基因可能并不参与植物幼苗期的盐胁迫反应, 而只在种子萌发期发挥抗盐作用。我们还同时采用40% PEG-8000模拟的渗透胁迫分析了转基因拟南芥萌发期与幼苗期的抗旱性, 结果显示, 渗透胁迫下, 转基因拟南芥与野生型在种子萌发期以及幼苗期的长势基本一致(未列出), 表明 ZmbZIP81基因在植物抗旱性方面可能无明显作用。
3 讨论在干旱、高盐等逆境条件下, 植物细胞能够迅速合成ABA。在内源ABA诱导下, 大量胁迫相关基因被表达, 从而参与植物抗逆反应。拟南芥中的A亚族bZIP转录因子多数已被较为深入地研究, 它们对于植物对ABA和外界胁迫响应具有重要作用[ 17]。已报道的几个拟南芥中的A亚族bZIP转录因子表达受ABA诱导, 且其编码蛋白作为正调控因子参与植物逆境胁迫响应[ 4], 具有代表性的基因包括 ABI5、 ABI5-like、 ABF1-4等。已报道的2个玉米A亚族bZIP转录因子基因 ZmABI5和 ZmbZIP72均受ABA与逆境胁迫诱导上调, 且参与植物逆境胁迫响应[ 11, 12]。其中ZmbZIP72过表达使转基因植物对ABA的敏感性增强, 且抗旱、抗盐, 但ZmABI5是作为负调控因子参与逆境下植物对盐、旱、高温和低温等非生物胁迫的响应[ 12]。
本研究从玉米中克隆到另一个A亚族bZIP转录因子基因 ZmbZIP81, 并通过序列分析证明其编码蛋白与拟南芥中A亚族bZIP转录因子具有相似的序列特征, 它们都有1段保守的bZIP结构域和2个保守性较高的基序, 在系统进化上与拟南芥中的GBF4和bZIP13构成一个分支, 而与ZmABI5和ZmbZIP72亲缘关系相对较远。我们的实验数据也证明, ZmbZIP81虽与ZmABI5和ZmbZIP72具有类似的胁迫诱导表达模式, 但与它们在植物逆境胁迫抗性中的作用却有所不同。 ZmbZIP81转基因拟南芥对外源ABA敏感性降低, 抗NaCl胁迫能力增强, 表明它可能是ABA信号途径的负调控因子, 但可提高植物抗逆性。这与Liao等[ 18]报道的几个负调控模式的大豆bZIP转录因子GmbZIP44、GmbZIP62和GmbZIP78相似。这3个大豆转录因子分别属于S、C和G亚族, 它们对ABA敏感性降低, 对NaCl胁迫抗性增强, 并且3个基因表达均受ABA、NaCl和干旱胁迫诱导, 说明 ZmbZIP81可能与3个大豆bZIP转录因子具有类似的调控模式。另外, 在本实验中虽未发现 ZmbZIP81基因对植物抗渗透胁迫能力的显著影响, 但基于 ZmbZIP81基因的表达受干旱诱导, 且较大幅度的表达量上调出现在植株失水量达到60%时, 推测 ZmbZIP81基因可能主要参与严重干旱胁迫的反应, 或者在干旱胁迫反应中的功能需要其他调控形式、或其他调控因子的协同作用。此研究中, 我们的主要目的是对比ZmbZIP81与ZmABI5和ZmbZIP72在基因表达和功能上的差异。由于过表达 ZmABI5和 ZmbZIP72两基因的植物表型主要出现在种子萌发期和幼苗期, 所以我们也重点关注这两个阶段。后续对植物生育后期的表型分析, 尤其是在土壤干旱和盐渍条件下植物的抗性以及利用关键bZIP转录因子缺失且对盐害敏感的突变体进行互补突变体表型验证, 将有助于更加全面、深入地说明 ZmbZIP81基因的功能。
玉米作为单子叶作物, 其逆境响应信号网络可能与双子叶植物拟南芥存在较大差异。目前有关玉米bZIP转录因子的报道还较少见, 进一步研究其各成员的功能对阐明它们参与依赖于ABA的逆境胁迫响应信号通路的机制具有重要意义。盐渍化土壤环境制约了玉米出苗时间与发芽率, 并影响其产量[ 9]。因此, 找到能提高玉米抗盐性的关键基因对于提高玉米产量至关重要。本文报道的玉米bZIP转录因子基因 ZmbZIP81可明显提高转基因植物种子在盐胁迫下的萌发速率, 对通过分子育种手段改善玉米抗逆性进而提高盐渍化土壤种植玉米的产量具有参考价值。
4 结论从玉米中克隆了一个编码A亚族bZIP转录因子ZmbZIP81的基因。该基因的表达受ABA、NaCl和干旱胁迫诱导, 而且过表达该基因的拟南芥株系具有对ABA敏感性下降和对NaCl胁迫抗性增强的表型。推测 ZmbZIP81基因编码的蛋白可能作为ABA信号途径的负调控因子参与植物逆境胁迫下的基因表达调控。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] |
