
* 通讯作者(Corresponding author): 才宏伟, E-mail:caihw@cau.edu.cn, Tel: 010-62734224 收稿日期:2014-06-16 基金:
摘要
关键词:结缕草; 耐寒性; CBF转录因子; 同源克隆; 转基因拟南芥
Cloning of Zoysiagrass
FENG Xun-Wei

Fund:
Abstract
Keyword:Zoysiagrass; Cold tolerance; CBF transcription factor; Homologous cloning; Transgenic
Show Figures
Show Figures









结缕草又名老虎皮、锥子草、崂山草、延地青, 属禾本科, 结缕草属( Zoysia)。该属包括大约11个种, 其中, 日本结缕草( Z. japonica)、沟叶结缕草( Z. matrella)、细叶结缕草( Z. tenuifolia)是公认的优质暖季型草坪草种, 主要应用于亚热带和温带地区。结缕草喜温暖湿润气候, 低温是影响结缕草分布、坪用性状和推广应用的一个重要的限制因素。尤其是沟叶结缕草和细叶结缕草, 在环境温度低于10℃时结缕草就进入休眠, 在北方地区每年的绿色期平均只有6个月左右, 一些亚热带原产的结缕草在过于低温的情况下则不能越冬, 以至于发生冻死现象, 严重限制了其在北方地区的推广应用。
利用转基因技术将抗寒基因导入植物栽培种, 已成为提高植物抗寒性的快速有效手段; 但植物抗寒性是多基因控制的性状, 大多数情况需要一系列相关基因的共同表达才能提高植物的抗寒性, 这是因为植物在遭受冷胁迫时, 从接收低温信号到引起生理生化反应, 再到调节基因表达, 最后产生抗寒能力, 存在一个复杂的信号传导系统[ 1], 这其中低温信号转录因子的作用尤为关键, 它可以诱导下游多个抗寒基因的表达从而提高植物的抗寒性, 所以在作物抗寒育种中转入该类基因比转入单个抗寒基因的应用前景更为广阔, 目前, 低温信号转录因子中被研究最多的就是 CBF转录因子。
1997年, Stocking等[ 2]首次从拟南芥中分离鉴定出一种编码转录因子的cDNA, 这种转录因子能与DRE/CRT顺式作用元件结合, 因此被命名为CBF1 (C-repeat binding factor 1)。将 CBF1基因转入未经冷驯化的拟南芥中, 大量表达后能诱导冷诱导基因在常温下表达, 增强了拟南芥的抗寒能力; 后来人们发现, 拟南芥 CBF1基因属于一个包括 CBF1、 CBF2、 CBF3、 CBF4、 CBF5和 CBF6基因在内的小基因家族; 其中 CBF1、 CBF2和 CBF3基因是受低温诱导表达且不依赖ABA的信号转导途径, 而 CBF4基因是干旱诱导表达和依赖ABA信号转导途径, CBF5、 CBF6基因则不受低温调控[ 3, 4]。除了模式植物拟南芥之外, 人们也从玉米、水稻、小麦、大麦、黑麦、油菜等植物中克隆了许多类 CBF基因, 这些类 CBF基因绝大多数都与植物的逆境胁迫相关[ 5, 6, 7, 8, 9]。
本研究以日本最北部原产的结缕草品系作为材料, 根据已知的抗寒基因 CBF, 通过同源克隆的方法得到在结缕草中相对应的同源基因 ZjCBF, 分析该基因在寒冷条件下的表达情况, 并将其构建到超表达载体上转化拟南芥, 验证其是否与抗寒相关, 为结缕草的抗寒性分子育种奠定技术基础。
1 材料与方法1.1 植物材料同源克隆采用结缕草为日本北海道地区的耐寒生态型室兰(Murorann); 日本九州地区的不耐寒生态型俵山北(Tawarayamakita); 转基因用拟南芥为Columbia生态型。
1.2 主要试剂TRIzol RNA提取试剂盒购自Invitrogen公司, 反转录酶购自Promega公司; RACE试剂盒、限制性内切酶购自TaKaRa公司; 农杆菌GV3101感受态细胞由清华大学刘玉乐教授实验室提供; 庆大霉素(Gentamycin)、卡那霉素(Kanamycin)、利福平(Rifampicin)和潮霉素(Hygromycin)购自生工生物工程(上海)有限公司; 试验中使用的各种引物由北京奥科生物技术公司合成; 各种序列由北京华大基因研究中心测序。
1.3 ZjCBF基因的克隆 首先, 根据http://www.ncbi.nlm.nih.gov/上已经发表的拟南芥、水稻、小麦、大麦、黑麦、玉米等几种植物CBF转录因子的氨基酸序列中高度保守的AP2/EREBP结构域设计1对简并引物: Midcbf-F: 5'-GARACNMGNCAYCCNGTNTA-3'; Midcbf-R: 5'- NGCRAARTTNARRCANGC-3', 然后按照Rogers和Bendich[ 10]提出的CTAB法(cetyltriethyl ammonium bromide)提取DNA, 以结缕草基因组DNA为模板进行PCR, 扩增得到中间片段, PCR扩增程序为95℃预变性5 min; 95℃变性30 s, 55℃复性30 s, 72℃延伸1 min, 35次循环; 72℃延伸10 min。用TaKaRa公司的pMD18-T vector进行目的片段的克隆, 并测序; 然后, 用Invitrogen的TRIzol RNA提取液提取室兰的总RNA, 反转录获得cDNA, 反应体系含2 μg总RNA, 2 μL oligo(DT)18(0.5 μg μL-1), 用RNase-free水补至10 μL; 72℃水浴5 min, 立即置冰浴2 min; 加入5×M-MLV缓冲液4 μL, 10 mmol L-1 dNTPs 2 μL, M-MLV反转录酶1 μL, RNase-free水3 μL, 42℃水浴1.5 h, -20℃保存备用; 接着, 利用TaKaRa的3'-Full RACE Core Set Ver.2.0试剂盒和5'-Full RACE Kit试剂盒获得完整的结缕草 CBF基因( ZjCBF)的cDNA片段, 3'-Full RACE的上游外侧特异引物为3rCBF1: 5'-GTC TGC GAG GTG AGG GAG CCC AAC AA-3'; 上游内侧特异引物为3rCBF2: 5'-CCG CAT CTG GCT GGG GAC CTT CG-3'; 5'-Full RACE的下游外侧特异引物为5rCBF1: 5'-TCG AAG GTC CCC AGC CAG ATG C-3'; 下游内侧特异引物为5rCBF2: 5'-GCT CCC TCA CCT CGC AGA CCC A-3'。
最后, 在 ZjCBF基因的编码区(从起始密码子开始到终止密码子结束, 包括终止密码子)设计特异引物jyCBF-F: 5'-ATG GAG AAC AAC ATG GGC GAC G-3'; jyCBF-R: 5'-CTA GTA GCT CCA AAG CTT GAC CTC-3', 分别以室兰的基因组DNA和cDNA为模板进行PCR扩增, 扩增程序为95℃预变性 5 min; 95℃变性30 s, 55℃复性30 s, 72℃延伸1 min, 35次循环; 72℃充分延伸10 min, 用TaKaRa公司的pMD18-T vector进行目的片段的克隆, 并测序。
1.4 不同植物中 CBF基因的氨基酸序列比 利用Clustal X软件比对 ZjCBF基因所对应的氨基酸序列与拟南芥、水稻、小麦、大麦、黑麦以及玉米的 CBF基因所对应的氨基酸序列。
1.5 半定量PCR将室兰和俵山北在低温培养箱中4℃处理0、3、6、12和24 h, 提取RNA, 反转录后进行半定量PCR, 特异引物序列为BDCBF-F: 5'-CGC ATA GCA CTG ATC GTC ACC CG-3'; BDCBF-R: 5'-CCT CAC CGC CGT CAT CAT CGT C-3', 扩增片段长度为156 bp; 内参基因选用结缕草的 Actin基因, Actin引物序列: Actin-F: 5'-TGT GCT CAG CGG TGG TTC AA-3'; Actin-R: 5'-TGC TGG GCC AGA CTC GTC AT-3', 扩增程序同一般PCR程序, 只是循环数降至28次。
1.6 实时荧光定量Real-time PCR将室兰和俵山北在低温培养箱中4℃处理0、3、6、12和24 h, 提取RNA, 反转录后进行实时荧光定量PCR, 特异引物序列同半定量PCR, 扩增片段长度为156 bp; 内参基因选用结缕草的 18S rRNA基因, 引物序列为: 18S-F: 5'-GCT TTG GTG ACT CTA GAT AAC-3'; 18S-R: 5'-GTC GGG AGT GGG TAA TTT GC-3'; 采用Real-time PCR仪进行PCR, 扩增程序为95.0℃ 3 min; 95.0℃ 30 s, 58.0℃ 30 s, 72.0℃ 30 s, 40次循环; 95.0℃ 10 s。65~95℃区间每隔0.5℃绘制熔解曲线, 读板。根据各样品特定荧光阈值下的 Ct值, 采用2-ΔΔCt计算方法分析不同样品间相对表达量。
1.7 构建 ZjCBF基因的超表达载体 设计带有保护碱基和酶切位点的 ZjCBF基因引物, ZjCBF-F: 5'-GGC CCC GGG ATG GAG AAC AAC ATG GGC GAC GAC A-3' (酶切位点为 Sma I); ZjCBF-R: 5'-GGC GAG CTC TCC ACT AGT GAT TTC ACT ATA GG-3' (酶切位点为 Sac I), 采用带有 CaMV35S启动子的载体pCAMBIA 1300构建 ZjCBF基因的超表达载体, 将该载体转入农杆菌GV3101, 挑取阳性克隆于含有庆大霉素(Gentamycin, 50 mg L-1),卡那霉素(Kanamycin, 50 mg L-1)和利福平(Rifampicin, 30 mg L-1)的液体LB培养基中, 28℃振荡过夜培养。
1.8 农杆菌转化拟南芥及转基因苗的获得采用蘸花法转化拟南芥Columbia生态型, 获得转基因拟南芥种子, 将收获的转基因拟南芥种子经过7~8 d的后熟后, 用0.2%的Triton X-100浸泡10 min; 用10%的次氯酸钠表面消毒12 min; 灭菌水洗涤5次, 每2 min一次; 用含0.2%琼脂的蒸馏水将种子铺在含20 mg L-1潮霉素(hygromycin)的MS固体培养基上, 4℃暗培养2 d; 22℃, 16 h光照培养。经潮霉素筛选两周, 挑选并初步认定种子萌芽后生长良好, 能够顺利长出真叶, 正常伸长根的苗为阳性苗(T1代), 并将其移盆种植, 培养至拟南芥的果荚变黄成熟时, 及时采收种子, 再经过上述方法筛选得到阳性苗(T2代)进行后续试验。
1.9 转基因拟南芥的冷处理试验将拟南芥转 ZjCBF基因阳性苗和野生型苗分别种在同一MS固体培养基上的各半边, 不经冷驯化, 22℃, 16 h光照培养2周, 然后-6℃处理6 h, 恢复生长1周, 观察表型。同样将另一部分拟南芥转 ZjCBF基因阳性苗和野生型苗分别种在同一MS固体培养基上的各半边, 22℃, 16 h光照培养1周, 4℃冷驯化48 h, 然后-10℃处理6 h, 恢复生长1周, 观察表型。
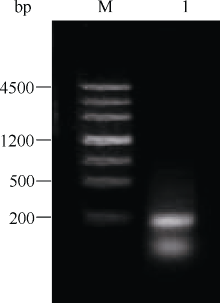
2 结果与分析2.1 结缕草 CBF基因( ZjCBF)中间片段的分离和测序 以结缕草基因组DNA为模板进行PCR, 利用简并引物Midcbf-F和Midcbf-R扩增得到一段192 bp的核苷酸片段Midcbf (5'-GAG ACG CGC CAC CCG GTG TAC CGC GGC GTG CGG CGG CGC GGG CCC GCC GGC CGC TGG GTC TGC GAG GTG AGG GAG CCC AAC AAG AAA TCC CGC ATC TGG CTG GGG ACC TTC GAG ACC GCC GAG ATG GCG GCG CGC GCG CAC GAC GTC GCC GCG CTG GCG CTC CGC GGC CTC GGC GCG TGC CTC AAC TTC GCG-3'), 琼脂糖电泳检测结果见图1。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 结缕草 CBF基因中间片段Midcbf琼脂糖电泳图Fig. 1 Agarose electrophoresis of Midcbf, a fragment of CBF gene in Zoysiagrass |
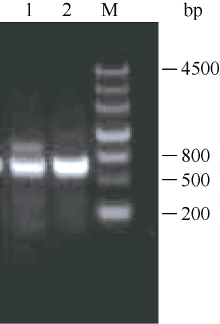
2.2 ZjCBF基因的克隆结果 在已知序列Midcbf基础上利用RACE技术向两端扩增, 结果如图2, ZjCBF基因3°RACE结果得到一段807 bp的cDNA片段, 5°RACE结果得到一段364 bp的cDNA片段; 从而得到 ZjCBF基因的全长cDNA序列。 ZjCBF基因cDNA序列为1184 bp, CDS序列长636 bp; ZjCBF基因编码区(包括终止密码子)的扩增结果(图3)以及测序结果表明, 以基因组DNA为模板和以cDNA为模板获得的序列是完全一致的, 这说明 ZjCBF基因没有内含子; ZjCBF的cDNA序列已提交到DDBJ (DNA Data Bank of Japan)数据库, ZjCBF的登录号为AB627353。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 ZjCBF基因RACE琼脂糖电泳图Fig. 2 Agarose electrophoresis image of ZjCBF’sRACE |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 ZjCBF基因编码区(包括终止密码子)的琼脂糖电泳图1: 以gDNA为模板; 2: 以cDNA为模板; M: 分子量标记marker III。Fig. 3 Agarose electrophoresis image of ZjCBF’s coding region (including termination codon)1: gDNA template; 2: cDNA template; M: marker III ladder. |
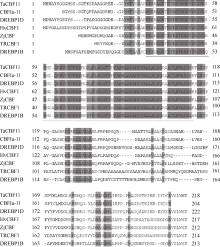
2.3 不同植物中 CBF基因的氨基酸序列比对结果 根据 ZjCBF基因, 得到 ZjCBF基因所对应的氨基酸序列, 与拟南芥、水稻、小麦、大麦、黑麦和玉米的 CBF基因所对应的氨基酸序列比对发现, 除了AP2/EREBP DNA结合结构域的氨基酸序列较为保守外, 其余两侧氨基酸序列均没有明显同源性(图4)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 不同植物种的 CBF基因的氨基酸序列分析TaCBF11: 小麦(GI编号: 60593403); CBFIa-11: 黑麦(GI编号: 164507129); DREBP1D: 玉米(GI编号: 195612664);HvCBF1: 大麦(GI编号: 60547419); ZjCBF: 结缕草; TRCBF1: 水稻(GI编号: 32966057); DREBP1B: 拟南芥(GI编号: 18416562)。下画线部分为AP2/EREBP DNA结合结构域。Fig. 4 Analysis of CBF gene amino acid sequence in different plant speciesTaCBF11: Triticum aestivum(GI: 60593403); CBFIa-11: Secale cereale (GI: 164507129); DREBP1D: Zea mays (GI: 195612664); HvCBF1: Hordeum vulgare (GI: 60547419); TRCBF1: Oryza sativa (GI: 32966057); DREBP1B: Arabidopsis thaliana (GI: 18416562). DNA binding domain of AP2/EREBP is underlined. |
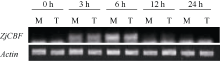
2.4 ZjCBF基因在不同冷处理条件下的表达情况 根据半定量PCR结果(图5)和实时荧光定量PCR结果(图6), 发现 ZjCBF基因的表达量无论是耐寒性好的室兰还是较差的俵山北都呈现比较一致的趋势, 即在4℃处理0 h时几乎没有表达, 6 h时表达量最高, 随后迅速降低。而在处理6 h时, 室兰 ZjCBF基因的表达量明显高于俵山北。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 ZjCBF基因在4℃低温处理的半定量结果M: 室兰; T: 俵山北。M: Murorann; T: Tawarayamakita.Fig. 5 Expression level of ZjCB at 4℃ treatment by semi-quantitative PCR |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 室兰和俵山北 ZjCBF基因在4℃低温处理的实时荧光定量PCR结果Fig. 6 Expression level of ZjCBF in Murorann and Tawarayamakita under 4℃ treatment by Real-time PCR |
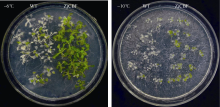
2.5 转基因( ZjCBF)冷处理结果 如图7所示, 在未经冷驯化的情况下, 直接用-6℃处理6 h, 恢复生长一周后, 野生型苗大部分叶片发白死亡; 而转 ZjCBF基因的拟南芥苗叶片仍呈绿色, 正常生长。在冷驯化的情况下(4℃处理48 h), -10℃处理6 h, 恢复生长1周后, 表型与未经冷驯化的冷处理结果一致, 野生型苗大部分叶片发白死亡; 而转 ZjCBF基因的拟南芥苗叶片仍大部分呈绿色, 并未死亡。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 转 ZjCBF基因拟南芥和野生型(WT)冷处理结果Fig. 7 Cold treatment results of transgenic ( ZjCBF) Arabidopsis and wild type Arabidopsis |
3 讨论3.1 ZjCBF的氨基酸序列分析AP2/EREBP家族的转录因子中包括与调控植物细胞周期、生长发育以及环境胁迫应答反应等有关的一系列转录因子, 家族成员的转录激活区差异很大, 但它们都含有由60个左右氨基酸残基组成的非常保守的DNA结合区(即AP2/EREBP结构域), 而且N末端都有起核定位作用的碱性氨基酸序列。本研究通过对结缕草 CBF基因( ZjCBF)编码的氨基酸序列分析发现, ZjCBF蛋白含有高度保守的AP2/EREBP结构域, 该结构域中含有79个氨基酸, 同时, ZjCBF蛋白的AP2/EREBP结构域以外的氨基酸序列与其他植物CBF蛋白氨基酸序列总体上看没有明显的同源性, 这与之前所得到的结果相一致[ 11, 12]。ZjCBF蛋白具备反式作用因子的典型特征, 即AP2/EREBP结构域的N末端有一段核定位信号肽, 序列为PKRPAGRTKFRETRHP, C末端有一段酸性活化区域, 序列为DSPR; 而在拟南芥的140多种AP2/EREBP结构域蛋白中, 只有CBF1、CBF2、CBF3蛋白才具有两段类似的短多肽序列, 因而称他们为CBF蛋白的特征序列[ 13]。由此, 可以推导出 ZjCBF基因可能与 CBF1、 CBF2、 CBF3基因具有类似的功能, 在结缕草冷信号转导中起重要作用。
3.2 ZjCBF基因在低温胁迫下的表达分析 在拟南芥中, CBF1、 CBF2和 CBF3基因在常温下几乎不表达, 冷处理后, 表达量迅速提高, 一般在3 h左右达到最高, 随后又逐渐降低, 但在低温处理下各 CBF基因的表达量仍然比常温下高[ 14]。在本研究中, ZjCBF基因的表达模式与拟南芥中 CBF基因的表达模式类似, 表达量也是先升高后下降, 但 ZjCBF基因的表达量高峰出现在低温处理6 h后, 较拟南芥 CBF基因有一定的滞后。同时, 室兰和俵山北2个耐寒性不同的结缕草品种的 ZjCBF基因的低温处理下的表达量也存在明显差异, 处理6 h后, 室兰的 ZjCBF基因的表达量明显高于俵山北的; 这种差异, 可能就是室兰和俵山北耐寒性不同的原因之一; 但对室兰和俵山北 ZjCBF基因测序发现, 两者之间序列一致(未发表数据), 所以造成室兰和俵山北 ZjCBF基因表达差异的原因还有待进一步研究。
3.3 转 ZjCBF基因冷处理结果分析 低温诱导CBF转录因子家族基因( CBF1、 CBF2和 CBF3)的表达, 这些转录因子在植物冷驯化的过程中, 结合在下游冷诱导基因启动子CRT/DRE区域, 调控冷诱导基因的表达, 从而调控植物的抗寒性[ 15, 16]。其中, CBF1和 CBF3基因是正向调控植物的抗寒性, CBF2基因通过下调 CBF1和 CBF3来反向调控植物的抗寒性[ 16]。本试验中转基因( ZjCBF)的拟南芥在低温处理下均表现出较强的抗寒性, 结合NCBI上的序列比对结果, 可以认定 ZjCBF基因应该属于CBF转录因子家族基因中 CBF1型基因。不经冷驯化的拟南芥野生型的半致死低温为-4.8℃, 经过冷驯化的拟南芥野生型的半致死低温为-9.4℃[ 17], 所以本试验在不经冷驯化的条件下采用了-6℃的处理温度; 在经冷驯化的条件下采用了-10℃的处理温度。从图7中可知, 不论是否经过冷驯化, 转基因( ZjCBF)的植株由于 ZjCBF的过量表达都要比野生型植株抗寒, 因此, 可以认为 ZjCBF基因对增强植物的抗寒性起重要作用。由于结缕草的组织培养技术并不成熟, 转基因周期长, 所以本试验将克隆得到的 ZjCBF基因转入拟南芥中观察表型, 可能所得结果与直接转基因结缕草有一定的差异, 后续试验可以增加一些这方面的工作。
4 结论利用同源克隆技术, 获得到与结缕草抗寒相关的 ZjCBF基因, 通过氨基酸序列比对分析, 该基因与已经克隆得到的其他植物中的 CBF基因高度同源。 ZjCBF基因受冷胁迫的诱导, 在4℃处理6 h时表达量最高。不论是否经过冷驯化, 转基因的植株由于 ZjCBF的过量表达均比野生型植株抗寒。 ZjCBF基因属于CBF转录因子家族基因中 CBF1型基因。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] |
