目前,亲水性聚糖和疏水性聚酯复合材料的制备方法主要有如下2种:
1) 物理共混。脂肪族聚酯通常是油溶性高分子,溶于一些有机溶剂[11],而细胞外基质聚糖是高度亲水性的,不溶于有机溶剂,只溶于少数的稀酸溶液中[12]。到目前为止,还没有发现能同时溶解这2类材料的溶剂。因此,物理共混通常是将亲水性聚糖或者疏水性聚酯溶解在溶剂中后,向其中加入另一相材料的固体粉末,充分搅拌混合均匀,然后冷冻干燥就可以得到二者的复合材料[13]。这种方法的优点是制备工艺简单,材料理化性能调控方便。但是,物理共混法存在的潜在问题是混合不均匀,存在相分离[14]。
2) 化学共聚。通常是采用溶液聚合的方法将疏水性聚酯的单体或中间体与亲水性聚糖进行直接缩聚或接枝共聚[15]。另外,随着对生物材料表面修饰的深入研究,聚酯表面接枝聚糖也取得了重要进展[16]。但是,采用化学方法直接将聚酯和聚糖进行共聚比较困难,其原因包括:第一,细胞外基质聚糖的热稳定性较差,一般在开始熔化之前就会发生分解[17],这就使得采用传统的熔融聚合工艺将其与脂肪族聚酯共聚变得相当困难;第二,如前所述,由于聚糖和聚酯的亲/疏水性相差太大,并且没有能同时溶解这2类材料的溶剂,这就使得采用溶液聚合的工艺将二者进行共聚常常由于非均相反应而宣告失败[18]。
事实上,从制备液体制剂的角度来看,亲水性细胞外基质聚糖与疏水性脂肪族聚酯的相容性问题其实就是如何将互不相容的2种液体相混合的问题,完全可以参照非均相液体制剂的原理来实现。按照液体制剂制备的原理,2种互不相容的液体,在表面活性剂的作用下,其中一相液体会以微液滴的状态分散于另一相中,形成稳定均一的非均相液体分散体系。因此,本文拟以天然细胞外基质聚糖——CS和合成降解性脂肪族聚酯——PLA为原料,采用乳液冷冻干燥法来制备聚糖/聚酯复合物。该方法通过向CS和PLA的混合溶液中加入表面活性剂来降低2种溶液之间的界面张力,这样可以有效避免物理共混法存在的混合不均匀和相分离等问题,从而得到稳定均一的CS/PLA两亲复合材料。
1 实验部分 1.1 主要原料 PLA购自山东省医疗器械研究所,重均分子量MM=3.0×105,使用前采用氯仿-甲醇共沉淀体系纯化。CS购自美国Sigma-Aldrich公司,黏度200~800 cP,脱乙酰度75%~85%,使用前精制2次:溶于稀醋酸,然后在稀氨水中沉淀。表面活性剂Tween80和本文所用的其他试剂均为分析纯,购买后直接使用。
1.2 CS/PLA复合材料的制备 采用乳液冷冻干燥法制备CS/PLA复合材料。首先,称取一定量的CS溶于2%(体积分数)的稀醋酸水溶液中,配成浓度为20 g/L的溶液。按照3 mL/L的浓度向上述溶液中加入表面活性剂Tween80。称取一定量的PLA溶于CHCl3中,配成浓度为40 g/L的溶液。在搅拌的状态下,将不同体积分数的PLA溶液(25%、50%和75%)滴加到CS溶液中,室温下充分搅拌混合均匀。将混合物转移到匀浆机中,于10 000 r/min高速乳化3 min,然后倒入聚四氟乙烯模具中,迅速置于液氮环境中降温、成型,冷冻干燥除去CHCl3。将得到的复合材料用过量乙醇反复浸洗,以除去其中的表面活性剂Tween80。最后,将产物再行冷冻干燥,即得CS/PLA复合材料(当PLA的体积分数为25%、50%和75%时,分别命名为CS/PLA-1,CS/PLA-2和CS/PLA-3)。对照组,纯CS和PLA材料,分别利用浓度为20 g/L的CS溶液和40 g/L的PLA溶液采用传统的热致相分离法制备而成。
1.3 产物表征
1.3.1 FTIR分析 CS、PLA以及CS/PLA复合材料(PLA的体积分数为50%)的博里叶变换红外光谱(FTIR)使用衰减全反射红外光谱仪(ATR-FTIR,Nicolet 560,America)来测定。光谱仪的分辨率为4 cm-1,测试范围为4 000~400 cm-1。
1.3.2 形貌观察 CS、PLA以及CS/PLA复合材料的微观形貌采用德国LEO公司生产的Gemini 1530型扫描电子显微镜(SEM)来观察。实验中将待观察的样品在液氮环境下掰开,利用导电胶将材料粘贴在样品台上,喷金后观察其内部形貌。
1.3.3 孔隙率和孔径分布测定 CS、PLA以及CS/PLA复合材料的孔隙率和孔径分布通过美国Quantachrome公司生产的AutoScan 33型压汞仪进行测定。其中水银的接触角为130°,表面张力为0.485 N·m-1。因为材料在汞中不溶解或不发生反应,且汞容易渗透入材料内部而不引起膨胀或收缩,所以使用汞作为置换液体。孔隙率和孔径分布的结果直接给出。
1.3.4 力学性能测试 CS、PLA以及CS/PLA复合材料的压缩强度使用德国Zwick公司生产的Zwick Z005型电子万能试验机测试,10 kN载荷。依据ASTM D5024-95a[19],样品高15 mm,直径8.6 mm,高径比约为1.7,下压速度为0.5 mm/min,压30%的高度值即停止。切除样品的顶部和底部以确保端面平整和合适的高径比。压缩模量由应力-应变曲线的线性部分计算得到。
2 结果与讨论 2.1 CS/PLA复合材料的制备与FTIR表征 乳液冷冻干燥法制备CS/PLA复合材料是按照水包油(O/W)型乳化体系制备的原理,利用表面活性剂Tween80的乳化作用和匀浆机的高速搅拌,将油相的PLA溶液均匀分散在水相的CS溶液中。然后将该O/W型乳状液迅速置于液氮环境中,使溶剂凝固,溶质析出。进而在负压条件下冷冻干燥,使凝固的溶剂升华并去除,从而得到CS和PLA均匀分布的复合材料。实验中发现,在没有表面活性剂存在的情况下,由于醋酸水溶液和CHCl3的不混溶性,CS和PLA的混合溶液很快出现明显的相分离。与此相对照,在Tween80存在的情况下,匀浆机分散后混合乳液呈乳白色,室温下静置30 min该乳状液不会出现明显的相分离,这说明表面活性剂的加入明显提高了CS和PLA溶液的可混合性。
FTIR是考察聚合物分子内和分子间相互作用的常用手段,图 1所示为CS、PLA以及CS/PLA复合材料(PLA的体积分数为50%)的FTIR谱图,T为透光率,k为波数。其中,CS有5个特征峰:3 412 cm-1处OH和NH的伸缩振动峰、2 875 cm-1处CH的伸缩振动峰、1 655和1 597 cm-1处的酰胺Ⅰ和酰胺Ⅱ的弯曲振动峰以及1 070 cm-1处C—O—C的伸缩振动峰。PLA的主要红外吸收特征在于:754和872 cm-1处CH的弯曲振动峰、1 045~1 211 cm-1之间C—O的伸缩振动峰、1 456 cm-1处CH3的弯曲振动峰、1 759 cm-1处酯键CO的伸缩振动峰、2 945 cm-1处CH的伸缩振动峰以及2 997 cm-1处CH3的伸缩振动峰。与这二者相比较,CS/PLA复合材料的FTIR谱图发生了2个明显变化:一是1 759 cm-1处PLA酯键的强振动峰显著减弱,但峰形变宽,峰位不变;二是CS的OH和NH伸缩振动峰的峰形变窄,强度减弱,且向高波移动。这些变化表明CS和PLA分子之间发生了相互作用。Wan等[18]在对PLA/CS混合膜的研究中也得到了类似结果,他们认为这主要是由于CS中的氨基和羟基与PLA中的羧基之间形成了较强的分子内和分子间氢键引起的。1 000 cm-1以下为指纹区,CS/PLA复合材料的FTIR谱图中871、755、694 cm-1处出现的尖峰分别为CS糖环吸收峰、PLA中CH的弯曲振动峰和CS苯环中CH的弯曲振动峰。
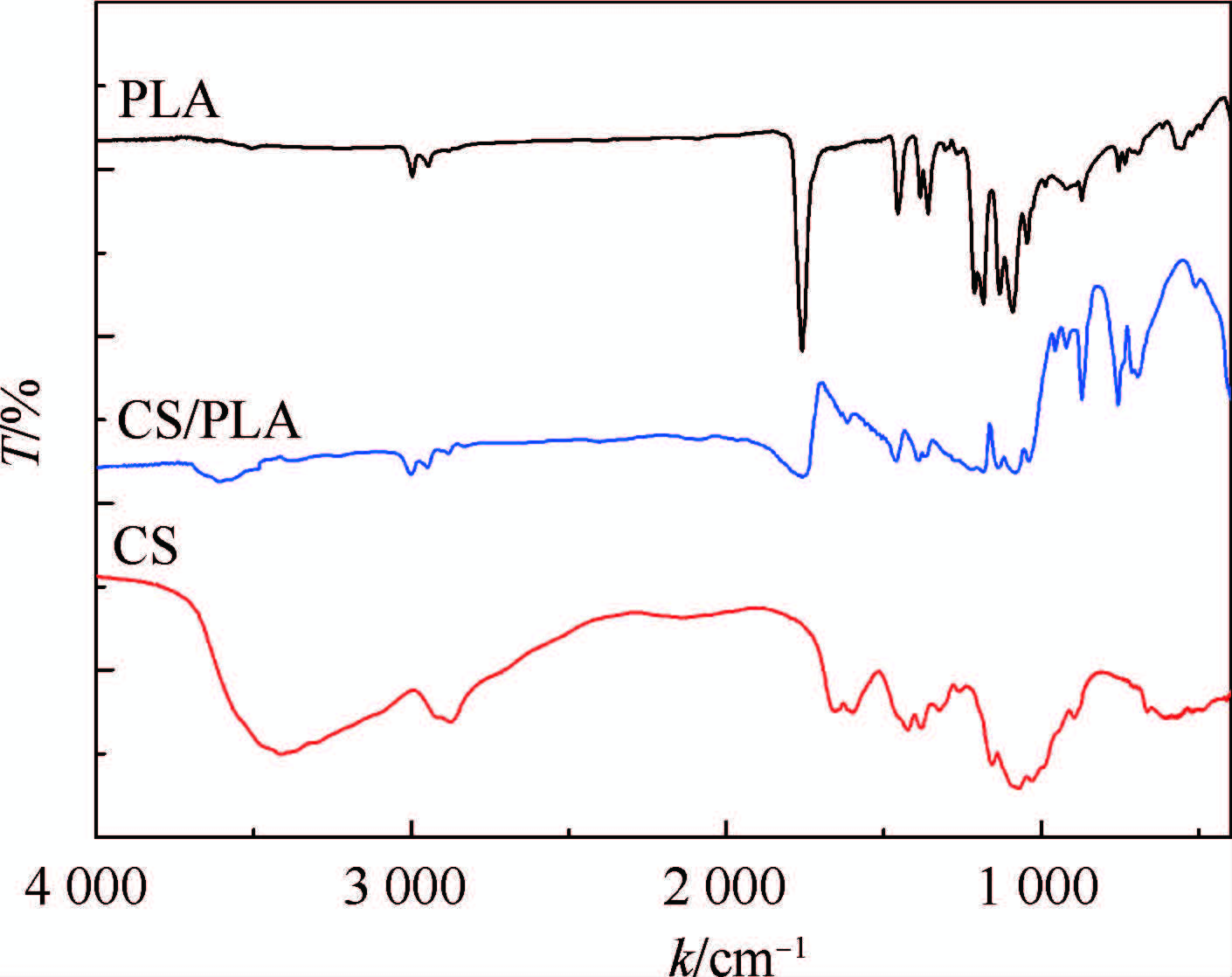 |
| 图 1 CS、PLA以及CS/PLA复合材料的FTIR谱图 Fig. 1 FTIR spectra of CS,PLA and CS/PLA composites |
| 图选项 |
2.2 SEM观察 图 2所示为CS、PLA以及CS/PLA复合材料的SEM照片。其中,由于CS溶液的浓度较小(质量分数为2%),所以纯CS材料含有大量孔径大于200 μm的大孔(见图 2(a))。纯PLA材料显示为由冷冻干燥法制备的聚合物泡沫的典型特征[20],孔结构由直径100~300 μm的规则球形大孔组成(见图 2(b))。PLA用量对CS/PLA复合材料微结构的影响通过调节其用量来进行考察,实验中保持CS的量恒定。当PLA用量体积分数为25%和50%时(见图 2(c)和图 2(d)),复合材料形成了大量的球形微区域。考虑到实验中CS和PLA的体积比总大于1,得到的是O/W型乳化体系。因此,在每个球形微区域中,CS组分(水相)存在于外层,而PLA组分(油相)存在于内层,这一现象在图 2(c)和图 2(d)右上角所示的局部放大图中显示的更清楚,孔隙结构相互贯通,表明2种组分分布均匀。并且,与CS/PLA-1相比,CS/PLA-2中球形微区的平均直径更小,这说明CS和PLA在后者中分布更均匀。然而,当PLA用量体积分数为75%时,复合材料的微结构发生了明显变化(见图 2(e)),球形微区域消失,不再出现内外层孔隙相贯穿的结构,表明2种组分发生了一定程度的相分离,这主要是由于PLA过量引起的。因为对这一组复合材料来说,尽管CS和PLA的体积比仍大于1(4∶3),但是考虑到它们的浓度分别为20和40 g/L,所以二者的质量比已小于1(2∶3)。因此,要获得具有均匀分布的CS/PLA复合材料,需要控制PLA的用量不高于50%。图中2(c)~图 2(e)右上角为图中箭头所示区域的放大图。
 |
| 图 2 CS、 PLA以及CS/PLA复合材料的SEM照片 Fig. 2 SEM photographs of CS,PLA andCS/PLA composites |
| 图选项 |
2.3 孔隙率与力学性能 表 1所示为CS、PLA以及CS/PLA复合材料的孔隙率测定结果。纯CS和PLA的孔隙率分别是96.8%和83.1%。随着二者的乳化混合,所有CS/PLA复合材料的孔隙率介于85%~90%之间,并且随PLA用量的增加,孔隙率略有下降。当PLA的体积分数为50%时,复合材料的孔径r的分布情况见图 3,V为单位质量材料的孔隙体积。结果发现,CS/PLA-2的孔径主要分布在20~200 μm。类似的结果同样出现在另外2组复合材料中。
表 1 CS、PLA以及CS/PLA复合材料的孔隙率 Table 1 Porosity of CS,PLA and CS/PLAcomposites
| 样品 | 孔隙率/% |
| CS | 96.8±0.8 |
| CS/PLA-1 | 89.8±1.8 |
| CS/PLA-2 | 88.5±2.1 |
| CS/PLA-3 | 87.1±1.5 |
| PLA | 83.1±1.2 |
表选项
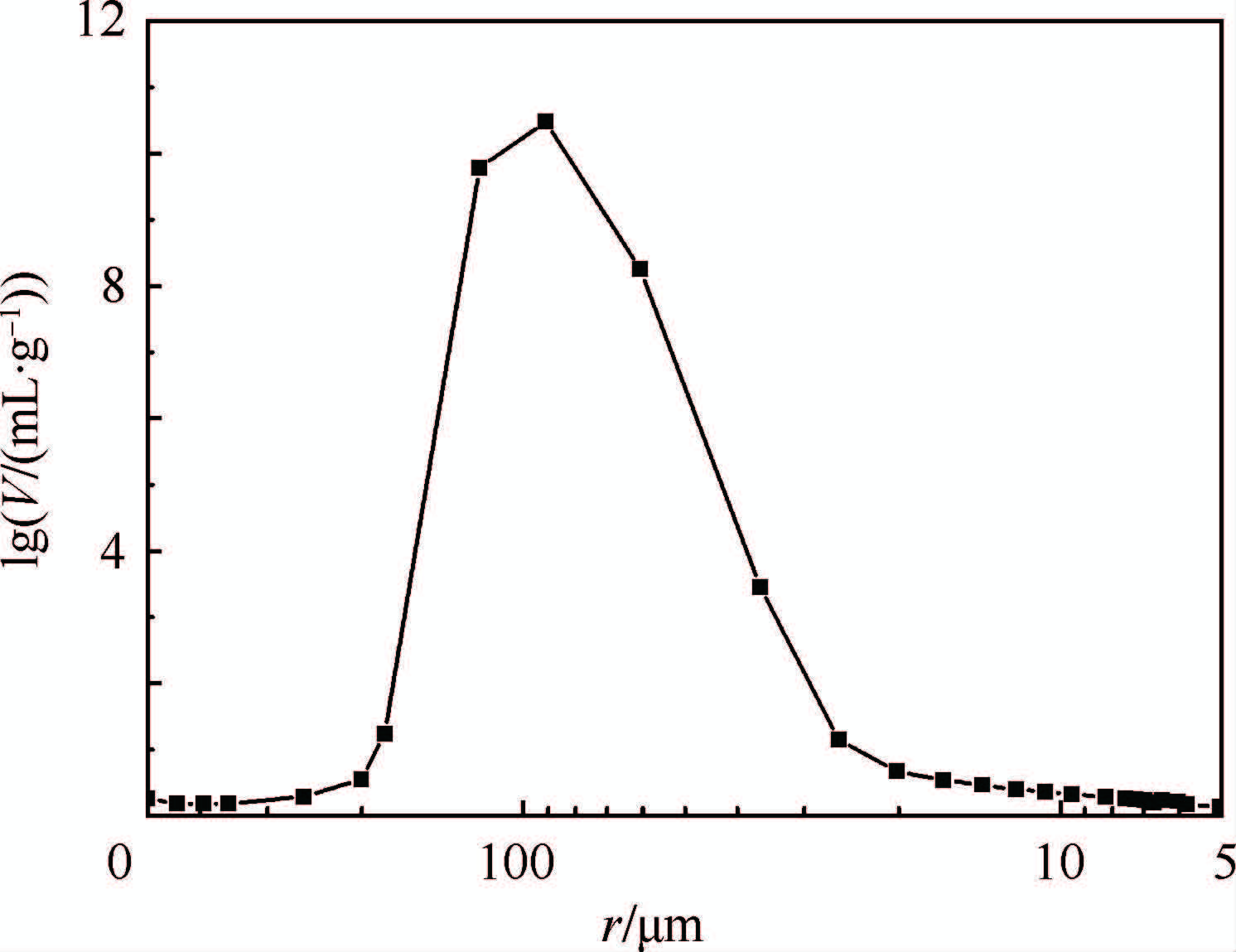 |
| 图 3 CS/PLA复合材料的孔径分布 Fig. 3 Pore size distribution of CS/PLA composites |
| 图选项 |
CS、PLA以及CS/PLA复合材料的力学性能通过压缩实验来表征,其压缩强度和压缩模量由应力-应变曲线计算得到。图 4所示为PLA用量对CS/PLA复合材料力学性能的影响。从图中可以看出,CS的力学性能较差,其压缩强度和压缩模量分别仅为0.15和1.63 MPa。而PLA材料的压缩强度和压缩模量分别为0.40和5.16 MPa。因此,当PLA用量体积分数由25%增加到75%时,复合材料的压缩强度和压缩模量也逐渐增大,前者由0.20 MPa升高到0.33 MPa,后者由2.84 MPa升高到4.83 MPa,这说明PLA的加入能提高复合材料的力学性能。
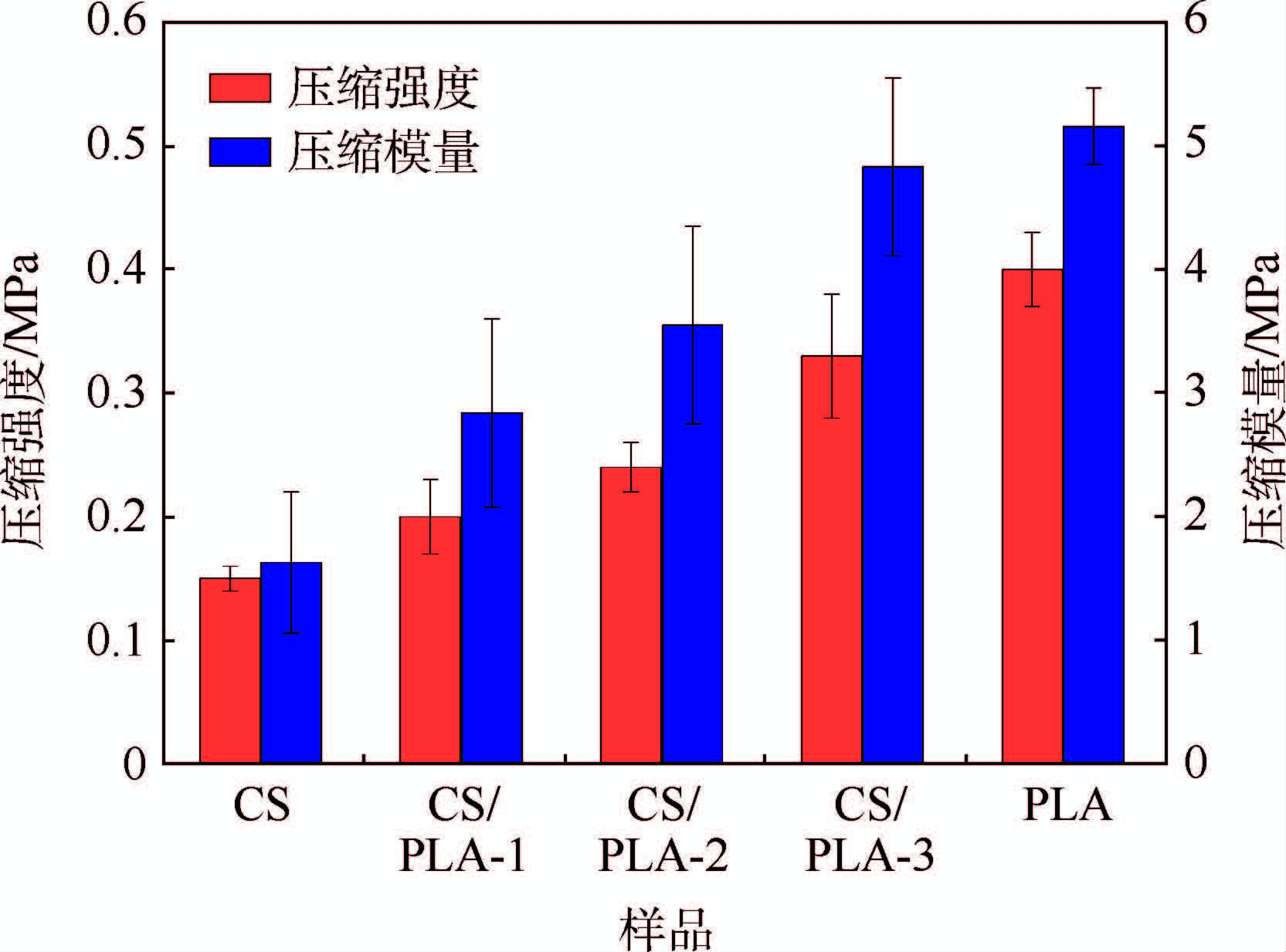 |
| 图 4 CS、 PLA以及CS/PLA复合材料的压缩强度和压缩模量 Fig. 4 Compressive strength and compressive modulus ofCS,PLA and CS/PLA composites |
| 图选项 |
总之,本文主要是采用乳液冷冻干燥法成功制备了CS基亲水性细胞外基质聚糖和PLA基疏水性脂肪族聚酯组成的复合材料。利用这种方法能将天然聚糖材料优越的亲水性和生物学特性与合成聚酯材料良好的可加工性和力学特性整合起来,同时能有效避免二者混合过程中存在的分布不均匀和相分离等问题,从而有望使该复合材料在生物材料领域获得广泛应用。
除了2种成分的比例,溶液浓度、冷冻干燥条件也是影响CS/PLA复合材料形貌、孔隙率、力学性能的重要因素,在接下来的工作中,笔者将就这些方面进行更加深入的研究。
3 结 论 1) 证明了采用过程温和的乳液冷冻干燥法能成功制备出稳定均一的CS/PLA复合材料。采用的实验方案是:以CS的醋酸溶液为水相,PLA的CHCl3溶液为油相,在表面活性剂Tween80的作用下,制备水包油型乳状液;进而将该乳状液冷冻干燥,并洗涤去除Tween80,从而得到CS/PLA复合材料。
2) FTIR分析表明,复合材料中CS和PLA组分之间存在强烈的氢键相互作用。并且,复合材料的微结构、孔隙率和孔径分布以及力学性能主要受CS和PLA用量的影响。控制PLA的体积分数不高于50%,则复合材料不会出现明显的相分离。
3) 提出的乳液冷冻干燥法具有通用性,也适用于其他亲水性聚糖和疏水性聚酯材料之间的复合,从而极大丰富了现有生物材料的种类。并且,利用该方法制备得到的复合材料由于具有优越的物理化学和生物学性能以及两亲表面特性,因而在药物投递和组织工程等领域具有广阔的应用前景。
参考文献
| [1] | PLACE E S, EVANS N D, STEVENS M M. Complexity in biomaterials for tissue engineering[J].Nature Materials, 2009, 8: 457–470.DOI:10.1038/nmat2441 |
| [2] | WILLIAMS D F. On the nature of biomaterials[J].Biomaterials, 2009, 30: 5897–5909.DOI:10.1016/j.biomaterials.2009.07.027 |
| [3] | HUEBSCH N, MOONEY D J. Inspiration and application in the evolution of biomaterials[J].Nature, 2009, 462(7272): 426–432.DOI:10.1038/nature08601 |
| [4] | MUNCH E, LAUNEY M E, ALSEM D H, et al. Tough,bio-inspired hybrid materials[J].Science, 2008, 322(5907): 1516–1520.DOI:10.1126/science.1164865 |
| [5] | NIU X F, LUO Y F, LI Y G, et al. Design of bioinspired polymeric materials based on poly(D,L-lactic acid) modifications towards improving its cytocompatibility[J].Journal of Biomedical Materials Research Part A, 2008, 84A(4): 908–916.DOI:10.1002/(ISSN)1552-4965 |
| [6] | BODDOHI S, KIPPER M J. Engineering nanoassemblies of polysaccharides[J].Advanced Materials, 2010, 22(28): 2998–3016.DOI:10.1002/adma.v22:28 |
| [7] | GUPTA B, REVAGADE N, HILBORN J. Poly(lactic acid) fiber:An overview[J].Progress in Polymer Science, 2007, 32(4): 455–482.DOI:10.1016/j.progpolymsci.2007.01.005 |
| [8] | BHATTARAI N, LI Z S, GUNN J, et al. Natural-synthetic polyblend nanofibers for biomedical applications[J].Advanced Materials, 2009, 21(27): 2792–2797.DOI:10.1002/adma.200802513 |
| [9] | AMIDI M, HENNINK W E. Chitosan-based formulations of drugs,imaging agents and biotherapeutics preface[J].Advanced Drug Delivery Reviews, 2010, 62(1): 1–118.DOI:10.1016/j.addr.2009.12.006 |
| [10] | STUART M A C, HUCK W T S, GENZER J, et al. Emerging applications of stimuli-responsive polymer materials[J].Nature Materials, 2010, 9(2): 101–113.DOI:10.1038/nmat2614 |
| [11] | NIU X F, FENG Q L, WANG M B, et al. In vitro degradation and release behavior of porous poly(lactic acid) scaffolds containing chitosan microspheres as a carrier for BMP-2-derived synthetic peptide[J].Polymer Degradation and Stability, 2009, 94(2): 176–182.DOI:10.1016/j.polymdegradstab.2008.11.008 |
| [12] | NIU X F, FENG Q L, WANG M B, et al. Preparation and characterization of chitosan microspheres for controlled release of synthetic oligopeptide derived from BMP-2[J].Journal of Microencapsulation, 2009, 26(4): 297–305.DOI:10.1080/02652040802319742 |
| [13] | 牛旭锋, 冯庆玲, 王明波, 等. 微囊化壳聚糖/纳米羟基磷灰石/胶原/聚乳酸复合材料[J].复合材料学报, 2009, 26(2): 143–148.NIU X F, FENG Q L, WANG M B. Chitosan microspheres/nano-hydroxyapatite/collagen/polylactide composite[J].Acta Materiae Compositae Sinica, 2009, 26(2): 143–148.(in Chinese) |
| [14] | WAN Y, FANG Y, WU H, et al. Porous polylactide/chitosan scaffolds for tissue engineering[J].Journal of Biomedical Materials Research Part A, 2007, 80A(4): 776–789.DOI:10.1002/(ISSN)1552-4965 |
| [15] | RASAL R M, JANORKAR A V, HIRT D E. Poly(lactic acid) modifications[J].Progress in Polymer Science, 2010, 35(3): 338–356.DOI:10.1016/j.progpolymsci.2009.12.003 |
| [16] | DING Z, CHEN J N, GAO S Y, et al. Immobilization of chitosan onto poly-L-lactic acid film surface by plasma graft polymerization to control the morphology of fibroblast and liver cells[J].Biomaterials, 2004, 25(6): 1059–1067.DOI:10.1016/S0142-9612(03)00615-X |
| [17] | LIM S M, SONG D K, OH S H, et al. In vitro and in vivo degradation behavior of acetylated chitosan porous beads[J].Journal of Biomaterials Science-Polymer Edition, 2008, 19(4): 453–466.DOI:10.1163/156856208783719482 |
| [18] | WAN Y, WU H, YU A X, et al. Biodegradable polylactide/chitosan blend membranes[J].Biomacromolecules, 2006, 7(4): 1362–1372.DOI:10.1021/bm0600825 |
| [19] | NIU X F, FENG Q L, WANG M B, et al. Porous nano-HA/collagen/PLLA scaffold containing chitosan microspheres for controlled delivery of synthetic peptide derived from BMP-2[J].Journal of Controlled Release, 2009, 134(2): 111–117.DOI:10.1016/j.jconrel.2008.11.020 |
| [20] | HONG Z, REIS R L, MANO J F. Preparation and in vitro characterization of scaffolds of poly(L-lactic acid) containing bioactive glass ceramic nanoparticles[J].Acta Biomaterialia, 2008, 4(5): 1297–1306.DOI:10.1016/j.actbio.2008.03.007 |
