在首次充电过程中,电压大于4.5 V时出现了一个长的不可逆电压平台,对应于Li2MnO3成分的活化过程[11]。从Li2MnO3结构中同时脱出锂和氧,即脱出Li2O,但在放电过程中,锂无法重新嵌入,导致不可逆容量较大。另外,倍率性能和循环稳定性等也有待改善[12]。
合成方法直接影响材料的结构和形貌,从而较大程度上决定着材料的电化学性能。目前常用的制备方法有共沉淀法[9, 13-15]、溶胶-凝胶法[16-18]和水热法[4, 19-21]等。溶胶-凝胶法是制备富锂正极材料的重要方法之一,合成出的材料具有纯度高、粒径分布窄和均匀性好等优点。
本文通过溶胶-凝胶法制备了富锂正极材料,对不同煅烧温度得到的2种材料进行了详尽的结构表征及电化学测试,讨论了煅烧温度对材料的结构、形貌及电化学性能的影响。
1 实验方法 1.1 材料制备 首先将一定计量比的LiNO3(分析纯,北京化工厂)、Mn(NO3)2(50wt%)(分析纯,北京化工厂)、Ni(NO3)2·6H2O(分析纯,北京化工厂)、Co(NO3)2·6H2O(分析纯,北京化工厂)溶于水和乙醇(分析纯,北京化工厂)的混合溶剂中(体积比为1:1),在不断搅拌下形成溶液,然后往溶液中加入一定量的柠檬酸和蔗糖,置于90℃的水浴锅中不断搅拌蒸干,放到真空烘箱中过夜烘干。充分研磨后在空气气氛中分步预烧120℃ 5 h、200℃ 5 h、500℃ 5 h,取出研磨,分别在800℃和900℃下煅烧12 h,冷却至室温得到目标产物,2个样品分别记为S8和S9。所有的原料都是分析纯的,锂盐过量5%,以弥补在高温煅烧过程中产生的锂损失。
1.2 结构表征与电化学测试 样品的结构是通过Rigaku D/Max-2400型X射线衍射仪测试得到的,采用Cu靶、Kα射线,测试电压为40 kV、电流为40 mA、扫描速度为6 (°)/min,扫描范围2θ为10°~80°。样品的表面形貌、颗粒大小和分布是通过日本日立公司的S-4800型扫描电子显微镜(SEM)进行观察。
将所制备的活性材料、导电炭黑、粘结剂(PVDF)以8:1:1的质量比混合、以N-甲基吡咯烷酮(NMP)为分散剂,调浆均匀涂在铝箔上,在真空烘箱中120℃ 12 h进行烘干,制得的正极极片与负极金属锂、电解液1 mol/L的LiPF6/EC-DEC-DMC (1:1:1)、Celgard聚乙烯隔膜在水氧值均低于0.5 mg/L手套箱内组装成模拟电池。电池的电化学性能是通过新威(NEWARE)电池测试系统进行充放电测试得到的,测试电压为2.0~4.8 V,电流以1 C=250 mA·g-1计算,温度为室温。采用辰华CHI660a型电化学工作站测试样品的循环伏安(CV)和电化学阻抗谱(EIS)。CV的扫速为0.1 mV·s-1,电压区间为2.0~4.8 V。EIS电压信号的振幅为10 mV,测试频率为10 mHz~100 kHz。
2 结果与讨论 2.1 XRD表征 样品S8和S9的XRD谱图如图 1所示。2个样品都具有典型的富锂结构。除20°~25°之间的峰外,其余峰都能很好地归属于层状α-NaFeO2结构,六方晶系,R-3m空间点群。位于20°~25°之间的峰归属于Li2MnO3结构中的LiMn6阳离子超晶格有序排列,是空间群C2/m的单斜结构。两组相邻峰(006)/(012)及(108)/(110)发生明显分裂,表明样品S8和S9都具有高度有序的层状结构。I(003)/I(104)的值代表锂层中阳离子的混排程度,数值越大,混排程度越小。样品S9的I(003)/I(104)值为1.16,大于样品S8的I(003)/I(104)值(1.12),说明样品S9中阳离子的混排程度要小。加之,样品S9比S8的峰强度大。所以,样品S9的结晶度比S8要好。
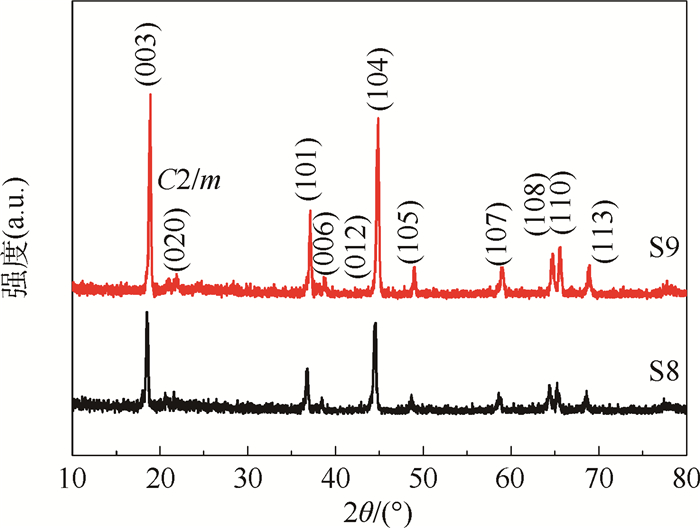 |
| 图 1 样品S8和S9的XRD谱图 Fig. 1 XRD patterns of sample S8 and S9 |
| 图选项 |
2.2 形貌分析 图 2为样品S8和S9的SEM照片。2个样品的颗粒形貌比较接近,分布均一。样品S9颗粒较大,大小为300~500 nm。样品S8颗粒较小,大小为100~300 nm。纳米颗粒尺寸小、比表面积大,既可缩短Li+的扩散路径,又可增加电极材料与电解液的接触面积,有助于提高电化学性能。但是,比表面积过大会导致一些副反应的发生,降低电化学性能。
 |
| 图 2 样品S8和S9的扫描电镜照片 Fig. 2 SEM photographs of sample S8 and S9 |
| 图选项 |
2.3 电化学测试 图 3是样品S8和S9在0.1 C时的充放电曲线图。从图中可以看到,2个样品的首次充电曲线在4.5 V处都有一个长的充电平台,这是富锂材料的特征之一,这一平台在随后的充电曲线中消失。样品S8的容量相对较低,首次充电容量为354.0 mA·h·g-1,首次放电容量为269.0 mA·h·g-1。样品S9的首次充电容量为345.0 mA·h·g-1,首次放电容量为273.9 mA·h· g-1。样品S8和S9的首次库伦效率分别为76.0%和79.4%。第2周充放电曲线中,样品S8的充电容量为268.8 mA·h·g-1,放电容量为259.6 mA·h·g-1,库伦效率为96.6%。第2周样品S9的充电容量为275.3 mA·h·g-1,放电容量为269.9 mA·h·g-1,库伦效率为98.0%。所以,样品S9具有较高的放电容量和库伦效率。
 |
| 图 3 样品S8和S9电极在0.1 C的充放电曲线 Fig. 3 Charge-discharge curves of sample S8 and S9 electrodes at 0.1 ? |
| 图选项 |
图 4为样品S8和S9的首周及前6周CV曲线。图 4(a)可以看出,2个样品的第1周氧化过程都出现了2个氧化峰,样品S8的氧化峰出现在4.25 V和4.69 V,样品S9的氧化峰出现在4.06 V和4.77 V。较低的氧化电位对应于Co3+/Co4+和Ni2+/Ni4+的氧化过程,较高的氧化电位对应于充电过程中4.5 V处的平台,是首次充电中Li2O的脱出过程Li2MnO3→Li2O+MnO2。第1周还原过程中,4.4 V的还原峰对应的是部分锂嵌入到Li2MnO3结构中,3.6 V的还原峰对应于Co4+/Co3+和Ni4+/Ni2+的还原过程,小于3.5 V出现的还原峰对应于Mn4+/Mn2+的还原反应。图 4(b)可以看出,从第2周开始,氧化过程出现3个峰,与第1周不同。第1个氧化电位(S8:3.25 V,S9:3.48 V)对应的是Mn2+/Mn4+的氧化过程,第2个氧化电位(S8为4.20 V,S9为3.95 V)对应的是Co3+/Co4+和Ni2+/Ni4+的氧化峰,第3个峰在4.59 V左右,是首圈没有活化完全的Li2MnO3的继续活化过程。还原峰的峰位与第1周相似。样品S9的氧化还原电压差小于样品S8,表明样品S9具有更好的循环可逆性能。
 |
| 图 4 样品S8和S9电极首周CV图及前6周CV曲线 Fig. 4 CV curves of sample S8 and S9 electrodes for initial cycle and for first six cycles |
| 图选项 |
循环稳定性曲线如图 5所示,0.1 C时,样品S8首周放电容量为269.0 mA·h·g-1,循环30周后放电容量为122.7 mA·h·g-1,容量保持率为45.6%。样品S9首周放电容量为273.9 mA·h·g-1,循环30周后放电容量为202.8 mA·h·g-1,容量保持率为74.0%。样品S9具有较高的放电容量和较好的循环稳定性。说明经过900℃煅烧后,材料的电化学性能更好。对样品S9进一步在1 C下进行充放电测试,如图 5(b)所示,结果表明,在1 C时首周放电容量为188.1 mA·h·g-1,循环30周后放电容量为173.3 mA·h·g-1,容量保持率为92.1%。样品S9在1 C下充放电循环时表现出了很好的循环稳定性。
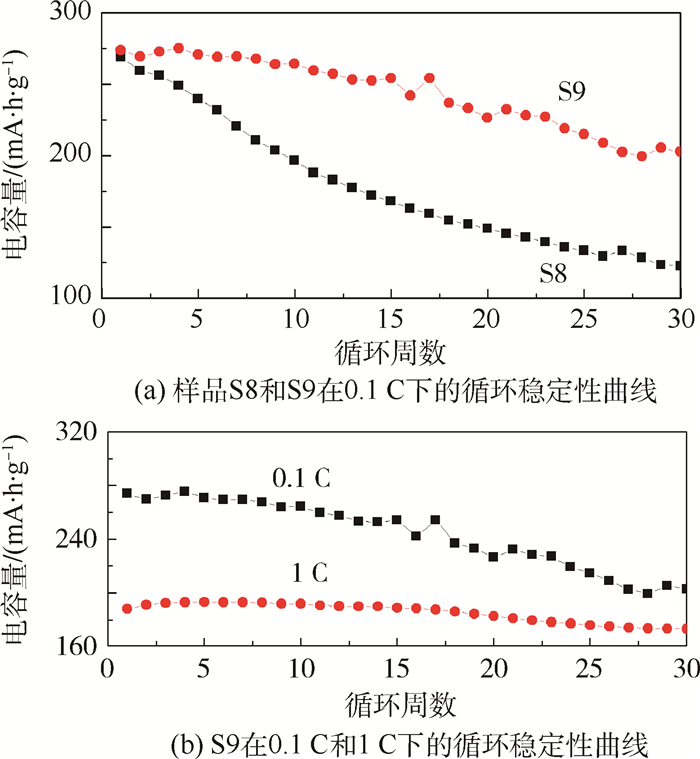 |
| 图 5 样品S8和S9在0.1 C下的循环稳定性曲线及S9在0.1 C和1 C下的循环稳定性曲线 Fig. 5 Cycle stability curves of sample S8 and S9 at 0.1 C and of sample S9 at 0.1 C and 1 ? |
| 图选项 |
图 6给出了样品S8和S9的EIS及其等效电路。等效电路图中:Rs为电池的体电阻,Rct为电池的电荷转移电阻,Zw为Warburg阻抗,CPE为恒相位元件,Z′和Z′′为阻抗实部和虚部。2个样品的EIS主要由高频区的半圆和低频区的斜线组成的。高频区半圆直径的大小代表着电荷转移电阻Rct,Rct对材料的电化学性能起着主要影响作用,低频区的斜线代表着Li+在正极材料体相扩散的Warburg阻抗。从图中可以看到,样品S9具有较小的电荷转移电阻,为315.7 Ω,样品S8的电荷转移电阻较大,为671.4 Ω。
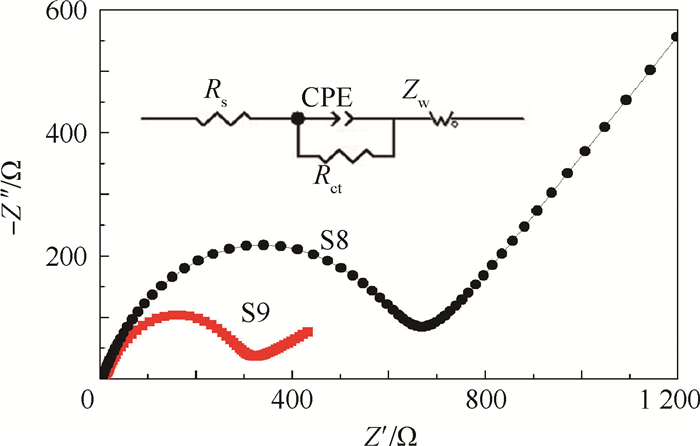 |
| 图 6 样品S8和S9的EIS及其等效电路 Fig. 6 EIS of sample S8 and S9 and its equivalent circuits |
| 图选项 |
综上,与样品S8相比,样品S9具有较好的电化学性能。这说明尽管R-3m层状结构在800℃煅烧后已形成,但仍需要经过更高温度煅烧,以便提高锂离子和过渡金属离子在各自层中的有序度,从而有效地提高电化学性能[22]。
3 结?论 1)?经过900℃煅烧后的材料具有较高的放电容量、较好的循环稳定性和较小的电荷转移电阻。
2)?较高温度的煅烧过程有利于提高材料的结晶性和结构的有序度,从而提高电化学性能。
参考文献
| [1] | QIU X Y, ZHUANG Q C, ZHANG Q Q, et al. Electrochemical and electronic properties of LiCoO2 cathode investigated by galvanostatic cycling and EIS[J].Physical Chemistry Chemical Physics, 2012, 14: 2617–2630.DOI:10.1039/c2cp23626e |
| [2] | XIANG X D, FU Z, LI W S. Morphology-controllable synthesis of LiMn2O4 particles as cathode materials of lithium batteries[J].Journal of Solid State Electrochemistry, 2013, 17(4): 1201–1206.DOI:10.1007/s10008-012-1980-4 |
| [3] | SHU H B, WANG X Y, WU Q, et al. Improved electrochemical performance of LiFePO4/C cathode via Ni and Mn co-doping for lithium-ion batteries[J].Journal of Power Sources, 2013, 237: 149–155.DOI:10.1016/j.jpowsour.2013.03.035 |
| [4] | WEI G Z, LU X, KE F S, et al. Crystal habit-tuned nanoplate material of Li Li1/3-2x/3NixMn2/3-x/3O2 for high-rate performance lithium-ion batteries[J].Advanced Materials, 2010, 22: 4364–4367.DOI:10.1002/adma.v22:39 |
| [5] | SINGH G, THOMAS R, KUMAR A, et al. Electrochemical behavior of Cr-doped composite Li2MnO3-LiMn0.5Ni0.5O2 cathode materials[J].Journal of the Electrochemical Society, 2012, 159(4): A410–A420.DOI:10.1149/2.059204jes |
| [6] | XIANG X, LI X, LI W. Preparation and characterization of size-uniform Li Li0.131Ni0.304Mn0.565O2 particles as cathode materials for high energy lithium ion battery[J].Journal of Power Sources, 2013, 230: 89–95.DOI:10.1016/j.jpowsour.2012.12.050 |
| [7] | LU Z H, BEAULIEU L Y, DONABERGER R A, et al. Synthesis, structure, and electrochemical behavior of Li NixLi1/3-2x/3Mn2/3-x/3O2[J].Journal of the Electrochemical Society, 2002, 149(6): A778–A791.DOI:10.1149/1.1471541 |
| [8] | THACKERAY M M, KANG S H, JOHNSON C S, et al. Li2MnO3-stabilized LiMO2 (M=Mn, Ni, Co) electrodes for lithium-ion batteries[J].Journal of Materials Chemistry, 2007, 17: 3112–3125.DOI:10.1039/b702425h |
| [9] | WANG C C, JARVIS K A, FERREIRA P J, et al. Effect of synthesis conditions on the first charge and reversible capacities of lithium-rich layered oxide cathodes[J].Chemistry of Materials, 2013, 25: 3267–3275.DOI:10.1021/cm402181f |
| [10] | 刘燕燕, 刘道坦, 陈立泉. 锰基富锂正极材料Li1.2Ni0.2Mn0.59Co0.01O2的首次充放电曲线分析[J].硅酸盐学报, 2015, 43(1): 8–13.LIU Y Y, LIU D T, CHEN L Q. First charge-discharge curves of Mn-based Li-rich cathode material Li1.2Ni0.2Mn0.59Co0.01O2[J].Journal of the Chinese Ceramic Society, 2015, 43(1): 8–13.(in Chinese) |
| [11] | WANG C C, MANTHIRAM A. Influence of cationic substitutions on the first charge and reversible capacities of lithium-rich layered oxide cathodes[J].Journal of Materials Chemistry A, 2013, 1: 10209–10217.DOI:10.1039/c3ta11703k |
| [12] | LU Z H, MACNEIL D D, DAHN J R. Layered cathode materials LiNixLi(1/3-2x/3)Mn(2/3-x/3)O2 for lithium-ion batteries[J].Electrochemical and Solid-State Letters, 2001, 4(11): A191–A194.DOI:10.1149/1.1407994 |
| [13] | FELL C R, CARROLL K J, CHI M F, et al. Synthesis-structure-property relations in layered, "Li-excess" oxides electrode materials LiLi1/3-2x/3NixMn2/3-x/3O2 (x=1/3, 1/4, and 1/5)[J].Journal of the Electrochemical Society, 2010, 157(11): A1202–A1211.DOI:10.1149/1.3473830 |
| [14] | XIANG X D, LI W S. Significant influence of insufficient lithium on electrochemical performance of lithium-rich layered oxide cathodes for lithium ion batteries[J].Electrochimica Acta, 2014, 133: 422–427.DOI:10.1016/j.electacta.2014.04.084 |
| [15] | ARMSTRONG A R, HOLZAPFEL M, NOVAK P, et al. Demonstrating oxygen loss and associated structural reorganization in the lithium battery cathode Li Ni0.2Li0.2Mn0.6O2[J].Journal of the American Chemical Society, 2006, 128(26): 8694–8698.DOI:10.1021/ja062027+ |
| [16] | SHOJAN J, RAO C V, TORRES L, et al. Lithium-ion battery performance of layered 0.3Li2MnO30.7LiNi0.5Mn0.5O2 composite cathode prepared by co-precipitation and sol-gel methods[J].Materials Letters, 2013, 104: 57–60.DOI:10.1016/j.matlet.2013.04.001 |
| [17] | KANG S H, AMINE K. Synthesis and electrochemical properties of layer-structured 0.5Li(Ni0.5Mn0.5)O20.5Li(Li1/3Mn2/3)O2 solid mixture[J].Journal of Power Sources, 2003, 124: 533–537.DOI:10.1016/S0378-7753(03)00804-8 |
| [18] | SONG B H, ZHOU C F, CHEN Y, et al. Role of carbon coating in improving electrochemical performance of Li-rich Li(Li0.2Mn0.54Ni0.13Co0.13)O2 cathode[J].RSC Advances, 2014, 4: 44244–44252.DOI:10.1039/C4RA04976D |
| [19] | WEI X, ZHANG S, DU Z, et al. Electrochemical performance of high-capacity nanostructured LiLi0.2Mn0.54Ni0.13Co0.13O2 cathode material for lithium ion battery by hydrothermal method[J].Electrochimica Acta, 2013, 107: 549–554.DOI:10.1016/j.electacta.2013.05.118 |
| [20] | ZHANG L, WU B, LI N, et al. Rod-like hierarchical nano/micro Li1.2Ni0.2Mn0.6O2 as high performance cathode materials for lithium-ion batteries[J].Journal of Power Sources, 2013, 240: 644–652.DOI:10.1016/j.jpowsour.2013.05.019 |
| [21] | FU F, HUANG Y Y, WU P, et al. Controlled synthesis of lithium-rich layered Li1.2Mn0.56Ni0.12Co0.12O2 oxide with tunable morphology and structure as cathode material for lithium-ion batteries by solvo/hydrothermal methods[J].Journal of Alloys and Compounds, 2015, 618: 673–678.DOI:10.1016/j.jallcom.2014.08.191 |
| [22] | WANG D P, BELHAROUAK I, ZHANG X F, et al. Insights into the phase formation mechanism of 0.5Li2MnO3 center dot 0.5LiNi0.5Mn0.5O2 battery materials[J].Journal of the Electrochemical Society, 2014, 161(1): A1–A5.DOI:10.1149/2.002401jes |
