文献[11-14]研究发现,铝合金在乙二醇水溶液中主要发生点蚀,且与溶液中溶解的氧密切相关;有氧气存在时,阴极反应主要由氧还原支配[15-17]。
温度是影响阴阳极腐蚀反应的重要因素,同时温度又是影响阴极还原剂氧扩散的关键因素,特别是,当温度变化时,缓蚀剂的效率会受到影响;而氯离子浓度(c(Cl-))是影响点蚀的关键因素。研究温度和c(Cl-)对腐蚀的影响都将会为材料保护和设计提供依据和有用的数据。因此有必要研究温度和氯离子对防锈铝在乙二醇水溶液中的腐蚀行为影响。
本文采用动电位极化曲线法、电化学阻抗法等电化学方法,研究了c(Cl-)对防锈铝在乙二醇水溶液中腐蚀行为的影响。采用金相显微镜、扫描电镜对铝合金腐蚀后的表面形貌进行观察,并对蚀坑做了记录和统计分析。
1 试验 1.1 电极和溶液 试验所采用的材料为防锈铝,牌号为5A02,材料从防锈铝板材上切下,加工成直径为10 mm的圆柱。材料的质量分数为:Cu 0.05, Mn 0.6, Fe 0.30, Si 0.30, Mg 0.5, Ti 0.05, Zn 0.2和余量Al。铝电极放入胶木粉中封装,留出0.785 cm2的工作面积。从试样后面焊接一条铜导线用作电极引线;电极的非工作面用环氧树脂密封。每个电极的工作面用5000#砂纸打磨。然后分别用酒精和去离子水冲洗干净。溶液是由体积分数均为50%的乙二醇水组成,加入了不同浓度的NaCl来模拟含有氯离子的冷却液,浓度分别为0、0.01、0.05、0.10和0.50 mol/L;做温度影响实验时NaCl浓度为0.01 mol/L,试验温度分别为30、40、50、60、70和80℃,试验的温度通过热电偶连接的水浴锅保持。
1.2 电化学测量 采用电化学工作站(CorrTest,CS150 Electrochemical Workstation)进行电化学测试。测试采用典型的三电极体系进行的,试样作为工作电极,铂电极作为辅助电极,饱和甘汞电极作为参比电极。在进行电化学测试之前,试样浸入静态溶液中至少1 h以得到一个相对稳定的腐蚀电位。在进行极化和阻抗测定之前,进行开路电位测量。不同c(Cl-)下动电位极化扫描速度为30 mV/min,扫描范围是-250~250 mV(vs. Eocp,Eocp为开路电位),不同温度下动电位极化扫描以30 mV/min的速度从-0.8 V向正方向扫到-0.45 V,通过Zview分析软件进行拟合,并计算腐蚀电流密度(icorr)、腐蚀电位(Ecorr)、阳极塔菲尔斜率(ba)和阴极塔菲尔斜率(bc)。
电化学阻抗采用CHI660E进行测量,频率范围为100~10 000 kHz,交流信号振幅为10 mV。每个试验测试了至少3个有用的平行试样以保证试验结果的重复性。
1.3 表面形貌观察 动电位极化以后,将防锈铝电极取下超声波清洗10 min,在电极表面镀上一层铂金增强导电性来进行扫描电镜(Cam Scan3400)分析。电极不同区域的表面形貌特征用2 000倍放大倍数下表征。无重复的记录下显微镜视野里点蚀坑的总数和蚀坑口宽度。选取一部分腐蚀后试样用去离子水清洗后吹干用于宏观形貌观察。
2 试验结果 图 1为室温防锈铝在含有0.01 mol/L氯离子的乙二醇水溶液测试的电位(E)与时间(t)的曲线。从图中可以看出,开路电位刚开始上升而后在-0.58 V附近波动。
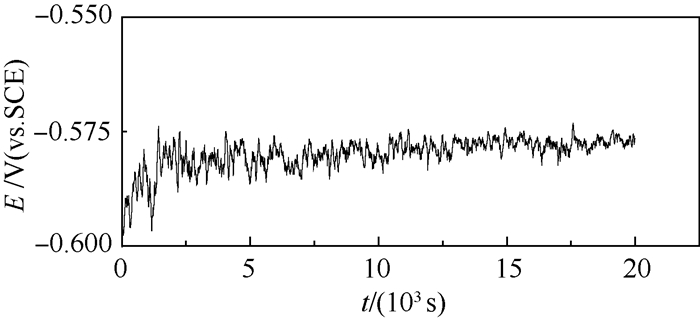 |
| 图 1 室温下防锈铝在含有0.01 mol/L氯离子的乙二醇水溶液中的电位与时间曲线 Fig. 1 Corrosion potential and time curve of aluminum alloy in ethylene glycol-water solution containing 0.01 mol/L chloride ions at room temperature |
| 图选项 |
2.1 氯离子影响电化学结果 图 2为防锈铝在c(Cl-)下的极化曲线。从图中可以看出,各条曲线形状相似,表明在不同浓度氯离子存在条件下,铝合金有着相同的腐蚀过程。另外图中曲线都没有出现钝化区,说明在不同浓度氯离子溶液中并未发生钝化现象。随着c(Cl-)的升高,阳极电流密度(i)增加,腐蚀电位(Ecorr)负移。由图 2拟合的自腐蚀电流密度、自腐蚀电位、阴极阳极塔菲尔斜率结果如表 1所示。
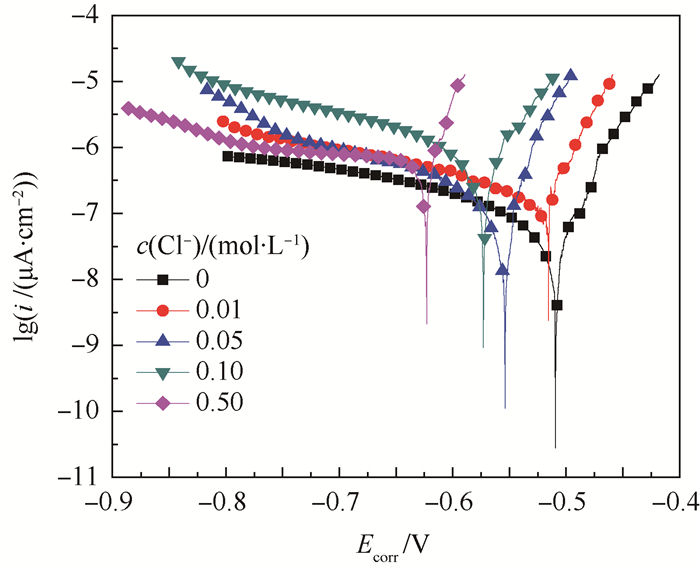 |
| 图 2 室温下防锈铝在不同氯离子浓度下的极化曲线 Fig. 2 Polarization curves of aluminum alloy under different concentrations of chloride ion at room temperature |
| 图选项 |
表 1 防锈铝在不同氯离子浓度的极化曲线拟合的电化学参数值 Table 1 Fitted electrochemical parameters of polarization curves of aluminum alloy under different concentrations of chloride ion
| c(Cl-)/(mol·L-1) | Ecorr/mV | icorr/(μA·cm-2) | ba/mV | bc/mV |
| 0 | -508.2 | 0.726 | 37.41 | -207.92 |
| 0.01 | -521.8 | 1.360 | 32.22 | -162.71 |
| 0.05 | -550.0 | 2.090 | 31.77 | -218.96 |
| 0.10 | -563.5 | 6.320 | 27.78 | -241.79 |
| 0.50 | -615.4 | 8.970 | 16.42 | -863.14 |
表选项
从拟合的结果看,腐蚀电位负移,一般情况下,自腐蚀电位越负说明电极表面状态越活泼,随着c(Cl-)升高,电极变得更容易受到腐蚀,腐蚀倾向变大;阴极、阳极塔菲尔斜率降低说明腐蚀反应所受阻力降低,阳极反应更容易进行。自腐蚀电流密度icorr变大,自腐蚀电流密度从0.726 μA·cm-2增加到8.97 μA·cm-2,增加了一个数量级,说明c(Cl-)升高到0.50 mol/L后腐蚀程度加剧很明显。随着溶液c(Cl-)增大,反应体系阴阳极反应阻力变小,从而导致合金基体表面更容易受到氯离子的侵蚀,自腐蚀电流密度变大,金属溶解速度加快,金属腐蚀速度显著加剧。
图 3为室温下防锈铝在含有不同氯离子浓度的乙二醇水溶液中的Nyquist图。从图中可以看出,随着c(Cl-)不同,观察到两种阻抗谱特征。当c(Cl-)为0和0.01 mol/L时,阻抗谱的特征为一个高频容抗弧和一个低频容抗弧;当c(Cl-)为0.05、0.10和0.50 mol/L时,阻抗谱特征为高频容抗弧和低频区的感抗弧。随着c(Cl-)的升高,高频容抗弧的半径降低,低频感抗弧的半径也降低。
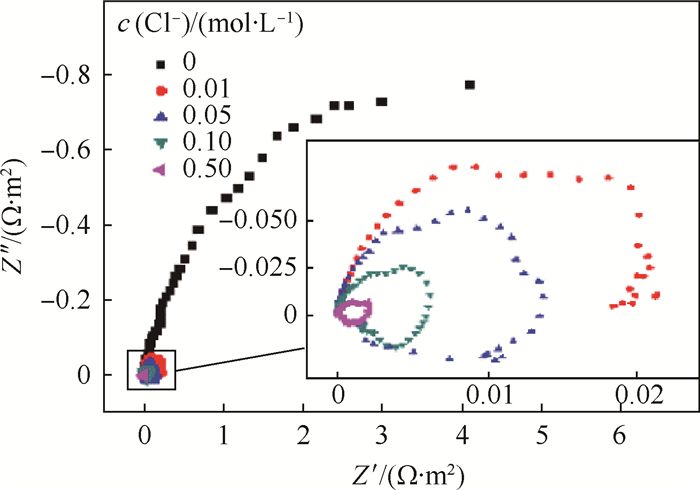 |
| 图 3 室温下防锈铝在含有不同氯离子浓度的乙二醇水溶液中的Nyquist图 Fig. 3 Nyquist diagrams of aluminum alloy in ethylene glycol-water solution containing different concentrations of chloride ion at room temperature |
| 图选项 |
2.2 温度影响电化学结果 图 4为防锈铝在含有0.01 mol/L氯离子的乙二醇水溶液中不同温度(T)下的极化曲线,可以看出,防锈铝在含有氯离子的乙二醇水溶液中并不会发生钝化。随着温度升高,铝的腐蚀电位降低而阳极电流密度呈升高趋势。拟合的自腐蚀电流密度、自腐蚀电位、阴极阳极塔菲尔斜率结果如表 2所示。
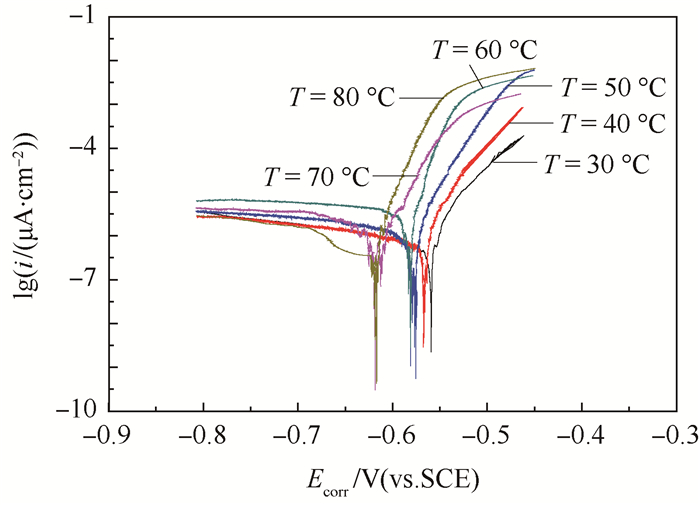 |
| 图 4 防锈铝在含有0.01 mol/L氯离子的乙二醇水溶液中不同温度下的极化曲线 Fig. 4 Polarization curves of aluminum alloy in ethylene glycol-water solution containing 0.01 mol/L chloride ions at different temperatures |
| 图选项 |
表 2 防锈铝在不同温度下的极化曲线拟合的电化学参数值 Table 2 Fitted electrochemical parameters of polarization curves of aluminum alloy at different temperatures
| T/℃ | Ecorr/mV | icorr/(μA·cm-2) | ba/mV | bc/mV |
| 30 | -577 | 0.77 | 45.9 | -317 |
| 40 | -584 | 0.92 | 38.2 | -402 |
| 50 | -585 | 1.59 | 31.7 | -545 |
| 60 | -589 | 2.49 | 27.5 | -656 |
| 70 | -608 | 3.87 | 26.5 | -458 |
| 80 | -618 | 3.91 | 19.3 | -287 |
表选项
从表 2可以看出温度升高,自腐蚀电位Ecorr负移。温度升高有促进阳极金属溶解的趋势。随着温度升高,阴极塔菲尔斜率bc从-317 mV降低到-656 mV然后又上升到-287 mV,这说明阴极反应随着温度升高有先升高后降低的趋势。阴极反应速度在60℃达到最大值。阳极塔菲尔斜率ba从45.9 mV降低到19.3 mV,说明了温度升高降低了阳极反应阻力。自腐蚀电流密度icorr随着温度的升高而增大,说明了温度越高腐蚀速度越大。
图 5为防锈铝在含有0.01 mol/L氯离子的乙二醇水溶液中不同温度下的Nyquist图。从图中可以看出,在高频区每一个阻抗谱图都有一个容抗弧。在低频区,温度为30、40、50、60 ℃时,阻抗谱图都有一个典型的扩散特征:一条直线。而当温度为70、80℃时,这条扩散特征的直线就被一段感抗弧所代替,并且感抗弧的直径随着温度的升高而降低;同时容抗弧的半径也随着温度的升高而降低。
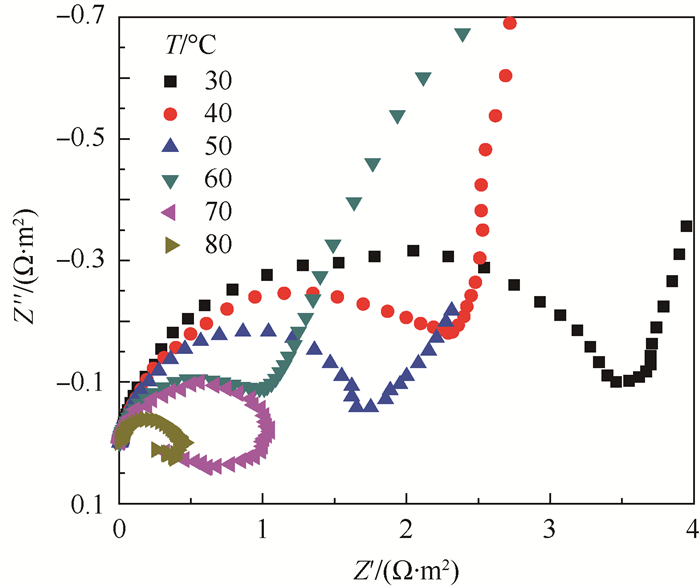 |
| 图 5 防锈铝在含有0.01 mol/L氯离子的乙二醇水溶液中不同温度下的Nyquist图 Fig. 5 Nyquist diagrams of aluminum alloy in test ethylene glycol solution containing 0.01 mol/L chloride ions at different temperatures |
| 图选项 |
2.3 表面形貌 图 6为防锈铝在不同氯离子浓度溶液中极化曲线测量以后的宏观表面形貌图。从图中可以看出,不同c(Cl-)下经过极化后,防锈铝表面都发生了点蚀,且点蚀坑的尺寸随着c(Cl-)的升高而变大。
 |
| 图 6 防锈铝在不同氯离子浓度溶液中极化后的金相显微镜照片 Fig. 6 Metallurgical photographs of aluminum alloy after polarization in solution containing different concentrations of chloride ion |
| 图选项 |
图 7为不同温度下的防锈铝在极化曲线测量以后的表面形貌扫描电镜(SEM)照片;图 8为统计的每mm2内的点蚀坑的数量(n),从图中可以看出,不同温度下经过极化后,各个电极表面都发生了点蚀,且点蚀坑口宽度都随着温度的升高而升高,蚀坑数量随着温度升高而稍有降低。
 |
| 图 7 防锈铝在不同温度下极化后的扫描电镜照片 Fig. 7 SEM photographs of aluminum alloy after polarization at different temperatures |
| 图选项 |
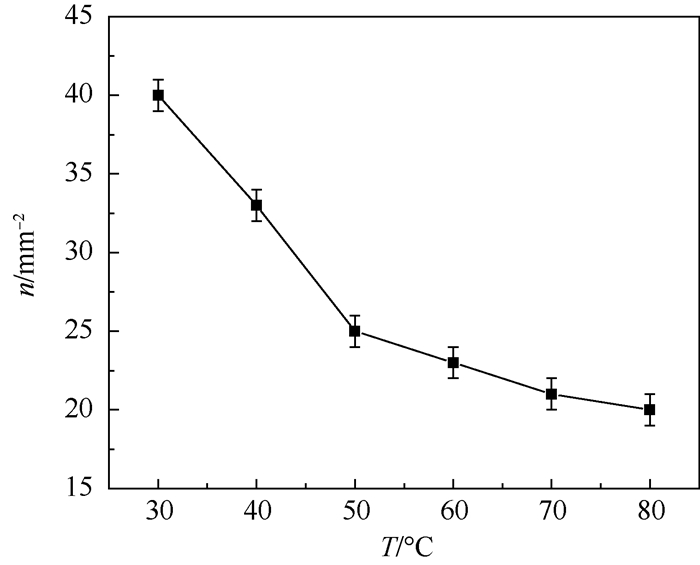 |
| 图 8 不同温度下点蚀坑数量统计 Fig. 8 Pit number at different temperatures |
| 图选项 |
3 分析讨论 3.1 反应机理与电化学讨论 一般的铝合金在含有氯离子的中性水溶液中的腐蚀反应如下。
阴极反应:
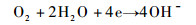 | (1) |
阳极反应:
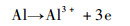 | (2) |
 | (3) |
当有氧气存在时,铝的表面就会产生一层氧化铝膜层。当溶液中含有乙二醇,乙二醇将会被还原,阴极反应增加了乙二醇的还原反应,产生醇化铝膜层[18]。
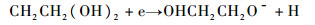 | (4) |
 | (5) |
醇化铝主要在氧气不足时产生。因此最终形成的氧化膜是氧化铝和醇化铝的混合[19]。
图 1中开路电位的正移说明电极在浸入溶液后发生了氧化。铝在溶液中发生溶解,阴极发生还原反应,金属铝被氧化生成膜层。开路电位最后稳定在一具体值,说明金属的溶解和膜层的形成达到一个动态的平衡。
室温下没有氯离子存在时,防锈铝的耐腐蚀性能比较好。图 2和表 1中c(Cl-)=0时的自腐蚀电位最正,自腐蚀电流密度最低,阴极和阳极塔菲尔斜率最大。当有氯离子存在,氯离子对氧化膜表面的穿透作用极强,氧化膜遭到破坏;金属发生点蚀的前置过程是氯离子的吸附。由于最终形成的氧化膜是氧化铝和醇化铝的混合,氯离子覆盖在金属表面慢慢代替Al(OH)3基体上的OH-和Al(OHCH2CH2O)3上的OHCH2CH2O-形成AlCl3。
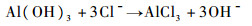 | (6) |
 | (7) |
Al(OH)3基体上的OH-和Al(OHCH2CH2O)3上的OHCH2CH2O-被氯离子替代形成AlCl3后,膜层被破坏,耐腐蚀性能下降。随着c(Cl-)的升高,氯离子对氧化铝和醇化铝膜层产生的破坏作用增强,材料的耐腐蚀性能严重下降。
在图 3阻抗谱中的高频容抗弧与氧化膜的形成有关,而低频感抗弧或者容抗弧与界面转移反应有关[20]。高频容抗弧半径越大说明铝合金氧化膜稳定性越好,保护性和耐腐蚀性就强。c(Cl-)=0时,高频容抗弧的半径远大于有氯离子存在时的半径,再次说明没有氯离子存在时防锈铝有良好的耐腐蚀性能。随着氯离子的出现,容抗弧半径减小,氧化膜耐腐蚀性能开始下降。当c(Cl-)>0.05 mol/L时,在低频区出现了感抗弧,这个感抗弧是由于腐蚀反应过程中中间产物的吸附作用增强引起的。这些中间产物主要是在Al(OHCH2CH2O)3上的OHCH2CH2O-被Cl-替代形成的AlCl3过程中产生的Al(OHCH2CH2O)2+、Al(OHCH2CH2O)Cl+和Al(OHCH2CH2O)2Cl[21]。中间产物吸附在氧化膜表面会降低氧化膜的稳定性,减弱其保护性。当c(Cl-)较低时,例如c(Cl-) < 0.01 mol/L时,中间产物的吸附影响并不明显,当c(Cl-)升高到0.05 mol/L时,反应中间产物吸附作用的增强,将导致腐蚀的加剧和耐腐蚀性能的明显下降。在宏观上表现为点蚀坑尺寸增大、深度增大、小的点蚀坑融合成大的斑状点蚀坑。
当温度升高时,阴极反应和阳极反应的活化能降低,反应阻力变小,反应速率变快。电极表面状态变得更活泼,所以自腐蚀电位负移,阴极、阳极塔菲尔斜率减小,如图 5和表 2所示。从自腐蚀电流密度icorr来看,腐蚀随着温度的升高而加剧。
在有氧气存在的条件下,阴极反应是由氧的扩散和还原支配的,当温度升高时,氧分子的扩散系数增加,乙二醇黏度降低[14],加快了氧气的扩散从而使阴极电流密度增加。但是,温度升高时,氧气的溶解度降低,随着反应进行氧含量降低,阴极反应没有足够的氧气支撑,从而受到抑制。温度上升到60℃时阴极反应速度达到最大值。而温度对阳极反应一直是促进的,阳极金属溶解速度随着温度升高而升高。从整体上看,整个腐蚀过程随着温度的升高而加速,这也是导致自腐蚀电流密度icorr升高的原因。
不同温度下电化学阻抗谱(EIS)测试中,较低温度下观察到的扩散特征代表了Warburg阻抗,是含有氧气扩散的腐蚀过程的典型特征[22]。这表明质子转移步骤在反应过程中起了重要作用。Warburg阻抗随着温度的升高而变小,当温度高于60℃时消失,说明扩散的支配作用随着温度升高而变小。温度高于60℃时出现了腐蚀产物的吸附引起的容抗弧。当温度较高时,中间产物在氧化膜表面的吸附作用增强,从而导致容抗弧的出现。随着温度的升高高频容抗弧的半径一直减小,也说明了随着温度升高耐腐蚀性减弱,氧化膜的保护作用减弱,防锈铝更容易受到氯离子侵蚀。
3.2 对点蚀的影响 从扫描电镜照片的形貌上看,不同c(Cl-)下经过极化后,防锈铝表面都发生了点蚀,且点蚀坑数量增加的同时尺寸随着c(Cl-)的升高而变大。由此可见氯离子对防锈铝点蚀的影响主要体现在促进点蚀形核和促进点蚀坑的生长。不同温度下,椭圆形蚀坑尺寸随着温度的升高而升高,而蚀坑的数量反而有所降低,这说明温度影响的是单个点蚀坑的大小(蚀坑口宽度和蚀坑深度)、生长程度而并没有显著增加点蚀的形核率。
防锈铝在含有氯离子的乙二醇水溶液中,当室温下c(Cl-)超过一定值(0.05 mol/L),或者在含有0.01 mol/L的氯离子、温度高于某一温度(60℃)时,其电化学阻抗谱都表现出一共同特征:出现由于反应中间产物吸附产生的感抗弧。一般认为这个时候点蚀正在电极表面萌生[23]。也就是说在乙二醇水溶液中,防锈铝点蚀的萌生是由溶液中c(Cl-)和温度共同影响决定的。不同的温度下都存在一个点蚀萌生的氯离子门槛值。c(Cl-)高于这个门槛值时,点蚀萌生。在门槛值下,温度升高时,点蚀萌生。粗略地估计点蚀萌生氯离子的门槛值可以评价点蚀发生的敏感性。在室温时,防锈铝在体积分数均为50%的乙二醇和水溶液中的点蚀萌生氯离子门槛值在0.01~0.05 mol/L之间;在60℃时,防锈铝在体积分数均为50%的乙二醇和水溶液中的点蚀萌生氯离子门槛值小于0.01 mol/L。可见,点蚀萌生氯离子门槛值随着温度的升高而降低。从另一个方面说明温度升高使腐蚀更容易发生,温度促进点蚀生长。
4 结论 1)?在乙二醇水(体积比1:1)溶液中,室温下没有氯离子存在时,防锈铝的耐腐蚀性能很好。防锈铝表面形成较稳定的氧化铝和醇化铝膜层。
2)?当氯离子出现时,氯离子吸附在氧化膜表面,对氧化膜表面造成破坏,造成点蚀。反应过程中产生的中间产物会吸附在氧化膜表面,当c(Cl-)不高时(小于0.01 mol/L),这种吸附作用不明显;当c(Cl-)较高(高于0.05 mol/L)时,中间产物吸附作用就会增强,阻抗谱中低频区出现感抗弧,点蚀萌生。随着c(Cl-)增高,防锈铝的腐蚀加剧,耐腐蚀性能下降。
3)?随着温度的升高,电极表面状态变得更活泼,阴极反应和阳极反应的活化能降低,反应阻力变小,腐蚀速度增大。温度升高的同时,溶解氧含量下降,阴极反应受到抑制。与此同时扩散过程在整个腐蚀反应过程中的支配性降低,中间产物在氧化膜表面的吸附作用增强,从而导致低频容抗弧的出现。
4)?从形貌分析上看,氯离子明显的促进点蚀坑的生长;温度对点蚀的影响主要体现在影响单个点蚀坑的几何大小(蚀坑口宽度和蚀坑深度)和生长程度,而并没有显著增加点蚀的形核率。
参考文献
| [1] | 刘建华, 高庆娜, 李英东, 等. 5A05和2A12铝合金在硫酸-己二酸中阳极氧化行为及膜层电化学性能研究[J].北京航空航天大学学报, 2015, 41(5): 757–763.LIU J H, GAO Q N, LI Y D, et al. Oxidation behavior of aluminum alloy 5A06 and 2A12 in sulfuric-adipic acid and eletrocheical property of anodic oxide[J].Journal of Beijing University of Aeronautics and Astronautics, 2015, 41(5): 757–763.(in Chinese) |
| [2] | SU J X, MA M Y, WANG T J, et al. Fouling corrosion in aluminum heat exchanger[J].Chinese Journal of Aeronautics, 2015, 28(3): 954–960.DOI:10.1016/j.cja.2015.02.015 |
| [3] | WEON J I. Corrosion mechanism of aluminum alloy by ethylene glycol-based solution[J].Materials Corrosion, 2013, 64(1): 50–59.DOI:10.1002/maco.v64.1 |
| [4] | MONTICELLI C, BRUNORO G, ZUCCHI F. Inhibition of localized attack on the aluminum alloy AA 6351 in glycol/water solutions[J].Materials and Corrossion, 1989, 40(6): 393–398.DOI:10.1002/(ISSN)1521-4176 |
| [5] | VIGDOROVIVH V I, TSYGANKOVA L E. Corrosion of aluminum in sulfate ethylene glycol solutions[J].Corrosion Science, 1993, 13(2): 215–222. |
| [6] | MONTICELLI C, BRUNORO G, FRIGNANI A. Corrosion behavior of the aluminum alloy AA 6351 in glycol/water solutions degraded at elevated temperature[J].Materials and Corrosion, 1988, 39(4): 379–384. |
| [7] | 战广深, 殷正安. NaCl溶液中氯离子浓度对铝合金电偶腐蚀的影响[J].材料保护, 1994, 27(2): 20–23.ZHAN G S, YIN Z A. Effect of concentration of chloride in NaCl solution to galvanic corrosion of aluminum[J].Material Protection, 1994, 27(2): 20–23.(in Chinese) |
| [8] | ABIOLA O K, OTAIGBE J O E. Effect of common water contaminants on the corrosion of aluminum alloys in ethylene glycol-water solution[J].Corrosion Science, 2008, 50(1): 242–247.DOI:10.1016/j.corsci.2007.06.013 |
| [9] | ZHOU W, AUNG N N, CHOUDHARY A. Heat-transfer corrosion behavior of cast Al alloy[J].Corrosion Science, 2008, 50(12): 3308–3313.DOI:10.1016/j.corsci.2008.08.047 |
| [10] | ZAHARIEVA J, MILANOVA M, MITOV M, et al. Corrosion of aluminum and aluminum alloy in ethylene glycol-water mixtures[J].Journal of Alloys and Compounds, 2009, 470: 397–403.DOI:10.1016/j.jallcom.2008.02.079 |
| [11] | 范金龙, 龚敏, 侯肖, 等. 3A21铝合金在乙二醇水溶液中的腐蚀行为[J].腐蚀与防护, 2014, 35(11): 1116–1121.FAN J L, GONG M, HOU X, et al. Corrosion behavior of 3A21 aluminum alloy in ethylene glycol water solution[J].Corrosion and Protection, 2014, 35(11): 1116–1121.(in Chinese) |
| [12] | FERIKY A M, FATAYERJI M Z. Electrochemical corrosion behavior of AZ91D alloy in ethylene glycol[J].Electrochimica Acta, 2009, 54(26): 6522–6528.DOI:10.1016/j.electacta.2009.06.025 |
| [13] | LUO C, GAO M, SUN Z, et al. FIB-SEM investigation on corrosion propagation of aluminum-lithium alloy in sodium chloride solution[J].Corrosion Engineering Science and Technology:The International Journal of Corrosion Processes and Corrosion Control, 2015, 50(5): 390–396. |
| [14] | XU L Y, CHENG Y F. Electrochemical characterization and CFD simulation of flow-assisted corrosion of aluminum alloy in ethylene glycol-water solution[J].Corrosion Science, 2008, 50(7): 2004–2010. |
| [15] | LIU Y, CHENG Y F. Effects of coolant chemistry on corrosion of 3003 aluminum alloy in automotive cooling system[J].Material Corrosion, 2010, 61(7): 574–578. |
| [16] | WONG D, SWETTE L. Aluminum corrosion in uninhibited ethylene glycol-water solutions[J].Journal of the Electrochemical Society, 1979, 126(1): 11–15.DOI:10.1149/1.2128966 |
| [17] | BAZELEVA N A, HERASYMENKO Y S. Corrosion-electrochemical behavior of aluminum alloys in aqueous ethylene glycol media[J].Material Science, 2007, 43(6): 851–860.DOI:10.1007/s11003-008-9032-z |
| [18] | LIU Y, CHENG Y F. Characterization of passivity and pitting corrosion of 3003 aluminum alloy in ethylene glycol-water solutions[J].Journal of Applied Electrochemstry, 2011, 41(2): 151–159.DOI:10.1007/s10800-010-0215-6 |
| [19] | NIU L, CHENG Y F. Electrochemical characterization of metastable pitting of 3003 aluminum alloy in ethylene glycol-water solution[J].Material Society, 2007, 42(20): 8613–8617.DOI:10.1007/s10853-007-1841-1 |
| [20] | ZHANG G A, XU Y L, CHENG Y F. Investigation of erosion-corrosion of 3003 aluminum alloy in ethylene glycol-water solution by impingement jet system[J].Corrosion Science, 2009, 51(2): 283–290.DOI:10.1016/j.corsci.2008.10.026 |
| [21] | ZHANG G A, XU Y L, CHENG Y F. Mechanistic aspects of electrochemical corrosion of aluminum alloy in ethylene glycol-water solution[J].Electrochimica Acta, 2008, 53(28): 8245–8252.DOI:10.1016/j.electacta.2008.06.043 |
| [22] | NIU L, CHENG Y F. Cathodic reaction kinetics and its implication on flow-assisted corrosion of aluminum alloy in aqueous ethylene glycol solution[J].Journal of Applied Electrochemistry, 2009, 39(8): 1267–1272.DOI:10.1007/s10800-009-9794-5 |
| [23] | NIU L, CHENG Y F. Synergistic effects of fluid flow and sand particles on erosion-corrosion of aluminum in ethylene glycol-water solutions[J].Wear, 2008, 265(3-4): 367–374.DOI:10.1016/j.wear.2007.11.007 |
