2198铝-锂合金可以替代部分2XXX系传统铝合金,是第3代Ai-Li-Cu合金,其中Li是最轻的金属元素,增加Li之后可以降低铝合金的密度,但是可以提高其弹性模量。众所周知在铝合金中铜的固溶度比较大,因此其强化效应比较明显。Ma等[7]研究了AA2099-T8铝-锂合金在五硼酸铵电解质溶液中阳极氧化膜的生长,结果发现阳极氧化过程中阻挡层的生长伴随着含铜合金相的氧化,氧化膜中氧气的形成和释放以及氧化膜的自封闭过程。本研究组对铝合金的硫酸-己二酸阳极氧化技术进行了大量的研究,分析了低浓度硫酸加上改性剂之后的成膜控制机理[8-10]。
本文对2198铝-锂合金在硫酸-己二酸溶液中阳极氧化之后的氧化膜的结构和电化学性能进行研究,分析合金相对氧化膜结构的影响;通过电化学阻抗谱和浸泡实验来研究阳极氧化之后试样的耐蚀性。
1 实验 1.1 实验材料 本实验所采用的材料是2198铝-锂合金(主要成分/wt%:Cu 2.9~3.5,Li 0.8~1.1,Si 0.08,Fe 0.10,Mn 0.50,Mg 0.25~0.80,Cr 0.05,Zn 0.35,Ti 0.10,Ag 0.10~0.50,Zr 0.04~0.18)。试样的尺寸是100 mm×50 mm×2mm,试样依次使用320#,600#,1 200#和2 000#砂纸进行打磨,使用去离子水进行清洗。在阳极氧化之前试样要进行预处理,预处理包括:除油、碱洗和出光。表 1为试样预处理溶液的化学组成、处理时间和温度。每一步结束之后都要使用去离子水进行清洗再进行下一步。
表 1 试样预处理溶液的化学组成、处理时间和温度 Table 1 Chemical composition, holding time and temperature of solutions used for surface preparation
| 表面预处理 | 溶液的化学组成 | 温度/℃ | 处理时间/s |
| 除油 | 20 g/L Na3PO4 10 g/L Na2CO3 5 g/L NaOH | 50 | 60 |
| 碱洗 | 50 g/L NaOH | 50 | 60 |
| 出光 | 400 g/L HNO3 | 室温 | 30 |
表选项
1.2 阳极氧化和封闭 电解质溶液组成为50 g/L硫酸+10 g/L己二酸,阳极氧化电压为15 V,持续氧化时间为30 min,缓起时间为5 min,温度为25℃,并记录阳极氧化过程中电流-时间的关系曲线。阳极氧化过程中进行机械搅拌以保证恒定的温度。阳极氧化之后试样使用去离子水进行清洗之后沸水封闭30 min。
1.3 氧化膜形貌观察 使用场发射扫描电子显微镜(FE-SEM,JEOL JSM-7500)和原子力显微镜(AFM,Icon,Veeco,USA)对氧化膜的表面和截面形貌进行观察。
1.4 电化学测试 采用电化学工作站(PARSTAT 2273,Princeton Application Research,USA)进行电化学测试。测试采用三电极体系,参比电极:饱和甘汞电极;辅助电极:铂电极;工作电极:阳极氧化铝试样,工作电极的面积是1 cm2。电化学工作站的工作条件是在室温下,体系是质量分数为3.5%的NaCl溶液。未封闭和封闭之后的阳极氧化试样浸泡在质量分数为3.5%的NaCl溶液不同时间之后进行电化学测试。交流阻抗测试所施加的频率范围是10-3~105 Hz,扫描的点数是50,外加激励信号幅值为±10 mV;Tafel曲线扫描速度是0.5 mV/s,扫描范围是-250 ~250 mV(扫描的电压设定的范围是以开路电位为基准)。等效电路是通过ZSimpwin软件来进行拟合。
2 结果与讨论 2.1 恒电压阳极氧化
2.1.1 电流-时间关系曲线 图 1为2198铝-锂合金阳极氧化电流-时间关系曲线。根据氧化电源的参数设置,氧化过程主要分为2个阶段:①氧化电压以3 V/min的速度上升至15 V;②在15 V的氧化电压下氧化30 min。电流-时间曲线符合阳极氧化膜生长的规律,从关系曲线可以看出在线性升压阶段电流也呈现线性增加趋势,主要是阻挡层的生长,阻挡层的厚度随着电压的升高而增加,电流升高至0.48 A时阻挡层的生长结束。随后电流下降并且逐渐趋于稳定,其稳定电流为0.37 A,说明多孔层氧化膜的生长趋于稳定阶段。
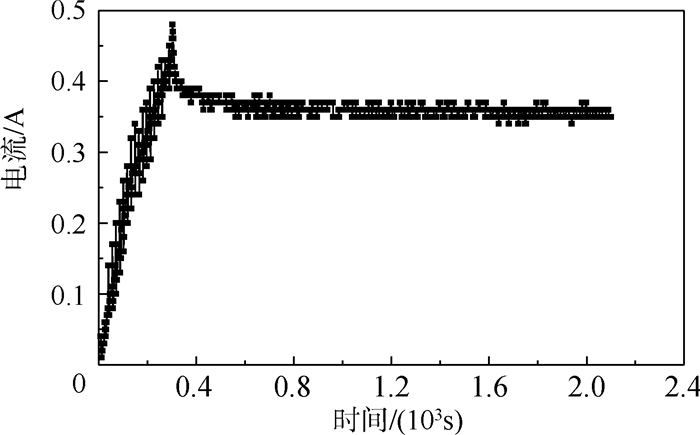 |
| 图 1 2198铝-锂合金阳极氧化电流-时间关系曲线 Fig. 1 Current -time relationship curve of 2198 aluminum-lithium alloy anodic oxidation |
| 图选项 |
2.1.2 氧化膜微观形貌 图 2为2198铝合金阳极氧化之后试样的FE-SEM显微照片。
 |
| 图 2 2198铝合金阳极氧化膜的FE-SEM显微照片 Fig. 2 fe-sem micrographs of anodic film of 2198 aluminum alloy |
| 图选项 |
图 2(a)为氧化膜未封闭时2198铝合金的FE-SEM显微照片,可以清楚地看到氧化膜多孔结构发生连通现象,这是因为含铜合金相会影响阳极氧化过程。含铜相主要包括θ(Al2Cu),T1(Al2CuLi),T2(Al6CuLi3),S(Al2CuMg),在阳极氧化开始的阶段,T1、T2和S相是作为阳极,在阳极氧化初始阶段会发生优先溶解,但是由于合金元素Li、Mg的含量并不高,随着反应的进行这2种合金元素逐渐被消耗掉,则Al-Cu相将会作为阴极,含Cu相的惰性比较高,发生氧化反应所需要的吉布斯自由能会高于铝发生氧化所需要的吉布斯自由能,不易发生氧化,同时合金中含铜相的分布是不均匀的,并且随着铝合金氧化的进行,会产生Cu的富集,当Cu原子的富集达到一定程度时,会发生氧化,并且进入氧化膜中。氧化的Cu会产生电子通道来连接氧化膜和基体合金。因此在氧化铜中通过向内移动O原子使O2-氧化成O2,随着氧化的进行会使O2得到富集,则内部的气压会升高,随着气泡的生长和气压相结合最终会导致氧化膜的破裂和O2的释放,因此造成了氧化膜中多孔结构产生连通现象[7, 11-12]。
图 2(b)为氧化膜封闭之后2198铝合金的表面形貌,封闭之后氧化膜的形貌发生了明显的变化,氧化膜呈“花瓣状”,覆盖在整个氧化膜的表面。这是因为在沸水封闭的过程中,多孔型的Al2O3和H2O发生反应[9],反应方程式为
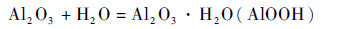 |
在封闭的过程中沸水很快渗透至微孔中,由于局部的pH值比较高,OH-与微孔中向外扩散的Al3+相遇,形成水合氢氧化铝沉淀,通过溶解-沉淀反应,从孔壁和孔洞开始发展直至阻塞整个微孔,使得形貌发生明显的变化[13]。封闭之后对氧化膜的厚度进行分析,从图 2(c)可以看出氧化膜的厚度为1.89 μm,和笔者团队[11]研究的5A06铝合金的硫酸-己二酸氧化膜厚度相比,比较小,这是因为含铜相的惰性比较高,在氧化的过程中发生氧化所需要的吉布斯自由能要高于铝氧化所需要的自由能,因此成膜效率比较低,氧化膜的厚度小。
采用原子力显微镜(AFM)对氧化膜的表面形貌进行观察,氧化膜(未封闭)的AFM照片如图 3所示。图 3(a)为3D图像,其取样范围是5 μm×5 μm,表面的平均粗糙度Ra=11.1 nm,表面均方根粗糙度Rq=14.2 nm,图 3(b)和图 3(c)对2D图像进行剖面分析,剖面分析可以看出氧化膜z轴方向最高点与最低点的落差大约是40 nm,可以和3D图像表面的纳米级长度的凸起进行对比,这是因为随着阳极氧化过程的进行必定伴随着氧化膜的局部溶解,这种溶解作用使得氧化膜的表面呈现高低不平的趋势,但总体上看氧化膜的总体平整性很好。
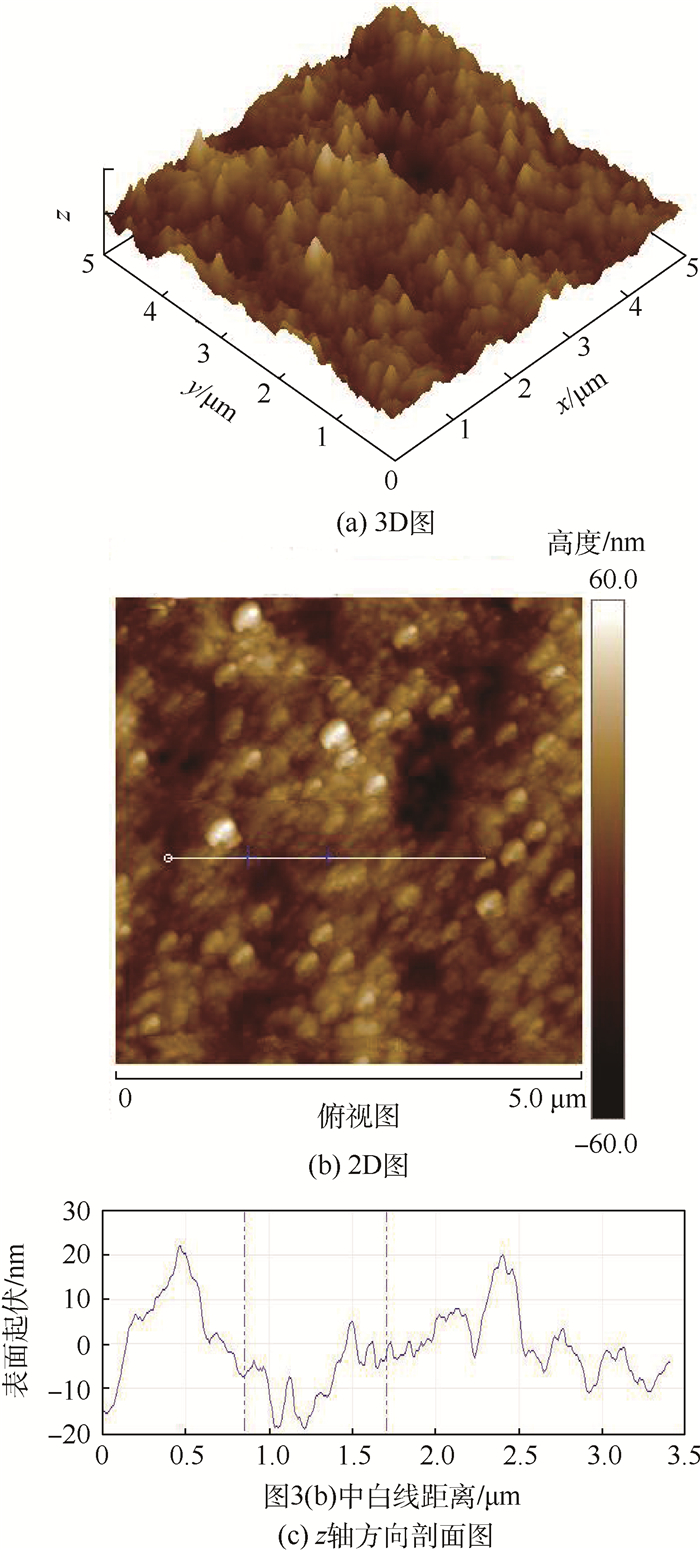 |
| 图 3 氧化膜(未封闭)的AFM照片 Fig. 3 AFM photographs of anodic film (unsealed) |
| 图选项 |
2.2 氧化膜的电化学分析
2.2.1 氧化膜动电位极化曲线 图 4为在质量分数为3.5%NaCl溶液中氧化膜(封闭和未封闭)的动电位极化曲线,封闭处理之后氧化膜的腐蚀电流明显降低。在极化时,未封闭试样的阳极极化电流密度I随电压的升高而急剧增加,封闭试样的阳极极化电流密度随电压的增加基本没有什么变化,极化电流越大说明腐蚀速度越快。因此封闭处理之后氧化膜的耐蚀性明显提高。
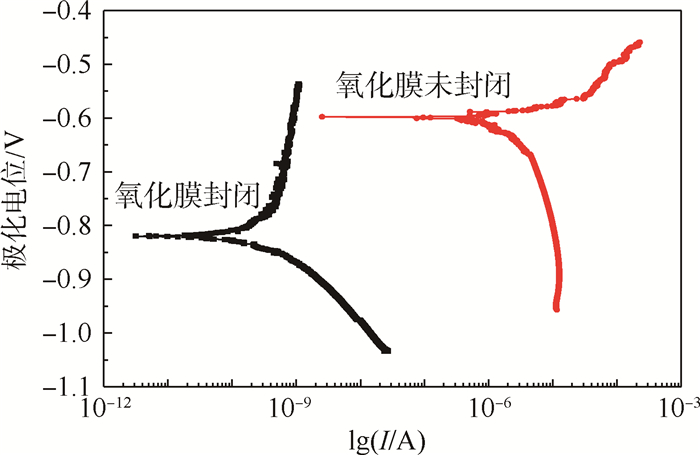 |
| 图 4 在质量分数为3.5%NaCl溶液中氧化膜(封闭和未封闭)的动电位极化曲线 Fig. 4 Potentiodynamic polarization curves of anodic films (sealed and unsealed) in NaCl solution with mass fraction of 3.5% |
| 图选项 |
2.2.2 电化学阻抗谱测试 氧化膜在NaCl体系中的交流阻抗谱图(EIS),如图 5所示。图 5(a)为2198铝合金阳极氧化之后未封闭和封闭试样的Nyquist图。模拟阳极氧化膜的响应使用最广泛的等效电路为Re(RpQp)(RbQb)其中:Re为溶液阻抗;Rp为多孔层阻抗;Qp为多孔层电容;Rb为阻挡层阻抗;Qb为阻挡层电容。电容使用常相位角元件(CPE)来进行表征,CPE的阻抗的定义为ZCPE=[Q(jω)n]-1,其中:Q为电容值;j为电流值;ω为频率;n为弥散效应的强度,当n=1时,CPE是纯电容;n=0时,CPE是纯电阻[14-15]。未封闭试样的Rb=2.06×105Ω,封闭之后Rb=1.76×108Ω,增加了近3个数量级,阻挡层的阻抗明显的增加说明耐蚀性明显的提高。封闭之后阻挡层的参数n的数值从0.871 3增加到0.935,说明封闭之后优化了阻挡层的性能[2]。图 5(a)中小图为高频部分的放大图像,可以清楚的看到封闭后试样的在Nyquist图的2个半弧,但是由于未封闭试样的多孔层的阻抗很小,因此多孔层的半弧不是很明显。从Bode图中可以看出阳极氧化之后的试样含有2个时间常数,对应着Nyquist图中的2个半弧。
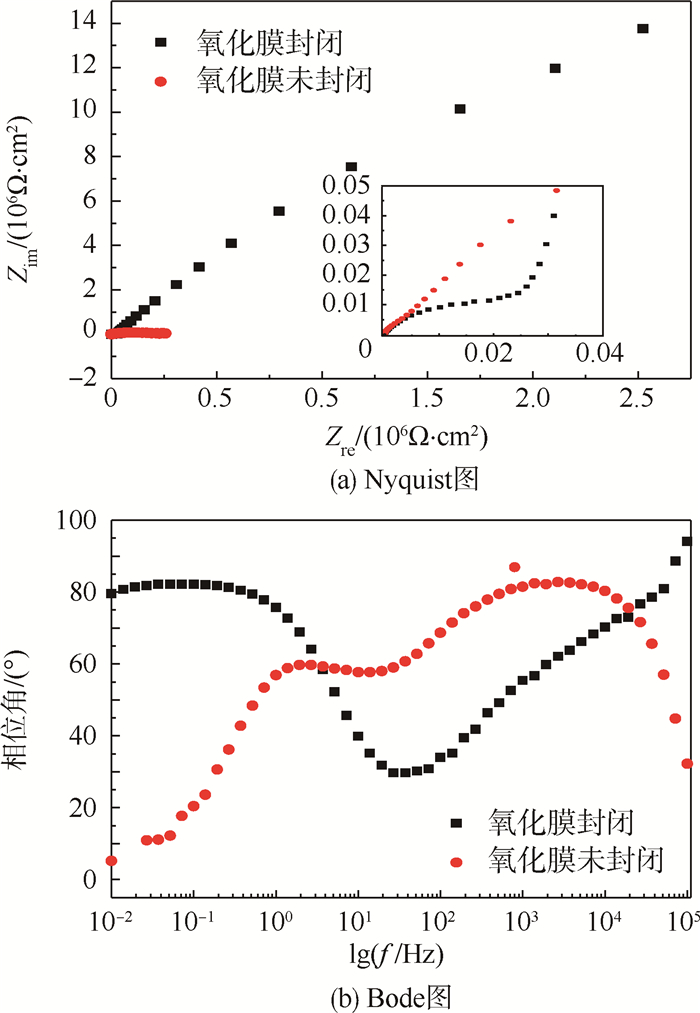 |
| Zim—阻抗虚部;Zre—阻抗实部;f—频率;Z—阻抗。 图 5 氧化膜在NaCl体系中的EIS Fig. 5 EIS of anodic film immersion in NaCl system |
| 图选项 |
2.3 未封闭氧化膜的电化学分析 图 6所示为未封闭氧化膜在质量分数为3.5%的NaCl溶液中浸泡1~12 h的Bode图。在NaCl中浸泡的未封闭氧化膜的EIS分析等效电路原理图,如图 7所示。模拟氧化膜响应使用的等效电路为Re(RpQp)(RbQb),如图 7(a)所示。浸泡1 h时,阻挡层的电阻就发生了明显的降低,拟合结果如表 2所示。Rb由2.06×105Ω降低至2.049×103Ω。这是因为未封闭氧化膜的表面是多孔型结构,在浸泡的开始阶段氧化膜直接暴露在电解质溶液中,多孔结构在浸泡的开始阶段就被电解质溶液填充,因此在最开始阶段浸泡过程已经完成。浸泡时间为8 h时阻挡层的阻抗值略有增加,这是因为在氧化膜的整个孔洞深度方向会发生自封闭过程,孔壁处的无水氧化铝的溶解,同时伴随着水合氧化铝的沉积使得孔洞变宽并且孔洞阻塞[16]。当浸泡时间达到12 h时,水溶液和腐蚀性离子Cl-到达基体导致基体腐蚀产生,等效电路发生改变,应使用拟合电路Re(QbRb(LR))进行拟合分析,如图 7(b)所示,其中R和L分别为电感阻抗和电感,对应氧化膜表面点蚀的发生,点蚀的萌生和发展意味着氧化膜的阻挡层遭到破坏。同时相位角值逐渐降低并且达到负值说明在浸泡的过程中有腐蚀产物形成,氧化膜遭到破坏[17]。
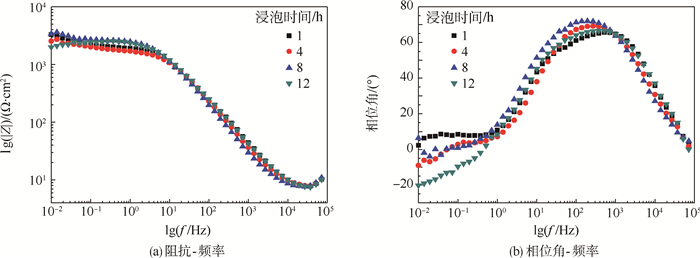 |
| 图 6 未封闭氧化膜在质量分数为3.5%的NaCl溶液中浸泡1~12 h的Bode图 Fig. 6 Bode plots of unsealed anodic film immersed in NaCl solution with mass fraction of 3.5%for 1-12 h |
| 图选项 |
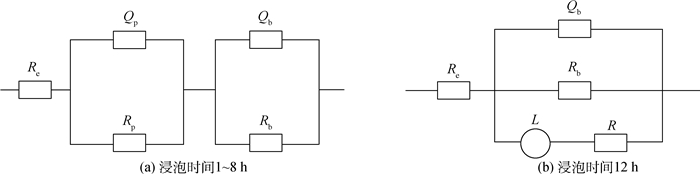 |
| 图 7 在NaCl溶液中浸泡的未封闭氧化膜的EIS分析等效电路原理图 Fig. 7 Schematic diagrams of EIS equivalent circuit of unsealed anodic film in NaCl solution |
| 图选项 |
表 2 未封闭样品Nyquist图拟合后结果 Table 2 Fitting results of unsealed sample Nyquist graph
| 浸泡时间/h | CPE(P) | Rp/(Ω·cm2) | CPE(B) | Rb/(kΩ·cm2) | L/(H·cm2) | R/(Ω·cm2) | ||
| Qp/(10-3F·cm-2) | n | Qb/(μF·cm-2) | n | |||||
| 1 | 3.949 | 0.8 | 1.05×103 | 22.51 | 0.8 | 2.049 | ||
| 4 | 2.270 | 1 | 5.027×102 | 17.29 | 0.85 | 1.767 | ||
| 8 | 6.983 | 0.958 4 | 4.60×102 | 14.99 | 0.858 3 | 2.705 | ||
| 12 | 20.49 | 0.8 | 2.532 | 5.32×104 | 191.8 | |||
表选项
2.4 封闭之后氧化膜的电化学分析 图 8为封闭之后的氧化膜在质量分数为3.5%的氯化钠溶液中的浸泡不同时间之后的Bode图。图 8(a)和图 8(b)为封闭处理的氧化膜在质量分数为3.5%的NaCl溶液中浸泡1~12 h后的Bode图,在浸泡的过程中氧化膜的结构会发生改变,因此用来模拟氧化膜响应的等效电路发生改变。在NaCl溶液中浸泡的封闭氧化膜的EIS分析等效电路原理图,如图 9所示。在最初浸泡时间内使用图 9(a)的等效电路Re(QPW(RPW(QpRp)(QbRb)))(其中:QPW为多孔层孔壁电容;RPW为多孔层孔壁阻抗)来进行拟合分析,可以得到3个时间常数。在低频处的时间常数是对应阻挡层的性能(QbRb),中频处的时间常数对应多孔层的性能(QpRp),而高频区域得到时间常数对应的是封闭之后由于体积膨胀而产生的孔壁和孔洞连接而形成的新的膜层的性能(QPWRPW),但是由于二者之间的连接性比较弱因此这一层很不稳定,Cl-仅需要很小的阻力就可以穿过这一膜层,因此在浸泡的过程中很容易遭到破坏。从图 8(a)可以看出在最开始的浸泡时间内阻抗发生了明显的降低,但在浸泡4 h之后阻抗值稳定说明腐蚀速度很小,这和Tafel曲线分析得到的封闭之后的氧化膜的腐蚀电流密度很小,腐蚀速度比较小是相对应的。当浸泡时间为12 h的时候RPW的数值降低到844 Ω,由此可知最外侧一层耐蚀性很差。因此当浸泡时间超过12 h时,由于在封闭的过程中产生的体积膨胀而出现的时间常数消失,则等效电路发生改变,使用等效电路Re(RpQp)(RbQb)(如图 9(b))来进行拟合分析。图 8(c)和图 8(d)是氧化膜浸泡超过48 h的Bode图,浸泡时间为48 h的时候,低频范围内的相位角增加,从拟合的结果来看,发现多孔层的阻抗增加到2.28×104Ω·cm2,这是浸泡的过程中有腐蚀产物产生使得氧化膜表面的缺陷减少因此阻抗增加,但是在浸泡时间超过72 h时,低频范围内的相位角发生明显的降低,说明在浸泡的过程中有电解质溶液通过多孔层浸入阻挡层,但由于腐蚀产物的产生将多孔层阻塞,因此使得电解质溶液残留在多孔层和阻挡层之间,使得参数n值发生下降,阻挡层的弥散效应比较强。
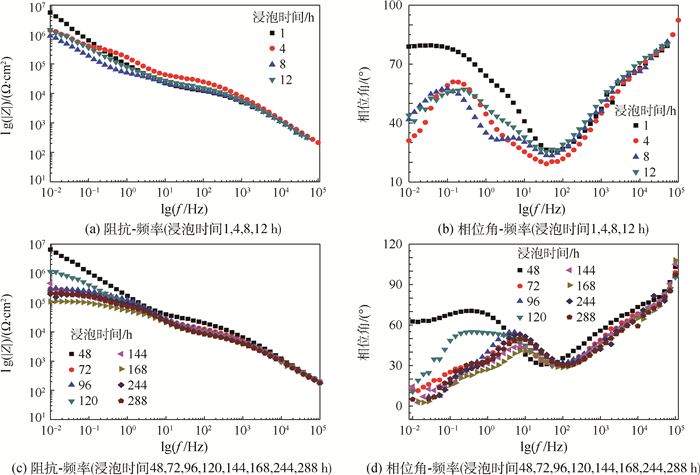 |
| 图 8 封闭之后的氧化膜在质量分数为3.5%的氯化钠溶液中的浸泡不同时间之后的Bode图 Fig. 8 Bode plotsof sealed anodic film in NaCl solutionwith mass fraction of 3.5%for different immersion time |
| 图选项 |
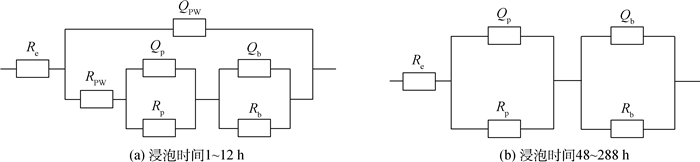 |
| 图 9 Cl溶液中浸泡的封闭氧化膜的EIS分析等效电路原理图 Fig. 9 Schematic diagrams of EIS equivalent circuit of sealed anodic film in NaCl solution |
| 图选项 |
表 3为封闭样品Nyquist图拟合后结果,包含等效电路拟合之后电化学阻抗谱的参数。从拟合的结果可以看出,当浸泡时间不超过12 h时,和多孔层QCPE相关的n的数值比较低,n值比较低可能和在封闭的过程中孔洞内的水合氧化铝相关[18]。随着浸泡时间的延长,多孔层的性能很稳定,这是因为在高频范围内的时间常数没有发生明显的变化。与之相反的是,从相位角图中可以看出低频范围内的阻挡层逐渐失去其电容特性,更多地展现出电阻特性,同时阻抗值会发产生轻微降低,表明试样遭到破坏。
表 3 封闭样品Nyquist图拟合后结果 Table 3 Fitting results of sealed sample Nyquist graph
| 浸泡 时间/h | CPE | RPW/ (Ω·cm2) | CPE | Rp/ (Ω·cm2) | CPE | Rb/ (Ω·cm2) | |||
| QPW/(μF·cm-2) | n | Qp/(μF·cm-2) | n | Qb/(μF·cm-2) | n | ||||
| 1 | 0.1050 | 0.813 | 1.08×104 | 8.76 | 0.528 | 2.54×105 | 2.57 | 0.981 | 3.67×107 |
| 4 | 0.074 7 | 0.829 | 3.23×104 | 1.19 | 0.854 | 2.93×105 | 7.04 | 0.800 | 1.11×106 |
| 8 | 0.097 2 | 0.823 | 1.11×104 | 5.20 | 0.577 | 3.98×104 | 8.98 | 0.872 | 1.35×106 |
| 12 | 0.011 0 | 0.988 | 8.44×102 | 7.15 | 0.576 | 1.91×104 | 3.86 | 0.704 | 3.34×106 |
| 48 | 0.121 | 0.805 8 | 2.28×104 | 1.35 | 0.820 | 2.31×107 | |||
| 72 | 0.121 | 0.8231 | 8.19×103 | 2.80 | 0.654 | 2.96×105 | |||
| 96 | 0.155 | 0.798 9 | 8.39×103 | 1.69 | 0.783 | 2.81×105 | |||
| 120 | 0.166 | 0.8 | 8.20×103 | 2.82 | 0.800 | 1.24×106 | |||
| 144 | 0.111 | 0.848 9 | 6.18×103 | 4.04 | 0.605 | 2.92×105 | |||
| 168 | 0.137 | 0.823 | 5.50×103 | 3.81 | 0.647 | 1.07×105 | |||
| 240 | 0.150 | 0.8 | 5.8×103 | 2.12 | 0.738 | 1.91×105 | |||
| 288 | 0.128 | 0.828 6 | 4.92×103 | 3.11 | 6.67 | 2.05×105 | |||
表选项
图 10所示为浸泡过程中(48~288 h)多孔层和阻挡层的阻抗和电容随浸泡时间的变化。图 10(a)中,Rb的数值比Rp的数值高出接近2个数量级,表明阳极氧化之后铝合金的耐蚀性主要是由阻挡层提供的。从图 10(a)和图 10(b)可以看出在浸泡时间超过48 h之后,和多孔层相关的参数(Rp和Qp)基本没有发生变化。但是浸泡过程是始终伴随着电解质溶液的侵入,多孔层保持稳定说明在浸泡的开始阶段电解质溶液对多孔层的侵入已经完成,这样的结果可能与多孔层的疏松结构有关[19]。同时阻挡层的电阻在浸泡时间超过48 h之后开始下降,说明有点蚀开始萌生,在120 h时阻抗增大,可能是在腐蚀的过程中的腐蚀产物将阻挡层的缺陷阻塞,使得电阻增加,随着浸泡时间延长阻抗继续下降表明腐蚀在持续进行。
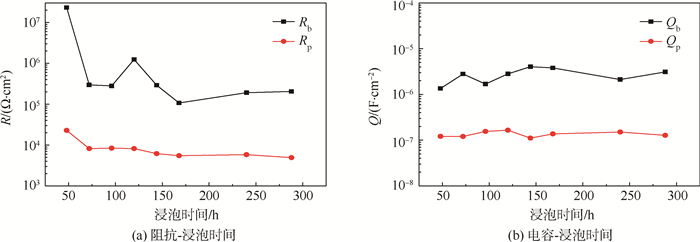 |
| 图 10 浸泡过程中(48~288 h)多孔层和阻挡层的阻抗和电容随浸泡时间的变化 Fig. 10 Evolution of impedance and capacitance of porous layer and barrier layer with immersiom time during immersion (48-288 h) |
| 图选项 |
3 结论 1) 氧化膜的表面微观形貌表明氧化膜的膜层孔洞不完整,出现连通现象,说明2198 Al-Li合金中的合金相影响氧化膜的形成,特别是含Cu合金相的氧化促进了氧气的形成,氧化膜发生破裂,使得氧化膜的孔洞发生连通。
2) 阳极氧化形成的多孔层结构很容易受到电解质溶液的侵入,阻挡层在防护过程中发挥主导作用。封闭处理很大程度上提高了氧化膜的耐蚀性,同时也优化了阻挡层的性能。
3) 氧化膜的电化学阻抗谱测试表明,氧化膜的孔壁和多孔层结构容易受到电解质溶液的入侵。在浸泡的过程中氧化膜的性能发生了变化,在浸泡腐蚀开始阶段封闭处理的保护作用不是特别明显,但是随着浸泡时间的延长,阻抗值基本稳定,说明氧化膜的耐蚀性很好,在浸泡时间达到288 h的时候试样仍未被腐蚀。
参考文献
| [1] | GARCIA-HERAS M, JIMENEZ-MORALES A, CASAL B, et al. Preparation and electrochemical study of cerium-silica sol-gel thin films[J]. Journal of Alloys and Compounds,2004, 380(1-2): 219–224. |
| Click to display the text | |
| [2] | CAPELOSSI V R, POELMAN M, RECLOUX I, et al. Corrosion protection of clad 2024 aluminum alloys anodized in tartaric-sulfuric acid bath and protected with hybrid sol-gel coating[J]. Elctrochimica Acta,2014, 124: 69–79. |
| Click to display the text | |
| [3] | MOUTARLIER V, GIGANDER M P, PAGETTI J, et al. An electrochemical approach to the anodic oxidation of Al 2024 alloy in sulfuric acid containing inhibitors[J]. Surface and Coatings Technology,2002, 161(2-3): 267–274. |
| Click to display the text | |
| [4] | ZUO Y, ZHAO P H, ZHAO J M. The influences of sealing methods on corrosion behavior of anodized aluminum alloys in NaCl solutions[J]. Surface and Coatings Technology,2003, 166(2-3): 237–242. |
| Click to display the text | |
| [5] | HUANG Y L, HONG S, HUANG H H, et al. Evaluation of the corrosion resistance of anodized aluminum 6061 using electrochemical impedance spectroscopy(EIS)[J]. Corrosion Science,2008, 50(12): 3569–3575. |
| Click to display the text | |
| [6] | SAEEDIKHANI M, JAVIDI M, YAZDANI A. Anodizing of 2024-T3 aluminum alloy in sulfuric-boric-phosphoric acids and its corrosion behavior[J]. Transactions of Nonferrous Metals Society of China,2013, 23: 2551–2559. |
| Click to display the text | |
| [7] | MA Y, ZHOU X, THOMPSON G E, et al. Anodic film growth on Al-Li-Cu alloy AA2099-T8[J]. Electrochimica Acta,2012, 80: 148–159. |
| Click to display the text | |
| [8] | 于美, 陈高红, 刘建华, 等. LY12CZ铝合金的己二酸硫酸阳极氧化[J]. 北京航空航天大学学报,2012, 38(3): 363–367.YU M, CHEN G H, LIU J H, et al. Adipic-sulfuric acid anodizing for LY12CZ aluminum alloy[J]. Journal of Beijing University of Aeronautics and Astronautics,2012, 38(3): 363–367.(in Chinese). |
| Cited By in Cnki (0) | Click to display the text | |
| [9] | 李英东.铝合金阳极氧化成膜控制机理及后处理工艺研究[D].北京:北京航空航天大学,2015:49-65. LI Y D.Study of the mechanism of anodizing process of aluminum alloy and post-treatment procedure[D].Beijng:Beihang University,2015:49-65.(in Chinese). |
| Cited By in Cnki (0) | Click to display the text | |
| [10] | LI S M, LI Y D, ZHANG Y, et al. Effect of intermetallic phases on the anodic oxidation and corrosion of 5A06 aluminum alloy[J]. International Journal of Minerals,Metallurgy and Materials,2015(22): 167–174. |
| Click to display the text | |
| [11] | 刘建华, 高庆娜, 李英东, 等. 5A05和2A12铝合金在硫酸-己二酸中阳极氧化行为及膜层电化学性能研究[J]. 北京航空航天大学学报,2015, 41(5): 757–763.LIU J H, GAO Q N, LI Y D, et al. Oxidation behavior of aluminum alloy 5A06 and 2A12 in sulfuric-adipic acid and eletrocheical property of anodic oxide[J]. Journal of Beijing University of Aeronautics and Astronautics,2015, 41(5): 757–763.(in Chinese). |
| Cited By in Cnki (0) | Click to display the text | |
| [12] | MA Y, ZHOU X, THOMPSON G E, et al. Anodic film formation on AA 2099-T8 aluminum alloy in tartaric-sulfuric acid[J]. Journal of the Electrochemical Society,2011, 158(2). |
| Click to display the text | |
| [13] | 马宗耀, 谢发勤. 铝-锂合金阳极氧化及膜层性能的研究[J]. 电镀与环保,2008, 26(6): 31–34.MA Z Y, XIE F Q. Study of anodizing Al-Li alloy and properties of anodization film[J]. Electrolating & Pollution Control,2008, 26(6): 31–34.(in Chinese). |
| Cited By in Cnki (0) | Click to display the text | |
| [14] | OCóN P, CURIONI M, THOMPSON G E, et al. Degradation of the corrosion resistance of anodic oxide films through immersion in the anodising electrolyte[J]. Corrosion Science,2010, 52(7): 2219–2227. |
| Click to display the text | |
| [15] | BENFEDDA B, HAMADOU L, BENBRAHIM N, et al. Electrochemical impedance investigation of anodic alumina barrier layer[J]. Journal of the Electrochemical Society,2012, 159(8). |
| Click to display the text | |
| [16] | GONZALEZ J A, LOPEZ V, OTERO E, et al. Postsealing changes in porous aluminum oxide films obtained in sulfuric acid solutions[J]. Journal of Electrochemical Society,2000, 147(3): 984–990. |
| Click to display the text | |
| [17] | CHEN J, SONG Y W, SHAND Y, et al. Study of the corrosion mechanism of the in situ grown Mg-Al-CO2-3 hydrotalcite film on AZ31 alloy[J]. Corrosion Science,2012, 65: 268–277. |
| Click to display the text | |
| [18] | BOISIER G, LAMURE A, PéBèRE N, et al. Corrosion protection of AA2024 sealed anodic layers using the hydrophobic properties of carboxylic acids[J]. Surface & Coatings Technology,2009, 203(22): 3420–3426. |
| Click to display the text | |
| [19] | LI S M, LI Y D, ZHANG Y, et al. Effect of intermetallic phases on the anodic oxidation and corrosion of 5A06 aluminum alloy[J]. International Journal of Minerals,Metallurgy and Materials,2015, 22(2): 167. |
| Click to display the text | |
