
 , 张怡青2,4, 王继创2, 卢瑶2, 李果3, 李永伟1, 李玉林2, 张恒5, 王晓军5
, 张怡青2,4, 王继创2, 卢瑶2, 李果3, 李永伟1, 李玉林2, 张恒5, 王晓军5 1. 河南中医药大学第二临床医学院, 河南 郑州 450000;
2. 河南省生物工程技术研究中心, 河南 郑州 450000;
3. 南阳农业职业学院, 河南 南阳 473000;
4. 郑州职业技术学院, 河南 郑州 450010;
5. 河南省职工医院, 河南 郑州 450002
收稿日期:2021-02-05;接收日期:2021-05-28;网络出版时间:2021-06-28
基金项目:郑州市新型冠状病毒防控应急科研攻关项目(No. 2020YJGG0007) 资助
摘要:表达纯化新型冠状病毒核衣壳(N) 蛋白不同片段,建立新冠病毒总抗体荧光免疫层析方法并评价不同蛋白片段对该方法的影响。利用生物信息学技术对N蛋白序列进行分析、合成及原核表达、纯化,制备不同N蛋白片段;采用1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC) 法荧光微球偶联抗原建立夹心荧光层析抗体检测方法,并分别进行性能评价。在制备的4个N蛋白片段中优选出全长N蛋白(N419) 包被,N412加入0.5 mol/L NaCl进行标记作为最优组合;删掉N抗原N端第91–120位氨基酸(N412) 可减少87.5%的非特异性干扰;线性范围为0.312–80 U/L,最低检出限为0.165 U/L,准确度在95%以上。优选配对N蛋白片段建立的新冠病毒总抗体荧光免疫层析检测方法,与广州万孚试纸条对比总符合率为98%,有望用于新型冠状病毒的辅助检测,同时为新冠抗体检测试剂性能的提升提供实验依据和借鉴。
关键词:新型冠状病毒抗体检测核衣壳蛋白荧光免疫层析
Preparation of different fragments of SARS-CoV-2 N protein and its application in fluorescence chromatography
Dengzhou Li1, Yunlong Wang2,4

 , Yiqing Zhang2,4, Jichuang Wang2, Yao Lu2, Guo Li3, Yongwei Li1, Yulin Li2, Heng Zhang5, Xiaojun Wang5
, Yiqing Zhang2,4, Jichuang Wang2, Yao Lu2, Guo Li3, Yongwei Li1, Yulin Li2, Heng Zhang5, Xiaojun Wang5 1. Second Clinical Medical College, Henan University of Traditional Chinese Medicine, Zhengzhou 450000, Henan, China;
2. Henan Bioengineering Technology Research Center, Zhengzhou 450000, Henan, China;
3. Nanyang Agricultural Vocational College, Nanyang 473000, Henan, China;
4. Zhengzhou Technical College, Zhengzhou 450010, Henan, China;
5. Henan Provincial Staff Hospital, Zhengzhou 450002, Henan, China
Received: February 5, 2021; Accepted: May 28, 2021; Published: June 28, 2021
Supported by: SARS-CoV-2 Prevention and Control Emergency Scientific Research Project of Zhengzhou, China (No. 2020YJGG0007)
Corresponding author: Yunlong Wang. Tel/Fax: +86-371-67999618; E-mail: biowyl@126.com.
Abstract: Different fragments of SARS-CoV-2 nucleocapsid (N) protein were expressed and purified, and a fluorescence immunochromatography method for detection of SARS-CoV-2 total antibody was established. The effect of different protein fragments on the performance of the method was evaluated. The N protein sequence was analyzed by bioinformatics technology, expressed in prokaryotic cell and purified by metal ion affinity chromatography column. Different N protein fragments were prepared for comparison. EDC reaction was used to label fluorescence microsphere on the synthesized antigen to construct sandwich fluorescence chromatography antibody detection assay, and the performance was systemically evaluated. Among the 4 prepared N protein fragments, the full-length N protein (N419) was selected as the optimized coating antigen, N412 with 0.5 mol/L NaCl was used as the optimal combination; deleting 91–120 amino acids from the N-terminal of N412 reduced non-specific signal by 87.5%. the linear range of detection was 0.312–80 U/L, the limit of detection was 0.165 U/L, and the accuracy was more than 95%. A fluorescence immunochromatographic detection method for analysis of SARS-CoV-2 total antibody was established by pairing N protein fragments. The detection result achieved 98% concordance with the commercially available Guangzhou Wanfu test strip, which is expected to be used as a supplementary approach for detection of SARS-CoV-2. The assay could also provide experimental reference for improving the performance of COVID-19 antibody detection reagents.
Keywords: SARS-CoV-2antibody detectionnucleocapsid proteinfluorescence immunechromatography
自2020年初,新冠疫情在全球蔓延,至今仍在流行。据统计,新型冠状病毒(SARS-CoV-2) 肺炎病死率为2.3%[1],传染性较SARS-CoV高,波及范围较MERS-CoV和SARS-CoV广[2]。抗体检测有助于了解地区人口免疫的整体平均水平和地区人体免疫基数,特别是作为特定人群初筛和辅助诊断的重要手段及流行病学调查工具,临床意义重大。
目前新冠病毒抗体检测主要采用化学发光法及胶体金法,据相关研究结果,抗体检测试剂性能仍亟待提升[3-4]。检测试剂性能的提升有赖于检测方法和检测靶标的改进。从方法学上,较多文献报道总抗体检测要比IgG、IgM单检的灵敏度、检出率更高,更加适合初筛[5-6]。在靶标蛋白方面,有研究显示N蛋白的IgG抗体与S蛋白的抗体同时或更早被检测到[7],发病两周后N蛋白的诊断性能更好,对抗体检测的敏感性更高[8-9],是血清学诊断的优势靶蛋白之一[10-11]。但N蛋白在多种冠状病毒中较为保守,易出现假阳性[12]。如何对N蛋白的各抗原决定簇进行取舍,以提升检测灵敏度和特异性,是检测试剂研究亟待解决的关键技术问题之一。此外,SARS-CoV-2的主要抗原与抗体检测关系尚未阐明,限制了其在血清学检测中的应用。
本研究在靶蛋白上通过对不同冠状病毒N蛋白比对分析,优选多种N蛋白片段组合并进行原核表达;在方法学上采用比胶体金更灵敏、更易定量检测的时间分辨荧光层析法建立新冠病毒总抗体检测方法;并对比不同N蛋白片段组合对灵敏度和特异性的影响,为新冠抗体检测试剂性能的提升提供实验依据和借鉴。
1 材料与方法1.1 实验材料、试剂1.1.1 试剂及样本昆明鼠IgG和羊抗鼠IgG抗体购自武汉华美公司。牛血清白蛋白(BSA)、PVP30、PEG20000、荧光微球、玻璃纤维、PVC底板和硝酸纤维素膜(Nitrocellulose membrane,NC膜) 由河南省生物工程技术研究中心提供。新冠患者的灭活COVID-19抗体检测阳性和阴性血清样本由郑州市疾病预防控制中心提供并检测。2018年临床血清由河南中医药大学第二附属医院提供。
1.1.2 室内参比品P1:兔抗N蛋白多抗16 U/mL (河南省生物工程技术研究中心提供,双扩散效价为1︰16,按琼扩血清稀释度测定其含量确定为16 U/mL,HNBC室内质控单位)。阴性质控品N1为健康人基质血清(河南中医药大学第二附属医院提供)。
1.2 实验方法1.2.1 N蛋白抗原决定簇分析及制备依据GenBank中SARS-CoV-2、SARS-CoV、MERS-CoV、HCoV-229E、HCoV-HKU1、HCoV- NL63、HCoV-OC43的N蛋白(Nucleocapsid protein) 序列,通过Clustal Omega软件进行蛋白质序列比对,用IEDB软件在线分析SARS-CoV-2 N蛋白的B细胞表位,确定各蛋白序列及优势表位保守性之间的对应关系。
根据N蛋白保守性分析结果,对SARS-CoV-2的N蛋白进行删减和拼接,形成不同的片段组合,由生工生物工程(上海) 股份有限公司合成并分别连接到pET-28a载体。将上述连接有目的片段的质粒转入大肠杆菌Escherichia coli BL21 (DE3) 中,在含30 μg/mL卡那霉素的LB液体培养液中,37 ℃振荡培养6 h至OD值达0.8–1.0之间,加入终浓度为0.2 mmol/L的异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactopyranoside,IPTG),25 ℃过夜诱导20 h,离心沉淀收集菌体,按每100 mL菌液加4 mL PBS悬起,冰浴超声破碎完全后,高速冷冻离心,收集上清经0.45 μm滤膜过滤后,用金属离子亲和层析柱纯化,用含100 mmol/L咪唑的PBS洗脱杂蛋白,含300 mmol/L咪唑的PBS洗脱得到目的蛋白。
1.2.2 荧光微球标记物制备采用EDC (碳二亚胺) 还原法将抗原和荧光微球偶联[13]。将荧光微球混匀,取(1%固含量) 200 nm荧光微球10 μL加入到装有1 000 μL纯化水的1.5 mL离心管中,混匀,15 000 r/min离心15 min,弃上清。重复清洗1次。将清洗过的荧光微球用20 mmol/L 2-吗啉乙磺酸(2-(N-Morpholino) ethanesulfonic acid,MES) 缓冲液(pH 7.0) 恢复到1 mL,加入EDC溶液50 μL,振荡混匀,再加入N-羟基丁二酰亚胺(N-Hydroxy succinimide,NHS)溶液50 μL,振荡混匀后避光室温活化1 h。将活化完成的荧光微球在15 000 r/min条件下离心15 min,弃上清,沉淀用上述MES缓冲液恢复到500 μL加入待标记抗原(N419、N422、N299、N192) 50 μg和昆明鼠IgG 10 μg振荡混匀,避光条件下室温反应2 h。偶联完成的荧光微球,在15 000 r/min条件下离心15 min,弃上清加封闭液封闭2 h,离心后用荧光标记物保存液500 μL将沉淀悬起,超声使分散均匀后存放4 ℃备用。
1.2.3 试纸条的组装及检测用划膜仪将包被抗原(N蛋白全长,N419) (1.5 mg/mL) 和羊抗鼠IgG (1 mg/mL) 包被于NC膜上分别作为检测线(T线) 和质控线(C线),置于37 ℃烘箱中过夜干燥。将微球标记的标记抗原喷于释放垫上,喷球浓度为3.0 μL/cm,置于37 ℃烘箱中干燥2 h。然后,将样品垫、释放垫、吸水垫依次粘在已包被抗原的PVC底板上,并用切条机切成3.95 mm宽度的试纸条[14]。
取10 μL血清标本加入到80 μL样品稀释液中,充分混匀后取80 μL加入到检测卡加样孔,反应15 min后,插入干式荧光免疫分析仪上读取检测结果。
1.2.4 4种组合检测的灵敏度及特异性根据《2019新型冠状病毒抗原/抗体检测试剂注册技术审评要点(试行)》[15]用室内参比品P1从1︰5倍比稀释一系列浓度,取T值大于且最接近500的样本,取该对应稀释倍数的样品连续检测20次,满足19次及以上T值大于500时,将该样本的T/C值定为最低检测限;同时,取N1检测20次,T值均应小于500。
采用郑州市疾病预防控制中心病程明确、核酸确诊的30例临床血清样本作为阳性样本,其中发病第3、5天标本各3例,发病7 d标本4例;8–14 d标本10例;15–30 d标本10例。采用河南中医药大学第二附属医院2018年收集的临床发热病人标本157份及健康体检血清43份作为阴性样本进行了性能评估。上述血清使用前均经过56 ℃灭活,阳性标本检测均由郑州市CDC实验室代为检测。
1.2.5 性能评估(1) 线性:选择最佳抗原配对组合制备试纸条,并采用P1梯度从1︰5倍比稀释进行加样检测,每个浓度重复检测5次,取5次重复检测的平均值与由P1室内参比品稀释而来的对应线性参考品浓度进行曲线绘制,得出线性检测范围以及标准曲线方程。
(2) 精密性:本研究采用由P1室内参比品稀释而来的40 U/L样本,梯度倍比稀释成高(20 U/L)、中(5 U/L)、低(1.25 U/L) 3个浓度的参考品进行加样检测,每个浓度平行检测10个试纸条,根据每组数据计算平均值及标准差,得出变异系数(Coefficient of variation,CV),对试纸条进行精密性分析及评价。
(3) 最低检出限:取阴性参考品对试纸条进行20次重复加样检测,根据荧光层析仪测得T值的信号强度进行平均值(x) 及标准差(s)的计算,将阴性参考品与邻近的线性参考品两点通过浓度与T值信号强度拟合一元线性方程,将上述(x+2s)回代到方程中得出最低检出限。
(4) 准确度:本研究使用健康人基质血清对P1进行不同比例的稀释,取10 μL稀释标本加入到80 μL样品稀释液中,充分混匀后取80 μL加入到检测卡加样孔,分别重复加样检测20次,通过荧光层析仪检测的荧光值计算平均值,代入到标准曲线中得出3种样本所对应的浓度,根据回收率=(实测浓度/真实浓度)×100%计算试纸条的准确度。
(5) 分析特异性:采用高胆红素血清样本、肺炎支原体抗体阳性血清样本、流感病毒抗体阳性血清样本进行交叉反应试验,在40 U/L的室内参比品中加入等体积的上述3种标本,重复检测3次。
(6) 稳定性:分别于加速0、7、14、21 d随机取一组置于37 ℃加速破坏的试纸条,使用蛋白浓度为10 U/L的样本进行检测,每组重复检测10次,根据加速破坏期间T值、C值、T/C值变化,绘制荧光值-加速时间曲线,分析试纸条的稳定性。
1.3 方法学对比及临床评价本实验病例标本总数177例,均为密切接触及疑似病例样本(后经郑州市CDC确认阳性46例,阴性131例),阴性对照样本均值(xN1)+2s为临界值(cut-off值),对照试剂采用万孚生物的新冠抗体检测试剂。
2 结果与分析2.1 抗原决定簇分析及制备经Clustal Omega软件比对发现N蛋白的N末端RNA结合结构域(NTD) 保守性较强,与SARS-CoV、MERS-CoV同源性较高(图 1),该区域中第104–119位氨基酸(LSPRWYFYYLGTGPEA) 在现有7种可感染人的冠状病毒中高度保守,且经Kolaskar & Tongaonkar Antigenicity Results分析显示该区域有较强的抗原性,作为诊断抗原理论上易产生非特异性反应,因此删除第101–120位的氨基酸(MKDLSPRWYFYYLGTGPEAG)。
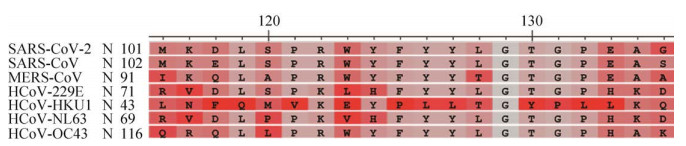 |
| 图 1 SARS-CoV-2 N蛋白(101–120氨基酸) 序列对比 Fig. 1 Alignment of SARS-CoV-2 N protein sequences (101–120 aa). |
| 图选项 |
根据NCBI上N蛋白基因全长序列(GenBank登录号:QOS44897.1),通过密码子优化,构建以下序列:N全长标记为N419,将第91–120位氨基酸替换为SGSSGSGSGGSGSGGGGSGSGGS标记为N412;删除N端120个氨基酸标记为N299。将MKD LSPRWYFYYLGTGPEAG通过SGSSGSGS GGSGSGGGGSGSGGS臂连接做成5个拷贝的重复序列,标记为N192 (图 2)。由生工生物工程(上海)股份有限公司合成,并连入载体pET-28a中,分别命名为pET-28a/N419、pET-28a/N412、pET-28a/ N299、pET-28a/N192。将各含有目的基因的表达载体转入大肠杆菌中,在本实验室已建立的稳定原核表达体系下完成蛋白表达,收菌后破碎,利用镍柱亲和层析纯化,100 mmol/L咪唑除去杂蛋白,目的蛋白在300 mmol/L咪唑时被洗脱,经SDS-PAGE分析结果显示,纯化后杂带得到有效去除,目的蛋白纯度达90% (图 3),将纯化后的蛋白进行Western blotting鉴定,100 V转膜1.5 h,转膜后的PVDF膜经5%脱脂奶粉于室温封闭2 h,用抗-6×His标签抗体以1︰1 000浓度反应2 h,用含吐温-20的磷酸盐缓冲液(Phosphate buffered solution,PBS)洗涤5次后,4种蛋白经显色鉴定均出现单一条带,蛋白大小吻合,且与抗-6×His标签抗体发生特异性反应,条带明显,结果见图 4。
 |
| 图 2 N蛋白片段序列的构建 Fig. 2 Schematic diagram showing the construction of N protein fragment. |
| 图选项 |
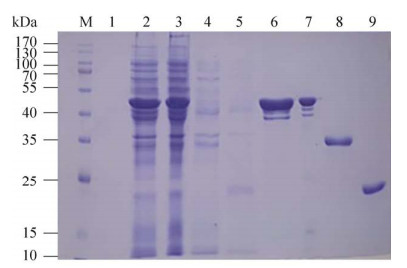 |
| 图 3 N419、N412、N299、N192蛋白的SDS-PAGE分析 Fig. 3 SDS-PAGE analysis of expressed and purified proteins. M: protein molecular weight standard; 1: blank; 2–5: N419, N412, N299, N192 after induction; 6–9: N419, N412, N299, N192 after purification. |
| 图选项 |
 |
| 图 4 N419、N412、N299、N192蛋白的Western blotting分析鉴定 Fig. 4 Western blotting analysis of N419, N412, N299 and N192 proteins. M: protein molecular weight standard. (A) 1–2: N419, N412. (B) 1–2: N192, N299. |
| 图选项 |
2.2 荧光微球标记物制备将上述4种抗原与荧光微球进行偶联用作标记抗原用于抗体检测,偶联后结果见图 5,可以看出偶联过程中加入0.5 mol/L NaCl能够有效防止聚集,有利于荧光微球-抗原标记物的稳定。
 |
| 图 5 蛋白偶联结果 Fig. 5 Protein coupling result. 1: the unlabeled antigen was used as the basic group; 2: the routinely labeled mouse IgG was used as the control; 3–6: 0.5 mol/L NaCl was added to the labeling process of N419, N412, N299 and N192; 7–10: N419, N412, N299 and N192 are labeled by conventional programs. |
| 图选项 |
2.3 检测卡制备4种组合检测结果见表 1和表 2,从中可以看出N419包被、N412标记组合的灵敏度最高,将P1稀释至25 600倍时仍可检测出阳性,同时其特异性最优。
表 1 4种组合灵敏度检测结果Table 1 Sensitivity test results of four combinations
| Pairing | N1 (T/C) | Sensitivity | ||
| Coating antigen | Labelled antigen | Dilution multiple | T/C | |
| N419 | N419 | 185/17 700 | P1/25 600 | 695/17 520 |
| N419 | N412 | 147/18 240 | P1/25 600 | 598/18 110 |
| N419 | N299 | 193/17 915 | P1/12 800 | 741/17 685 |
| N419 | N192 | 112/18 561 | P1/800 | 729/18 375 |
表选项
表 2 4种组合特异性检测结果Table 2 Detection results of specificity of four combinations
| Coating antigen | Labelled antigen | Sample | |||
| 3–7 days after onset | 8–14 days after onset | 15–30 days after onset | Negative | ||
| N419 | N419 | 8/10 | 10/10 | 10/10 | 184/200 |
| N419 | N412 | 8/10 | 10/10 | 10/10 | 198/200 |
| N419 | N299 | 6/10 | 10/10 | 10/10 | 200/200 |
| N419 | N192 | 5/10 | 9/10 | 10/10 | 200/200 |
表选项
2.4 线性以兔抗N蛋白多抗活力单位为横坐标并以T/C值数据为纵坐标作图,结果如图 6所示,其在0.312–80 U/L线性范围较好,y=0.047 54x+ 0.072 28,R2=0.991 8。
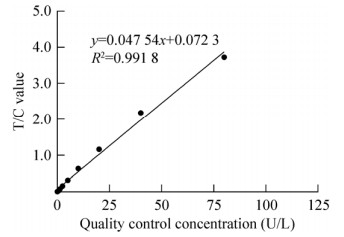 |
| 图 6 试纸条标准曲线的建立 Fig. 6 Standard curve of the test strip. |
| 图选项 |
2.5 精密性精密性检测结果见表 3,不同浓度样本下试纸条的CV在4.28%–7.74%之间,符合要求。
表 3 试纸条精密性检测结果Table 3 Precision test of the test strip
| Reference rabbit polyclonal antibody concentration (U/L) | The average (U/L) | The standard deviation | CV (%) |
| 1.250 | 1.240 | 0.096 | 7.74 |
| 5.000 | 4.864 | 0.208 | 4.28 |
| 20.000 | 20.064 | 0.873 | 4.35 |
表选项
2.6 最低检出限计算20次检测结果T值的x为155.650,SD为39.552,将x+2SD代入到阴性参考品和相邻浓度线性参考品两点进行拟合得出的线性方程(y=477.56x+156)中,求得最低检出限为0.165 U/L。
2.7 准确度准确度检测结果见表 4,分别检测兔多抗浓度为1.25、5.00、20.00 U/L的样本,其回收率分别为108.16%、95.52%、96.24%,符合回收率85%–115%的要求。
表 4 试纸条准确度检测结果Table 4 Accuracy test of the test strip
| Sample | 1:12 800 | 1:3 200 | 1:800 |
| The real content (U/L) | 1.25 | 5.00 | 20.00 |
| The determination of content (U/L) | 1.352±0.168 | 4.776±0.288 | 19.248±0.504 |
| Recovery rate (%) | 108.16 | 95.52 | 96.24 |
表选项
2.8 分析特异性收集临床标本,样本中添加等体积的高胆红素血清样本、肺炎支原体抗体阳性血清样本、流感病毒抗体阳性血清样本3种干扰物质,测得混合后样本中SARS-CoV-2抗体含量在(20±2) U/L,试纸条特异性较好。
2.9 稳定性稳定性结果见图 7,37 ℃加速21 d后,T值、C值以及T/C值的变化均在15%以内,试纸条稳定性良好。
 |
| 图 7 试纸条稳定性检测结果 Fig. 7 Stability test of the test strip. |
| 图选项 |
2.10 方法学对比及临床评价方法学对比检测结果见表 5,两种试纸条的阴性符合率为98%,阳性符合率为98%,总符合率为98%,说明其一致性较好。
表 5 考核试剂结果与临床参考标准一致性Table 5 The concordance of the reagent with the clinical reference standard
| Developed test strip | Guangzhou Wanfu test strip | Total | |
| Positive (+) | Negative (–) | ||
| Positive (+) | 43 | 2 | 45 |
| Negative (–) | 1 | 131 | 132 |
| Total | 44 | 133 | 177 |
表选项
综合之前4种组合检测的灵敏度及特异性中的N419、N412组合检测的结果,该方法临床病例检测敏感度为96.1%,特异度为99.4%。
3 讨论SARS-CoV-2特异性抗体通常在症状发作后一周能够检测到[16],可作为核酸检测的有效补充。试剂所选用的检测靶标是抗体检测试剂的诊断性能差异[17]的重要因素。SARS-CoV-2 N端第101–120位氨基酸在7种可感染人的新型冠状病毒中高度保守,结果显示,删除该位点可以将非特异性反应降低87.5%;通过单独用N抗原N端第101–120位氨基酸多拷贝串联表达蛋白检测,16份非特异性反应标本5份不能检出,除检测的灵敏度外,N抗原N端第101–120位氨基酸可能和N蛋白其他部位氨基酸能形成空间构象决定簇,影响抗体检测。这与早期报道的SARS-CoV NΔ121蛋白(第1–120位氨基酸截短的N蛋白) 要比全长的N蛋白有更高的阳性检出率、特异性和敏感性更高的结论一致[18]。从N抗原生物信息学分析来看,N端的120个氨基酸中包含了2个主要抗原决定簇,在7种可感染人的新型冠状病毒中有一定的保守性,将其删除后,非特异性反应消失,表明N蛋白产生的非特异性反应主要是由于N端120个氨基酸造成。删去该区域后,显示对感染7 d以上的患者检出率仍能保持在100%,对降低试剂的假阳性、同时保持较高灵敏度有一定的价值。基于此病的特殊性和条件所限,后续我们将针对不同分期、不同地区、时间段的病例及新冠症状类似病例进一步开展研究。
本研究经过对不同N蛋白片段的诊断性能探究和标记抗原的优化选择,建立一种新型冠状病毒总抗体的荧光免疫层析检测方法,并对其进行了初步的性能评价,其精密性、准确度以及特异性均符合临床需要,线性范围在0.312–80 U/L,最低检出限为0.165 U/L,与已批准的试纸条总符合率达到98%以上,为新冠抗体检测试剂性能的提升提供实验依据和借鉴。
参考文献
| [1] | 中国疾病预防控制中心新型冠状病毒肺炎应急响应机制流行病学组. 新型冠状病毒肺炎流行病学特征分析. 中华流行病学杂志, 2020, 41(2): 145-151. Chinese Center for Disease Control and Prevention Epidemiology Working Group for NCIP Epidemic Response. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China. Chin J Epidemiol, 2020, 41(2): 145-151 (in Chinese). |
| [2] | 祝丙华, 冯攀, 李芳芳, 等. 三种新发现的冠状病毒病原学及临床流行病学研究进展. 中华医院感染学杂志, 2020, 30(15): 2274-2280. Zhu BH, Feng P, Li FF, et al. Progress of study on etiological and clinical characteristics of three types of novel coronaviruses. Chin J Nosocomiol, 2020, 30(15): 2274-2280 (in Chinese). |
| [3] | Montesinos I, Gruson D, Kabamba B, et al. Evaluation of two automated and three rapid lateral flow immunoassays for the detection of anti-SARS-CoV-2 antibodies. J Clin Virol, 2020, 128: 104413. DOI:10.1016/j.jcv.2020.104413 |
| [4] | Petherick A. Developing antibody tests for SARS-CoV-2. Lancet, 2020, 395(10230): 1101-1102. DOI:10.1016/S0140-6736(20)30788-1 |
| [5] | Zhao JJ, Yuan Q, Wang HY, et al. Antibody responses to SARS-CoV-2 in patients with novel coronavirus disease 2019. Clin Infectious Dis, 2020, 71(16): 2027-2034. DOI:10.1093/cid/ciaa344 |
| [6] | Li Z, Yi YX, Luo XM, et al. Development and clinical application of a rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis. J Med Virol, 2020, 92(9): 1518-1524. DOI:10.1002/jmv.25727 |
| [7] | Burbelo PD, Riedo FX, Morishima C, et al. Detection of nucleocapsid antibody to SARS-CoV-2 is more sensitive than antibody to spike protein in COVID-19 patients. medRxiv, 2020. DOI: 10.1101/2020.04.20.20071423. |
| [8] | Algaissi A, Alfaleh MA, Hala S, et al. SARS-CoV-2 S1 and N-based serological assays reveal rapid seroconversion and induction of specific antibody response in COVID-19 patients. Sci Rep, 2020, 10(1): 16561. DOI:10.1038/s41598-020-73491-5 |
| [9] | 张西西, 张怡青, 李玉林, 等. 新型冠状病毒(SARS-CoV-2)N蛋白C端重组蛋白的原核表达、纯化及应用. 生物技术通报, 2021, 37(5): 92-97. Zhang XX, Zhang YQ, Li YL, et al. Prokaryotic expression, purification and application of N protein C-terminal recombinant protein in novel coronavirus (SARS-CoV-2). Biotechnol Bullet, 2021, 37(5): 92-97 (in Chinese). |
| [10] | To KKW, Tsang OTY, Leung WS, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis, 2020, 20(5): 565-574. DOI:10.1016/S1473-3099(20)30196-1 |
| [11] | Guo L, Ren L, Yang SY, et al. Profiling early humoral response to diagnose novel coronavirus disease (COVID-19). Clin Infect Dis, 2020, 71(15): 778-785. DOI:10.1093/cid/ciaa310 |
| [12] | Yamaoka Y, Jeremiah SS, Miyakawa K, et al. Whole nucleocapsid protein of severe acute respiratory syndrome coronavirus 2 may cause false-positive results in serological assays. Clin Infect Dis, 2021, 72(7): 1291-1292. DOI:10.1093/cid/ciaa637 |
| [13] | 唐秋艳, 王云龙, 陈兴业. 免疫诊断试剂实用技术. 北京: 海洋出版社, 2009: 184-200. |
| [14] | 王云龙, 李果, 李玉林, 等. 建立联合检测人附睾蛋白4、糖类抗原15-3荧光层析方法. 中国免疫学杂志, 2020, 36(4): 461-466. Wang YL, Li G, Li YL, et al. Establishment of a fluorescent immunochromatographic method for combined detection of human epididymal protein 4 and breast cancer antigen 15-3. Chin J Immunol, 2020, 36(4): 461-466 (in Chinese). |
| [15] | 2019新型冠状病毒抗原抗体检测试剂注册技术审评要点(试行)[EB/OL]. [2021-01-25]. https://www.nmpa.gov.cn/yaowen/ypjgyw/20200330170001581.html. |
| [16] | Haveri A, Smura T, Kuivanen S, et al. Serological and molecular findings during SARS-CoV-2 infection: the first case study in Finland, January to February 2020. Eurosurveillance, 2020, 25(11): 2000266. |
| [17] | Krüttgen A, Cornelissen CG, Dreher M, et al. Comparison of four new commercial serologic assays for determination of SARS-CoV-2 IgG. J Clin Virol, 2020, 128: 104394. DOI:10.1016/j.jcv.2020.104394 |
| [18] | Yu FX, Le MQ, Inoue S, et al. Evaluation of inapparent nosocomial severe acute respiratory syndrome coronavirus infection in Vietnam by use of highly specific recombinant truncated nucleocapsid protein-based enzyme-linked immunosorbent assay. Clin Diagnost Lab Immunol, 2005, 12(7): 848-854. |
