

1. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;
2. 江南大学 生物工程学院,江苏 无锡 214122
收稿日期:2020-03-31;接收日期:2020-05-26
基金项目:国家自然科学基金优秀青年基金(No. 21822806),国家自然科学基金(No. 31770097)资助
摘要:黄杉素是一种重要的黄酮类化合物,具有抗炎症、抗氧化等功效,在医药及保健品行业有着广泛的应用。黄酮3-羟化酶(Flavanone 3-hydroxylase,F3H)可以催化圣草酚合成黄杉素等3位羟基化的黄酮类化合物。一直以来,由于黄酮3-羟化酶催化效率低,使得利用微生物法合成黄杉素等多种3位羟基化黄酮的产量较低。文中从水飞蓟转录组中鉴定得到一个黄酮3-羟化酶SmF3H。发酵验证结果表明,SmF3H具有黄酮3位羟基化功能,且催化效率显著高于常用的来源于番茄(Solanum lycopersicum)的SlF3H。选取6个转录强度不同的启动子优化从黄酮前体柚皮素到黄杉素的合成途径,发现PGAL7启动子起始转录SmF3H时黄杉素合成产量最高,在摇瓶中产量达到695.90 mg/L;在5-L发酵罐上进行发酵优化,以柚皮素为底物发酵得到3.54 g/L黄杉素,是目前可见报道的最高产量。
关键词:黄酮3-羟化酶黄杉素圣草酚柚皮素酿酒酵母
Identification of flavonoids 3-hydroxylase from [Silybum marianum (L.) Gaertn] and its application in enhanced production of taxifolin
Song Gao1,2, Jingwen Zhou1,2, Jian Chen1,2


1. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: March 31, 2020; Accepted: May 26, 2020
Supported by: National Science Fund for Excellent Young Scholars (No. 21822806), National Natural Science Foundation of China (No. 31770097)
Corresponding author: Jian Chen. Tel: +86-510-85913660; E-mail: jchen@jiangnan.edu.cn.
Abstract: (2S)-taxifolin is an important flavonoid that has anti-inflammatory and anti-oxidation effects. It is widely used in pharmaceutical and nutraceutical industries. Flavone 3-hydroxylase (F3H) can catalyze the synthesis of (2S)-taxifolin and other 3-hydroxylated flavonoids from (2S)-eriodictyol. Due to the low catalytic efficiency of F3H, the titer of many 3-hydroxyflavones, such as taxifolin, synthesized by microbial method is relatively low. In this study, a SmF3H was identified from the transcriptome of Silybum marianum (L.) Gaertn. The results of fermentation showed that SmF3H can catalyze the flavone 3-hydroxylation reaction, and its catalytic efficiency was significantly higher than that of commonly used SlF3H from Solanum lycopersicum. Six promoters with different transcription strength were selected to optimize the synthesis pathway from the flavonoid precursor (2S)-naringenin to (2S)-taxifolin. The results showed that the highest titer of (2S)-taxifolin (695.90 mg/L in shake flask) could be obtained when the PGAL7 promoter was used to control the expression of SmF3H. The titer of (2S)-taxifolin was further improved to 3.54 g/L in a 5-L fermenter, which is the highest titer according to current available literatures.
Keywords: flavanone 3-hydroxylasetaxifolineriodictyolnaringeninSaccharomyces cerevisiae
黄杉素((2S)-taxifolin),又名二氢槲皮素(Dihydroquercetin),最早由日本****自花旗松中分离并鉴定[1],是一种重要的黄酮类化合物。黄杉素结构中含有多个酚羟基,具有强抗氧化性[2],可以高效清除各种自由基。黄杉素具有多种重要的生理活性,如保护肝脏[3]、抗肾脏纤维化[4]、抗肥胖[5]、抗炎症[6]、抗肿瘤[7]、治疗牛皮癣[8]等,被广泛应用于多种保护肝脏和治疗心血管疾病的药品中[9]。此外,黄杉素也是多种具有重要价值的黄酮类化合物的前体,如二氢杨梅素(Dihydromyricetin)、花青素(Anthocyanins)[10]和黄酮木质素(Flavonolignans)[11]等。
目前黄杉素主要来源是从花旗松、落叶松等原生于俄罗斯和加拿大的植物中提取[12]。植物提取法受季节性和产地影响较大,存在效率较低、价格昂贵、产量难以满足市场需求等问题。采用微生物法生产黄杉素等黄酮类化合物,不受季节影响,对生长环境要求低,且有利于质量控制。此外,微生物还具有生长迅速、环境污染小、生产强度大、绿色环保等优势[13]。利用微生物已经实现了多种高附加值植物天然产物的高水平积累,如青蒿酸产量达到25 g/L[14]、番茄红素产量达到3.2 g/L、β-胡萝卜素产量达到6 g/L[15]。由于上述优势,微生物法合成植物天然产物受到了广泛关注。酿酒酵母千百年来被广泛应用于食品行业,具有高度的食品安全特性,容易被消费者接受。同时,酿酒酵母遗传背景清晰[16]、基因操作工具完善[17],作为微生物法合成天然化合物的底盘细胞具有巨大潜力。
柚皮素经过黄酮3’-羟化酶(Flavanone 3’-hydroxylas,F3’H)及其辅酶P450还原酶(Cytochrome P450 reductase,CPR)的催化可以合成圣草酚,圣草酚进一步经过F3H的催化可以得到黄杉素(图 1)。由于已经报道的F3H催化效率普遍较低,目前微生物法合成黄杉素等3位羟基化黄酮的产量提升受到限制[18],在酿酒酵母和解脂亚洛酵母Yarrowia lipolytica中的最高产量仅为336.8 mg/L[19]和110.5 mg/L[20]。以儿茶素为前体,使用嗜氧伯克霍尔德菌Burkholderia oxyphila (OX-01)全细胞经过两步催化生产黄杉素,产量仅为20 mg/L[21-22]。黄杉素的低积累量也严重限制了其下游化合物的高效积累。如水飞蓟宾是典型的黄酮木脂素,由一分子黄杉素和一分子松柏醇(Coniferyl alcohol)耦合而成,具有保肝护肝等功效[23]。虽然微生物法合成松柏醇的产量高达22.9 g/L[24],但是由于黄杉素产量仅数百毫克,使得微生物法合成水飞蓟宾难以实现产业化应用[11]。因此,获得高活性的F3H是获得黄杉素高产量菌株的关键。
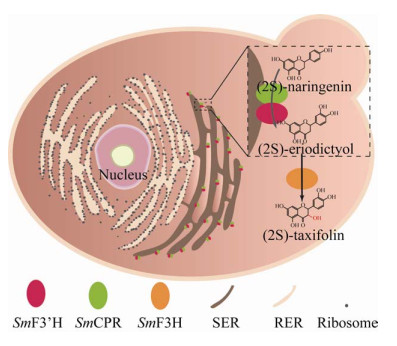 |
| 图 1 从柚皮素开始合成黄杉素路径示意图 Fig. 1 Biosynthesis pathway of (2S)-taxifolin from (2S)-naringenin. SER: smooth endoplasmic reticulum; RER: rough endoplasmic reticulum. |
| 图选项 |
黄杉素是水飞蓟宾合成的前体之一,因此我们推测在水飞蓟中必定存在催化柚皮素合成黄杉素的基因。实验室在前期研究中获得了水飞蓟不同组织的RNA-seq数据,并成功进行拼接[25]。本研究以已知功能的F3H的氨基酸序列为模板,通过tBLASTN,从水飞蓟RNA-seq数据库中获得潜在的同源基因,通过逆转录获得DNA序列,并在酿酒酵母中发酵验证其功能。以柚皮素为底物进行催化反应,通过与已知来源的常用SlF3H比较,证明来自于水飞蓟的SmF3H具有更高的催化效率。在验证SmF3H的功能后,使用不同转录强度的启动子优化SmF3H表达,获得最佳启动子组合。将获得的最佳菌株在5 L发酵罐水平进行发酵优化,以柚皮素为前体最终黄杉素产量达到3.54 g/L,是已知报道的最高产量。
1 材料与方法1.1 材料菌株、质粒和试剂:大肠杆菌Escherichia coli JM109用于分子克隆。酿酒酵母Saccharomyces cerevisiae C800 (CEN.PK2-1D;MATα;ura3-52;leu2-3, 112;trp1-289;his3Δ1;MAL2-8C;SUC2;gal80::KanMX)[26]用于表达黄酮合成相关基因。包含SmF3’H和SmCPR表达框的质粒pY26-THGR、pY26- P05mut12、pUC57-SlF3H和pMD-T-GAL7为本实验室保存[27]。(2S)-黄杉素、(2S)-圣草酚、(2S)-柚皮素标准品购自Sigma-Aldrich (St. Louis,MO)公司。限制性内切酶购自Thermo公司。高保真DNA聚合酶购自南京诺唯赞生物科技有限公司。RNA提取试剂盒Plant RNA Extraction kits购自QIAGEN公司。Oligo(dT)18引物和逆转录酶M-MuLV购自生工生物工程(上海)股份有限公司。其他试剂购自上海国药集团。
1.2 培养基LB培养基(Luria Broth):蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L;YPD培养基:蛋白胨20 g/L,酵母提取物10 g/L,葡萄糖20 g/L。10×YNB培养基:酵母氮源(无氨基酸和硫酸铵) 17.4 g/L,硫酸铵50 g/L,过滤除菌,4 ℃保存。10×葡萄糖培养基:200 g/L葡萄糖,高温高压灭菌,备用。1×YNB:100 mL 10×YNB培养基,100 mL 10×葡萄糖培养基,加水定容至1 L。如有需要可添加1%氨基酸母液。氨基酸母液:5 g/L各种氨基酸,溶解在水中,加热或超声助溶,待完全溶解后过滤除菌,4 ℃保存。固体培养基添加2%的琼脂。
流加培养基A:(2S)-柚皮素溶解在乙醇中,终浓度为50 g/L,过滤除菌后保存备用。流加培养基B根据之前报道进行优化[14],含量分别为:葡萄糖400 g/L,KH2PO4 18 g/L,MgSO4·7H2O 10.24 g/L,K2SO4 7 g/L,Na2SO4 0.56 g/L,金属盐母液20 mL/L,维生素母液24 mL/L,亮氨酸、色氨酸、组氨酸各1 g/L。金属盐母液含量分别为:ZnSO4·7H2O 5.75 g/L,MnCl2·4H2O 0.32 g/L,CoCl2·6H2O 0.47 g/L,NaMoO4·2H2O 0.48 g/L,CaCl2·2H2O 2.9 g/L,FeSO4·7H2O 2.8 g/L,80 mL的0.5 mol/L EDTA (pH 8.0)。维生素母液含量分别为:生物素0.05 g/L,泛酸钙1 g/L,烟酸1 g/L,myo-肌醇25 g/L,盐酸硫胺1 g/L,盐酸吡哆醛HCl 1 g/L,p-氨基苯甲酸0.02 g/L。
1.3 水飞蓟来源黄酮3-羟化酶的预测以来源于拟南芥Arabidopsis thaliana的AtF3H (GenBank登录号:AEE78767.1,NCBI蛋白质登录号GI (Geninfo identifier):332645246,358 aa)的氨基酸序列作为模板,经TBLASTN (TBLASTN 2.2.31+)[28]从水飞蓟转录组中预测获得了一个评分最高的序列Contig68823,长度为1 321 bp,在各组织中的FPKM (Fragments per kilobase per million)值[29]结果见表 1。
表 1 在水飞蓟不同组织中Contig68823的FPKM值Table 1 The FPKM of Contig68823 in different tissues of Silybum marianum
| UniGene name | Contig68823 |
| ??Embryo | 0.25 |
| ??Flower | 940.34 |
| ??Leaf | 7.11 |
| ??Root | 0.12 |
| ??Seed coat | 24.00 |
| ??Stem | 40.18 |
表选项
1.4 扩增和鉴定Sm F3H水飞蓟种子由吉林农业大学杨世海教授赠送。FPKM的值可以反映RNA的丰度,由于Contig68823在花蕊中的FPKM值较高,因此从花蕊中提取总RNA。剪下盛花期的水飞蓟花朵,置于液氮中速冻后取出,剪下花蕊置于焦碳酸二乙酯(Diethyl pyrocarbonate,DEPC)处理后,于?20 ℃过夜的研钵中,快速研磨成粉末。快速取约50 μL粉末至1.5 mL离心管中,按照植物RNA提取试剂盒说明书提取出总RNA。按照逆转录酶说明书逆转录水飞蓟mRNA获得cDNA库。
使用引物F3H-F/F3H-R扩增Contig68823,获得的基因命名为SmF3H。将扩增得到的序列插入到T载体中,得到pMD-T-SmF3H。以pMD-T- SmF3H、pMD-T-GAL7和T载体为模板分别扩增,将PCR产物经Gibson组装后获得pMD-G7SmF3H、pMD-G7SlF3H。使用BsiWⅠ/PacⅠ对pMD-G7SmF3H和pMD-G7SlF3H进行双酶切,将得到的片段分别连接到pY26-THGR的BsiWⅠ/PacⅠ酶切位点,依次获得pY26-THGRGF和pY26-THGRGF2。将pY26-THGRGF/pY26-THGRGF2转化至菌株C800中,得到菌株C800THGRGF和C800THGRGF2。将菌株进行发酵验证,以柚皮素为底物,检测黄杉素的产量。本节所用菌株和质粒见表 2。
表 2 本研究所用质粒和菌株Table 2 Plasmids and strains used in this section
| Plasmids or strains | Characteristics |
| ??C800 | CEN.PK2-1D; MATα; ura3-52; leu2-3, 112; trp1-289; his3Δ1; MAL2-8C; SUC2; gal80::KanMX |
| ??pMD-T-SmF3H | SmF3H |
| ??pUC57-SlF3H | SlF3H |
| ??pMD-T-PGAL7 | PGAL7 |
| ??pMD-G7SmF3H | pMD-BsiWI-PGAL7-SmF3H-PacI |
| ??pMD-G7SlF3H | pMD-BsiWI-PGAL7-SlF3H-PacI |
| ??pY26-THGR | pY26-PTEF1-SmCPR-PGPD1-SmF3’H |
| ??pY26-P05mut12 | pY26-PINO1-SmF3’HD285N-PTDH1-SmCPRI453V |
| ??pY26-THGRGF | pY26-PTEF1-SmCPR-PGPD1-SmF3’H-PGAL7-SmF3H |
| ??pY26-THGRGF2 | pY26-PTEF1-SmCPR-PGPD1-SmF3’H-PGAL7-SlF3H |
| ??C800THGRGF | C800; pY26-THGR |
| ??C800THGRGF2 | C800; pY26-THGRGF2 |
| ??pMD-P1SmF3H | PPGK1-SmF3H |
| ??pMD-P2SmF3H | PTPI1-SmF3H |
| ??pMD-P3SmF3H | PACS2-SmF3H |
| ??pMD-P4SmF3H | PGAL7-SmF3H |
| ??pMD-P5SmF3H | PLEU2-SmF3H |
| ??pMD-P6SmF3H | PARO7-SmF3H |
| ??pY26-P5m1 | pY26-PINO1-SmF3’HD285N-PTDH1-SmCPRI453V-PPGK1-SmF3H |
| ??pY26-P5m2 | pY26-PINO1-SmF3’HD285N-PTDH1-SmCPRI453V-PTPI1-SmF3H |
| ??pY26-P5m3 | pY26-PINO1-SmF3’HD285N-PTDH1-SmCPRI453V-PACS2-SmF3H |
| ??pY26-P5m4 | pY26-PINO1-SmF3’HD285N-PTDH1-SmCPRI453V-PGAL7-SmF3H |
| ??pY26-P5m5 | pY26-PINO1-SmF3’HD285N-PTDH1-SmCPRI453V-PLEU2-SmF3H |
| ??pY26-P5m6 | pY26-PINO1-SmF3’HD285N-PTDH1-SmCPRI453V-PARO7-SmF3H |
| ??C800P5m1 | C800; pY26-P5m1 |
| ??C800P5m2 | C800; pY26-P5m2 |
| ??C800P5m3 | C800; pY26-P5m3 |
| ??C800P5m4 | C800; pY26-P5m4 |
| ??C800P5m5 | C800; pY26-P5m5 |
| ??C800P5m6 | C800; pY26-P5m6 |
表选项
1.5 基于启动子优化基因表达水平在实验室保存的高产圣草酚的质粒pY26-P05mut12基础上,融合SmF3H表达框,SmF3H由不同启动子起始转录。首先在T载体上构建SmF3H与不同启动子融合的表达框,经过Gibson组装获得pMD-P1SmF3H、pMD-P2SmF3H、pMD-P3SmF3H、pMD-P4SmF3H、pMD-P5SmF3H和pMD-P6SmF3H。依次扩增上述6个质粒中SmF3H的表达框并与线性化的pY26-P05mut12经Gibson组装依次获得pY26-P5m1、pY26-P5m2、pY26-P5m3、pY26-P5m4、pY26-P5m5和pY26- P5m6。测序正确后将上述6个质粒转化至菌株C800中,得到菌株C800P5m1–C800P5m6。将启动子优化的6株菌进行发酵,检测最佳启动子组合。本实验所有引物在表 3中列出。
表 3 本实验中使用的引物序列Table 3 The primers used in this study
| Primer name | Sequence (5′–3′) |
| F3H-F | ATGCTTGAAAACAGGTTCGTTCGCGATGAAG |
| F3H-R | CTAAGCAAATATATTCTCGATTGG |
| SmF3H-homo1-F | TCCCTCAAAAATGCTTGAAAACAGGTTCGTTCGCGATG |
| SmF3H-homo1-R | TTTTAATTAACTAAGCAAATATATTCTCGATTGGCTTC |
| PGAL7-homo1-F | GATTCGTACGTTTGCCAGCTTACTATCCTTCTTGAAAATATG |
| PGAL7-homo1-R | TTTCAAGCATTTTTGAGGGAATATTCAACTGTTTTTTTTTATC |
| pMD-homo1-F | AGTTAATTAAAATCGTCGAACGGCAGGCGTGCAAAC |
| pMD-homo1-R | CAAACGTACGAATCTCTGGAAGATCCGCGCGTACCG |
| SlF3H-homo2-F | TCCCTCAAAAATGGCACCGAGCACCCTGACCGCCCTG |
| SLF3H-homo2-R | GATTTTAATTAATTATGCCAGGATTTCTTCAATCGGTTTAC |
| PGAL7-homo2-F | GATTCGTACGTTTGCCAGCTTACTATCCTTCTTGAAAATATG |
| PGAL7-homo2-R | TCGGTGCCATTTTTGAGGGAATATTCAACTGTTTTTTTTTATC |
| pMD-homo2-F | AATTAATTAAAATCGTCGAACGGCAGGCGTGCAAAC |
| pMD-homo2-R | CAAACGTACGAATCTCTGGAAGATCCGCGCGTACCG |
| SmF3H-homo3-F | ATGCTTGAAAACAGGTTCGTTCGCGATG |
| SmF3H-homo3-R | AATCTCTGGAAGATCCGCGCGTACCGAG |
| PGK1-homo3-F | GCGCGGATCTTCCAGAGATTGTGAGTAAGGAAAGAGTGAGGAACTATCGC |
| PGK1-homo3-R | ACGAACCTGTTTTCAAGCATTGTTTTATATTTGTTGTAAAAAGTAGATAATTAC |
| TPI1-homo3-F | GCGCGGATCTTCCAGAGATTACCCAAATGGACTGATTGTGAGGGAGACCTAAC |
| TPI1-homo3-R | AACGAACCTGTTTTCAAGCATTTTTAGTTTATGTATGTGTTTTTTGTAGTTATAG |
| ACS2-homo3-F | GCGCGGATCTTCCAGAGATTACCTTCAGTAATGGCGCCATCCTCTCGGGAAAC |
| ACS2-homo3-R | ACGAACCTGTTTTCAAGCATATTTTATTATTGTATTGATTTACTTTCCTG |
| GAL7-homo3-F | GCGCGGATCTTCCAGAGATTTTTGCCAGCTTACTATCCTTCTTGAAAATATGCA |
| GAL7-homo3-R | ACGAACCTGTTTTCAAGCATTTTTGAGGGAATATTCAACTGTTTTTTTTTATCATG |
| LEU2-homo3-F | GCGCGGATCTTCCAGAGATTTCCTGTACTTCCTTGTTCATGTGTGTTCAAAAACG |
| LEU2-homo3-R | ACGAACCTGTTTTCAAGCATTAGAATGGTATATCCTTGAAATATATATATATATATTG |
| ARO7-homo3-F | GCGCGGATCTTCCAGAGATTTGGATTACATTTGATTCAGTCATACACGAATTATGG |
| ARO7-homo3-R | ACGAACCTGTTTTCAAGCATATCTTATACCAATTTTATGCAGGATGCTGAGTG |
| PGK1-homo4-F | TGTTTGGTAGGTGAGTAAGGAAAGAGTGAGGAACTATC |
| SmF3H-homo4-R | CTCCCGTACGCTAAGCAAATATATTCTCGATTGGCTTC |
| TPI1-homo4-F | TGTTTGGTAGACCCAAATGGACTGATTGTGAGGGAG |
| ACS2-homo4-F | TGTTTGGTAGACCTTCAGTAATGGCGCCATCCTCTCGGGAAAC |
| GAL7-homo4-F | TGTTTGGTAGTTTGCCAGCTTACTATCCTTCTTGAAAATATGC |
| LEU2-homo4-F | TGTTTGGTAGTCCTGTACTTCCTTGTTCATGTGTG |
| ARO7-homo4-F | GTGATGTTTGGTAGTGGATTACATTTGATTCAGTCATAC |
| P51-homo4-F | CCTTACTCACCTACCAAACATCACGGAGGTATCTTCCTGAC |
| P51-homo4-R | ATTTGCTTAGCGTACGGGAGTCCTTTAATTAACAATTCTTC |
| P52-homo4-F | GTCCATTTGGGTCTACCAAACATCACGGAGGTATCTTCCTGAC |
| P53-homo4-F | ATTACTGAAGGTCTACCAAACATCACGGAGGTATCTTCCTGAC |
| P54-homo4-F | AGCTGGCAAACTACCAAACATCACGGAGGTATCTTCCTGAC |
| P55-homo4-F | AAGTACAGGACTACCAAACATCACGGAGGTATCTTCCTGACA |
| P56-homo4-F | ATGTAATCCACTACCAAACATCACGGAGGTATCTTCCTGAC |
表选项
1.6 培养条件菌株C800THGRGF和C800THGRGF2在250 mL摇瓶中的发酵条件为:挑取至少10个单菌落接种在含有20 mL YNB+LEU+HIS+TRP液体培养基的250 mL摇瓶中,30 ℃、220 r/min培养16–18 h,获得种子培养基。将种子培养基以2% (V/V)转接到含有20 mL新鲜YNB+LEU+ HIS+TRP液体培养基的250 mL摇瓶中,培养基中含有250 mg/L柚皮素,30 ℃、220 r/min培养72 h后检测黄杉素及中间产物圣草酚的产量。如有添加碳酸钙,则其浓度为10 g/L。
菌株C800P5m1–C800P5m6在250 mL摇瓶中发酵条件:种子培养基同菌株C800THGRGF,将种子培养基以2% (V/V)转接到含有20 mL新鲜YPD液体培养基的250 mL摇瓶中,在第0、12、24、36 h时,分别向培养基中添加250 mg/L柚皮素。30 ℃、220 r/min培养72 h后,检测黄杉素和中间产物圣草酚的产量。
最佳菌株C800P5m4在5 L发酵罐发酵条件优化为:种子培养基同C800P5m1,按2% V/V转接到装有2.5 L新鲜YPD培养基的5 L发酵罐中,在第0、12 h时添加250 mg/L柚皮素。在葡萄糖浓度为0 g/L时(一般在第12–15 h之间)开始流加培养基A和流加培养基B,设定流速分别为2.5 mL/h和1.3 mL/h、3.8 mL/h和1.9 mL/L、6.3 mL/h和3.1 mL/L。根据起始流加时间不同,在第55 h左右停止所有培养基流加,添加的柚皮素总量分别为2.5 g/L、3.5 g/L和5.5 g/L。每3 h取样检测OD600、柚皮素、圣草酚和黄杉素。
1.7 检测条件取100 μL的发酵液添加900 μL甲醇,涡旋振荡30 s混合后,13 500 r/min离心5 min,取上清液过滤后备用检测。样品使用安捷伦高效液相检测(Agilent 1200),C18反相色谱柱(4.6 mm× 250 mm,Thermo),柱温25 ℃。流动相为甲醇︰水(41︰59),流速1 mL/min,进样量10 μL,检测波长为290 nm。所有菌株经过3次生物学平行发酵实验,结果图中显示数值均为3次平行实验的平均值。
2 结果与分析2.1 SmF3H的序列分析将Contig68823的DNA序列分析后发现,第一个起始密码子ATG在第208个碱基处,第一个终止密码子在第1 030个碱基处,中间表达框可以翻译成一段总长度为274个氨基酸的蛋白质。
由于大部分已知F3H的长度在364–377个氨基酸之间:InF3H (牵牛花Ipomoea nil,GenBank登录号:BAA21897.1,GI:2344781,366 aa),RaF3H (茶藨子Ribes album,GenBank登录号:ANC98544.1,GI:1026538506,365 aa),PeF3H (余甘子Phyllanthus emblica,GenBank登录号:AGT79807.1,GI:532164777,364 aa),HsF3H (冬青树Hololachna songarica,GenBank登录号:AEY81365.1,GI:374082390,366 aa),NuF3H (莲Nelumbo nucifera,GenBank登录号:AGT56413.1,GI:531063900,377 aa),因此Contig68823未拼接完全。继续分析Contig的5′端1–208个碱基序列,发现这段DNA序列可以翻译成69个连续的氨基酸序列,并且经过序列比对后发现69个氨基酸序列基本与其他F3H的N端序列同源(图 2)。将这段69个氨基酸序列添加一个蛋氨酸后总表达框可以翻译为长度344个氨基酸的蛋白质,与上述不同来源的F3H平均氨基酸长度接近。因此在扩增Contig68823时,在已知DNA序列前添加一个起始密码子ATG,将此补充后的序列作为一个开放阅读框,长度为1 035 bp,命名为SmF3H。SmF3H的氨基酸序列与其他来源的F3H具有较多完全匹配区域(图 2)。
 |
| 图 2 SmF3H与不同来源F3H序列对比 Fig. 2 The alignment of SmF3H and other F3H. Peptides in black rectangles were the 69 amino acids in N-terminal; * means exactly matched amino acids. |
| 图选项 |
2.2 SmF3H的催化功能鉴定菌株C800THGRGF和菌株C800THGRGF2在YNB培养基中发酵,添加250 mg/L的柚皮素为前体。菌株C800THGRGF可以合成(16.69±0.88) mg/L的黄杉素,同时积累(9.85±0.50) mg/L的圣草酚。而菌株C800THGRGF2可以合成(6.48±1.00) mg/L的黄杉素,无中间产物圣草酚积累。两株菌的柚皮素转化能力较低。经过检测菌株C800THGRGF和C800THGRGF2菌体OD600在3–4之间,较常规培养下OD600在6–8之间相比,菌体生长受到明显抑制。经检测发现,培养基的pH在1.5–2.0之间,较常规培养下pH在5–6之间下降显著。推测由于pH较低,导致了菌体生长和酶活受到抑制[30],从而影响了催化效率。因此,在培养基中添加碳酸钙控制pH。添加碳酸钙后,发酵结束时培养基pH维持在4.0–4.5之间,菌体生长得到改善,OD600维持在5–6之间。在控制pH条件下,菌株C800THGRGF可以合成(73.38±4.25) mg/L的黄杉素,同时积累(37.33±1.83) mg/L的圣草酚。菌株C800THGRGF2可以合成(60.68±2.82) mg/L的黄杉素,同时积累(32.02±1.95) mg/L的圣草酚。底物柚皮素消耗较不控制pH时显著提高(图 3)。经过发酵检验,SmF3H具有黄酮3-羟化酶作用,并且SmF3H较SlF3H的催化活性更高。
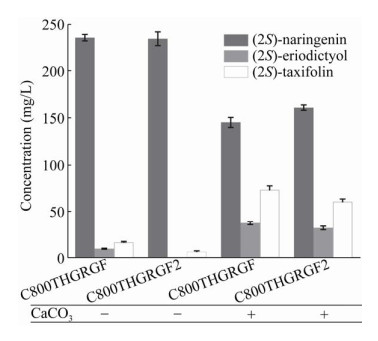 |
| 图 3 SmF3H的催化能力验证 Fig. 3 The verification of SmF3H catalytic ability. |
| 图选项 |
2.3 启动子优化合成黄杉素选用6个不同强度的启动子起始转录SmF3H,通过检测黄杉素的积累量获得最佳启动子。所选用的6个启动子PPGK1、PTPI1、PACS2、PGAL7、PLEU2、PARO7的转录强度从高到低,积累的黄杉素依次为(534.36±68.79) mg/L、(474.98±21.51) mg/L、(361.39±10.46) mg/L、(695.90±3.65) mg/L、(367.00±22.30) mg/L和(213.31±10.82) mg/L。中间代谢产物圣草酚积累量依次为(414.76±14.64) mg/L、(585.68±17.07) mg/L、(569.42±34.74) mg/L、(334.30±5.42) mg/L、(592.58±34.55) mg/L和(693.87±25.00) mg/L。前体柚皮素的剩余量依次为(76.41±4.96) mg/L、(57.94±5.65) mg/L、(108.10±14.10) mg/L、(67.33±16.59) mg/L、(153.00±27.09) mg/L和(160.99±53.76) mg/L (图 4)。
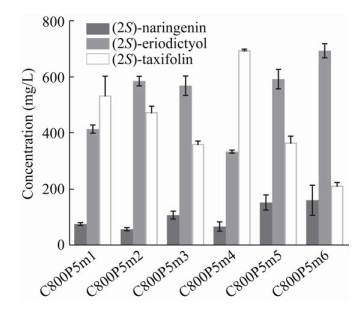 |
| 图 4 基于启动子优化Sm F3H的表达水平 Fig. 4 Optimize SmF3H expression level through promoter adjustment. |
| 图选项 |
总体看来,随着启动子强度的增强,黄杉素的积累也随之增加,但是黄杉素积累量最高时,SmF3H是由PGAL7起始转录的。可能是由于PGAL7自带强终止子序列TGAL10,影响了上游基因SmCPR的终止转录,提高了基因总体的表达强度[31]。在最强启动子PPGK1起始转录时,发酵结果并不稳定,黄杉素产量波动较大,而由PGAL7起始转录时黄杉素的产量波动小,鲁棒性强。在不同启动子起始转录下,柚皮素的剩余量基本在50–150 mg/L左右,可见SmF3’H/SmCPR的表达强度很高,对底物柚皮素的催化能力较强,即使在黄杉素积累最低的菌株C800P5m6中,柚皮素大部分被转化。可见,圣草酚到黄杉素的转化效率是影响柚皮素到黄杉素转化的限制因素。
2.4 在5 L发酵罐水平进行黄杉素发酵优化最佳菌株C800P5m4在5 L发酵罐水平进行补料速度的优化。当柚皮素流加速度控制在1 mL/(L·h)时,菌株OD600最高达到(179.17±4.86),黄杉素的最高产量达到(1.60±0.06) g/L,中间产物圣草酚的积累为(0.32±0.02) g/L,而柚皮素剩余约(0.55±0.04) g/L。黄杉素的摩尔转化率约为57.3% (图 5A)。当柚皮素流加速度控制在1.5 mL/(L·h)时,菌株OD600最高达到(235.18±4.34),黄杉素的最高产量达到(2.28±0.07) g/L,中间产物圣草酚的积累为(0.92±0.02) g/L,而柚皮素剩余约(0.40±0.03) g/L。黄杉素的摩尔转化率约为58.4% (图 5B)。当柚皮素流加速度控制在2.5 mL/(L·h)时,菌株OD600最高达到(159.60±2.85),黄杉素的最高产量达到(3.54±0.07) g/L,中间产物圣草酚的积累为(0.30±0.02) g/L,而柚皮素最终剩余约(2.33±0.10) g/L。黄杉素摩尔转化率约为57.6% (图 5C)。随着底物流加速度的提高,黄杉素的产量明显提高,但是黄杉素的转化率并未明显提高,维持在60%左右。当底物流加速度提高到2.5 mL/(L·h)时,黄杉素的积累速度明显提高,但是当黄杉素积累超过3.0 g/L后,黄杉素的合成速率显著下降,底物柚皮素则迅速积累,OD600较1.5 mL/(L·h)流速时下降32.1%。这表明随着柚皮素及黄杉素浓度增加,菌体生长受到严重抑制。
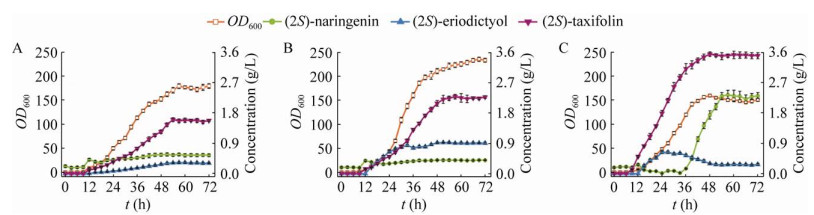 |
| 图 5 在5 L发酵罐水平优化黄杉素合成 Fig. 5 Optimize taxifolin fermentation in 5 L bioreactor. |
| 图选项 |
3 讨论黄杉素具有重要的生理功能,而且是水飞蓟宾、花青素等复杂黄酮类化合物合成的重要前体。来源和价格问题严重限制了黄杉素及其下游产物的广泛应用。以往的研究表明,F3H是黄杉素合成的限速步骤。在本研究中,从水飞蓟中鉴定得到一个催化性能较好的SmF3H,通过启动子工程优化SmF3H的表达水平,获得了克级别的黄杉素积累,是已知报道最高产量的10.5倍[19]。本研究为高效、经济合成黄杉素及其下游高附加值化合物奠定了良好基础。
微生物法合成化合物的本质是酶催化反应,不同来源的同工酶活性差距较大,高活性的同工酶可以显著提高催化效率。如来源于水蛭的透明质酸酶可以高效催化获得低分子量透明质酸[32]。在相同催化条件下,本研究中获得的SmF3H催化活性较常用的SlF3H高20.93%。在获得高活性F3H后,本研究采用了6个不同转录强度的启动子协调酶的表达水平,使酶的表达水平处在最佳比例,提高产物的积累量。最终通过发酵优化验证了最佳启动子组合,并进一步在5 L发酵罐中验证了菌株扩大培养的稳定性,最终得到3.54 g/L的产量,是目前可见报道的最高产量。说明了启动子工程策略能有效地在酿酒酵母中优化基因的表达水平[33-34]。
本研究中作为前体的柚皮素,虽然相对价格依然高昂,但目前在酿酒酵母中从头合成柚皮素的最高产量已经达到898 mg/L[35]。随着近年来在酿酒酵母中合成柚皮素的机理不断被解析,如有研究多次验证了CHS是酿酒酵母中合成柚皮素的主要限速步骤[36]。而柚皮素的另一个限制因素对香豆酸在酿酒酵母中的积累量已经高达12.5 g/L[37]。通过整合上述研究结果,有望大幅度提高黄杉素前体物质柚皮素的产量,将为低成本获得黄杉素及其下游高附加值化合物奠定良好基础。综上所述,酿酒酵母作为合成黄酮类化合物等植物天然产物的底盘生物,具有巨大的开发和应用潜力。
参考文献
| [1] | Fukui Y, Nakadome K, Ariyoshi H. Studies on the monomer flavonoides of the plants of coniferae. Ⅱ. Isolation of a new taxifolin glucoside from the leaves of Chamaecyparis obtusa Endlicher. Yakugaku Zasshi, 1996, 86(3): 184-187. |
| [2] | Topal F, Nar M, Gocer H, et al. Antioxidant activity of taxifolin: an activity-structure relationship. J Enzyme Inhib Med Chem, 2016, 31(4): 674-683. DOI:10.3109/14756366.2015.1057723 |
| [3] | Chen JJ, Sun X, Xia TT, et al. Pretreatment with dihydroquercetin, a dietary flavonoid, protected against concanavalin A-induced immunological hepatic injury in mice and TNF-α/ActD-induced apoptosis in HepG2 cells. Food Funct, 2018, 9(4): 2341-2352. DOI:10.1039/C7FO01073G |
| [4] | Wang W, Ma BL, Xu CG, et al. Dihydroquercetin protects against renal fibrosis by activating the Nrf2 pathway. Phytomedicine, 2020, 69: 153185. DOI:10.1016/j.phymed.2020.153185 |
| [5] | Elsbaey M, Amen Y, Nakagawa T, et al. White poplar: targeted isolation of pancreatic lipase inhibitors. Ind Crops Prod, 2019, 141: 111778. DOI:10.1016/j.indcrop.2019.111778 |
| [6] | Jha JC, Banal C, Chow BSM, et al. Diabetes and kidney disease: role of oxidative stress. Antioxid Redox Signal, 2016, 25(12): 657-684. DOI:10.1089/ars.2016.6664 |
| [7] | Hossain MM, Ray SK. EWS knockdown and taxifolin treatment induced differentiation and removed DNA methylation from p53 promoter to promote expression of puma and noxa for apoptosis in ewing's sarcoma. J Cancer Ther, 2014, 5(12): 1092-1113. DOI:10.4236/jct.2014.512114 |
| [8] | Yuan XH, Li N, Zhang MM, et al. Taxifolin attenuates IMQ-induced murine psoriasis-like dermatitis by regulating T helper cell responses via Notch1 and JAK2/STAT3 signal pathways. Biomed Pharmacother, 2020, 123: 109747. DOI:10.1016/j.biopha.2019.109747 |
| [9] | Sunil C, Xu BJ. An insight into the health- promoting effects of taxifolin (dihydroquercetin). Phytochemistry, 2019, 166: 112066. DOI:10.1016/j.phytochem.2019.112066 |
| [10] | Owens DK, Crosby KC, Runac J, et al. Biochemical and genetic characterization of Arabidopsis flavanone 3β-hydroxylase. Plant Physiol Biochem, 2008, 46(10): 833-843. DOI:10.1016/j.plaphy.2008.06.004 |
| [11] | Lv YK, Xu S, Lyu YB, et al. Engineering enzymatic cascades for the efficient biotransformation of eugenol and taxifolin to silybin and isosilybin. Green Chem, 2019, 21(7): 1660-1667. DOI:10.1039/C8GC03728K |
| [12] | Liu WC, Liu XL, Meng LQ, et al. Research progress of dihydroquercetin. J Jilin Agric Univ, 2018, 40(4): 444-448 (in Chinese). 刘文丛, 刘兴龙, 孟令全, 等. 二氢槲皮素的研究进展. 吉林农业大学学报, 2018, 40(4): 444-448. |
| [13] | Wang XW, Xiang L, Xu T, et al. Construction and high-density fermentation of alkaline pectate lyase high-yield yeast. Chin J Biotech, 2017, 33(12): 2017-2027 (in Chinese). 望潇文, 向腊, 徐婷, 等. 碱性果胶酶高产菌株的构建和高密度发酵. 生物工程学报, 2017, 33(12): 2017-2027. |
| [14] | Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-532. DOI:10.1038/nature12051 |
| [15] | Ma T, Chen ZL, Huang MJ, et al. Promotion of synthetic microbial technology in carotenoids overproduction. Biotechnol Business, 2019(1): 27-33 (in Chinese). 马田, 陈智莉, 黄敏坚, 等. 合成微生物技术促进类胡萝卜素产品的高效合成. 生物产业技术, 2019(1): 27-33. |
| [16] | Ye C, Xu N, Gao C, et al. Comprehensive understanding of Saccharomyces cerevisiae phenotypes with whole-cell model WM_S288C. Biotechnol Bioeng, 2020, 117(5): 1562-1574. DOI:10.1002/bit.27298 |
| [17] | Lian JZ, Mishra S, Zhao HM. Recent advances in metabolic engineering of Saccharomyces cerevisiae: New tools and their applications. Metab Eng, 2018, 50: 85-108. DOI:10.1016/j.ymben.2018.04.011 |
| [18] | Ajikumar PK, Xiao WH, Tyo KEJ, et al. Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli. Science, 2010, 330(600): 70-74. |
| [19] | Yang JZ, Liang JC, Shao L, et al. Green production of silybin and isosilybin by merging metabolic engineering approaches and enzymatic catalysis. Metab Eng, 2020, 59: 44-52. DOI:10.1016/j.ymben.2020.01.007 |
| [20] | Lv YK, Marsafari M, Koffas M, et al. Optimizing oleaginous yeast cell factories for flavonoids and hydroxylated flavonoids biosynthesis. ACS Synth Biol, 2019, 8(11): 2514-2523. DOI:10.1021/acssynbio.9b00193 |
| [21] | Matsuda M, Otsuka Y, Jin S, et al. Biotransformation of (+)-catechin into taxifolin by a two-step oxidation: primary stage of (+)-catechin metabolism by a novel (+)-catechin-degrading bacteria, Burkholderia sp. KTC-1, isolated from tropical peat. Biochem Biophys Res Commun, 2008, 366(2): 414-419. |
| [22] | Otsuka Y, Matsuda M, Sonoki T, et al. Enzymatic activity of cell-free extracts from Burkholderia oxyphila OX-01 bio-converts (+)-catechin and (-)-epicatechin to (+)-taxifolin. Biosci Biotechnol Biochem, 2016, 80(12): 2473-2479. DOI:10.1080/09168451.2016.1220822 |
| [23] | Wu XM, Liu GM, Feng YB, et al. Silybin-derived flavonolignans and their structure-activity relationships: research advances. Int J Pharm Res, 2010, 37(3): 187-197 (in Chinese). 巫秀美, 刘光明, 冯玉冰, 等. 水飞蓟宾类黄酮木质素衍生物的研究进展. 国际药学研究杂志, 2010, 37(3): 187-197. |
| [24] | Lv YK, Cheng XZ, Wu D, et al. Improving bioconversion of eugenol to coniferyl alcohol by in situ eliminating harmful H2O2. Bioresour Technol, 2018, 267: 578-583. DOI:10.1016/j.biortech.2018.07.104 |
| [25] | Lv YK, Gao S, Xu S, et al. Spatial organization of silybin biosynthesis in milk thistle[Silybum marianum (L.) Gaertn]. Plant J, 2017, 92(6): 995-1004. DOI:10.1111/tpj.13736 |
| [26] | Entian KD, K?tter P. Yeast genetic strain and plasmid collections. Methods Microbiol, 2007, 36: 629-666. DOI:10.1016/S0580-9517(06)36025-4 |
| [27] | Gao S, Lyu YB, Zeng WZ, et al. Efficient biosynthesis of (2S)-naringenin from p-coumaric acid in Saccharomyces cerevisiae. J Agric Food Chem, 2020, 68(4): 1015-1021. |
| [28] | Altschul SF, Madden TL, Sch?ffer AA, et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Res, 1997, 25(17): 3389-3402. DOI:10.1093/nar/25.17.3389 |
| [29] | Mortazavi A, Williams BA, McCue K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq. Nat Methods, 2008, 5(7): 621-628. DOI:10.1038/nmeth.1226 |
| [30] | Dos Santos JP, Zavareze EDR, Dias ARG, et al. Immobilization of xylanase and xylanase-β- cyclodextrin complex in polyvinyl alcohol via electrospinning improves enzyme activity at a wide pH and temperature range. Int J Biol Macromol, 2018, 118(Pt 13): 1676-1684. |
| [31] | Wei LN, Wang ZX, Zhang GL, et al. Characterization of terminators in Saccharomyces cerevisiae and an exploration of factors affecting their strength. Chem Bio Chem, 2017, 18(24): 2422-2427. DOI:10.1002/cbic.201700516 |
| [32] | Jin P, Kang Z, Yuan PH, et al. Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168. Metab Eng, 2016, 35: 21-30. DOI:10.1016/j.ymben.2016.01.008 |
| [33] | Hammer K, Mijakovic I, Jensen PR. Synthetic promoter libraries - tuning of gene expression. Trends Biotechnol, 2006, 24(2): 53-55. DOI:10.1016/j.tibtech.2005.12.003 |
| [34] | Redden H, Morse N, Alper HS. The synthetic biology toolbox for tuning gene expression in yeast. FEMS Yeast Res, 2014, 15(1): 1-10. |
| [35] | Palmer CM, Miller KK, Nguyen A, et al. Engineering 4-coumaroyl-CoA derived polyketide production in Yarrowia lipolytica through a β-oxidation mediated strategy. Metab Eng, 2019, 57: 174-181. |
| [36] | Jiao TT, Zhou JW, Xu S. Quantitative effect of the expression level of key genes in naringenin synthesis on the accumulation level of target products. Chin J Biotech, 2019, 35(7): 1256-1265 (in Chinese). 焦亭亭, 周景文, 徐沙. 柚皮素合成关键基因表达水平对目标产物积累水平的量化影响. 生物工程学报, 2019, 35(7): 1256-1265. |
| [37] | Liu QL, Yu T, Li XW, et al. Rewiring carbon metabolism in yeast for high level production of aromatic chemicals. Nat Commun, 2019, 10(1): 4976. |
