

1. 清华大学 化学工程系教育部 工业生物催化重点实验室,北京 100084;
2. 中国石油天然气股份有限公司大庆炼化公司,黑龙江大庆 163000
收稿日期:2020-03-24;接收日期:2020-06-11;网络出版时间:2020-06-17
基金项目:国家重点研发计划(No. 2018YFA0902200),国家自然科学基金(Nos. 21706145,21776157),中国博士后科学基金(No. 2017M610915)资助
摘要:表面活性素是一种新型生物表面活性剂,因其具有良好的表面活性、可生物降解及抗菌活性,在石油开采、医药、农业和食品化妆品等领域具有广阔的应用前景。高产表面活性素菌株的获得和发酵过程优化是其商业化生产的关键。文中考察了脂肪酸合成途径对表面活性素合成的影响,强化脂肪酸生物合成关键基因以及该途径全部基因分别构建了高产表面活性素枯草芽孢杆菌Bacillus subtilis THBS-2和THBS-8,并对发酵过程中氨基酸种类及添加量、诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)添加时间和添加量等条件对产物合成的影响进行考察,获得优化的两阶段前体添加方案:发酵3 h,加入IPTG和L-亮氨酸,使其终浓度分别为1.25 mmol/L、5 g/L;发酵24 h,添加L-亮氨酸(终浓度5 g/L)和浓缩培养基5 mL。优化条件下,枯草芽孢杆菌THBS-2摇瓶发酵48 h,表面活性素产量高达24 g/L;30 L发酵罐中发酵68 h,产物产量最高达到34 g/L。研究结果为表面活性素的工业化生产及应用奠定基础。
关键词:表面活性素重组枯草芽孢杆菌脂肪酸合成前体优化
Construction and optimization of engineered Bacillus subtilis for surfactin production
Miaomiao Wang1, Huimin Yu1, Xin He2, Yanmei Li2, Huaiyu Yang2


1. Key Laboratory of Industrial Biocatalysis Ministry of Education, Department of Chemical Engineering, Tsinghua University, Beijing 100084, China;
2. Daqing Refining & Petrochemical Company, Daqing 163000, Heilongjiang, China
Received: March 24, 2020; Accepted: June 11, 2020; Published: June 17, 2020
Supported by: National Key Research and Development Project (No. 2018YFA0902200), National Natural Science Foundation of China (Nos. 21706145, 21776157), China Postdoctoral Science Foundation (No. 2017M 610915)
Corresponding author: Huimin Yu. Tel: +86-10-62795492; Fax: +86-10-62770304; E-mail: yuhm@tsinghua.edu.cn.
Abstract: Surfactin has great potential applications in enhancing oil recovery, agriculture, pharmaceuticals, foods and beverages, and cosmetics due to its extraordinary surface activity, biodegradability, anti-bacterial activity and biocompatibility. Enhancing surfactin production by engineering surfactin-producer and optimizing culture conditions is the key of its industrial production and subsequent applications. In this study, the effect of fatty acid synthesis pathway on surfactin synthesis was investigated, and Bacillus subtilis THBS-2 and THBS-8 with high surfactin titer were constructed by overexpressing key genes involved in the fatty acid synthesis pathway. To optimize culture condition, the amount and adding time of isopropyl-beta-D-thiogalactopyranoside (IPTG) and amino acids were studied, and a two-stage culture method was obtained: IPTG (final concentration: 1.25 mmol/L) and leucine (final concentration: 5 g/L) were added at 3 h, leucine (final concentration 5 g/L) and condensed culture medium (5 mL) were added at 24 h. Applying this strategy, the surfactin titer of B. subtilis THBS-2 reached to 24 g/L in shake flask at 48 h and up to 34 g/L after 68 h fermentation in a 30-L fermentor. The results provide basis for large-scale production and broad application of surfactin.
Keywords: surfactinBacillus subtilisfatty acid synthesis pathwayculture optimization
表面活性素(Surfactin)是一类主要由芽孢杆菌属合成的脂肽类生物表面活性剂,由亲水的环7肽环(由Leu、Glu、Asp和Val 4种、共7个氨基酸组成)和疏水的脂肪酸链(C13–C17)通过内酯键相连而成[1-3]。由于其结构独特,具有可显著降低溶液表面张力、改变润湿性、改善界面性质、可生物降解和抗菌活性等特点而在石油开采、环境治理、医药农药、食品和化妆品等领域具有良好的应用前景[4-7]。然而,微生物发酵生产表面活性素效率低限制了其工业化生产和应用。
针对表面活性素发酵产率低这一问题,众多****围绕产表面活性素菌株筛选、基因改造、培养基及发酵条件优化等方面开展研究:Habe等[8]筛选得到一株表面活性素产量为1.84 g/L的枯草芽孢杆菌Bacillus subtilis NBRC 109107;姬杨等[9]对短小芽孢杆菌BA06发酵培养基组分进行优化,表面活性素产量由1.43 g/L提高到6.48 g/L;Sun等[10]用诱导型启动子Pspac替换基因组中表面活性素合酶原启动子PsrfA,表面活性素产量提升了约10倍(3.87 g/L); Wu等[3, 11]在枯草芽孢杆菌168中通过整合表面活性素合成激活因子、敲除竞争途径、强化脂肪酸前体供应等多个策略协同改造,将表面活性素产量提高到12.8 g/L。笔者课题组经由菌株筛选[12-13]、培养条件优化[13]、人工强诱导型启动子Pg3设计并替换基因组中原启动子PsrfA增强表面活性素合酶表达[14]、导入透明颤菌血红蛋白提高细胞低氧状态下生长及能量利用[15]、强化表达β-羟基脂肪酸合成路径中限速酶提高脂肪酸前体供应[16],得到了目前文献报道表面活性素产量最高(13.3 g/L)的基因工程菌B. subtilis TS1726Y。虽然工程菌株的表面活性素产量较天然生产菌株已有大幅提高,但发酵产率仍难以满足商业化生产的要求。为此,在前期研究基础上,力图通过强化β-羟基脂肪酸合成途径,结合优化培养条件进一步提高基因工程菌表面活性素发酵产量。
1 材料与方法1.1 菌株和质粒以产表面活性素枯草芽孢杆菌THY-7基因组为模板,用表 1所列引物扩增脂肪酸途径相关基因构建表 2所列的质粒和表 3中本研究所使用的菌株。
表 1 本研究中所使用的引物Table 1 Primers used in this study
| Primer name | Sequence (5′–3′) | Restriction sites |
| yngH-F | CACGGATCCATGTTTACAAAAGTACTGATC | BamHⅠ |
| yngH-R | AACTCTAGATTATAGGTGCTGTTTCA | XbaⅠ |
| accAD-F | CCCTCTAGAAAGGAGATGTTAAAGGATATATTCACG | XbaⅠ |
| accAD-R | ACAGACGTCTTAGTTTACCCCGATATATTGATCTTC | AatⅡ |
| fabD-F | CACCCTAGGAAGGAGGAGAATGAGTAAGATTGCATTTTTAT | AvrⅡ |
| fabD-R | CACTCTAGATTAAGCATTATCATTCTCCTCCTTA | XbaⅠ |
| fabHB-F | TATCCTAGGAAGGAGGAGAATGTCAAAAGCAAAAATTACA | AvrⅡ |
| fabHB-R | ACATCTAGATTACATCCCCCATTTAATAAGCAAT | XbaⅠ |
| Pg3-F | ATATCTAGAAGCTATTGTAACATAATCGGTACGG | XbaⅠ |
| Pg3-R | CACGACGTCAGATCCTTCCTCCTTTAATTGGGAA | AatⅡ |
| fabGF-F | ATATCTAGAATGCTTAATGATAAAACGGC | XbaⅠ |
| fabGF-R | CACGACGTCTTATAGGTGCTGTTTCAAAAAGTCA | AatⅡ |
| fabZ-F | ATAGACGTCAAAGGAGGAAGGAATGCTTGATACTCAGCAAAT | AatⅡ |
| fabZ-R | ACACCCGGGTTATTCTCCGAGGGCAAAAGTCAGTT | XmaⅠ |
| fabI-F | CACCCCGGGAAAGGAGGAAGATGAATTTTTCACTTGAAGGCCGTA | XmaⅠ |
| fabI-R | ATACCATGGTTAGCGGGCAGTGATATGGAAACCA | NcoⅠ |
| Underlined sequence: restriction sites. Sequence in italitics: ribosome binding site. | ||
表选项
表 2 本研究中所使用的质粒Table 2 Plasmids used in this study
| Plasmid name | Descriptions | Sources |
| pJMP-yngH | ColE1 ori, repA, KanaR(Bs), AmpR(Ec), Pg3-yngH | [10] |
| pJMP-YAD | ColE1 ori, repA, KanaR(Bs), AmpR(Ec), Pg3-yngH-accAD | This study |
| pJMP-YD | ColE1 ori, repA, KanaR(Bs), AmpR(Ec), Pg3-yngH-fabD | This study |
| pJMP-YHB | ColE1 ori, repA, KanaR(Bs), AmpR(Ec), Pg3-yngH-fabHB | This study |
| pJMP-YDHB | ColE1 ori, repA, KanaR(Bs), AmpR(Ec), Pg3-yngH-fabD-fabHB | This study |
| pJMP-YDHBGF | ColE1 ori, repA, KanaR(Bs), AmpR(Ec), Pg3-yngH-fabD-fabHB-Pg3-fabG-fabF | This study |
| pJMP-YDHBGFZI | ColE1 ori, repA, KanaR(Bs), AmpR(Ec), Pg3-yngH-fabD-fabHB-Pg3-fabG-fabF-fabZ-fabI | This study |
表选项
表 3 本研究中所使用的菌株Table 3 Strains used in this study
| Strains | Genotype | References or sources |
| E. coli TOP10 | Applied for harvesting plasmid | Solarbio (Beijing, China) |
| THY-7 | Wild type, CGMCC No. 8906 | [12] |
| THBS-1 | THY-7/Pg3-srfA, CmR | [14] |
| THBS-2 | THBS-1carrying plasmid pJMP-yngH | [16] |
| THBS-3 | THBS-1carrying plasmid pJMP-YAD | This study |
| THBS-4 | THBS-1carrying plasmid pJMP-YD | This study |
| THBS-5 | THBS-1carrying plasmid pJMP-YHB | This study |
| THBS-6 | THBS-1carrying plasmid pJMP-YDHB | This study |
| THBS-7 | THBS-1carrying plasmid pJMP-YDHBGF | This study |
| THBS-8 | THBS-1carrying plasmid pJMP-YDHBGFZI | This study |
表选项
1.2 培养基枯草芽孢杆菌种子培养基及脂肽发酵培养基配方见文献[13]。
浓缩培养基(g/L):红糖(食用级,市售) 350,NaNO3 125。
上述培养基于121 ℃、20 min高温高压灭菌。
1.3 培养方法1.3.1 种子培养从平板上挑取产表面活性素枯草芽孢杆菌单菌落接种于种子培养基,37 ℃、200 r/min培养16–18 h。
1.3.2 摇瓶发酵培养测定种子液生物量(OD600),并接种于装有50 mL发酵培养基的500 mL摇瓶中,使接种后溶液中OD600为0.2,37 ℃、200 r/min培养一定时间后取出在无菌超净台中加入诱导剂后继续摇床培养,48 h取样检测表面活性素产量。每组3个平行,取平均值。
1.3.3 30 L自动发酵罐培养30 L发酵罐装液量为10 L,调节pH至7.2,灭菌后冷却待用。
测定种子液生物量,并取适量接入发酵罐使发酵罐中OD600为0.2,温度控制为37 ℃,通风0.63 m3/h,转速≥250 r/min,发酵罐罐压保持0.06 MPa,发酵过程取样测定生物量和表面活性素产量。
1.3.4 IPTG及前体IPTG配制成100 mmol/L IPTG母液,过滤除菌,?20 ℃保存。
亮氨酸(Leu)、天门冬氨酸(Asp)、缬氨酸(Val)、谷氨酸(Glu)和福临门大豆油(Oil)常温保存。氨基酸在添加前放置于紫外灯下照射0.5 h。
1.3.5 两阶段补料方法添加IPTG时,同时加入经紫外线照射的Leu (终浓度为5 g/L);发酵24 h时,加入Leu (终浓度为5 g/L)和浓缩培养基(5 mL)。
1.4 表面活性素含量的测定将发酵液离心(13 000 r/min,3 min),上清液待测。
表面活性素产量通过高效液相法HPLC-UV定量测定[12]。采用LC-20AT (Shimadzu,Kyoto,Japan)系统,色谱柱为Amethyst C18-P column (5 μm,4.6 mm×250 mm),流动相为95%甲醇和10%水(含有0.1%三氟乙酸),进样量20 μL,流速1.0 mL/min,柱温40 ℃,采用紫外检测器检测,检测波长205 nm。表面活性素标准品购自Sigma公司,含4种同系物。
2 结果与分析2.1 强化脂肪酸合成途径构建高产表面活性素菌株表面活性素是以胞内合成的多种前体(脂肪酸、Leu、Glu、Asp和Val)为底物合成的[17-18],其分子结构中包含一条脂肪酸链和一个环7肽环。作为表面活性素合成的重要前体,胞内脂肪酸和氨基酸含量直接影响表面活性素产物的合成。
脂肪酸合成是所有生物体内共有的,其中乙酰CoA到丙二酰CoA的反应为脂肪酸合成的限速步骤,由羧基转移酶、生物素羧基载体蛋白和生物素羧化酶形成的乙酰辅酶A羧化酶复合体催化进行(图 1)。本课题组前期工作[16]表明,枯草芽孢杆菌中的生物素羧化酶Ⅱ(GeneID 939474,KEGG数据库中标注为yngH,NCBI数据库中标注为ldeHA)是该限速步骤的关键酶,过表达该基因的工程菌B. subtilis TS1726Y中表面活性素产量达到13.3 g/L,这是目前文献报道的最高产量。在此基础(THBS-2,即B. subtilis TS1726Y)上,过表达该复合体另一组分(羧基转移酶基因accAD)构建基因工程菌THBS-3。摇瓶发酵显示2株含质粒的基因工程菌生物量差异不大(图 2A),都较出发菌株略低。3株菌株表面活性素产量差异明显,THBS-3最高产量为10.7 g/L (图 2B),比出发菌株THBS-1提高了11.7%,但对比THBS-2,产量减少了18%。这可能是因为作为乙酰CoA羧化酶的重要组成成分,生物素羧化酶与羧基转移酶需共同存在形成复合体,进而催化丙二酰CoA的生成,该过程(图 1B)由生物素羧化酶和羧基转移酶各催化2个独立的半反应[19],而由羧基转移酶催化的第2个反应是可逆的[20-21],过表达羧基转移酶可能强化了该反应的逆反应过程,从而影响了表面活性素的合成。在THBS-2的基础上,强化脂肪酸合成途径中其他基因分别构建了工程菌THBS-4、THBS-5、THBS-6、THBS-7和THBS-8 (基因型如表 3所示),摇瓶发酵结果(图 2C)显示,过表达该途径相关基因均能促进表面活性素合成,说明强化脂肪酸前体的合成是提高菌株表面活性素合成能力的有效措施,这一结论与Wu等[11]在枯草芽孢杆菌168S12中强化酮脂酰CoA和支链脂肪酸途径进而提高表面活性素产量一致。进一步,当脂肪酸合成途径所有基因同时过表达(即THBS-8),表面活性素产量最高,达到13.7 g/L,对比出发菌株THBS-1提高了46.7%。但实验发现,THBS-8菌株多次摇瓶发酵时,批次间误差大,产量不稳定,因此,后续针对表面活性素产量高且稳定的THBS-2菌株进行发酵条件优化。
 |
| 图 1 枯草芽孢杆菌中脂肪酸合成途径 Fig. 1 Fatty acids synthesis pathway in B. subtilis. |
| 图选项 |
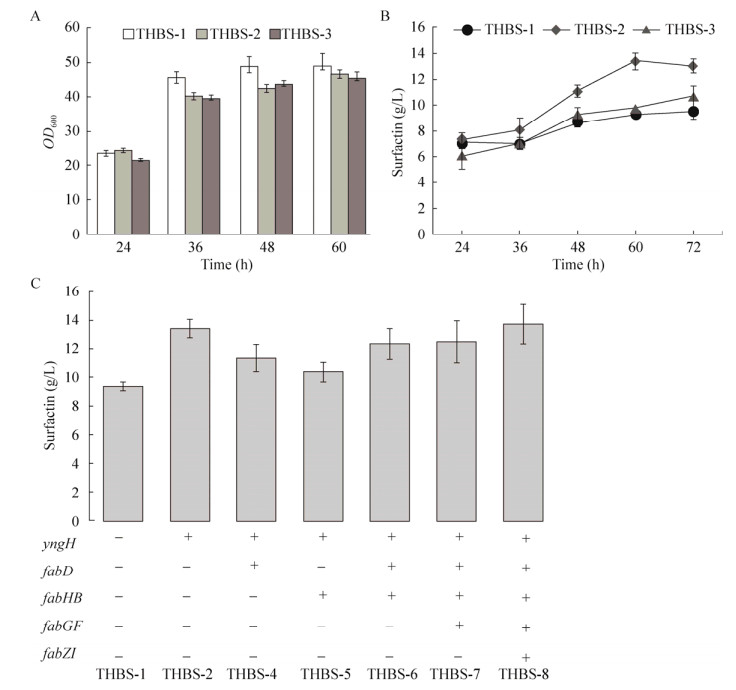 |
| 图 2 基因工程菌株摇瓶发酵生产表面活性素 Fig. 2 Surfactin production by engineered strains in flask culture.Time-course profiles of cell growth (A) and surfactin titer (B) by THBS-1, THBS-2 and THBS-3. (C) Surfactin production by all improved fatty acid biosynthesis B. subtilis in shaking flask culture at 60 h. |
| 图选项 |
2.2 诱导剂IPTG对表面活性素积累的影响高产表面活性素菌株THBS-2中用于强化表面活性素合酶以及脂肪酸合成的启动子Pg3受IPTG诱导[14],为此,对IPTG的添加时间和添加量进行考察。
首先,分别于不同发酵时间加入IPTG,发酵结束(60 h)时检测发酵液中生物量和表面活性素含量,结果如图 3所示。发酵不同时间加入IPTG对生物量影响差异不显著。在0–4 h内,随着IPTG加入时间的延迟,表面活性素产量逐渐增加,4 h时达到最高;IPTG超过4 h添加,表面活性素产量显著下降。综合考虑生物量和产物产量,选择3 h添加IPTG,此条件下可获得12 g/L产物。
 |
| 图 3 IPTG添加时间对生物量(A)和表面活性素(B)的影响 Fig. 3 Effect of IPTG addition time on biomass (A) and surfactin production (B). |
| 图选项 |
随后,于发酵3 h加入不同剂量IPTG,发酵结束(60 h)时发酵液中生物量和表面活性素产量如图 4所示。加入不同剂量IPTG对生物量影响差异不显著,但对产物产量影响显著。诱导剂添加量低(终浓度1.0 mmol/L)或高(终浓度1.75 mmol/L或2.0 mmol/L)都不利于产物合成,当加入终浓度为1.25 mmol/L IPTG时,表面活性素产量最高。
 |
| 图 4 IPTG添加量对生物量(A)和表面活性素(B)的影响 Fig. 4 Effect of IPTG concentration on biomass (A) and surfactin production (B). |
| 图选项 |
2.3 不同氨基酸对表面活性素积累的影响表面活性素由环7肽环和脂肪酸组成,以图 5A所示分子结构为例,表面活性素分子中含有Leu、Glu、Asp和Val 4种氨基酸,且其摩尔比约为4︰1︰1︰1。发酵3 h摇瓶中分别添加0.2 g表面活性素组成氨基酸(Leu、Glu、Asp、Val)以及等比例混合氨基酸,发酵48 h表面活性素产量如图 5B所示。补充Leu的实验组产量比对照组提高了约25%,此外,添加Val及混合氨基酸的实验组表面活性素产量略优于对照组,而添加Glu和Asp对THBS-2合成表面活性素呈现负作用,这可能是由于外源添加Glu会抑制TCA循环、脂肪酸β氧化和电子传递[22],进而影响表面活性素的合成。发酵过程中添加Leu和Val能有效促进表面活性素合成,这一结果与文献报道一致。姬杨等[9]在对短小芽孢杆菌BA06发酵产表面活性素的培养条件进行优化时,发现Val、Tyr、Gly、Phe、Glu和Thr这6种氨基酸中Val和Tyr更有利于表面活性素合成。此外,朱玲燕等[23]在以葡萄糖培养基发酵合成表面活性素研究中,发现添加Leu显著提高表面活性素产量。同样,Yao等[24]也发现培养基中添加Leu和Lys能提高发酵液中表面活性素产量。
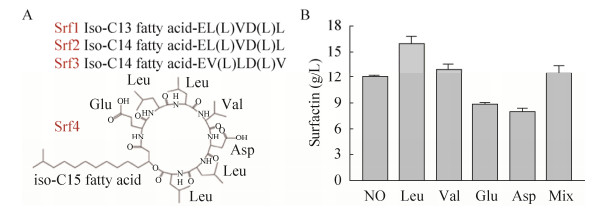 |
| 图 5 氨基酸对表面活性素积累的影响 Fig. 5 Effect of amino acids on surfactin production.(A) The molecular structure of surfactin. (B) Effect of adding different amino acids on surfactin production. |
| 图选项 |
2.4 Leu添加时间及添加量对表面活性素积累的影响由2.3结果可知,4种氨基酸前体中,Leu对提高表面活性素产量效果显著。本节对Leu添加时间和添加量进行优化,结果如图 6所示。对比发酵开始即加入Leu,在发酵3 h或6 h加入Leu对产物合成有更显著的促进作用,但这二者之间差异不显著,考虑到发酵操作方便性,于发酵3 h加入IPTG时一同加入Leu。分析图 6B发现,添加Leu,使其终浓度为1–5 g/L时,发酵液中表面活性素产量随着Leu添加量增加而增大,而Leu添加量继续增大至终浓度为6 g/L时,表面活性素产量并不能继续随之增加,因此,Leu的最优添加量应为5 g/L,此时表面活性素产量(发酵48 h)最高,达到17.4 g/L。
 |
| 图 6 Leu添加时间、添加量对表面活性素合成的影响 Fig. 6 Effects of Leu addition time (A) and concentration (B) on surfactin production. |
| 图选项 |
2.5 二次添加前体对表面活性素积累的影响为进一步提高表面活性素产量,发酵24 h时,二次添加表面活性素前体和营养物(Leu终浓度5 g/L、5 mL大豆油、5 mL浓缩培养基、5 g/L Leu+5 mL大豆油、5 g/L Leu+5 mL浓缩培养基),考察其对产物积累的影响,结果如图 7所示。二次添加上述前体和营养物均能进一步提高产量,尤其是同时添加Leu (终浓度5 g/L)和浓缩培养基(5 mL)能非常显著地促进表面活性素合成,发酵48 h时平均产量达到24 g/L。
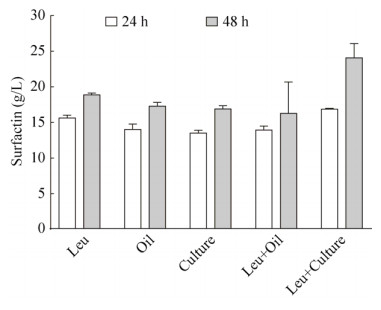 |
| 图 7 二次添加前体或营养物对表面活性素积累的影响 Fig. 7 Effects of secondary addition of precursor and culture medium on surfactin production. |
| 图选项 |
2.6 优化条件下重组枯草芽孢杆菌合成表面活性素通过优化上述各因素,得到THBS-2的优化培养策略:发酵3 h,加入诱导剂IPTG (终浓度为1.25 mmol/L)和Leu (终浓度为5 g/L);发酵24 h,二次添加Leu (终浓度5 g/L)和浓缩培养基(5 mL)。
采用优化前/后培养方案摇瓶发酵B. subtilis THBS-2菌株并每隔12 h测定发酵液中产物含量,结果如图 8A所示。优化前,表面活性素产量60 h达到最高,为13.6 g/L;采用优化后的两阶段补料法时,发酵时间缩短至48 h且产物产量最高达到24 g/L,这一结果与不加前体相比,表面活性素产量提高了近一倍。
 |
| 图 8 THBS-2菌株二阶段优化培养条件下摇瓶(A)和30 L发酵罐(B)发酵结果 Fig. 8 Time course profiles of surfactin production by B. subtilis THBS-2 under the two-stage scheme of adding precursor in flask culture(A) and 30-L fermenter (B). |
| 图选项 |
将上述两阶段补料策略应用于30 L发酵罐发酵,结果如图 8B所示。发酵前8 h菌株处于延迟期,此阶段菌株在适应环境,发酵液中pH降低,而后进入菌体快速繁殖期,同时菌株开始合成表面活性素,发酵液pH缓慢上升,发酵68 h后产物不再进一步合成,表面活性素产量为34 g/L,这是已知文献报道的最高表面活性素产量。
3 结论经过摇瓶发酵优化,利用优化后的两阶段前体添加策略,B. subtilis THBS-2摇瓶发酵48 h,表面活性素平均产量达到24 g/L,30 L发酵罐中表面活性素产量最高达到34 g/L。此结果为已有报道中最高产量,实现了30 L发酵罐中表面活性素高水平生产,有望实现枯草芽孢杆菌表面活性素工业化生产。
参考文献
| [1] | Peypoux F, Bonmatin JM, Wallach J. Recent trends in the biochemistry of surfactin. Appl Microbiol Biot, 1999, 51(5): 553-563. DOI:10.1007/s002530051432 |
| [2] | Baltz RH. Combinatorial biosynthesis of cyclic lipopeptide antibiotics: a model for synthetic biology to accelerate the evolution of secondary metabolite biosynthetic pathways. ACS Synth Biol, 2014, 3(10): 748-758. DOI:10.1021/sb3000673 |
| [3] | Hu FX, Li S. Directed modification of strains for surfactin production. Acta Microbiol Sin, 2018, 58(10): 1711-1721 (in Chinese). 胡仿香, 李霜. 生物表面活性剂Surfactin生产菌株的定向改造策略. 微生物学报, 2018, 58(10): 1711-1721. |
| [4] | Seydlová G, Svobodová J. Review of surfactin chemical properties and the potential biomedical applications. Cent Eur J Med, 2008, 3(2): 123-133. |
| [5] | Cui YH, Huang XQ. Surfactant from microbial-surfactin. Biotechnology, 2006, 16(5): 91-94 (in Chinese). 崔艳红, 黄现青. 生物表面活性剂——表面活性素. 生物技术, 2006, 16(5): 91-94. |
| [6] | Yi YJ, Wang K, Zhou GZ, et al. Advance in study on cyclic lipopeptides produced by Bacillus. J Henan Univ Technol: Nat Sci Ed, 2018, 39(3): 127-134 (in Chinese). 伊艳杰, 王康, 周广舟, 等. 芽孢杆菌合成环脂肽的研究进展. 河南工业大学学报:自然科学版, 2018, 39(3): 127-134. |
| [7] | Yoneda T, Tsuzuki T, Ogata E, et al. Surfactin sodium salt: An excellent bio-surfactant for cosmetics. J Cosmet Sci, 2015, 52(2): 153-154. |
| [8] | Habe H, Taira T, Imura T. Screening of a Bacillus subtilis strain producing multiple types of cyclic lipopeptides and evaluation of their surface-tension-lowering activities. J Oleo Sci, 2017, 66(7): 785-790. DOI:10.5650/jos.ess17039 |
| [9] | Ji Y, Feng H. Optimization of fermentation medium for producing surfactin by Bacillus pumilus BA06. J Sichuan Univ: Nat Sci Ed, 2016, 53(4): 925-930 (in Chinese). 姬杨, 冯红. 短小芽孢杆菌BA06产表面活性素培养基组分的优化. 四川大学学报:自然科学版, 2016, 53(4): 925-930. |
| [10] | Sun HG, Bie XM, Lu FX, et al. Enhancement of surfactin production of Bacillus subtilis fmbR by replacement of the native promoter with the Pspac promoter. Can J Microbiol, 2009, 55(8): 1003-1006. DOI:10.1139/W09-044 |
| [11] | Wu Q, Zhi Y, Xu Y. Systematically engineering the biosynthesis of a green biosurfactant surfactin by Bacillus subtilis 168. Metab Eng, 2019, 52: 87-97. DOI:10.1016/j.ymben.2018.11.004 |
| [12] | Yang H, Yu HM, Shen ZY. A novel high-throughput and quantitative method based on visible color shifts for screening Bacillus subtilis THY-15 for surfactin production. J Ind Microbiol Biotechnol, 2015, 42(8): 1139-1147. DOI:10.1007/s10295-015-1635-4 |
| [13] | Liu H, Yang H, Li X, et al. Identification of Bacillus subtilis THY-7 and high titer optimization for the blend-biosurfactant of lipopeptide and glycolipid. Chin J Biotech, 2013, 29(4): 1870-1874 (in Chinese). 刘皓, 杨欢, 李雪, 等. 脂肽-糖脂混合生物表面活性剂产生菌筛选和优化培养. 生物工程学报, 2013, 29(12): 1870-1874. |
| [14] | Jiao S, Li X, Yu HM, et al. In situ enhancement of surfactin biosynthesis in Bacillus subtilis using novel artificial inducible promoters. Biotechnol Bioeng, 2017, 114(4): 832-842. DOI:10.1002/bit.26197 |
| [15] | Wang Q, Yu HM, Wang MM, et al. Enhanced biosynthesis and characterization of surfactin isoforms with engineered Bacillus subtilis through promoter replacement and Vitreoscilla hemoglobin co-expression. Process Biochem, 2018, 70: 36-44. DOI:10.1016/j.procbio.2018.04.003 |
| [16] | Wang MM, Yu HM, Shen ZY. Antisense RNA-based strategy for enhancing surfactin production in Bacillus subtilis TS1726 via overexpression of the unconventional biotin carboxylase Ⅱ to enhance ACCase activity. ACS Synth Biol, 2019, 8(2): 251-256. DOI:10.1021/acssynbio.8b00459 |
| [17] | Pratap SS, Seema G, Neetu P, et al. Surfactin: a review on novel microbial surfactant. Int J Bioassays, 2013, 2(5): 740-745. |
| [18] | Shaligram NS, Singhal RS. Surfactin-A review on biosynthesis, fermentation, purification and applications. Food Technol Biotechnol, 2010, 48(2): 119-134. |
| [19] | Cronan JE Jr, Waldrop GL. Multi-subunit acetyl-CoA carboxylases. Progr Lipid Res, 2002, 41(5): 407-435. DOI:10.1016/S0163-7827(02)00007-3 |
| [20] | Blanchard CZ, Waldrop GL. Overexpression and kinetic characterization of the carboxyltransferase component of acetyl-CoA carboxylase. J Biol Chem, 1998, 273(30): 19140-19145. DOI:10.1074/jbc.273.30.19140 |
| [21] | Guchhait RB, Polakis SE, Lane MD. Carboxyltransferase component of acetyl-CoA carboxylase from Escherichia coli. Methods Enzymol, 1975, 35: 32-37. DOI:10.1016/0076-6879(75)35135-5 |
| [22] | Zhang Y. Transcriptome analysis of Bacillus subtilis responding to valine, glutamate and glutamine[D]. Shanghai: East China University of Science and Technology, 2010 (in Chinese). 张燕.枯草杆菌响应缬氨酸, 谷氨酸和谷氨酰胺的转录组研究[D].上海: 华东理工大学, 2010. |
| [23] | Zhu YL, Liu Q, Liu Y, et al. Optimization of culture medium for high production of surfactin C15 component by Bacillus subtilis. Chin J Biopr Eng, 2015, 13(5): 8-13 (in Chinese). 朱玲燕, 刘强, 刘洋, 等. 培养基组分对枯草芽胞杆菌产表面活性素的影响. 生物加工过程, 2015, 13(5): 8-13. |
| [24] | Yao SL, Lu ZX, Hao TY, et al. Effect of amino acids and carbon backbone precursors on surfactin biosynthesis. J Nanjing Agric Univ, 2014, 37(2): 139-145 (in Chinese). 姚树林, 陆兆新, 郝天怡, 等. 氨基酸和碳架物质前体对surfactin生物合成的影响. 南京农业大学学报, 2014, 37(2): 139-145. |
