李洋洋1,2, 王权2, 郭容2, 张海洋2, 刘鹏选1,2, 齐瑜2, 方维焕3, 孙卫东1

 , 蒋蔚2
, 蒋蔚2

1. 南京农业大学动物医学院, 江苏 南京 210095;
2. 中国农业科学院上海兽医研究所, 上海 200241;
3. 浙江农林大学动物科技学院, 浙江 临安 311300
收稿日期:2021-02-09;修回日期:2021-03-30;网络出版日期:2021-04-27
基金项目:国家自然科学基金(31702277);上海市自然科学基金(17ZR1437200);中央级公益性科研院所基本科研业务费专项资金(2020JB07)
*通信作者:孙卫东, E-mail: swd100@njau.edu.Cn;
蒋蔚, Tel/Fax: +86-21-34293397;E-mail: jiangweijw99@163.com.
摘要:Ⅵ型分泌系统(T6SS)是细菌的一种毒力因子分泌系统,通过分泌蛋白参与调控细菌的环境适应性和毒力。副溶血弧菌具有两个T6SS系统(T6SS1和T6SS2)。[目的] 前期通过差异蛋白质组学技术筛选到副溶血弧菌T6SS1相关的分泌蛋白,本文选择其中的VPA1500为研究对象,研究其基因缺失对副溶血弧菌的生物学特性及致病性的影响。[方法] 利用同源重组技术构建缺失株ΔVPA1500和互补株CΔVPA1500;分析各菌株生长特性、在体外的细菌竞争能力、运动性、细菌鞭毛相关基因的转录水平及生物被膜形成能力的差异,比较各菌株对细胞毒性、小鼠毒力、动物组织载菌量以及组织病理学变化的影响。[结果] 与野生株相比,VPA1500基因缺失后不影响细菌的生长能力、生物被膜形成能力和群集运动,然而ΔVPA1500的浮泳运动能力显著下降;进一步通过透射电镜观察和实时定量PCR检测发现,VPA1500缺失影响副溶血弧菌鞭毛的形成;细菌竞争实验显示缺失VPA1500基因降低了副溶血弧菌野生株体外对大肠杆菌的杀伤能力;ΔVPA1500对细胞毒性、小鼠毒力以及在动物组织的定殖能力均显著低于野生株,互补株毒力基本恢复至野生株水平;组织病理学结果进一步表明,缺失VPA1500基因能够降低副溶血弧菌对小鼠组织的损伤。[结论] VPA1500参与副溶血弧菌的体外细菌竞争能力、浮游运动能力和致病性。
关键词:副溶血弧菌VPA1500运动性鞭毛致病性
Study on biological characteristics and pathogenicity of VPA1500 gene knock-out mutant of Vibrio parahaemolyticus
Yangyang Li1,2, Quan Wang2, Rong Guo2, Haiyang Zhang2, Pengxuan Liu1,2, Yu Qi2, Weihuan Fang3, Weidong Sun1

 , Wei Jiang2
, Wei Jiang2

1. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China;
2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China;
3. College of Animal Science and Technology, Zhejiang Agriculture & Forestry University, Lin'an 311300, Zhejiang Province, China
Received: 9 February 2021; Revised: 30 March 2021; Published online: 27 April 2021
*Corresponding author: Weidong Sun, E-mail: swd100@njau.edu.Cn;
Wei Jiang, Tel/Fax: +86-21-34293397;E-mail: jiangweijw99@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31702277), by the Shanghai Natural Science Foundation of China (17ZR1437200) and by the Basic Foundation for Scientific Research of State-level Public Welfare Institutes of China (2020JB07)
Abstract: The type Ⅵ secretion system (T6SS) is widespread in bacterial pathogens and used to deliver virulence effector proteins into target cells. Vibrio parahaemolyticus also harbours T6SS gene clusters and possesses two T6SSs, T6SS1 and T6SS2. [Objective] In previous work, we identified several potential T6SS effectors by using comparative proteomics. In this study, VPA1500 was chosen to explore the roles on biological characteristics and pathogenicity of Vibrio parahaemolyticus. [Methods] The deletion mutant ΔVPA1500 and complementary strain CΔVPA1500 were constructed by using homologous recombination technology. Growth characteristics, anti-bacterial activity in vivo, motility, the transcription level of flagella-related genes, and biofilm formation ability were analyzed in the wild-type strain (WT), ΔVPA1500 and CΔVPA1500. Furthermore, cytotoxicity to host cell, lethality rate in mice, bacterial colonization, and histopathological changes were also analyzed between WT and ΔVPA1500. [Results] Compared with WT, there were no significant changes in growth characteristics, swarming ability, and biofilm formation of ΔVPA1500 (P > 0.05), while swimming ability was significantly decreased (P < 0.05). Transmission electron micrographs showed that VPA1500 deletion affected the formation of bacterial flagella in V. parahaemolyticus. qPCR results also showed that the VPA1500 gene significantly inhibited the transcription level of some flagella-related genes in WT. Bacterial competition experiments showed that the deletion of VPA1500 reduced the anti-bacterial activity of Vibrio parahaemolyticus against E. coli in vitro. However, ΔVPA1500 showed significantly weaker cytotoxicity to Hela cells than WT. In addition, ΔVPA1500 exhibited attenuated virulence in mice that showed lower a lethality rate than that of the wild-type strain. Moreover, VPA1500 deletion affected the colonization in heart, liver, spleen, and kidney of mice, whereas the complementation strain restored the virulence to resemble that of WT. Histopathological analyses further demonstrated that detection of VPA1500 could reduce the damage of Vibrio parahaemolyticus to tissues in mice. [Conclusion] The VPA1500 plays an important role in swimming motility, pathogenicity, and anti-bacterial activity in V. parahaemolyticus.
Keywords: Vibrio parahaemolyticusVPA1500motilityflagellapathogenicity
Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)是细菌的一种新型蛋白分泌系统,首次在霍乱弧菌和铜绿假单胞菌中被鉴定出来[1–2],目前发现大约25%的革兰氏阴性菌存在一个或多个T6SS[3]。T6SS是一种纳米机器,与细菌在环境中的生存和对宿主的致病性相关。T6SS主要通过分泌的效应因子发挥作用,能够传递效应因子并作用于原核生物和真核生物靶细胞[4]。已有研究证实,T6SS可以抵抗宿主防御机制,帮助细菌在宿主体内定殖及生存[5]。Pukatzki等[6]证实在霍乱弧菌中VgrG-1对T6SS依赖的细胞毒性作用至关重要。
副溶血弧菌(Vibrio parahaemolyticus)广泛分布于海洋环境中,可以导致水生动物发病,如虾急性肝胰腺坏死病,给水产养殖带来严重的经济损失[7]。食用被致病性副溶血弧菌污染的水产品可能会导致患者腹部绞痛、腹泻、呕吐等,严重者导致胃肠炎患者死亡[8]。目前已经确定了副溶血弧菌的多种毒力相关因子,主要有热稳定直接溶血素(the rmostable direct hemolysin,TDH)、耐热直接溶血相关毒素(TDH-related hemolysin,TRH)、Ⅲ型分泌系统(the type Ⅲ secretion systems,T3SSs)和Ⅵ型分泌系统等[3, 9]。副溶血弧菌编码两种功能性T6SS (T6SS1和T6SS2)[10]。T6SS1位于1号染色体(VP1386-VP1414),T6SS2位于2号染色体(VPA1025-VPA1046)[11],存在于所有副溶血弧菌分离株中。已有研究表明副溶血弧菌的T6SS1和T6SS2与粘附宿主细胞相关[12],T6SS1与细菌竞争性相关[13]。Salomon等[14]通过差异蛋白质组学找到了6个与T6SS1相关的分泌蛋白,发现其中VP1391和VP1407与Hcp1表达、分泌和细菌杀伤能力相关。目前关于副溶血弧菌T6SS效应因子的研究还处于初期阶段。
T6SS装置由13种核心蛋白组成[15]。Hcp是一种溶血素共调节蛋白,同时也是一种转运蛋白,能够将效应因子从细菌内部传送到宿主细胞的细胞质[16]。VipA是一种主要结构蛋白,Hcp是转位蛋白,VipA通过伸缩作用推送Hcp将效应蛋白输送到细菌外或宿主细胞内[17]。本实验室前期构建了T6SS1的双组分VipA1和Hcp1的基因缺失株ΔvipA1-hcp1,并通过差异蛋白质组学技术(lab-free quantitation)比较分析野生株SH112和ΔvipA1-hcp1的分泌差异蛋白[3, 17],从中发现了部分潜在效应因子,本研究选取其中的VPA1500作为研究对象,以副溶血弧菌SH112为亲本株,利用同源重组技术构建VPA1500基因缺失株和互补株,深入探究VPA1500在副溶血弧菌生物学特性及致病性中的作用。
1 材料和方法 1.1 试验材料 副溶血弧菌SH112株,同源重组质粒pYAK1、pRK2013-HB101、pMMB-207,Hela细胞,均为本实验室保存;大肠杆菌DH5α (含pBAD33-Gm)购自北京中源合聚生物科技有限公司;ICR (Institute of Cancer Research)小鼠购自上海杰思捷实验动物有限公司;细菌基因组DNA快速提取和质粒提取试剂盒购自天根生化科技(上海)有限公司;胶回收试剂盒、PCR产物纯化试剂盒购自赛默飞世尔科技(Thermo Fisher Scientific)有限公司;限制性内切酶、2000 DNA Marker及T4连接酶购自大连TaKaRa公司;CytoTox 96非放射性细胞毒性检测试剂盒购自Promega公司;DMEM细胞培养基和胎牛血清均购自Gibco公司;细胞培养相关耗材购自美国Corning公司;硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)购自广东环凯微生物公司;结晶紫染色液购自上海碧云天生物技术有限公司;细胞计数仪购自Bio-Rad公司;普通PCR仪和高速低温离心机购自Eppendorf公司。
1.2 VPA1500基因缺失株和互补株的构建 根据副溶血弧菌RIMD2210633基因序列VPA1500 (GenBank:BA000032.2),用Primer Premier 5.0软件设计引物用于构建VPA1500基因的缺失株和互补株(表 1)。
表 1. 本研究中所用引物 Table 1. Primers used in this study
| Primers | Primer pairs sequence (5'→3')a | Restriction enzyme |
| VPA1500-A/B | AAAGGATCCGCCAACACCAAATGAG/ATCTGCCTCCGATAATTCAAGTGCCAA | BamH I |
| VPA1500-C/D | TTATCGGAGGCAGATCTTGCTCGTCAAATTA/ GCTGCAGTACATCGGCTGGCTGGGTGC | Pst I |
| VPA1500-E/F | AAACACGGAGTTAGGC/GCAGGCGTTACTACATTA | |
| VPA1500-pMMB-F/R | AAAGGATCCATGGAATTTACAGAGCTGGA/ AAGCTGCAGCTAGCTAACTTGGTGAACGT | BamH I/Pst I |
| sacB-F/R | ACGGCACTGTCGCAAACTAT /TTCCGTCACCGTCAAAGAT | |
| a: restriction enzyme sites are underlined. | ||
表选项
以副溶血弧菌SH112株为野生株(WT),挑取WT单菌落接种于3% NaCl-LB液体中培养至生长对数期,利用基因提取试剂盒提取其DNA。以野生株DNA为模板,分别以VPA1500-A/B和VPA1500-C/D为引物进行扩增得到VPA1500的上、下游同源臂AB、CD片段,以上述回收、纯化的PCR产物为模板,利用融合PCR将AB、CD片段融合成VPA1500-AD片段。使用BamH I/Pst I对pYAK1质粒和VPA1500-AD片段进行双酶切,经T4 DNA连接酶连接后通过热激转化至CC118 λpir感受态细胞中,涂布至含氯霉素抗性(10 μg/mL)的平板上。挑取单菌落进行PCR验证,命名阳性重组质粒为VPA1500-pYAK1。参照文献[3]的方法进行接合转移。运用引物VPA1500-E/F筛选、鉴定不含氯霉素抗性基因的缺失株,将成功缺失VPA1500并经sacB-F/R扩增无目的条带的菌株命名为ΔVPA1500。
以野生株DNA为模板,经VPA1500-pMMB-F/R扩增获得整个ORF片段,对pMMB-207质粒和VPA1500-pMMB片段进行双酶切,经连接后转入CC118 λpir感受态细胞,于含10 μg/mL氯霉素的LB平板上培养,挑取单菌落进行PCR鉴定成功后测序,命名阳性互补质粒为VPA1500-pMMB。同样参考文献[3]的方法进行接合转移试验,利用引物VPA1500-E/F和VPA1500-pMMB-F/R进行PCR鉴定,其阳性菌株命名为CΔVPA1500。
1.3 生长曲线测定 挑取WT、ΔVPA1500、CΔVPA1500单菌落接种于3% NaCl-LB液体中培养至生长对数期,以1:100 (V/V)接种于新的3% NaCl-LB液体中,37 ℃振荡培养12 h,每隔1 h吸取100 μL液体测定OD600值,该实验重复3次。
1.4 细菌竞争能力检测 细菌竞争性实验参考文献[14, 18]并经适当修改:将WT、ΔVPA1500、CΔVPA1500接种于3% NaCl-LB液体培养基中,大肠杆菌DH5α (含pBAD33-Gm质粒)接种于含庆大霉素抗性(50 μg/mL) LB液体中,均培养至对数生长期,进行细菌计数,分别按照4:1 (副溶血弧菌: 大肠杆菌)的比例充分混匀,吸取100 μL的菌液加到3% NaCl-LB固体培养板上,在0 h和37 ℃孵育4 h后,将细菌从平板上洗下并倍比稀释,分别涂于TCBS与含庆大霉素抗性LB (50 μg/mL)平板确定剩余存活菌数。该实验重复至少两次,结果相似。仅呈现一个有代表性的实验结果。
1.5 群集和浮泳运动 群集实验需预先配置1.5%琼脂、3% NaCl-LB的BHI固体培养基[19],将WT、ΔVPA1500、CΔVPA1500培养至OD600=0.20±0.02时,各取2 μL垂直滴于平板上,正置于30 ℃温箱中静置培养24 h,拍照并记录菌株运动直径。
浮泳实验需要预先配置0.3%琼脂、3% NaCl-LB半固体培养基[20],同群集实验一样,各取2 μL垂直滴于平板上,正置于37 ℃温箱培养4 h,拍照并记录菌株运动直径。
1.6 电镜观察鞭毛 将WT、ΔVPA1500、CΔVPA1500划线接种于3% NaCl-LB固体培养皿上过夜培养,次日挑取大小一致的单菌落接种于3% NaCl-LB液体中培养至生长对数期。每种菌液吸取2 μL滴于0.3%琼脂-3% NaCl-LB半固体培养基上,37 ℃培养3.5 h后,参考王少辉等[21]的方法进行电镜观察实验,主要观察细菌的极性鞭毛结构及形态变化。
1.7 实时荧光定量PCR (qRT-PCR)检测鞭毛相关基因的表达 qRT-PCR检测VPA1500基因缺失对副溶血弧菌极性鞭毛相关基因转录水平的影响,引物设计参照文献[20],以gap为内参基因,详细序列见表 2。将3种菌株培养至生长对数期,分别取1 mL菌液提取mRNA后反转录成cDNA,根据SYBRP remix Ex Taq (中国大连,TaKaRa)步骤分析转录水平,在Applied Biosystems 7500快速实时PCR系统上运行。设置反应参数:95 ℃预变性2 min;PCR反应阶段:95 ℃ 15 s;60 ℃ 30 s,40个循环;溶解曲线绘制阶段:95 ℃ 1 s;60 ℃ 1 min;95 ℃ 15 s。使用2–ΔΔCt法计算各菌株基因转录水平差异。
表 2. 实时荧光定量检测鞭毛基因引物 Table 2. Real time quantitative PCR detection primers
| Primers | Primer pairs sequence (5′→3′) |
| flgE-RT-F | TGGGGTGAATCAAACAAAGGC |
| flgE-RT-R | TTATCTAATCTGCAGGATATT |
| fliF-RT-F | GAAACCAGCCTAATTGGTAGC |
| fliF-RT-R | TTAGCCATTTTCGTTCATCCA |
| fliD-RT-F | ATTCGTACGCGAGAGAAAAGT |
| fliD-RT-R | TTAACCTAACGCACTCATAAG |
| flaA-RT-F | ATCAGCAACCTAGACAACATA |
| flaA-RT-R | TTAGCCCAACAAGCTTAGCGC |
| flgM-RT-F | AGCCAACAAAGTAAAGCCGTC |
| flgM-RT-R | TTAGCTTTTGCCTTGCAATTC |
| gap-RT-F | TTTGAAGAGCGTCCGTTGGTG |
| gap-RT-R | TTAAGCCAACACAACGTTACG |
表选项
1.8 各菌株生物被膜形成能力的测定 将WT、ΔVPA1500、CΔVPA1500培养至OD600=0.20±0.02时,各吸取200 μL菌液加到酶标板中,每种菌株重复8个孔,以空白培养基为对照组,37 ℃温箱静置培养48 h。培养完成后,弃去菌液上清,用无菌PBS洗涤3次除去多余菌液,60 ℃烘干固定30 min,每孔加入0.1%结晶紫染液染色15 min后,PBS洗涤3次烘干。最后加入200 μL无水乙醇作用10 min,用酶标仪测量595 nm处的吸光值(OD595)。
1.9 细胞毒性试验 本实验参考白雪瑞[9]的实验方法,将Hela细胞铺于96孔细胞板中,过夜培养长至80%–90%覆盖率,用PBS清洗2遍后,每个试验孔加入50 μL无酚红DMEM待用。将WT、ΔVPA1500、CΔVPA1500培养至OD600=0.20±0.02时,用无酚红DMEM清洗3遍并倍比稀释,按照MOI=100:1感染Hela细胞,每个细胞孔加入50 μL菌液作为试验孔,重复6个孔;将细胞板放置于37 ℃、5% CO2培养箱中孵育1.5 h。本实验采用CytoTox 96试剂盒检测细胞上清液中乳酸脱氢酶(LDH)的释放,参照说明书计算各菌株感染细胞后的LDH释放百分比。
1.10 对小鼠毒力的影响 为了测定WT、ΔVPA1500、CΔVPA1500三种菌株对4周龄ICR实验小鼠的毒力作用,本实验将3种菌株培养至生长对数期,离心重悬于生理盐水中清洗3遍,调整浓度至5×108 CFU/mL。用酒精棉球消毒小鼠腹部,腹腔注射实验组小鼠(100 μL)与空白对照组小鼠(100 μL生理盐水),每组6只小鼠,每隔1 h观察并记录小鼠存活率,连续观察48 h,最终绘制ICR小鼠存活率图。
1.11 细菌组织载量 根据体重将4周龄的ICR小鼠平均分成4组(WT、ΔVPA1500、CΔVPA1500、空白对照组),每组6只,以1×107 CFU/只细菌剂量腹腔注射,测定不同菌株在小鼠心、肝、脾、肾等组织的定殖能力。攻毒15 h后处死小鼠并进行无菌解剖,将各个组织研磨后,以无菌PBS倍比稀释组织匀浆,涂布于TCBS琼脂平板培养12 h后,平板计数,计算每种细菌在ICR小鼠4种器官中每克的载菌量。每个样品重复3次。
1.12 组织病理学切片观察 WT、ΔVPA1500、CΔVPA1500分别以1×107 CFU/只细菌剂量腹腔注射5周龄ICR小鼠,空白对照组注射生理盐水,16 h后收集小鼠肝脏、脾脏、肾脏等新鲜病料,样品经4%多聚甲醛固定并石蜡包埋,H.E染色,并通过光学显微镜进行组织病理学观察(武汉塞维尔生物科技有限公司)。
1.13 数据分析 所有试验均重复3次。数据采用Graph Pad Prism 8软件进行单因素方差分析(one-way ANOVA),用平均数±标准差(X±SD)表示。P < 0.05认为是变化显著。
2 结果和分析 2.1 基因缺失株ΔVPA1500及互补株CΔVPA1500的鉴定 如图 1所示,用VPA1500-E/F引物扩增野生株基因组时,目的片段为2119 bp (泳道1),扩增缺失株基因组获得片段1771 bp (泳道2),用引物VPA1500-pMMB-F/R扩增缺失株基因组时,无目的基因片段(泳道5),表明ΔVPA1500缺失株构建成功。
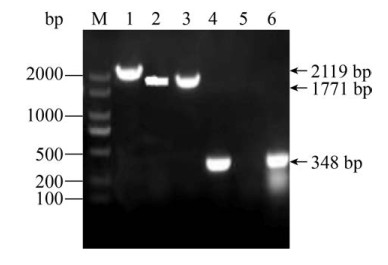 |
| 图 1 副溶血弧菌缺失株ΔVPA1500及互补株CΔVPA1500的鉴定 Figure 1 PCR identification of ΔVPA1500 and CΔVPA1500 of V. parahaemolyticus. M: DL2000; lane 1–3: primers of VPA1500-E/F; lane 4–6: primers of VPA1500-pMMB-F/R. |
| 图选项 |
用引物VPA1500-E/F和VPA1500-pMMB-F/R对互补株基因组进行PCR鉴定,结果显示VPA1500-E/F扩增互补株基因组片段为1771 bp(泳道3)。ΔVPA1500转入互补质粒pMMB-VPA1500后能够扩增出348 bp的VPA1500片段(泳道6),与野生株用VPA1500-pMMB-F/R引物扩增后片段大小相同(泳道4),提示CΔVPA1500构建成功。
将缺失株与互补株连续培养20代后,通过上述PCR方法验证,均可扩增出相应片段,证明ΔVPA1500、CΔVPA1500具有较好的遗传稳定性(数据未显示)。
2.2 生长曲线测定 对WT、ΔVPA1500、CΔVPA1500生长曲线分析结果表明(图 2),缺失VPA1500并未影响细菌的生长特性(P > 0.05)。
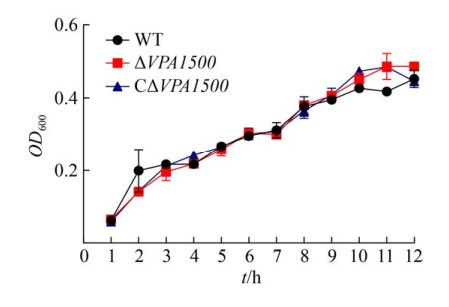 |
| 图 2 WT、ΔVPA1500及CΔVPA1500三种菌株的生长曲线测定 Figure 2 The growth curve of WT, ΔVPA1500, and CΔVPA1500. P > 0.05. |
| 图选项 |
2.3 细菌竞争 WT、ΔVPA1500、CΔVPA1500分别以相同比例4:1分别攻击大肠杆菌DH5α,进而判断各副溶血弧菌菌株对大肠杆菌DH5α的杀伤作用。结果如图 3所示:0 h时,各菌株菌量一致;4 h后,与WT相比,ΔVPA1500组对大肠杆菌杀伤能力显著降低(P≤0.0001),CΔVPA1500回复到野生株水平,结果表明VPA1500参与副溶血弧菌的细菌竞争活性。
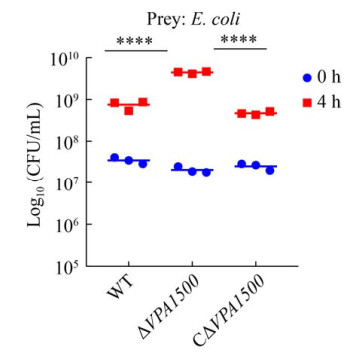 |
| 图 3 各菌株对大肠杆菌DH5α的抗菌作用 Figure 3 Anti-bacterial activity of V. parahaemolyticus strains when co-cultured with E. coli DH5α. ****: P≤0.0001. |
| 图选项 |
2.4 浮泳运动和群集运动的影响 浮泳实验结果显示,4 h内WT、ΔVPA1500、CΔVPA1500表现出明显的运动性,运动轨迹为半透明圆环状(图 4-A),测量浮泳运动半径结果如图 4-B所示:相比于WT,ΔVPA1500的运动能力显著下降(P≤0.01),互补株浮泳运动能力恢复到野生株水平。群集实验结果表明(图 4-C、4-D),24 h后WT、ΔVPA1500、CΔVPA1500运动能力无显著差异(P > 0.05)。以上结果表明,缺失VPA1500后不会影响群集运动能力,但会降低细菌的浮泳运动能力。
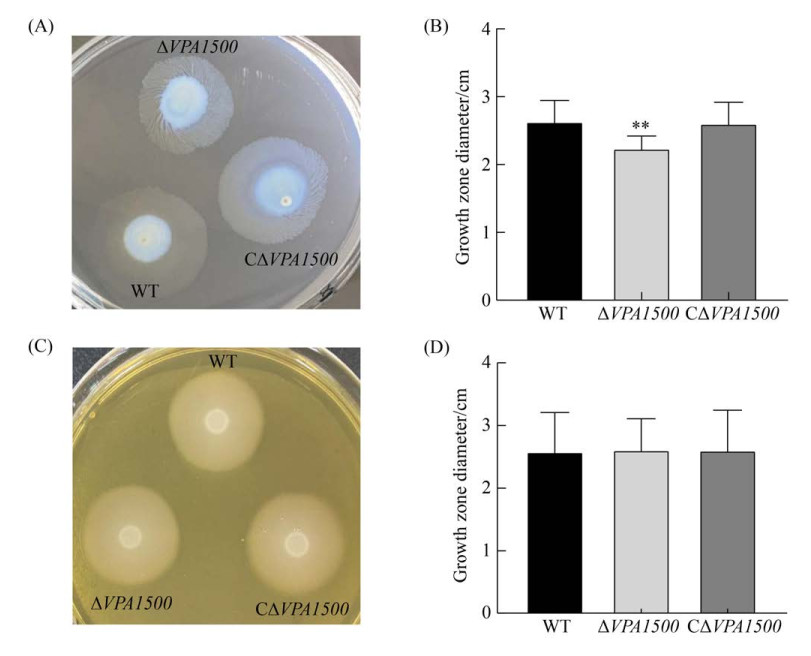 |
| 图 4 各菌株在0.3%琼脂-3% NaCl-LB半固体平板和1.5%琼脂-3% NaCl的BHI固体平板上运动情况 Figure 4 The results of swimming ability and swarming ability of three strains in 0.3% agar-3% NaCl-LB plates and 1.5% agar-3% NaCl-BHI plates. A: the swimming patterns of three strains were exhibited in 0.3% agar-3% NaCl-LB plates for 4 h; B: motility zone diameter (mm) was used to compare the differences in the movement of the strains for 4 h; **: P≤0.01; C: the swarming patterns of three strains were exhibited in 1.5% agar-3% NaCl-BHI plates for 24 h; D: motility zone diameter (mm) was used to compare the differences in the movement of the strains for 24 h. |
| 图选项 |
2.5 透射电镜观察极性鞭毛 透射电镜观察各菌株极性鞭毛的结果如图 5所示:当WT极性鞭毛完好,表面光滑(如箭头所示);而ΔVPA1500的极性鞭毛呈现不同程度的损伤,有的甚至完全脱落(如箭头所示),CΔVPA1500的极性鞭毛状态与野生株相似(如箭头所示)。以上结果说明缺失VPA1500会影响副溶血弧菌极性鞭毛的结构完整性。
 |
| 图 5 透射电镜图观察极性鞭毛 Figure 5 Transmission electron micrographs of polar flagellum. |
| 图选项 |
2.6 qRT-PCR检测三种菌株鞭毛基因转录水平 通过qRT-PCR检测WT、ΔVPA1500、CΔVPA1500三种菌株的极性鞭毛的基因转录水平,结果显示VPA1500基因缺失后会显著降低极性鞭毛相关基因fliF、flaA、flgE的转录水平(图 6),试验结果表明,VPA1500影响副溶血弧菌的极性鞭毛基因转录水平。
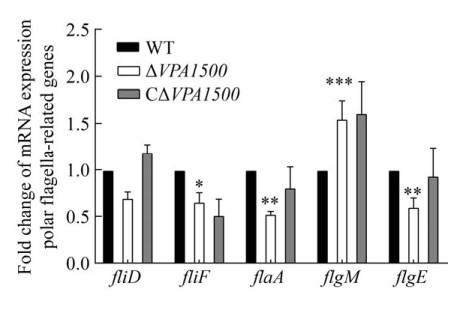 |
| 图 6 各菌株极性鞭毛基因转录水平的测定 Figure 6 Determination of the transcription levels of polar flagella-related genes in WT, ΔVPA1500, and CΔVPA1500. *: P≤0.05; **: P≤0.01; ***: P≤0.001. |
| 图选项 |
2.7 VPA1500基因缺失对生物被膜形成能力的影响 本实验采用结晶紫染色法检测生物被膜形成能力,结果如图 7,WT、ΔVPA1500、CΔVPA1500之间生物被膜形成能力无明显差异(P > 0.05),表明VPA1500基因缺失并未影响副溶血弧菌的生物被膜形成能力。
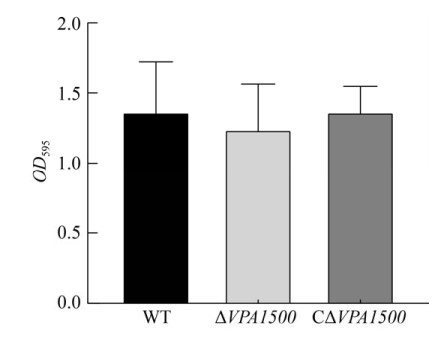 |
| 图 7 各菌株生物被膜形成能力的比较 Figure 7 Biofilm formation ability of WT, ΔVPA1500, and CΔVPA1500. P > 0.05. |
| 图选项 |
2.8 VPA1500基因缺失对Hela细胞毒性的影响 WT、ΔVPA1500、CΔVPA1500以MOI为100:1感染Hela细胞1.5 h后,结果如图 8,ΔVPA1500对细胞的毒性水平显著下降(P≤0.05),仅为野生株的0.36倍,互补株的细胞毒性作用基本恢复至野生株水平。表明VPA1500基因缺失后能够显著降低副溶血弧菌对Hela细胞的毒性作用。
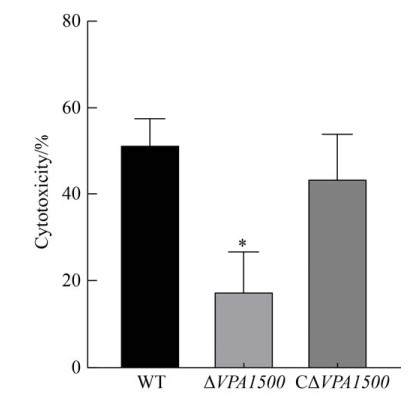 |
| 图 8 各菌株对Hela细胞的毒性测定结果 Figure 8 Comparison of cytotoxic effects of WT, ΔVPA1500, and CΔVPA1500. With Hela cells attacked by the strains at an MOI (1:100) for 1.5 h, the LDH release were collected and measured with the CytoTox 96 Non-Radioactive Cytotoxicity Assay. Statistically significant differences were indicated with asterisks. *: P≤0.05. |
| 图选项 |
2.9 VPA1500缺失对小鼠毒力的影响 实验组中WT、ΔVPA1500、CΔVPA1500以5×107 CFU/只攻毒ICR小鼠后,小鼠死亡集中在24 h以内。其中WT、CΔVPA1500小鼠感染3 h左右出现扎堆聚集、浑身颤抖不止,精神萎靡,10 h后眼睑出血,逐渐开始死亡。ΔVPA1500感染的小鼠上述症状表现较轻微,5 h后出现扎堆现象,整体死亡时间延后。24 h后,未死亡小鼠开始恢复至正常状态,自由采食饮水等,死亡情况保持不变。ICR小鼠毒力实验结果如图 9所示,感染WT、ΔVPA1500和CΔVPA1500的小鼠死亡率分别为100%、50%和66.7%。结果表明VPA1500缺失后能够明显降低副溶血弧菌对小鼠的致病性。
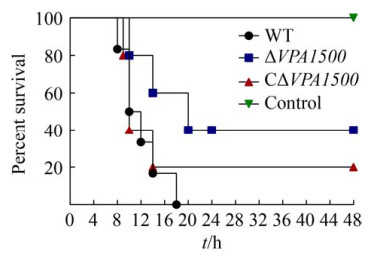 |
| 图 9 各菌株感染小鼠的存活率比较 Figure 9 Survival curve of ICR mice infected with WT, ΔVPA1500, and CΔVPA1500 with an intermediate dose. |
| 图选项 |
2.10 各菌株感染ICR小鼠脏器中的细菌载量 实验组WT、ΔVPA1500、CΔVPA1500以1×107 CFU/只细菌剂量腹腔感染4周龄ICR小鼠,结果如图 10显示。ΔVPA1500定殖在心脏、肝脏、脾脏、肾脏的细菌数量显著低于野生株(**:P≤0.01;***:P≤0.001;****:P≤0.0001),互补株的细菌定殖情况恢复至野生株水平(P > 0.05)。该结果提示VPA1500基因在副溶血弧菌的致病过程中起重要作用。
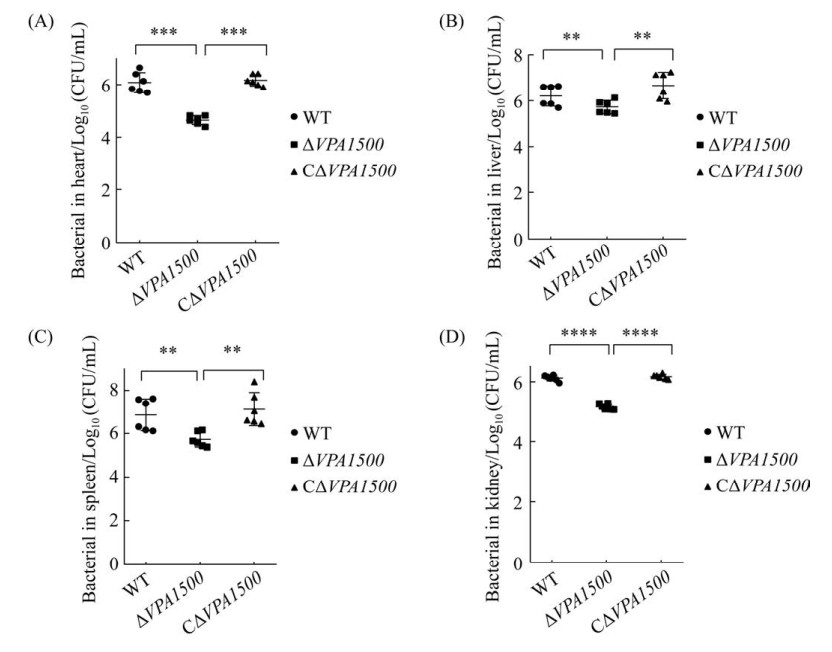 |
| 图 10 各菌株在ICR小鼠心脏、肝脏、脾脏和肾脏的组织载量 Figure 10 Viable bacterial distribution in heart (A), liver (B), spleen (C), and kidney (D). **: P≤0.01; ***: P≤0.001; ****: P≤0.0001. |
| 图选项 |
2.11 病理组织切片观察结果 各菌腹腔感染5周龄ICR小鼠,16 h后取小鼠组织送检,根据病理组织切片观察结果可知,感染WT的小鼠的肝脏、脾脏和肾脏出现明显损伤:肝脏组织中(图 11-A),肝实质内大量的细胞坏死,胞核固缩深染或溶解,胞质嗜酸性增强(黑色箭头),多处可见细菌团(蓝色箭头);脾脏组织中(图 11-B),红髓大量细胞坏死,胞核固缩深染、碎裂或溶解,胞质嗜酸性增强(黑色箭头);肾组织(图 11-C)中,未见髓质,大量的血管可见淤血(黑色箭头),多量的肾小管上皮细胞坏死,胞核固缩深染,胞质嗜酸性增强(蓝色箭头),偶见细菌团(红色箭头)。而与WT相比,ΔVPA1500感染小鼠的肝脏、脾脏和肾脏损伤相对较轻:肝组织中(图 11-D),肝小叶分界明显,但肝实质内可见部分肝细胞颗粒变性,胞质疏松淡染呈颗粒状(黑色箭头);脾脏组织中(图 11-E),红髓内可见多量的髓外造血细胞(黑色箭头),多量粒细胞浸润(红色箭头);肾组织(图 11-F)中,皮质髓质分界明显,皮质中肾小球分布均匀,肾小球中细胞数量以及基质均匀,肾小管上皮细胞圆润、饱满,刷状缘排列整齐规则;皮质与髓质中等量的血管可见淤血(黑色箭头)。该结果提示缺失VPA1500基因能够减轻副溶血弧菌对小鼠的组织损伤。
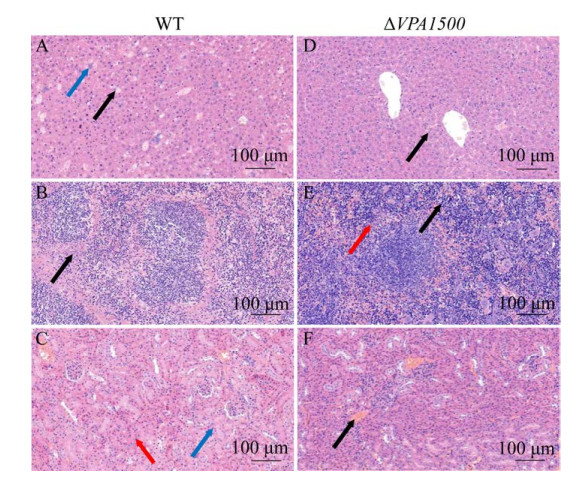 |
| 图 11 病理组织学分析(H.E染色) Figure 11 Histological analysis of representative tissues (H.E stain). |
| 图选项 |
3 讨论 关于副溶血弧菌T6SS系统在细菌运动性、生物被膜形成等生物学特性和致病性的相关研究还较少。本实验室前期通过差异蛋白质组学技术比较分析野生株SH112和T6SS1的双基因缺失株ΔvipA1-hcp1的分泌差异蛋白,发现VPA1500存在于野生株的上清,而不存在于在双基因缺失株的上清中(数据未显示),是T6SS1潜在的效应蛋白,经结构预测VPA1500仍是一个未知蛋白,本文选取其为研究对象,通过同源重组的方法构建其基因缺失株和互补株,分析VPA1500在副溶血弧菌环境适应性和致病性中的作用。
众所周知,革兰氏阴性细菌的T6SS参与细菌间的竞争[14, 22]。有研究已证实副溶血性弧菌依赖T6SS能够对包括大肠杆菌、假结核菌、霍乱弧菌以及其他副溶血性弧菌在内的一些革兰氏阴性菌产生杀伤作用[23–24]。本研究中我们也发现,与野生株相比,ΔVPA1500杀死大肠杆菌的能力显著下降,提示VPA1500参与了副溶血弧菌T6SS1的细菌之间的竞争能力。
生物被膜是细菌为适应环境而聚集形成的一种膜样物,病原菌可以依靠生物被膜防御各种环境压力[9]。在最初形成过程中,鞭毛依赖性的运动性能够帮助细菌识别适当的表面并与之相互作用形成生物被膜[25]。我们前期研究发现副溶血弧菌T6SS1影响细菌的生物被膜形成能力[3],本实验研究结果表明,VPA1500缺失后并未影响副溶血弧菌的生物被膜形成能力,提示VPA1500不参与T6SS1影响副溶血弧菌的生物被膜形成过程。
运动性能够为细菌生存提供有利条件,副溶血弧菌具有极性鞭毛系统和侧生鞭毛系统,双鞭毛系统使得它可以在复杂环境中生存[19]。极性鞭毛主要负责在液体环境中副溶血弧菌的浮泳运动,但当它们在固体表面或粘性环境生长时,会诱导出许多适合群集运动的侧生鞭毛以响应周围环境粘度的增加[26],侧生鞭毛主要负责群集运动[3]。我们研究发现缺失VPA1500基因后副溶血弧菌的浮泳能力下降,但是群集运动没有受到影响。进一步通过电镜观察发现,野生株的极性鞭毛完整,而ΔVPA1500的极性鞭毛出现损伤甚至完全脱离的现象。副溶血弧菌鞭毛形态结构的形成是一个复杂的级联事件,需要60个编码结构亚单位、调节蛋白和化学感受器的基因相互协同表达,这些基因根据极性鞭毛装配过程中基因表达的时期被分为早期、中期和晚期表达基因[19, 27–28]。我们进一步通过qRT-PCR试验发现,与野生株相比,VPA1500基因缺失株的中期(fliF和flgE)和晚期(flaA)鞭毛表达基因转录水平均显著下调,而flgM基因的转录水平则显著上调。FlgM是鞭毛基因表达时间协调的重要负调控因子[20, 29],可阻止晚期鞭毛基因过早表达。因此,本研究结果提示缺失VPA1500基因可能导致编码极性鞭毛蛋白的部分基因表达水平降低或延迟表达,具体机制还需要进一步研究,未来我们会结合转录组学等数据分析VPA1500是否直接影响鞭毛生物合成过程。此外,副溶血弧菌的运动性还受到群体感应系统、Ⅲ型分泌系统、转录调节因子等多种调控影响[30–31]。VPA1500影响副溶血弧菌泳动水平的分子机制还需要深入研究。
细菌感染宿主致病包括4个过程:粘附宿主细胞、定殖感染或侵袭、生长和维持、扩散至其他宿主细胞等[12]。当宿主细胞感染副溶血弧菌后,靶细胞受损裂解从而产生细胞毒性作用,这有助于细菌在宿主体内繁殖和扩散[9]。当宿主因素利于细菌生长、繁殖并允许病原体调节毒力因子的表达以抵抗宿主的防御机制时,就会发生感染[32]。我们通过细胞毒性试验发现,VPA1500缺失后能够显著降低副溶血弧菌对Hela细胞的毒性作用,提示VPA1500参与T6SS1副溶血弧菌对宿主细胞产生毒性的过程。我们进一步通过小鼠致病性实验发现,缺失VPA1500基因能够明显降低副溶血弧菌对小鼠的毒力作用。互补株CΔVPA1500对小鼠的毒力作用仅部分回复至野生株水平,可能原因是VPA1500基因缺失还影响副溶血弧菌其他毒力因子的表达,互补质粒不能完全回复其毒力作用,以后我们将对此进一步深入研究。
细菌组织载量结果表明,ΔVPA1500定殖在心脏、肝脏、脾脏、肾脏的细菌数量显著低于野生株,提示与野生株相比,ΔVPA1500入侵组织的能力降低或毒力下降。副溶血弧菌入侵宿主时,在感染早期鲜少引发机体出现明显的临床症状,但在新发感染6 h内菌体增殖和毒力因子释放即可引起体内靶器官或局部组织的损伤,其损伤程度因菌株的进化发育、毒力因子表达和感染方式不同而具有显著差异[33]。我们通过病理组织学观察发现,与缺失株相比,野生株造成了更严重的肝、脾及肾脏的损伤,进一步佐证VPA1500与副溶血弧菌毒力相关。
本研究结果表明VPA1500参与副溶血弧菌的细菌竞争能力、运动性、细胞毒性作用和对小鼠的毒力,缺失该基因会影响副溶血弧菌极性鞭毛结构的完整性。副溶血弧菌不仅会引起肠胃炎,还会引起伤口感染和败血病,其致病性与多种毒力因子密切相关。鞭毛系统可以参与趋化性运动、细菌迁移、粘附和入侵宿主细胞,有利于细菌在宿主体内群聚定殖[32, 34]。病原体对宿主内部组织的附着或粘附是感染过程的初始及关键步骤,干扰此步骤能够抑制病原体感染[35]。有研究表明弧菌的运动性不会影响生长速度,但是缺乏运动性状的弧菌突变体在宿主体内易被控制、聚集、捕获及驱逐[36]。许多病原菌的运动性能够促进细菌生物膜形成和在宿主组织中的定殖[37–38]。在肠道感染相关的病原菌中,如沙门氏菌,鞭毛介导的运动性与细菌粘附、侵袭和毒力息息相关[39]。结合已有文献报道,我们猜测VPA1500通过参与副溶血弧菌极性鞭毛的形成过程,进而影响该菌的浮泳运动能力和致病过程,具体机制还需进一步深入研究。
References
| [1] | Pukatzki S, Ma AT, Sturtevant D, Krastins B, Sarracino D, Nelson WC, Heidelberg JF, Mekalanos JJ. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system. Proceedings of the National Academy of Sciences, 2006, 103(5): 1528-1533. DOI:10.1073/pnas.0510322103 |
| [2] | Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordo?ez C L, Lory S, Walz T, Joachimiak A, Mekalanos JJ. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [3] | 蒋蔚. Ⅵ型分泌系统T6SS-1核心组分及烯醇化酶在副溶血弧菌致病过程中的作用. 南京农业大学学位论文, 2014. |
| [4] | Ho BT, Basler M, Mekalanos JJ. Type 6 secretion system-mediated immunity to type 4 secretion system-mediated gene transfer. Science, 2013, 342(6155): 250-253. DOI:10.1126/science.1243745 |
| [5] | Yu KW, Xue P, Fu Y, Yang L. T6SS mediated stress responses for bacterial environmental survival and host adaptation. International Journal of Molecular Sciences, 2021, 22(2): 478. DOI:10.3390/ijms22020478 |
| [6] | Ma AT, McAuley S, Pukatzki S, Mekalanos JJ. Translocation of a Vibrio cholerae type Ⅵ secretion effector requires bacterial endocytosis by host cells. Cell Host & Microbe, 2009, 5(3): 234-243. |
| [7] | Yu Y, Zhang Y, Li J, Yang H, Song HH, Fang WH. VPA1045 and VPA1049 of Vibrio parahaemolyticus regulate translocation of Hcp2. Acta Microbiologica Sinica, 2012, 52(8): 954-961. (in Chinese) 俞盈, 张晏, 李俊, 杨虹, 宋厚辉, 方维焕. 副溶血弧菌VPA1045和VPA1049调节Hcp2蛋白转位. 微生物学报, 2012, 52(8): 954-961. |
| [8] | Guo D, Yang ZY, Zheng XY, Kang SM, Yang ZK, Xu YF, Shi C, Tian HY, Xia XD. Thymoquinone inhibits biofilm formation and attachment-invasion in host cells of Vibrio parahaemolyticus. Foodborne Pathogens and Disease, 2019, 16(10): 671-678. DOI:10.1089/fpd.2018.2591 |
| [9] | Bai XR, Wang Q, Ling J, Wan Y, Chen YJ, Fang WH, Sun WD, Jiang W. Comparison of biological characteristics and cytopathogenicities between T3SS1 and T3SS2 in Vibrio parahaemolyticus. Acta Microbiologica Sinica, 2018, 58(3): 455-466. (in Chinese) 白雪瑞, 王权, 凌娇, 万莹, 陈永军, 方维焕, 孙卫东, 蒋蔚. T3SS1和T3SS2影响副溶血弧菌生物学特性及细胞致病性的比较. 微生物学报, 2018, 58(3): 455-466. |
| [10] | Zhang T, Yang MH. Molecular mechanisms of virulence genes expression in Vibrio parahaemolyticus. Acta Microbiologica Sinica, 2020, 60(7): 1345-1357. (in Chinese) 张婷, 杨梦华. 副溶血弧菌的毒力基因表达调控的分子机制. 微生物学报, 2020, 60(7): 1345-1357. |
| [11] | Ben-Yaakov R, Salomon D. The regulatory network of Vibrio parahaemolyticus type Ⅵ secretion system 1. Environmental Microbiology, 2019, 21(7): 2248-2260. DOI:10.1111/1462-2920.14594 |
| [12] | 白雪瑞. Ⅵ型分泌系统2及Ⅲ型分泌系统对副溶血弧菌生物学特性和致病性的影响. 南京农业大学学位论文, 2017. |
| [13] | Fridman CM, Keppel K, Gerlic M, Bosis E, Salomon D. A comparative genomics methodology reveals a widespread family of membrane-disrupting T6SS effectors. Nature Communications, 2020, 11: 1085. DOI:10.1038/s41467-020-14951-4 |
| [14] | Salomon D, Klimko JA, Orth K. H-NS regulates the Vibrio parahaemolyticus type Ⅵ secretion system 1. Microbiology: Reading, England, 2014, 160(Pt 9): 1867-1873. |
| [15] | Bernal P, Llamas MA, Filloux A. Type Ⅵ secretion systems in plant-associated bacteria. Environmental Microbiology, 2018, 20(1): 1-15. DOI:10.1111/1462-2920.13956 |
| [16] | Zhu PC, Li YM, Yang X, Zou HF, Zhu XL, Niu XN, Xu LH, Jiang W, Huang S, Tang JL, He YQ. Type Ⅵ secretion system is not required for virulence on rice but for inter-bacterial competition in Xanthomonas oryzae pv. oryzicola. Research in Microbiology, 2020, 171(2): 64-73. DOI:10.1016/j.resmic.2019.10.004 |
| [17] | 凌娇. 副溶血弧菌qPCR检测及T6SS-1效应因子的筛选和功能研究. 南京农业大学学位论文, 2018. |
| [18] | Ben-Yaakov R, Salomon D. The regulatory network of Vibrio parahaemolyticus type Ⅵ secretion system 1. Environmental Microbiology, 2019, 21(7): 2248-2260. DOI:10.1111/1462-2920.14594 |
| [19] | Gu D, Meng HM, Li Y, Ge HJ, Jiao XN. A GntR family transcription factor (VPA1701) for swarming motility and colonization of Vibrio parahaemolyticus. Pathogens, 2019, 8(4): 235. DOI:10.3390/pathogens8040235 |
| [20] | Noh HJ, Nagami S, Kim MJ, Kim J, Lee NK, Lee KH, Park SJ. Role of VcrD1 protein in expression and secretion of flagellar components in Vibrio parahaemolyticus. Archives of Microbiology, 2015, 197(3): 397-410. DOI:10.1007/s00203-014-1069-9 |
| [21] | Wang SH, Liu X, Xu X, Yang DH, Wang D, Han XG, Shi YH, Tian MX, Ding C, Peng DX, Yu SQ. Escherichia coli type Ⅲ secretion system 2 ATPase EivC is involved in the motility and virulence of avian pathogenic Escherichia coli. Frontiers in Microbiology, 2016, 7: 1387. |
| [22] | Salomon D, Gonzalez H, Updegraff BL, Orth K. Vibrio parahaemolyticus type Ⅵ secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PLoS One, 2013, 8(4): e61086. DOI:10.1371/journal.pone.0061086 |
| [23] | Une T. Studies on the pathogenicity of Yersinia enterocolitica. Microbiology and Immunology, 1977, 21(7): 349-363. DOI:10.1111/j.1348-0421.1977.tb00300.x |
| [24] | Ritchie JM, Waldor MK. Vibrio cholerae Interactions with the Gastrointestinal Tract: Lessons from Animal Studies. Molecular Mechanisms of Bacterial Infection Via the Gut, 2009. |
| [25] | Liu X, Zhuo SY, Jing XY, Yuan Y, Rensing C, Zhou SG. Flagella act as Geobacter biofilm scaffolds to stabilize biofilm and facilitate extracellular electron transfer. Biosensors and Bioelectronics, 2019, 146: 111748. DOI:10.1016/j.bios.2019.111748 |
| [26] | Khan F, Tabassum N, Anand R, Kim YM. Motility of Vibrio spp.: regulation and controlling strategies. Applied Microbiology and Biotechnology, 2020, 104(19): 8187-8208. DOI:10.1007/s00253-020-10794-7 |
| [27] | Kim YK, McCarter LL. Cross-regulation in Vibrio parahaemolyticus: compensatory activation of polar flagellar genes by the lateral flagellar regulator LafK. Journal of Bacteriology, 2004, 186(12): 4014-4018. DOI:10.1128/JB.186.12.4014-4018.2004 |
| [28] | Kim YK, McCarter LL. Analysis of the polar flagellar gene system of Vibrio parahaemolyticus. Journal of Bacteriology, 2000, 182(13): 3693-3704. DOI:10.1128/JB.182.13.3693-3704.2000 |
| [29] | Barketi-Klai A, Monot M, Hoys S, Lambert-Bordes S, Kuehne SA, Minton N, Collignon A, Dupuy B, Kansau I. The flagellin FliC of Clostridium difficile is responsible for pleiotropic gene regulation during in vivo infection. PLoS One, 2014, 9(5): e96876. DOI:10.1371/journal.pone.0096876 |
| [30] | Tian Y, Wang QY, Liu Q, Ma Y, Cao XD, Guan LY, Zhang YX. Involvement of LuxS in the regulation of motility and flagella biogenesis in Vibrio alginolyticus. Bioscience, Biotechnology, and Biochemistry, 2008, 72(4): 1063-1071. DOI:10.1271/bbb.70812 |
| [31] | Gode-Potratz CJ, Chodur DM, McCarter LL. Calcium and iron regulate swarming and type Ⅲ secretion in Vibrio parahaemolyticus. Journal of Bacteriology, 2010, 192(22): 6025-6038. DOI:10.1128/JB.00654-10 |
| [32] | Wu KF, Xu HM, Zheng YQ, Wang LB, Zhang XM, Yin YB. CpsR, a GntR family regulator, transcriptionally regulates capsular polysaccharide biosynthesis and governs bacterial virulence in Streptococcus pneumoniae. Scientific Reports, 2016, 6: 29255. DOI:10.1038/srep29255 |
| [33] | Yang H, de Souza Santos M, Lee J, Law HT, Chimalapati S, Verdu EF, Orth K, Vallance BA. A novel mouse model of Enteric Vibrio parahaemolyticus infection reveals that the type Ⅲ secretion system 2 effector VopC plays a key role in tissue invasion and gastroenteritis. mBio, 2019, 10(6). |
| [34] | Guan W, Wang TL, Huang Q, Tian EY, Liu B, Yang YW, Zhao TC. A LuxR-type regulator, AcrR, regulates flagellar assembly and contributes to virulence, motility, biofilm formation, and growth ability of Acidovorax citrulli. Molecular Plant Pathology, 2020, 21(4): 489-501. DOI:10.1111/mpp.12910 |
| [35] | Angthong P, Roytrakul S, Jarayabhand P, Jiravanichpaisal P. Involvement of a tachylectin-like gene and its protein in pathogenesis of acute hepatopancreatic necrosis disease (AHPND) in the shrimp, Penaeus monodon. Developmental & Comparative Immunology, 2017, 76: 229-237. |
| [36] | Wiles TJ, Schlomann BH, Wall ES, Betancourt R, Parthasarathy R, Guillemin K. Swimming motility of a gut bacterial symbiont promotes resistance to intestinal expulsion and enhances inflammation. PLoS Biology, 2020, 18(3): e3000661. DOI:10.1371/journal.pbio.3000661 |
| [37] | Mandlik A, Swierczynski A, Das A, Ton-That H. Pili in Gram-positive bacteria: assembly, involvement in colonization and biofilm development. Trends in Microbiology, 2008, 16(1): 33-40. DOI:10.1016/j.tim.2007.10.010 |
| [38] | Silva AJ, Leitch GJ, Camilli A, Benitez JA. Contribution of hemagglutinin/protease and motility to the pathogenesis of El Tor biotype cholera. Infection and Immunity, 2006, 74(4): 2072-2079. DOI:10.1128/IAI.74.4.2072-2079.2006 |
| [39] | Barbosa FDO, de Freitas Neto OC, Batista DFA, de Almeida AM, Rubio MDS, Alves LBR, Vasconcelos RDO, Barrow PA, Berchieri A Jr. Contribution of flagella and motility to gut colonisation and pathogenicity of Salmonella Enteritidis in the chicken. Brazilian Journal of Microbiology, 2017, 48(4): 754-759. DOI:10.1016/j.bjm.2017.01.012 |
