袁梦1, 张雯2, 胡鹏威1, 俞慕华1, 陈辉1, 徐丽2, 高源2, 朱兵清2

 , 段永翔1
, 段永翔1
 , 邵祝军2
, 邵祝军2 1. 南山区疾病预防控制中心, 广东 深圳 518054;
2. 中国疾病预防控制中心, 北京 102206
收稿日期:2020-06-09;修回日期:2020-09-02;网络出版日期:2020-10-28
基金项目:深圳市“医疗卫生三名工程”引进高层次医学团队项目(SZSM201803081);南山区卫健局病原生物学、传染病防控医学重点学科建设资助
*通信作者:朱兵清, Tel: +86-10-58900753, E-mail: zbqzhu@126.com;
段永翔, Tel: +86-755-26410928, E-mail: szduanyx@163.com.
摘要:[目的] 建立并评估1种适宜的脑膜炎奈瑟菌(Neisseria meningitidis,Nm)基因组分子分型方法。[方法] 本研究以125株代表性Nm菌株的基因组序列为对象,建立了基于核心基因SNP的基因组分型方法,并与pubMLST网站公布的MLST和cgMLST分型方法进行比较。[结果] 基于核心基因SNP的基因组分型方法和cgMLST方法对125株Nm菌株的分型结果一致性较高,两种方法均明显优于MLST分型方法。基于SNP的基因组分型方法在认识Nm菌的种群结构、界定克隆群方面具有优势;cgMLST分型方法能够对任一菌株进行分型,但不能进行克隆群的界定和归类。[结论] 基于核心基因SNP的基因组分型方法和cgMLST均明显优于MLST分型方法,未来仍有待进一步整合和提高。
关键词:脑膜炎奈瑟菌核心基因SNP分型cgMLSTMLST
Whole genome sequence-based typing methods for Neisseria meningitidis
Meng Yuan1, Wen Zhang2, Pengwei Hu1, Muhua Yu1, Hui Chen1, Li Xu2, Yuan Gao2, Bingqing Zhu2

 , Yongxiang Duan1
, Yongxiang Duan1
 , Zhujun Shao2
, Zhujun Shao2 1. Nanshan Center for Disease Control and Prevention, Shenzhen 518054, Guangdong Province, China;
2. Chinese Center for Disease Control and Prevention, Beijing 102206, China
Received: 9 June 2020; Revised: 2 September 2020; Published online: 28 October 2020
*Corresponding author: Zhu Bingqing, Tel: +86-10-58900753, E-mail: zbqzhu@126.com;
Duan Yongxiang, Tel: +86-755-26410928, E-mail: szduanyx@163.com.
Foundation item: Supported by the Sanming Project of Medicine in Shenzhen (SZSM201803081) and by the Medical Key Subject for Pathogen Biology and Prevention and Control of Infectious Diseases of Nanshan District Municipal Health Commission
Abstract: [Objective] To find a suitable molecular typing method for Neisseria meningitides. [Methods] We used 125 presentative N. meningitidis strains to develop a new typing method, named core genome single nucleotide polymorphism (SNP) typing, based on the whole genome sequencing. This method was compared to the MLST and cgMLST typing that have been published on pubMLST website. [Results] The genotyping results of 125 N. meningitides strains isolates were consistent between the core genome SNP typing and egMLST, both of which are significantly better than MLST. The core genome SNP typing identified the population structure and defined the clonal complexes. Comparatively, cgMLST could type any strain but cannot define or assign its clonal complex. [Conclusion] Core genome SNP typing showed consistent results with cgMLST and both methods are significantly better than MLST.
Keywords: Neisseria meningitidiscore genome SNP typingcgMLSTMLST
脑膜炎奈瑟菌(Neisseria meningitidis,Nm)是引起流行性脑脊髓膜炎(简称“流脑”)的病原体,其感染还可引起严重的脓毒血症[1]。根据荚膜多糖的抗原结构,Nm可分为12个血清群;95%以上的侵袭性病例由A、B、C、Y、W和X等6个血清群感染引起[2–3]。采用多位点序列分型(multi-locus sequence typing,MLST)方法,大部分Nm菌株被归入42个克隆群(clonal complex,cc),其中cc1、cc5、cc8、cc11、cc32、cc41/44、cc4821、cc269等属于高致病cc[4–9]。这些分型方法的应用对我们认识中国Nm菌株的遗传特征和变异规律起到了至关重要的作用。然而,大量的研究结果显示,MLST分型能力有限,无法识别菌株在短时间内发生的变化[10–11]。另外,在已经定义的cc之外,尚有大量菌株无法进行cc归类(UA菌株),对这部分菌株,无法确定其互相之间以及与其他菌株的遗传关系(https://pubmlst.org/neisseria/)。
近年来,随着基因组测序的普及,许多研究者尝试从基因组水平对菌株进行分型,并且在一些菌株的分型上取得了良好的结果[12–13]。这些方法主要基于两种原理——每个核心基因作为一个变异单元(cgMLST)和核心基因(core gene)的SNP作为变异单元。目前,Nm的cgMLST方案已在pubMLST网站公布,并被用于重要cc的菌株进化分析[10–11]。本研究基于核心基因SNP建立Nm的基因组分型方法,并与cgMLST方法进行比较,分析二者的优缺点,为后期分型方法的选择和分型结果的解释提供理论依据。
1 材料和方法 1.1 材料 根据分离年代、分离地点、血清群和基因型,选择125株具有代表性的且背景清楚的Nm菌株,涵盖A、B、C、X、W、E和cnl等7个血清群/基因群;它们共分为103个ST型,其中,60个ST型属于16个cc,其余43个ST型为UA菌株。其中111株为本科室测序,14株来源于公共数据库。
1.2 DNA提取、基因组测序和组装 复苏实验室保存的Nm,挑取单菌落,接种于血琼脂培养基上,置5% CO237 ℃条件下培养18–20 h。参照试剂盒(Promega,美国)说明书提取细菌基因组DNA。采用二代测序技术(Illumina Hiseq2000或2500平台)进行基因组测序,这一部分工作由深圳华大基因科技服务有限公司和北京诺禾致源生物信息科技有限公司完成。测序下机的数据先进行过滤,获得clean data,测序深度大于100×。使用SOAPdenovo 1.04[14–15]短序列组装软件对clean data进行组装。拼接后基因组contig少于100个。
1.3 核心基因SNP分型方法
1.3.1 基因预测和核心基因鉴定: 采用Glimmer 3软件[16]进行基因预测,并通过比对COG、KEGG、NT、NR和SwissProt等数据库进行基因的功能注释。对以上预测的基因,采用OrthoMCL (http://orthomcl.org/orthomcl/)进行氨基酸水平的聚类分析,相似度较高(在50%以上的长度上同源性高于50%)且存在于所有菌株基因组中的单拷贝基因即为核心基因。
1.3.2 单核苷酸多态性(single nucleotide polymorphism,SNP)检测: 采用SOAPsnp[14]和MUMmer中NUCmer[17]软件,以Nm 8013(GCA_000026965.1)的完整基因组为参比序列,进行菌株间基因组序列比较,查找核心基因和核心基因SNP。位于核心基因中、不在重复区域且2个SNP间距≥20bp的SNP被定义为核心基因SNP。
1.3.3 群体结构分析: 采用STRUCTURE 2.2程序[18],对125个Nm基因组筛查出的核心基因SNP开展群体结构分析,使用的迭代次数为5,参数为Burn-in=200000和Reps=500000。分别基于假设有1个群(K=1)逐次增加到30个群(K=30),依次计算,重复5次,之后运用Structure HARVEST[19]计算不同假设下所获得的ΔK值,选择ΔK值最高者为最终的分群方案。利用CLUMPP[20]软件将STRUCTURE运行得到的对应K值的多次重复结果进行合并,并据此评估对各株菌进行分组的情况。
1.3.4 系统发育分析: 采用MEGA 6软件中的临近法,对核心基因SNP构建系统发育树。树的构建选择的bootstrap值为1000。
1.4 cgMLST分型 向pubMLST网站Nm基因组数据库提交已组装的基因组序列。采用网站内Genome comparator工具,选择Scheme为“N. meningitidis cgMLST v1.0”,参数设置为“最小同源性≥70%,最短匹配长度≥50%”,将基因组序列与核心基因数据库(1605个基因)比对,寻找基因组中的核心基因及其等位基因号,并获得菌株间的差异矩阵。采用Splits Tree (版本4.14.8)图像化展示菌株间差异,即为菌株的系统发育树。
2 结果和分析 2.1 核心基因SNP分型
2.1.1 核心基因和核心SNP: 在125株Nm菌株的基因组中,1049个基因为所有菌株共有,即为核心基因。在这些基因中共筛选出4263个符合要求的核心SNP位点,用于群体结构和系统发育分析。
2.1.2 群体结构: 采用STRUCTURE[18]和Structure HARVEST[19]分析流程,分别将125个Nm基因组基于分为1–30个群的假设分别进行群体结构计算。结果显示,Nm分为20个群(K=20)时ΔK(81.30)最高,其他分群方案ΔK值为0.53–74.35,因此,选定20个祖先群为最终的分型方案,并采用该分型方案进行后续群特异性SNP和基因的鉴定,此处将每一个群定义为基因组群(genome typing group,GTG)。基于Clumpp软件,计算20个GTG中的125株菌株的最高构成比(the highest proportion of putative ancestral population,HPPAP),如图 1所示,该值为0.2018–1。按照HPPAP大于0.4则将该菌划分为该GTG的标准[12],114株菌株可归入18个GTG,每个GTG包括2–18株菌株,剩余11株菌株由于每个GTG的HPPAP都低于0.4而不能归入任何一个GTG (图 1)。
 |
| 图 1 18个GTG在114株Nm菌株中的构成比 Figure 1 The constituent ratio of 18 GTGs of 114 N. meningitidis strains. Strains are arrayed along the horizontal ordinate. The proportion of different GTGs in each strain is shown on the vertical coordinate. Different GTGs are indicated by colors. |
| 图选项 |
在18个GTG的114株Nm菌株中,91株菌株(79.8%) HPPAP≥0.6,其中,60株菌株HPPAP高于0.9,18株HPPAP为0.8–0.9,8株为0.7–0.8。GTG4、GTG6和GTG18的所有菌株HPPAP均高于0.9,另有8个GTG的所有菌株HPPAP均高于0.6。HPPAP低的菌株主要在GTG9和GTG11中,而这2个GTG包括的cc也较其他GTG多。
2.1.3 核心基因SNP分型与MLST分型的比较: 将以上核心基因分型结果与MLST分型结果进行比较后发现二者吻合度较高,但核心基因分型对MLST明显具有补充作用(表 1)。18个GTG中,7个GTG分别与7个cc对应,6个GTG仅包括UA菌株,5个GTG对应2个以上的cc (包括UA)。18个GTG的HPPAP以及与cc的对应关系见表 1。值得注意的是,42株UA菌株显示出明显的序列多态性,其中部分菌株单独归入一个特定的GTG,部分菌株与其他cc菌株归入同一个GTG。有11株菌株无法归入任何GTG,这些菌株中有10株为UA菌株。
表 1. 125株Nm菌株的基因组群(GTG)分类结果 Table 1. The classification results of GTG of 125 N. meningitidis strains
| GTG | Strains | HPPAP | Clonal complex (cc) |
| 1 | 3 | 0.8744–0.9659 | UA |
| 2 | 6 | 0.4290–0.9966 | UA |
| 3 | 7 | 0.7226–1.0000 | UA |
| 4 | 3 | 0.9401–1.0000 | UA |
| 5 | 18 | 0.4039–0.9418 | cc4821, UA |
| 6 | 13 | 0.9515–1.0000 | cc4821 |
| 7 | 13 | 0.6833–1.0000 | cc4, cc5 |
| 8 | 8 | 0.5677–0.6000 | cc1 |
| 9 | 3 | 0.4111–0.5210 | cc53, cc213, UA |
| 10 | 2 | 0.8114–0.9354 | UA |
| 11 | 6 | 0.4043–0.6546 | cc18, cc174, cc175, cc269, UA |
| 12 | 2 | 0.7968–0.8000 | cc11 |
| 13 | 7 | 0.8069–1.0000 | cc8, cc11, UA |
| 14 | 7 | 0.4488–0.9978 | cc41/44 |
| 15 | 2 | 0.7146–0.7522 | cc41/44 |
| 16 | 6 | 0.4063–0.9802 | UA |
| 17 | 6 | 0.7866–0.9918 | cc32 |
| 18 | 2 | 0.9838–0.9970 | cc198 |
| NA* | 11 | 0.2018–0.3794 | cc103, UA |
| * 11 strains cannot be assigned any GTG due to the low HPPAP (< 0.4). | |||
表选项
2.1.4 基于SNP的系统发育树: 为了验证以上核心基因分型的可靠性,采用以上4263个SNP对125株菌株进行了系统发育分析。从系统发育树上可以看出(图 2),核心基因分型结果与系统发育一致性较好。除了GTG9和GTG11,其他GTG的菌株在系统发育树上各自成簇,相互之间界限清晰。反过来,16个cc中的13个分别被归入单一的GTG中,另外3个[cc4821(GTG5和GTG6)、cc11(GTG12和GTG13)和cc41/44(GTG14和GTG15)]分别被归入2个分支相邻的GTG中。值得注意的是,同1个GTG中菌株之间的遗传距离可长于它们与其他GTG菌株间的距离,而且UA菌株(如GTG4中)之间的距离可相当近,甚至比同一个cc (如cc4821)中菌株之间的距离更近。除GTG9和GTG11中有3株菌株分散于系统发育树不同处外,其余同一个cc的菌株均聚集在树上的同一处。
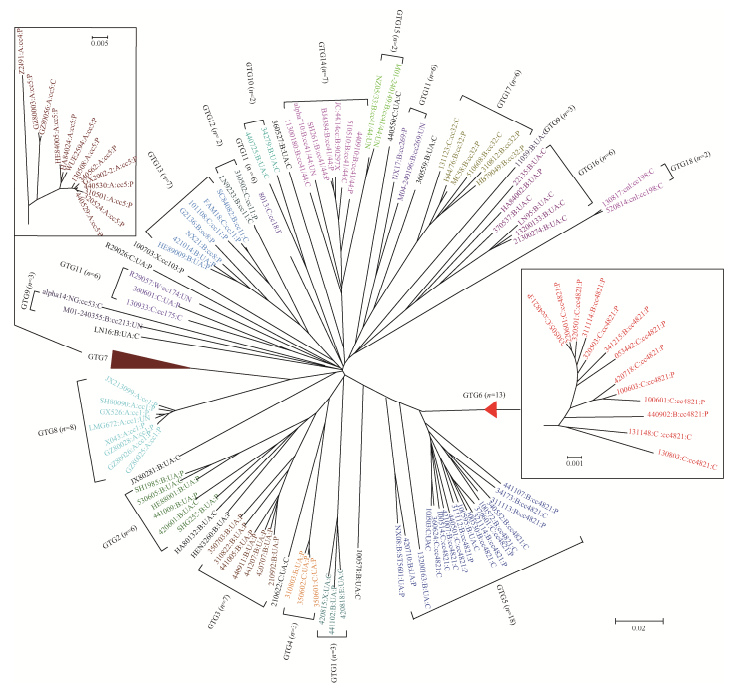 |
| 图 2 基于SNP构建的Nm菌株系统发育树 Figure 2 The phylogenetic tree of N. meningitidis constructed based on SNPs. The information of strain includes the identification number, Serogroup clonal complex and strain source (P: patient; C: carrie) which were separated by a colon. The genome typing groups of all strains marked with different colors are labeled on the tree. |
| 图选项 |
2.1.5 GTG特异SNP和基因: 寻找GTG特异的SNP和/或基因可以快速确定菌株的遗传学归类。对18个GTG的全基因组序列(包括核心和非核心)进行比较,发现14个GTG具有特异性SNP,其中5个GTG还含有特异性的基因。其余4个GTG中未发现特异基因或SNP,但可以通过SNP组合对其进行鉴定。GTG18的特异性基因和SNP明显多于其他GTG,与系统发育树中显示其为独立进化分支的结果吻合。
2.2 cgMLST分型 1605个核心基因中,5个基因在所有菌株中完全相同,1600个基因存在差异;另有111个基因序列与数据库中两个或更多的基因位点匹配。保留菌株间存在差异且仅与唯一位点匹配的1489个基因,用于计算菌株间的遗传距离和构建系统发育树(图 3)。从图中可以看出,该系统发育树的拓扑结构与基于SNP构建的系统发育树几乎一致,菌株之间的遗传关系亦高度相似,那些属于同一个GTG但遗传距离较远的菌株在该树上距离亦较远。
 |
| 图 3 基于cgMLST构建的Nm菌株系统发育树 Figure 3 The phylogenetic tree of N. meningitidis constructed based on cgMLST. The information of strain included the identification number and clonal complex which were separated by a colon. The genome typing groups of all strains were labeled and the color of each GTG was in accordance with that in Figure 2. |
| 图选项 |
3 讨论 随着高通量测序技术的发展,细菌基因组已逐渐应用到部分菌种的鉴定分型领域[12, 21–22],其与传统分型方法相结合,具有分辨率高的优点。本研究建立了基于核心基因的Nm的分型方法,同时采用cgMLST基因组分型方法,对同一批125株菌株进行了分子分型,并与传统的MLST方法的分型结果进行了比较。结果显示,基于基因组序列的分型方法与MLST的分型结果一致性较高,同时在以下方面又具有明显的优势:(1) 在分辨UA菌株方面,基因组分型方法相较于MLST方法更灵敏。在定义UA菌株间以及UA与其他cc菌株间的关系上,本研究中的大部分UA菌株在基因组系统发育树上成簇分布,显示出克隆性。分析菌株的MLST位点信息,发现除了GTG9和GTG11外,每个GTG中的菌株具有至少一个相同的MLST位点,说明这些菌株确实具有相关性,MLST之所以未能将其归为相应的cc,原因是MLST分析的位点有限而对cc的定义又比较严格(4个以上的位点相同方可归入该cc)。GTG9和GTG11比较特别,其3株菌株分散于系统发育树上多处,且MLST位点也没有同源性,因为这些菌株归入相应GTG的HPPAP均较低,因此推测它们不是这两个GTG的代表菌株,或者这些菌株在进化过程中发生了较多的重组,导致菌株间差异较大。(2) 基于基因组序列的分型方法能够对现有的cc进行更准确的界定。在基因组序列分型中,cc4821分为2个明显不同的GTG(GTG5和GTG6)或簇,已有研究结果显示,两簇菌株之间生物学特征差异显著[23–24],这说明cc4821确实是由2个遗传分支组成,对cc4821菌株如果仅仅按照MLST结果进行归类将会掩盖许多有价值的信息。反过来,有些cc具有紧密的遗传关系,但在MLST分型中被界定为独立的cc,如cc8和cc11 (二者的中心ST型有4个位点相同),基因组分型结果显示这2个cc同属于GTG13,在基因组分型上没有明显的差异。
本研究中的两种基因组分型方法对菌株的分型结果几乎一致,但二者分型原理不同,潜在的适用范围也有差异。基于SNP的基因组分型方法如同MLST方法一样,先对基因组型别(GTG)进行界定,确定每个型别的特异基因或SNP位点,然后根据待检菌株中这些特异基因和位点信息,对菌株进行GTG归类。该方法的优点是分型标准固定,便于不同批次或不同实验室间结果的比较。而且,还可以根据每个GTG组特异的SNP位点或基因设计简单的PCR方法对GTG进行鉴定,从而提高分型效率和降低分型费用。本研究建立的Nm核心基因分型方法的缺点是,仍有可能有未知的GTG未被涵盖。Nm种群结构复杂,目前公布的cc已超40个,另外还有相当一部分菌株不能归入任何一个cc;而且,近年来Nm新的cc或亚群不断出现[5, 11, 25],在这一种属中选取代表性菌株建立基因组分型系统是相当困难的。本研究发现,不能进行GTG归类的菌株具有多个祖先群的成分但比例都不高,这说明在本研究鉴定的20个GTG之外,可能还有其他的GTG未被识别出来。此外,Nm具有较高的转化和重组能力[26],可致使菌株快速变化,对于基于特异的SNP位点或基因开发的用于GTG鉴定的PCR方法,如果变化发生于GTG特异性位点,有可能会导致GTG的误判。
相比起来,cgMLST方法纳入了所有的核心基因,且以每个核心基因作为一个变异单元,既避免了利用少数几个基因进行分型带来的不稳定性,又避免由重组带来的大量SNP的影响。cgMLST是一个开放的分型系统,可以对任何新的Nm菌株进行分型。但是,目前cgMLST分型系统中还没有对不同的cgMLST型别进行cc归类的方案,因此,只能通过构建系统发育树,根据菌株间的遗传距离,判断某个菌株与其他菌株的关系。然而,从本研究中构建的系统发育树来看,有的cc内部菌株间的遗传距离较大,有的又相当小,不同的GTG之间也是这种情况,这说明仅仅根据菌株间的遗传距离对菌株进行归类是不准确的。
总体来说,基于SNP的基因组分型方法和cgMLST分型方法要明显优于传统的MLST分型方法,但二者适用范围也不一样。基于SNP的基因组分型方法在认识Nm的种群结构、界定cc方面具有优势。cgMLST分型方法能够计算任何两株菌株之间的遗传距离,但不能进行cc的界定和归类,目前cgMLST方法主要用于对单一cc菌株的变异分析[10–11]。目前这两种方法可结合应用在Nm的分型工作中。未来我们计划进一步整合和优化两种分型方法,进一步提高其适用性、实用性和准确性。
References
| [1] | Harrison LH, Pelton SI, Wilder-Smith A, Holst J, Safadi MAP, Vazquez JA, Taha MK, LaForce FM, von Gottberg A, Borrow R, Plotkin SA. The global meningococcal initiative: recommendations for reducing the global burden of meningococcal disease. Vaccine, 2011, 29(18): 3363-3371. DOI:10.1016/j.vaccine.2011.02.058 |
| [2] | Abio A, Neal KR, Beck CR. An epidemiological review of changes in meningococcal biology during the last 100 years. Pathogens and Global Health, 2013, 107(7): 373-380. DOI:10.1179/2047773213Y.0000000119 |
| [3] | Li JH, Li YX, Shao ZJ, Li L, Yin ZD, Ning GJ, Xu L, Luo HM. Prevalence of meningococcal meningitis in China from 2005 to 2010. Vaccine, 2015, 33(8): 1092-1097. DOI:10.1016/j.vaccine.2014.10.072 |
| [4] | Harrison LH, Trotter CL, Ramsay ME. Global epidemiology of meningococcal disease. Vaccine, 2009, 27(Suppl 2): B51-B63. |
| [5] | Caugant DA, Kristiansen PA, Wang X, Mayer LW, Taha MK, Ouédraogo R, Kandolo D, Bougoudogo F, Sow S, Bonte L. Molecular characterization of invasive meningococcal isolates from countries in the African meningitis belt before introduction of a serogroup A conjugate vaccine. PLoS ONE, 2012, 7(9): e46019. DOI:10.1371/journal.pone.0046019 |
| [6] | Achtman M. Microevolution and epidemic spread of serogroup a Neisseria meningitidis-a review. Gene, 1997, 192(1): 135-140. DOI:10.1016/S0378-1119(97)00083-8 |
| [7] | Maiden MCJ, Bygraves JA, Feil E, Morelli G, Russell JE, Urwin R, Zhang Q, Zhou JJ, Zurth K, Caugant DA, Feavers IM, Achtman M, Spratt B G. Multilocus sequence typing: a portable approach to the identification of clones within populations of pathogenic microorganisms. Proceedings of the National Academy of Science of the United States of America, 1998, 95(6): 3140-3145. DOI:10.1073/pnas.95.6.3140 |
| [8] | Shao ZJ, Li W, Ren J, Liang XF, Xu L, Diao BW, Li MC, Lu MJ, Ren HY, Cui ZG, Zhu BQ, Dai ZW, Zhang L, Chen X, Kan B, Xu JG. Identification of a new Neisseria meningitidis serogroup C clone from Anhui province, China. The Lancet, 2006, 367(9508): 419-423. DOI:10.1016/S0140-6736(06)68141-5 |
| [9] | Law DKS, Lorange M, Ringuette L, Dion R, Giguère M, Henderson AM, Stoltz J, Zollinger WD, De Wals P, Tsang RSW. Invasive meningococcal disease in Quebec, Canada, due to an emerging clone of ST-269 serogroup B meningococci with serotype antigen 17 and serosubtype antigen P1.19(B: 17:P1.19).. Journal of Clinical Microbiology, 2006, 44(8): 2743-2749. DOI:10.1128/JCM.00601-06 |
| [10] | Lucidarme J, Hill DMC, Bratcher HB, Gray SJ, du Plessis M, Tsang RSM, Vazquez JA, Taha MK, Ceyhan M, Efron AM, Gorla MC, Findlow J, Jolley KA, Maiden MCJ, Borrow R. Genomic resolution of an aggressive, widespread, diverse and expanding meningococcal serogroup B, C and W lineage. Journal of Infection, 2015, 71(5): 544-552. DOI:10.1016/j.jinf.2015.07.007 |
| [11] | Zhu BQ, Lucidarme J, Bai XL, Guo PB, Zhang AY, Borrow R, Gao WY, Xu L, Gao Y, Shao ZJ. Comparative genomic analyses of Chinese serogroup W ST-11 complex Neisseria meningitidis isolates. Journal of Infection, 2020, 80(1): 54-60. DOI:10.1016/j.jinf.2019.08.019 |
| [12] | Chen C, Zhang W, Zheng H, Lan RT, Wang HY, Du PC, Bai XM, Ji SB, Meng Q, Jin D, Liu K, Jing HQ, Ye CY, Gao GF, Wang L, Gottschalk M, Xu JG. Minimum core genome sequence typing of bacterial pathogens: a unified approach for clinical and public health microbiology. Journal of Clinical Microbiology, 2013, 51(8): 2582-2591. DOI:10.1128/JCM.00535-13 |
| [13] | Meijs AP, Hengeveld PD, Dierikx CM, Maassen CBM, de Greeff SC, de Haan A, Bosch T, van Duijkeren E. Prolonged carriage of (livestock-associated) MRSA in individuals without professional livestock contact. Journal of Antimicrobial Chemotherapy, 2020, 75(6): 1405-1409. DOI:10.1093/jac/dkaa045 |
| [14] | Li RQ, Li YR, Fang XD, Yang HM, Wang J, Kristiansen K, Wang J. SNP detection for massively parallel whole-genome resequencing. Genome Research, 2009, 19(6): 1124-1132. DOI:10.1101/gr.088013.108 |
| [15] | Luo RB, Liu BH, Xie YL, Huang WH, Yuan JY, He GZ, Chen YX, Pan Q, Liu YJ, Tang JB, Wu GX, Zhang H, Shi YJ, Liu Y, Yu C, Wang B, Lu Y, Han CL, Cheung DW, Yiu SM, Peng SL, Zhu XQ, Liu GM, Liao XK, Li YR, Yang HM, Wang J, Lam TW. SOAPdenovo2:an empirically improved memory-efficient short-read de novo assembler. GigaScience, 2012, 1(1): 18. DOI:10.1186/2047-217X-1-18 |
| [16] | Delcher AL, Bratke KA, Powers EC, Salzberg SL. Identifying bacterial genes and endosymbiont DNA with glimmer. Bioinformatics, 2007, 23(6): 673-679. DOI:10.1093/bioinformatics/btm009 |
| [17] | Kurtz S, Phillippy A, Delcher AL, Smoot M, Shumway M, Antonescu C, Salzberg SL. Versatile and open software for comparing large genomes. Genome Biology, 2004, 5(2): R12. DOI:10.1186/gb-2004-5-2-r12 |
| [18] | Pritchard JK, Stephens M, Donnelly P. Inference of population structure using multilocus genotype data. Genetics, 2000, 155(2): 945-959. DOI:10.1093/genetics/155.2.945 |
| [19] | Earl DA, Vonholdt BM. STRUCTURE HARVESTER: a website and program for visualizing STRUCTURE output and implementing the Evanno method. Conservation Genetics Resources, 2012, 4(2): 359-361. DOI:10.1007/s12686-011-9548-7 |
| [20] | Jakobsson M, Rosenberg NA. CLUMPP: a cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure. Bioinformatics, 2007, 23(14): 1801-1806. DOI:10.1093/bioinformatics/btm233 |
| [21] | Zhou HJ, Liu WB, Qin T, Liu C, Ren HY. Defining and evaluating a core genome multilocus sequence typing scheme for whole-genome sequence-based typing of Klebsiella pneumoniae. Front Microbiology, 2017(8): 371. |
| [22] | Kan B, Zhou HJ, Du PC, Zhang W, Lu X, Qin T, Xu JG. Transforming bacterial disease surveillance and investigation using whole-genome sequence to probe the trace. Frontiers of Medicine, 2018, 12(1): 23-33. DOI:10.1007/s11684-017-0607-7 |
| [23] | Zhu B, Xu Z, Du P, Xu L, Sun X, Gao Y, Shao Z. Sequence type 4821 clonal complex serogroup B Neisseria meningitidis in China, 1978-2013. Emerging Infectious Diseases, 2015, 21(6): 925-932. DOI:10.3201/eid2106.140687 |
| [24] | Guo PB, Zhu BQ, Liang H, Gao WY, Zhou GL, Xu L, Gao Y, Yu JX, Zhang MJ, Shao ZJ. Comparison of pathogenicity of invasive and carried meningococcal isolates of ST-4821 complex in China. Infection and Immunity, 2019, 87(12): e00584-19. |
| [25] | Kristiansen PA, Diomandé F, Wei SC, Ouédraogo R, Sangaré L, Sanou I, Kandolo D, Kaboré P, Clark TA, Ouédraogo AS, Absatou KB, Ouédraogo CD, Hassan-King M, Thomas JD, Hatcher C, Djingarey M, Messonnier N, Préziosi MP, LaForce M, Caugant DA. Baseline meningococcal carriage in Burkina Faso before the introduction of a meningococcal serogroup A conjugate vaccine. Clinical and Vaccine Immunology, 2011, 18(3): 435-443. DOI:10.1128/CVI.00479-10 |
| [26] | Cui YJ, Yang XW, Didelot X, Guo CY, Li DF, Yan YF, Zhang YQ, Yuan YT, Yang HM, Wang J, Wang J, Song YJ, Zhou DS, Falush D, Yang R. Epidemic clones, oceanic gene pools, and eco-ld in the free living marine pathogen Vibrio parahaemolyticus. Molecular Biology and Evolution, 2015, 32(6): 1396-1410. DOI:10.1093/molbev/msv009 |
