何广正#, 韩卿卿#, 翟浠佐, 徐书景, 鞠建松


河北师范大学生命科学学院, 河北 石家庄 050024
收稿日期:2020-07-13;修回日期:2020-11-09;网络出版日期:2021-02-02
基金项目:国家自然科学基金(31971204);河北省自然科学基金(C2020205004,C2020205031);河北师范大学科研基金(L2019B30)
*通信作者:鞠建松, Tel: +86-311-80787573;Fax: +86-311-80789794;E-mail: jujiansong@126.com.
#并列第一作者
摘要:[目的] 将嗜碱芽孢杆菌丙氨酸消旋酶OF4DadX的N-端结构域分别与多个不同种属的丙氨酸消旋酶C-端结构域重组,探究丙氨酸消旋酶C-端结构域功能。[方法] 利用基因拼接构建丙氨酸消旋酶重组基因,通过镍亲和层析纯化酶蛋白,采用D-氨基酸氧化酶偶联法检测重组酶蛋白的酶学特性,借助分子筛和HPLC液相色谱分析其聚合状态及动力学参数。[结果] 通过基因拼接构建了12个重组基因,经检测,表达、纯化获得的重组酶蛋白中只有OF4TtDadX240c具有催化活性,其活性仅为OF4DadX的60.54%,酶催化动力学结果显示OF4TtDadX240c催化反应速率Vmax/Km下降约10倍,但其稳定性大幅提高,半衰期比OF4DadX延长约5倍,耐热性提高较明显;聚合状态表明OF4DadX、OF4TMDadX226c和OF4TtDadX240c为二聚体结构,其他酶蛋白均为单体,但OF4TMDadX226c未检测到活性,推测可能是酶催化活性中心移位,未能形成质子转移而失去活性。[结论] 丙氨酸消旋酶C-端折叠结构域对消旋酶低聚化、稳定性和酶催化功能具有重要作用。
关键词:丙氨酸消旋酶C-端结构域酶学特性二聚化基因重组
Study on the construction and function of C-terminal domain recombinant of alanine racemase
Guangzheng He#, Qingqing Han#, Xizuo Zhai, Shujing Xu, Jiansong Ju


College of Life Sciences, Hebei Normal University, Shijiazhuang 050024, Hebei Province, China
Received: 13 July 2020; Revised: 9 November 2020; Published online: 2 February 2021
*Corresponding author: Jiansong Ju, Tel: +86-311-80787573;Fax: +86-311-80789794;E-mail: jujiansong@126.com.
Foundation item: Supported by the National Natural Science Foundation of China (31971204), by the Natural Science Foundation of Hebei Province (C2020205004, C2020205031) and by the Science Foundation of Hebei Normal University (L2019B30)
#These authors contributed equally to this work.
Abstract: [Objective] The N-terminal domain of alanine racemase from Bacillus pseudofirmus OF4 was recombined with the alanine racemase C-terminal domains of many different species to explore the function of C-terminal domain. [Methods] The recombinant genes of alanine racemase were constructed by the gene splicing and expressed in E. coli BL21(DE3). The recombinant proteins were purified by affinity chromatography. D-amino acid oxidase coupling method was used to detect the enzymatic properties of the proteins, while the polymerization states and kinetic parameters of recombinant enzymes were analyzed by the molecular sieve and high-performance liquid chromatography (HPLC). [Results] The recombinant proteins were expressed and purified successfully. OF4TtDadX240c had a catalytic activity which was 60.54% of OF4DadX, whereas other recombinant enzymes lost their activities. The catalytic kinetics showed that the catalytic rate (Vmax/Km) of OF4TtDadX240c decreased about 10-fold, but its stability improved significantly. The half-life of OF4TtDadX240c had about a 5-fold prolongation than OF4DadX, and a significantly improved heat resistance. The results of the molecular sieve showed that OF4DadX, OF4TMDadX226c and OF4TtDadX240c were dimers and other proteins were monomers. However, OF4TMDadX226c lost its activity which could be attributed to the shift of the catalytic active center that failed to form the proton transfer. [Conclusion] The C-terminal folding domain of alanine racemase plays an important role in racemase dimerization, stability and catalytic function.
Keywords: alanine racemaseC-terminal domainenzymatic propertiesdimerizationgene recombination
丙氨酸消旋酶(alanine racemase, Alr, EC 5.1.1.1)具有催化L-丙氨酸和D-丙氨酸相互转化的功能,属于5′-磷酸吡哆醛(pyridoxal 5′-phosphate,PLP)依赖型酶类,归类于异构酶家族[1]。丙氨酸消旋酶为细菌细胞壁合成提供D-丙氨酸,调控细菌生长及孢子萌发,其广泛分布于原核生物中,人类及其他真核生物中较少存在。目前丙氨酸消旋酶已成为新型抑菌药物设计和研发的重要靶标[2-5]。丙氨酸消旋酶产物D-丙氨酸可作为甜味剂、保湿剂和药物合成中间体应用在食品、化妆品和医药等行业,所以丙氨酸消旋酶作为理想的生物合成D-丙氨酸的元器件而受到科研工作者的关注[6]。
丙氨酸消旋酶主要以同型二聚体形式存在,该结构由2个单体首尾相连,每个单体都是由N-端(α/β)8桶状结构域和C-端β折叠结构域组成,其催化活性中心是由N-端保守序列中的Lys40 (质子供体)与另一个单体C-端β折叠结构域中的Tyr263? (质子受体,“?”表示来自另一单体)共同组成。该催化由结合PLP的质子供体Lys40与L-丙氨酸的ε-Amino基团形成醛亚胺,质子受体Tyr263?从L-丙氨酰-PLP醛亚胺上接收α-氢形成乙酰-PLP碳酸根,碳酸根中间体结合Lys40提供的质子形成D-乙酰-PLP醛亚胺,再通过Lys40介导转醛亚胺作用产生D-丙氨酸[7-9];由此可见,N/C-端结构域对于构成丙氨酸消旋酶活性中心及发挥催化功能至关重要。
丙氨酸消旋酶可分为生物合成型(Alr)和分解代谢型(DadX/B),它们具有相同的催化功能;基因缺失实验表明,二者均可为细菌细胞壁合成提供D-Ala[10]。前期研究发现嗜碱芽孢杆菌(Bacillus pseudofirmus) OF4中仅含有1个丙氨酸消旋酶基因OF4DadX (GenBank:EU751624),通过分析丙氨酸消旋酶OF4DadX的酶学性质,可知其具有较高的催化活性和转化率[11]。根据OF4DadX (PDB:5YYC)三维结构信息发现二聚体界面存在盐键作用力(Asp43-Lys360?,Asp70-Lys2?,Glu71-Arg361?,Glu134-Arg259?和Asp318-Lys41?),替换参与盐键作用的保守位点(Asp43、Asp70、Glu71、Glu134和Asp318),探明71、134和318位点所形成的盐键对于OF4DadX二聚体形成、维持二聚体结构和酶催化活性至关重要[11],值得注意的是大部分参与二聚化的氨基酸残基位于C-端折叠区域内。据文献报道丙氨酸消旋酶N-端桶状结构域较保守,而不同种属来源的丙氨酸消旋酶C-端折叠结构域有较大差别[7],推测C-端折叠可能对丙氨酸消旋酶二聚化、结构稳定性和酶催化功能具有重要作用。
本文以嗜碱芽孢杆菌丙氨酸消旋酶OF4DadX的N-端结构域与不同种属来源的丙氨酸消旋酶C-端结构域重组,通过重组酶蛋白表达、纯化,检测重组蛋白的酶学特性、聚合状态和动力学参数等,分析丙氨酸消旋酶C-端结构域对酶蛋白的影响,探明丙氨酸消旋酶C-端结构域的功能,为以丙氨酸消旋酶为靶标的抑菌药物研发和酶法合成D-丙氨酸元器件改造提供理论支撑。
1 材料和方法 1.1 菌株、质粒和试剂 大肠杆菌(Escherichia coli) DH5α用于基因克隆,E. coli BL21(DE3)用于蛋白表达;质粒pET- OF4DadX、pET-TtDadX、pET-EcAlr、pET-PaAlr、pET-PaDadX、pET-TMDadX、pET-LRBDadX、pET-StAlr由本实验室构建,pMD18-T购自TaKaRa公司,pET-22b(+)本实验室保存。
ExTaq DNA Polymerase、QuickCut enzyme、T4 DNA Ligase、DNA Marker和Protein Molecular Weight Marker购自TaKaRa公司,Peroxidase、4-Aminoantipyrine(4-AA)、N-ethyl-N-(2-hydroxy-3- sulfopropyl)-3-methylaniline sodium salt (TOOS)、D-amino acid oxidase和Gel Filtration Markers Kit购自Sigma公司,其他常用化学试剂均为分析纯。
1.2 基因克隆所用引物 根据丙氨酸消旋酶(单体)N-端结构域和C-端结构域之间的核苷酸序列信息,利用Primer Premier 5软件设计引物,表 1引物由苏州金唯智生物科技有限公司合成,下划线所示核苷酸序列为限制内切酶的识别位点。
表 1. 本研究所用引物 Table 1. Primers used in this study
| Primers | Sequences (5?→3?) | Restriction enzymes |
| OF4DadX241n-F01 | GCCCATATGAAGACGAGCAGTTTTAGA | NdeⅠ |
| OF4DadX241n-R01 | GAATTCTAAGGAAACGTCCGGTCTTAA | EcoRⅠ |
| TtDadX240c-F01 | CGAATTCATTTTAGACTTAAGACCTGCC | EcoRⅠ |
| TtDadX240c-R01 | CTCGAGAATTTTTAAATAATTTT TTACAT | XhoⅠ |
| EcAlr226c-F01 | CGAATTCGGTGCCGATTTTGGCTGT | EcoRⅠ |
| EcAlr227c-F01 | CGAATTCGCCGATTTTGGCTGT | EcoRⅠ |
| EcAlr228c-F01 | CGAATTCGATTTTGGCTGTCAG | EcoRⅠ |
| EcAlr229c-F01 | CGAATTCTTTGGCTGTCAGCCAG | EcoRⅠ |
| EcAlr c-R01 | CTCGAGATCCACGTATTTCATCGCGAC | XhoⅠ |
| PaAlr227c-F01 | CGAATTCGAACTGGGCCTGAAG | EcoRⅠ |
| PaAlr c-R01 | CTCGAGGTGGCTGTAGCGTCGCGG | XhoⅠ |
| PaDadX226c-F01 | AGAATTCGCCGACCGCTTGCGC | EcoRⅠ |
| PaDadX227c-F01 | AGAATTCGACCGCTTGCGCCCG | EcoRⅠ |
| PaDadX228c-F01 | AGAATTCCGCTTGCGCCCGGTGAT | EcoRⅠ |
| PaDadX c-R01 | AAGCTTAGCCCCGGAATAGACGCG | Hind Ⅲ |
| StAlr228c-F01 | CGAATTCGATTTTGGTTTTCAG | EcoRⅠ |
| StAlr228c-R01 | CTCGAGATCAATATACTTCATCGCCACCCTT | XhoⅠ |
| LRBDadX226c-F01 | CGAATTCGCCTCGCGCCTGCA | EcoRⅠ |
| LRBDadX226c-R01 | AAGCTTATGCCCGGAATAGAGCCG | Hind Ⅲ |
| TMDadX226c-F01 | CGAATTCGCCTCTCGCTTGCA | EcoRⅠ |
| TMDadX226c-R01 | AAGCTTGTTACCGGAATAGAGCC | Hind Ⅲ |
| The underlined are restriction enzyme cutting sites. | ||
表选项
1.3 重组基因构建 以pET-OF4DadX为模板,通过PCR扩增获得嗜碱芽孢杆菌丙氨酸消旋酶N-端结构域的DNA片段(OF4DadX241n),同时利用PCR分别克隆来自大肠杆菌(E.coli)、腾冲嗜热厌氧菌(Thermoanaerobacter tengcongensis) MB4、鼠伤寒沙门氏菌(Salmonella typhimurium)、铜绿假单胞菌(Pseudomonas aeruginosa) PAO1、荧光假单胞菌(Pseudomonas fluorescens) LRB3W1和荧光假单胞菌(P. fluorescens) TM5-2中的丙氨酸消旋酶C-端结构域的DNA片段(EcAlr226c、EcAlr227c、EcAlr228c、EcAlr229c、TtDadX240c、StAlr228c、PaAlr227c、PaDadX226c、PaDadX227c、PaDadX228c、LRBDadX226c、TMDadX226c);上述DNA片段通过限制内切酶EcoR Ⅰ处理后,80 ℃热失活5 min,将N-端(OF4DadX241n)片段分别与不同来源的C-端DNA片段连接,16 ℃、8 h后,加入pMD18-T载体连接3 h,构建重组基因的克隆载体。
将含有重组基因的克隆载体转入大肠杆菌DH5α感受态细胞中,培养于含有氨苄抗生素(Amp+)的LB固体琼脂上;随机挑取菌落,通过菌落PCR筛选阳性克隆;经测序验证,将序列正确的重组基因用限制性内切酶处理,与pET-22b表达载体连接,构建重组基因的表达载体。
1.4 酶蛋白的表达和纯化 将构建的重组质粒转入大肠杆菌BL21(DE3)感受态细胞中,于LB液体培养基(Amp+)中扩培至OD600为0.5左右,加入终浓度为1 mmol/L的IPTG,于30 ℃诱导培养12 h,离心收集菌体。
将菌体重悬于细胞裂解缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L imidazole)中,超声波破碎细胞,4 ℃、8000 r/min离心10 min,将上清液通过Ni-NTA亲和层析柱分离、纯化酶蛋白。通过膜透析法去除高浓度盐和咪唑,超滤管浓缩蛋白后分装保存于-80 ℃。采用12.5%的SDS-PAGE检测蛋白表达和纯化情况,利用BCA Protein Assay Kit (TaKaRa)测定酶蛋白浓度。
1.5 酶学特性分析
1.5.1 丙氨酸消旋酶活性测定: 丙氨酸消旋酶的活性分析采用消旋和氧化(D-氨基酸)两步反应法进行测定[12]。
消旋反应[12]:在200 μL反应体系中加入终浓度为50 mmol/L L-丙氨酸、10 μmol/L PLP、40 mmol/L Britton-Robinson缓冲液(pH 10.38)以及20 μL酶液,于40 ℃反应10 min。加入25 μL 2 mol/L HCl混合均匀终止反应,随即以25 μL 2 mol/L NaOH中和HCl,14000 r/min、4 ℃离心10 min,取上清待用。以相同体积的缓冲液代替酶蛋白进行消旋反应作为空白对照。
氧化反应[12]:在200 μL反应体系中加入终浓度为200 mmol/L Tris-HCl (pH 8.0)、0.1 mg/mL 4-aminoantipyrine、0.1 mg/mL TOOS、2 units peroxidase、0.1 unit D-amino acid oxidase以及100 μL消旋反应上清,于37 ℃孵育20 min,采用微孔板分光光度计(BioTek,USA)在OD550处测定消旋产物D-丙氨酸被氧化生成NH4+的量(酶活性判断标准:单位时间内,相同氧化反应体系中NH4+的生成量)。一个酶活力单位(unit)定义为1 min内转化生成1 μmoL D-丙氨酸所需的酶量。
1.5.2 重组酶蛋白相对活性: 按照丙氨酸消旋酶活性检测法,以L-丙氨酸为底物对丙氨酸消旋酶OF4DadX以及重组酶蛋白进行催化活力分析。首先确定各酶蛋白浓度,在相同反应体系中分别加入等量的消旋酶蛋白进行催化反应,检测反应产物的生成量并判断OF4DadX与重组消旋酶的相对催化活力。设定OF4DadX的相对活力为100%,比较其他几种重组消旋酶的催化活力,分别以其变性失活的酶蛋白作为空白对照。
1.5.3 重组酶蛋白最适反应pH: 按照丙氨酸消旋酶活性检测法,以L-丙氨酸为底物,在40 ℃条件下,等量酶蛋白于不同pH (7.00-11.92)的Britton-Robinson缓冲溶液中进行消旋催化反应,检测反应产物的生成量并确定消旋酶蛋白的最适反应pH。设定产物生成速率较快的酶催化活力为100%,比较酶蛋白在其他pH反应的催化活力,以变性失活的酶蛋白作为空白对照。
1.5.4 最适反应温度: 以L-丙氨酸为底物,最适反应pH缓冲溶液中,等量酶蛋白于不同温度(25-70 ℃)下进行消旋反应,检测反应产物的生成量并确定消旋酶蛋白的最适反应温度。设定产物生成速率较快的酶催化活力为100%,比较酶蛋白在其他温度反应的催化活力,以变性失活的酶蛋白作为空白对照。
1.5.5 酶蛋白pH稳定性: 将等量的丙氨酸消旋酶分别置于不同pH的Britton-Robinson缓冲溶液(pH 7.96、9.15、10.38和11.20)中,40 ℃孵育不同时间,待孵育结束,向处理后的消旋酶中加入50 mmol/L L-丙氨酸和10 μmol/L PLP,最适条件下进行消旋反应。通过测定不同处理时间的丙氨酸消旋酶活性,确定消旋酶蛋白在不同pH条件下的稳定性情况。空白组以不作处理的酶蛋白的催化活力为100%。
1.5.6 酶蛋白热稳定性: 在丙氨酸消旋酶最适反应pH下,将等量的酶蛋白分别置于30、40、50、60 ℃处理不同时间,待热处理结束,向热处理后的消旋酶中加入50 mmol/L L-丙氨酸和10 μmol/L PLP,最适条件下进行消旋反应。通过测定不同热处理时间的丙氨酸消旋酶活性,确定消旋酶蛋白的热稳定性情况。空白组以不作热处理的酶蛋白的催化活力为100%。
1.6 酶催化动力学 以不同浓度梯度的L-丙氨酸或D-丙氨酸作为底物,分别加入等量的酶蛋白,在最适催化条件下进行消旋反应,待消旋反应结束后,取上清进行荧光检测,以相同体积的缓冲液代替酶蛋白液进行消旋反应作为空白对照。
荧光反应:向40 μL消旋反应溶液中加入280 μL硼酸盐缓冲溶液(0.4 mol/L,pH 9.0)和80 μL Boc-L-Cys-OPA reagent (10 mg O-Phthaldialdehyde和10 mg Boc-L-Cys溶解在1 mL甲醇中,现用现配),混匀后孵育2 min,取10 μL反应液加入HPLC液相色谱系统进行荧光检测。根据L-丙氨酸和D-丙氨酸的峰面积,计算消旋酶的Km和Vmax[11-12]。
1.7 酶蛋白聚合状态分析 利用?KTA蛋白纯化系统进行分子筛层析,将亲和层析纯化获得的酶蛋白上样到Superdex 200 10/300GL预装柱(GE)中,流动相为20 mmol/L磷酸钾缓冲液(pH 8.0),流速为0.5 mL/min,记录消旋酶蛋白的峰保留时间[11]。
根据蛋白分子量标品(cytochrome c,12.4 kDa;carbonic anhydrase,29 kDa;albumin bovine serum,66 kDa;alcohol dehydrogenase,150 kDa;β-amylase,200 kDa)在层析中的保留时间与其分子量的关系绘制标准曲线,由此计算丙氨酸消旋酶蛋白分子量以确定其聚合状态[11]。
1.8 序列测定和分析 核酸序列由苏州金唯智生物科技有限公司测定,序列比对采用Clustal X软件处理。丙氨酸消旋酶基因的核苷酸序列信息:EcAlr (GenBank:NP418477)、TtDadX (GenBank:AAM25327)、StAlr (GenBank:CP050753)、PaAlr (GenBank:AAD47082)、PaDadX (GenBank:AAD47081)、LRBDadX (GenBank:AB204722)及TMDadX (GenBank:AB204721)。
2 结果和分析 2.1 同源序列分析、基因重组及载体构建 利用Clustal X和在线软件ESPript (http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)对嗜碱芽孢杆菌、腾冲嗜热厌氧菌、大肠杆菌、铜绿假单胞菌等不同来源的丙氨酸消旋酶进行同源序列比对,分析丙氨酸消旋酶催化活性位点,确定N-端桶状结构域和C-端β折叠结构域位置及重组位点(图 1)。OF4DadX的N-端结构域由1-244位氨基酸残基组成,C-端折叠结构域为残基245-369,催化活性位点为Lys41和Tyr269;由氨基酸序列和核苷酸序列分析发现,N-端结构域末Glu240和Phe241密码子的核苷酸序列GAATTC为EcoR Ⅰ酶切位点,且该基因片段只有1个EcoR Ⅰ位点;根据OF4DadX (PDB:5YYC)三维结构信息分析,Glu240和Phe241在N-端桶状结构外,介于2个结构域之间,不影响桶状结构域和折叠结构域的空间结构,所以选择以EcoR Ⅰ位点进行基因片段拼接(重组),以获得重组C-端结构域的丙氨酸消旋酶(图 1)。
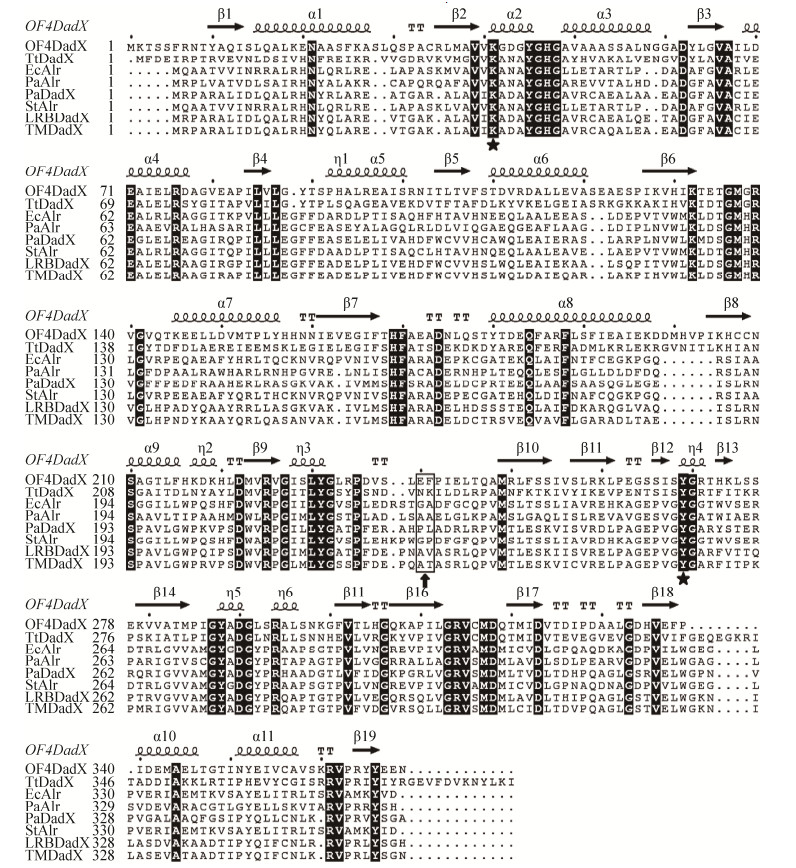 |
图 1 基于丙氨酸消旋酶二级结构的氨基酸序列比对 Figure 1 Structural-based amino acid sequences alignment of alanine racemases. Amino acid sequences of alanine racemase from B. pseudofirmus OF4 (OF4DadX), T. tengcongensis MB4 (TtDadX), E. coli (EcAlr), P. aeruginosa PAO1 (PaAlr, PaDadX), S. typhimurium (StAlr), P. fluorescens LRB3W1 (LRBDadX) and P. fluorescens TM5-2 (TMDadX) are aligned. Amino acids are numbered and secondary structures are labeled, two key catalytic residues Lys41 and Tyr269 are marked with a star (  |
| 图选项 |
通过PCR扩增、DNA片段重组、重组序列检测及载体构建,成功得到12个重组基因的表达载体pET-OF4EcAlr226c、pET-OF4EcAlr227c、pET-OF4EcAlr228c、pET-OF4EcAlr229c、pET-OF4TtDadX240c、pET-OF4StAlr228c、pET-OF4PaAlr227c、pET-OF4PaDadX226c、pET-OF4PaDadX227c、pET-OF4PaDadX228c、pET-OF4LRBDadX226c、pET-OF4TMDadX226c,可用于后续重组酶蛋白表达纯化。
2.2 酶蛋白诱导表达及纯化 将pET-OF4DadX和其他12个含重组基因的质粒转入E. coli BL21(DE3)感受态细胞中,经摇瓶培养、IPTG诱导、菌体收集、超声波破碎后4 ℃离心取上清,通过Ni-NTA亲和层析柱纯化酶蛋白,经透析除盐和超滤管浓缩后,成功得到13个酶蛋白。利用SDS-PAGE检测发现,所有酶蛋白均在44.3-66.4 kDa之间有单一且清晰的条带,约45.4 kDa,与理论分子量基本一致(图 2)。
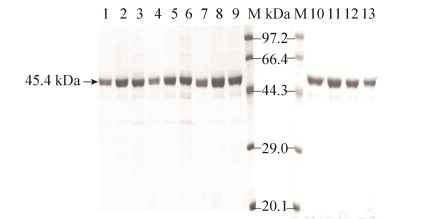 |
| 图 2 丙氨酸消旋酶蛋白SDS-PAGE检测 Figure 2 SDS-PAGE identification of alanine racemase. Lane 1: OF4DadX; lane 2: OF4EcAlr226c; lane 3: OF4EcAlr227c; lane 4: OF4EcAlr228c; lane 5: OF4EcAlr229c; lane 6: OF4TtDadX240c; lane 7: OF4StAlr228c; lane 8: OF4PaAlr227c; lane 9: OF4PaDadX226c; lane 10: OF4PaDadX227c; lane 11: OF4PaDadX228c; lane 12: OF4LRBDadX226c; lane 13: OF4TMDadX226c; M: protein molecular weight marker. |
| 图选项 |
2.3 酶学特性分析
2.3.1 丙氨酸消旋酶相对活性: 利用BCA试剂盒测定各酶蛋白浓度,以OF4DadX的蛋白浓度为标准,取等量蛋白酶在40 ℃、pH 10.38的Britton-Robinson缓冲溶液中检测其相对活性,发现只有丙氨酸消旋酶OF4DadX和重组酶OF4TtDadX240c具有催化活性,以OF4DadX的相对活性为标准(100.00%),TtDadX的相对活性为41.13%,重组酶OF4TtDadX240c的相对活性为60.54%,其他重组消旋酶未检测到活性。
2.3.2 最适反应pH和温度: 在不同pH (7.0-11.92)或不同温度(25-70 ℃)条件下,测定OF4DadX和重组消旋酶OF4TtDadX240c的相对活性,分析其最适催化反应条件。结果如图 3所示,OF4DadX和OF4TtDadX240c的最适反应pH分别为10.38和9.15,二者的最适催化反应温度均为40 ℃,而TtDadX的最适反应温度为70 ℃,最适反应pH约为11.00[13],由此可见,来自TtDadX的C-端结构域对于嵌合体蛋白的最适反应温度影响极小。
 |
| 图 3 丙氨酸消旋酶的最适反应pH和温度 Figure 3 The optimal pH and temperature of alanine racemase. A: optimal pH; B: optimal temperature. The data were presented as the mean±SD, and the experiments were performed in triplicates with similar results using three independent purified proteins. |
| 图选项 |
2.3.3 pH稳定性: 将OF4DadX和OF4TtDadX240c分别在pH 7.96、9.15、10.38和11.20条件下处理不同时间后,分析蛋白酶的活性衰减及半衰期。
OF4DadX分别在pH 7.96、9.15、10.38和11.20条件处理6 h,OF4DadX酶活性下降至初始酶活的39.89%、52.67%、45.99%、8.00%;值得注意的是在pH 11.20条件下仅仅处理0.5 h,酶活即衰减至15.33%,此后酶活力维持在10%左右,其他3个pH下的酶活性衰减趋势相近,酶活半衰期约为5 h (图 4-A)。OF4TtDadX240c分别在pH 7.96、9.15、10.38和11.20的条件下处理,当处理2 h左右,酶活衰减较快;处理6 h时,OF4TtDadX240c酶催化活性分别降至初始酶活的70.18%、87.57%、70.84%、82.55%;当处理时间延长至22 h,酶活力仍保留在66.00%-75.69%之间,预计酶活半衰期在22 h以后(图 4-B)。可以看出,在pH 7.96-11.20范围内,相比于OF4DadX,重组酶OF4TtDadX240c具有更好的pH稳定性。
 |
| 图 4 丙氨酸消旋酶的pH稳定性 Figure 4 The pH stability of alanine racemase. A: OF4DadX; B: OF4TtDadX240c. The data were presented as the mean±SD, and the experiments were performed in triplicates with similar results using three independent purified proteins. |
| 图选项 |
分析嗜热酶TtDadX的酶学特性可见,TtDadX在70 ℃、pH 9.00-11.20条件下处理2 h后其相对酶活仍然超过90%[13],这说明该酶具有较好的pH稳定性。因此,或许正是来自TtDadX的C-端结构域的插入才使重组酶OF4TtDadX240c在pH稳定性方面优于OF4DadX。
2.3.4 热稳定性: OF4DadX和重组蛋白OF4Tt DadX240c的最适催化温度均为40 ℃,分别在40、50、60 ℃条件下热处理,测定不同热处理后的酶活力保留情况及半衰期。
OF4DadX分别在40 ℃和50 ℃条件下热处理1.5 h,仅保留63.72%和25.41%的催化活力,活性丧失较快;继续热处理至10 h,酶活力则衰减为44.38%和18.91%,其在40 ℃和50 ℃下的半衰期分别为4 h和0.5 h。OF4DadX在60 ℃稳定性最差,热处理1 h即完全失去活性(图 5-A)。OF4TtDadX240c分别在40 ℃、50 ℃和60 ℃条件下热处理10 h,酶活力分别降为77.45%、83.50%和57.09%;处理22 h后,酶活力降为61.69%、48.29%和1.65%。OF4TtDadX240c在最适催化温度下,其半衰期约为22 h,但较高温度60 ℃时的半衰期约为10 h (图 5-B)。
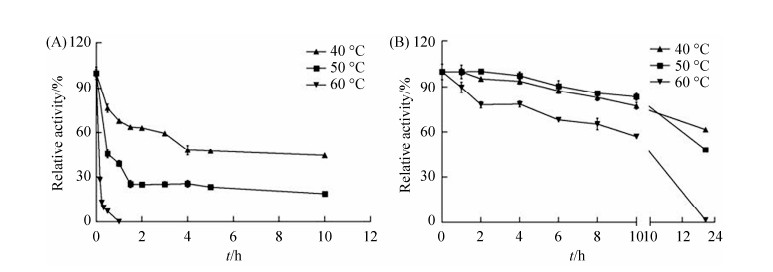 |
| 图 5 丙氨酸消旋酶的热稳定性 Figure 5 The temperature stability of alanine racemase. A: OF4DadX; B: OF4TtDadX240c. The data were presented as the mean±SD, and the experiments were performed in triplicates with similar results using three independent purified proteins. |
| 图选项 |
分析TtDadX的热稳定性可以发现,该酶在70 ℃下其半衰期约为15 h,在50 ℃下处理22 h后其相对活力仍保持在95%以上[13],说明TtDadX具有极强的耐热性。从这些结果可以看出,在相同条件下,重组酶OF4TtDadX240c的热稳定性虽然弱于嗜热酶TtDadX,但在相同条件下,重组酶的热稳定性却明显优于OF4DadX。由此可见,嗜热酶TtDadX的C-端结构域的插入赋予了重组酶OF4TtDadX240c较强的耐热性。
2.4 酶催化动力学 以不同浓度梯度的L-Ala或D-Ala为底物,利用液相色谱测定最适催化条件下OF4TtDadX240c的酶催化动力学参数。如表 2所示,以L-Ala为底物,OF4DadX、TtDadX和OF4TtDadX240c的催化反应速率Vmax/Km分别约为251.26、70.14和24.57,OF4DadX及TtDadX的催化速率分别约是重组酶OF4TtDadX240c的10倍和3倍;以D-Ala为底物,OF4DadX、TtDadX和OF4TtDadX240c的Vmax/Km值为248.69、70.61和19.66,2个亲本的催化速率分别约是OF4TtDadX240c的13和3.6倍;OF4DadX对L-Ala或D-Ala的亲和常数Km值分别约为重组酶OF4TtDadX240c的0.51倍和0.36倍;TtDadX对L-Ala或D-Ala的亲和常数Km值与OF4TtDadX240c的Km比值相当,均约为0.24倍。从反应平衡常数Keq (L/D)来看,OF4DadX和TtDadX的平衡反应常数均接近1.0,说明二者所催化的反应为可逆平衡反应,而重组酶OF4TtDadX240c的Keq (L/D)值为1.25。从上述结果可以看出,来自TtDadX的C-端结构域在不同程度上改变了重组酶对底物的亲和性及催化活性,并在一定程度上打破了该酶原有的可逆平衡反应。
表 2. 丙氨酸消旋酶动力学参数 Table 2. The kinetic parameter of alanine racemases
| Enzymes | L-Ala→D-Ala | D-Ala→L-Ala | ||||
| Km/(mmol/L) | Vmax/[μmol/(min·L)] | Km/(mmol/L) | Vmax/[μmol/(min·L)] | Keq/(L/D) | ||
| OF4DadX | 41.79 | 10500.00 | 14.91 | 3708.00 | 1.01[11] | |
| TtDadX | 20.16 | 1414.00 | 9.95 | 702.60 | 0.99[13] | |
| OF4TtDadX240c | 82.45±3.14 | 2026.00±12.57 | 41.32±2.05 | 812.20±7.82 | 1.25 | |
表选项
由于丙氨酸消旋酶通常是以同源二聚体参与催化反应,其活性中心及活性通道的构成氨基酸残基分别来自一个亚基的N-端域和另一个亚基的C-端域[11]。从酶蛋白的一级结构来看,OF4DadX和TtDadX的氨基酸序列同源性为39.46%,其中二者的C-端氨基酸序列之间的同源性为45.87%;从三维结构来看,二者的N-端结构域主要由相对保守的(β/α)8桶状结构组成,主要由β折叠构成的C-端结构域则存在较大差异[7]。可以推测,在将OF4DadX的C-端序列替换为TtDadX的C-端序列后,尽管从一级结构上维持了构成酶蛋白活性中心关键氨基酸位点的位置不变,但构成重组酶OF4TtDadX240c活性中心周边的氨基酸残基的空间结构及其微环境均发生了一定的改变,从而影响了重组酶活性中心之间的契合度,进而导致其对底物的亲和能力和催化速率较大幅度下降,反应平衡常数方面也发生了一定程度的改变。
2.5 酶蛋白聚合状态分析 根据蛋白分子量标品和重组酶蛋白在层析柱内的峰保留时间,计算重组蛋白的分子量并分析聚合状态。由标准分子量蛋白和酶蛋白分子筛数据分析发现,只有OF4DadX、OF4TMDadX226c和OF4TtDadX240c形成二聚体结构,其他重组酶蛋白以单体形式存在(表 3)。
表 3. 酶蛋白的分子量与聚合状态 Table 3. The molecular weight and polymerization of proteins
| Proteins | Volume/mL | M.W./kDa | Polymerization |
| OF4DadX | 14.41 | 79.52 | Dimer |
| OF4EcAlr226c | 15.42 | 50.98 | Monomer |
| OF4EcAlr227c | 15.49 | 49.43 | Monomer |
| OF4EcAlr228c | 15.61 | 46.89 | Monomer |
| OF4EcAlr229c | 15.54 | 48.35 | Monomer |
| OF4TtDadX240c | 14.37 | 80.93 | Dimer |
| OF4StAlr228c | 15.56 | 47.93 | Monomer |
| OF4PaAlr227c | 15.82 | 42.75 | Monomer |
| OF4PaDadX226c | 15.28 | 54.22 | Monomer |
| OF4PaDadX227c | 15.35 | 52.57 | Monomer |
| OF4PaDadX228c | 15.64 | 46.27 | Monomer |
| OF4LRBDadX226c | 15.33 | 53.04 | Monomer |
| OF4TMDadX226c | 14.52 | 75.76 | Dimer |
表选项
经检测,OF4DadX和OF4TtDadX240c具有催化活性,然而却未能检测到OF4TMDadX226c的催化活性。氨基酸序列比对结果显示,OF4DadX与TMDadX、PaAlr、LRBDadX、PaDadX、EcAlr及StAlr之间的氨基酸序列同源性分别为33.51%、32.75%、31.89%、32.97%、30.96%和31.23%,二者的C-端域序列同源性分别为36.92%、36.64%、36.15%、35.43%、29.60%和28.24%。可以看出,这些亲本无论是整体序列亦或是C-端序列,它们与OF4DadX的同源性比值均低于TtDadX与OF4DadX之间的比值(39.46%和45.87%)。因此,这预示了构成重组酶亲本及其C-端结构域序列的同源性高低对于重组酶活性中心的良好契合以及二聚体结构的形成有着一定程度的影响,同源性越低,活性中心的契合度和二聚体形成的可能性就越差,如重组酶OF4TMDadX226c,尽管重组酶可以形成二聚体结构,但却因活性中心契合度差无法完成催化反应;至于其他重组酶蛋白,则可能因其同源更低从而仅以无活性的单体形式呈现。
3 讨论 丙氨酸消旋酶催化丙氨酸旋光异构反应,是D-丙氨酸生物合成途径中的关键酶[12, 14]。D-丙氨酸传统生产工艺不仅存在产物浓度低、生产成本偏高以及反应机制复杂等缺点,且不能满足市场的需求[6, 15];而利用丙氨酸消旋酶参与的酶法生物合成D-丙氨酸具有反应过程简单、低污染和低成本等优点而受到广泛关注,但丙氨酸消旋酶在热稳定性较差、催化活性低以及转化效率低等方面存在的不足一直是酶法生物合成D-丙氨酸面临的主要难题[14]。本课题组在利用OF4DadX等三基因共表达合成D-丙氨酸时,发现重组菌的重复利用次数较少,进一步说明可能是酶蛋白稳定性差导致。
嗜碱芽孢杆菌丙氨酸消旋酶OF4DadX (PDB:5YYC)为同型二聚体,催化活性中心由Lys41和Tyr269?组成,活性中心的底物通道由N-端桶状结构域和C-端β折叠结构域共同组成,N-端桶状结构域较为保守,而C-端折叠为非保守域[11]。目前对该通道内氨基酸位点的功能研究较多,如Sun等研究发现TtAlr底物通道内Q360位点与酶蛋白催化活性相关[12];Xue等探究TtDadX底物通道内H359位点功能,发现其与S171位点相互协同参与稳定酶蛋白与辅酶的结合[13]。He等成功分析了丙氨酸消旋酶TtAlr底物通道内A172和S173位点功能,发现二者为酶蛋白催化活性和稳定性的关键位点[14];探究OF4DadX二聚化的关键氨基酸位点,发现大部分参与二聚化盐键的氨基酸残基位于C-端折叠域,但关于C-端非保守折叠结构域的研究较少。为改造丙氨酸消旋酶克服酶法合成D-丙氨酸的难题,本文通过结构域交换探究其C-端非保守折叠结构域的功能。
本研究将具有高催化活性的OF4DadX的N-端桶状结构域与不同种属来源的丙氨酸消旋酶C-端β折叠结构域重组,经检测,成功构建的12个重组丙氨酸消旋酶中仅OF4TtDadX240c具有催化活性;酶学特性分析发现,OF4TtDadX240c的最适反应温度和最适反应pH值与亲本OF4DadX接近,分别为40 ℃和9.15,与亲本TtDadX相差甚远;而在最适反应条件下,重组酶OF4TtDadX240c的pH稳定性和热稳定性均优于OF4DadX,呈现出趋近于TtDadX的特性;从动力学参数结果来看,重组酶OF4TtDadX240c对于底物的亲和能力(Km)和催化速率(Vmax/Km)方面均明显弱于OF4DadX及TtDadX,但OF4TtDadX240c的反应平衡常数Keq (L/D)为1.25,略高于丙氨酸消旋酶所参与平衡反应的理论值(1.0)[1]。郭青云和高建华等在分别通过结构域交换探究苏云金芽孢杆菌杀虫晶体形态及表达形式时发现,结构域交换后, 晶体中蛋白的排列方式发生改变,导致其杀虫活性和形成效率降低[16-17]。由此可见,来自嗜热酶TtDadX的C-端结构域对于重组酶的稳定性方面存在一定的贡献,但由于其结构上的变化导致其活性中心的契合度发生改变,从而使其在催化活性、亲和性、催化效率和反应平衡常数等方面均发生了一定程度的改变。
为了分析其余重组蛋白丧失催化活性的原因,我们分析了所有重组酶蛋白的低聚合状态,可以看出,除了重组酶OF4TMDadX226c呈现为二聚体外,其余没有催化活性的重组酶蛋白均为单体状态,这符合丙氨酸消旋酶以同源二聚体状态参与催化反应的酶学机制[18]。经分析各亲本的C-端结构域序列同源性发现,与OF4DadX相比,亲本TMDadX的C-端序列同源性为36.92%,仅次于TtDadX (45.87%),高于其余蛋白(28.24%-36.64%),可以看出,C-端结构域与亲本的同源性越低,所构建的重组蛋白形成二聚体的可能性就越小,使得酶蛋白活性中心的契合度也愈低,从而导致重组蛋白丧失催化活性。
综上,丙氨酸消旋酶C-端结构域的来源和序列同源性的高低对于所构建重组体的稳定性、催化活性以及低聚合化等方面具有显著影响,此区域可作为丙氨酸消旋酶改造的重要靶点。
References
| [1] | Israr M, Lv G, Xu SJ, Li YH, Ding ST, Zhao BH, Ju JS. Biochemical characterization and mutational analysis of alanine racemase from Clostridium perfringens. Journal of Bioscience and Bioengineering, 2019, 128(2): 149-155. DOI:10.1016/j.jbiosc.2019.02.003 |
| [2] | Shrestha R, Lockless SW, Sorg JA. A Clostridium difficile alanine racemase affects spore germination and accommodates serine as a substrate. Journal of Biological Chemistry, 2017, 292(25): 10735-10742. DOI:10.1074/jbc.M117.791749 |
| [3] | Azam MA, Jayaram U. Inhibitors of alanine racemase enzyme: a review. Journal of Enzyme Inhibition and Medicinal Chemistry, 2016, 31(4): 517-526. DOI:10.3109/14756366.2015.1050010 |
| [4] | Nakatani Y, Opel-Reading HK, Merker M, Machado D, Andres S, Kumar SS, Moradigaravand D, Coll F, Perdig?o J, Portugal I, Sch?n T, Nair D, Devi KRU, Kohl TA, Beckert P, Clark TG, Maphalala G, Khumalo D, Diel R, Klaos K, Aung HL, Cook GM, Parkhill J, Peacock SJ, Swaminathan S, Viveiros M, Niemann S, Krause KL, K?ser CU. Role of alanine racemase mutations in Mycobacterium tuberculosis d-cycloserine resistance. Antimicrobial Agents and Chemotherapy, 2017, 61(12): e01575-17. |
| [5] | Liu D, Zhang L, Xue W, Wang YP, Ju JS, Zhao BH. Knockout of the alanine racemase gene in Aeromonas hydrophila HBNUAh01 results in cell wall damage and enhanced membrane permeability. FEMS Microbiology Letters, 2015, 362(13): fnv089. DOI:10.1093/femsle/fnv089 |
| [6] | Wang Y, Li YZ. Application and preparation methods of D-alanine. Liaoning Chemical Industry, 2003, 32(2): 58-60. (in Chinese) 王颖, 李云政. D-丙氨酸的用途及制备方法. 辽宁化工, 2003, 32(2): 58-60. DOI:10.3969/j.issn.1004-0935.2003.02.005 |
| [7] | Im H, Sharpe ML, Strych U, Davlieva M, Krause KL. The crystal structure of alanine racemase from Streptococcus pneumoniae, a target for structure-based drug design. BMC Microbiology, 2011, 11(1): 1-15. DOI:10.1186/1471-2180-11-1 |
| [8] | Davis E, Scaletti-Hutchinson E, Opel-Reading H, Nakatani Y, Krause KL. The structure of alanine racemase from Acinetobacter baumannii. Acta Crystallographica Section F, 2014, 70(9): 1199-1205. |
| [9] | Tassoni R, van der Aart LT, Ubbink M, van Wezel GP, Pannu NS. Structural and functional characterization of the alanine racemase from Streptomyces coelicolor A3(2). Biochemical and Biophysical Research Communications, 2017, 483(1): 122-128. DOI:10.1016/j.bbrc.2016.12.183 |
| [10] | Awasthy D, Bharath S, Subbulakshmi V, Sharma U. Alanine racemase mutants of Mycobacterium tuberculosis require D-alanine for growth and are defective for survival in macrophages and mice. Microbiology: Reading, England, 2012, 158(Pt 2): 319-327. |
| [11] | Dong H, Hu TT, He GZ, Lu DR, Qi JX, Dou YS, Long W, He X, Ju JS, Su D. Structural features and kinetic characterization of alanine racemase from Bacillus pseudofirmus OF4. Biochemical and Biophysical Research Communications, 2018, 497(1): 139-145. DOI:10.1016/j.bbrc.2018.02.041 |
| [12] | Sun XL, He GZ, Wang XY, Xu SJ, Ju JS, Xu XL. Crystal structure of a thermostable alanine racemase from Thermoanaerobacter tengcongensis MB4 reveals the role of Gln360 in substrate selection. PLoS ONE, 2015, 10(7): e0133516. DOI:10.1371/journal.pone.0133516 |
| [13] | Xue ZW, Hu Y, Xu SJ, Ohnishi K, Ma YH, Ju JS, Zhao BH. Characterization and preliminary mutation analysis of a thermostable alanine racemase from Thermoanaerobacter tengcongensis MB4. Extremophiles, 2013, 17(4): 611-621. DOI:10.1007/s00792-013-0545-5 |
| [14] | He GZ, Han QQ, Xu SJ, Zhao BH, Ju JS. Function of amino acid sites in the substrate entryway of alanine racemase TtAlr from Thermoanaerobacter tengcongensis. Acta Microbiologica Sinica, 2018, 58(8): 1397-1406. (in Chinese) 何广正, 韩卿卿, 徐书景, 赵宝华, 鞠建松. 腾冲嗜热厌氧菌丙氨酸消旋酶底物通道氨基酸位点的功能. 微生物学报, 2018, 58(8): 1397-1406. |
| [15] | Zhang WW, Wei Y, Zhang HJ, Jiao QC, Liu JZ. Double enzyme continuous catalytic biosynthesis of D-alanine. Fine Chemicals, 2017, 34(10): 1132-1138, 1160. (in Chinese) 张卫卫, 魏宇, 张宏娟, 焦庆才, 刘均忠. 双酶连续催化生物合成D-丙氨酸. 精细化工, 2017, 34(10): 1132-1138, 1160. |
| [16] | Guo QY, Cai QX, Han B, Yuan ZM. Domain swapping of Cry1Aa and Cry1Ca from Bacillus thuringiensis influence crystal formation and toxicity. Acta Microbiologica Sinica, 2006, 46(6): 906-911. (in Chinese) 郭青云, 蔡全信, 韩蓓, 袁志明. 苏云金芽孢杆菌Cry1Aa和Cry1Ca结构域交换对晶体形态和杀虫活性影响. 微生物学报, 2006, 46(6): 906-911. DOI:10.3321/j.issn:0001-6209.2006.06.010 |
| [17] | Gao JH, Niu X, Chang YN, Ren SC, Zheng YS, Huo LJ. Study on the expression pattern of domain-exchange mutants of Cry1Ia and Cry2Ab in Bt strain. Journal of Shanxi Agricultural Sciences, 2015, 43(6): 668-670. (in Chinese) 高建华, 牛鑫, 常亚男, 任善崇, 郑永松, 霍利杰. Bt菌株中Cry1Ia和Cry2Ab结构域交换突变体的表达形式. 山西农业科学, 2015, 43(6): 668-670. DOI:10.3969/j.issn.1002-2481.2015.06.09 |
| [18] | Ju JS, Xu SJ, Furukawa Y, Zhang Y, Misono H, Minamino T, Namba K, Zhao BH, Ohnishi K. Correlation between catalytic activity and monomer-dimer equilibrium of bacterial alanine racemases. The Journal of Biochemistry, 2011, 149(1): 83-89. DOI:10.1093/jb/mvq120 |
