孙红1, 柴丽娟2, 陆震鸣2,4, 张晓娟2,4, 吉晋波1, 史劲松3, 许正宏1,2,5


1. 江南大学生物工程学院, 工业生物技术教育部重点实验室, 江苏 无锡 214122;
2. 江南大学粮食发酵工艺与技术国家工程实验室, 江苏 无锡 214122;
3. 江南大学药学院, 江苏 无锡 214122;
4. 江苏省生物活性制品加工工程技术研究中心, 江苏 无锡 214122;
5. 国家固态酿造工程技术研究中心, 四川 泸州 646000
收稿日期:2020-08-18;修回日期:2020-11-09;网络出版日期:2021-02-03
基金项目:国家自然科学基金(31771967);国家轻工技术与工程一流学科自主课题(LITE2018-11)
*通信作者:许正宏, Tel/Fax: +86-510-85918206; E-mail: zhenghxu@jiangnan.edu.cn.
摘要:[目的] 研究镇江香醋酿造过程核心功能微生物醋酸杆菌属与乳酸杆菌属菌株之间的相互作用关系。[方法] 本文以分离到的镇江香醋酿造中的核心微生物2株醋酸杆菌和8株孔酸杆菌为研究对象,构建醋酸杆菌和乳酸杆菌共培养发酵体系,比较异位与原位条件下,纯培养及共培养中菌株的生长和代谢(包括还原糖、乙醇和总酸等含量)差异;采用GC-MS检测原位共培养中挥发性物质的变化,分析微生物间的交互作用对镇江香醋主要风味物质形成的潜在影响。[结果] 醋酸杆菌和乳酸杆菌之间的交互作用具有种间特异性和环境特异性,A.pasteurianus G3-2和L.helveticus M3-1、L.plantarum M10-1、L.pontis M17-5及L.reuteri GE7-1在异位及原位模拟共培养中整体的生长和代谢优于纯培养;A.pomorum G15-6和L.paracasei E1-1在异位和原位共培养下还原糖利用率和总酸的产生率都低于纯培养,和L.helveticus M3-1、L.reuteri GE7-1、L.plantarum M10-1、L.fermentum M10-3、L.casei E10-1、L.pontis M17-5、L.hilgardii M3-4共培养在异位和原位模拟中代谢不一致。根据GC-MS分析显示,A.pasteurianus G3-2和L.helveticus M3-1及L.reuteri GE7-1原位模拟共培养时异戊酸、乙酸乙酯、甲酸辛酯等风味物质的含量明显优于纯培养,其中一种重要风味物质2,3-丁二酮只在共培养时被检出,其含量分别达到了9.87 mg/L及14.28 mg/L。[结论] 镇江香醋醋醅中的醋酸杆菌和乳酸杆菌之间的交互作用能够影响菌株生长和主要代谢产物生成,这一研究有助于深入剖析镇江香醋风味形成的酿造机理,为理性调控酿造菌群以改善镇江香醋风味品质奠定了理论基础。
关键词:镇江香醋微生物相互作用乳酸杆菌(Lactobacillus)醋酸杆菌(Acetobacter)挥发性风味物质
Effect of co-culture of Acetobacter and Lactobacillus strains on growth and metabolism of the key functional microbes during Zhenjiang aromatic vinegar fermentation
Sun Hong1, Chai Lijuan2, Lu Zhenming2,4, Zhang Xiaojuan2,4, Ji Jinbo1, Shi Jinsong3, Xu Zhenghong1,2,5


1. Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
3. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
4. Jiangsu Engineering Research Center for Bioactive Products Processing Technology, Wuxi 214122, Jiangsu Province, China;
5. National Engineering Research Center of Solid-State Brewing, Luzhou 646000, Sichuan Province, China
Received: 18 August 2020; Revised: 9 November 2020; Published online: 3 February 2021
*Corresponding author: Zhenghong Xu, Tel/Fax: +86-510-85918206; E-mail: zhenghxu@jiangnan.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31771967) and by the National First Class Subject of Light Industry Technology and Engineering (LITE2018-11)
Abstract: [Objective] To better explain the metabolic mechanism of microbial community during Zhenjiang vinegar fermentation, we studied the interaction between Acetobacter and Lactobacillus, the key functional microorganisms during multispecies solid-state acetic acid fermentation. [Methods] Here, two strains of Acetobacter and eight strains of Lactobacillus isolated from vinegar fermentation culture, namely, Acetobacter pasteurianus G3-2, A. pomorum G15-6, Lactobacillus paracasei E1-1, L. helveticus M3-1, L. reuteri GE7-1, L. plantarum M10-1, L. fermentum M10-3, L. casei E10-1, L. pontis M17-5, L. hilgardii M3-4, were selected for microbial growth and metabolism analysis in monoculture and coculture fermentation. We compared the differences of interaction types between in vitro fermentation and in situ fermentation, then GC-MS was used to analyze the effects of interaction on the flavor of Zhenjiang vinegar. [Results] Synergistic effect between A. pasteurianus G3-2 and L. helveticus M3-1, L. plantarum M10-1, L. pontis M17-5 and L. reuteri GE7-1 in vitro fermentation and in situ fermentation was identified. Negative effect between A. pomorum G15-6 and L. paracasei E1-1, however, A. pomorum G15-6 showed different effects on L. plantarum M10-1, L. pontis M17-5 and L. reuteri GE7-1 in vitro fermentation and in situ fermentation. Coculture of A. pasteurianus G3-2 and L. helveticus M3-1, L. reuteri GE7-1 showed better performance in 2, 3-butanedione, valeric acid, ethyl acetate and octyl formate production than monoculture, and the yield of 2, 3-butanedione increased from none detected to 9.87 mg/L and 14.28 mg/L. [Conclusion] The interaction between Lactobacillus and Acetobacter in Cupei can affect the changes of main metabolites and volatile substances. This work provides a theoretical basis for in-depth analysis of the brewing mechanism of Zhenjiang vinegar, lays the foundation for rational regulation of the microbial community and improving the flavor and quality of Zhenjiang vinegar.
Keywords: Zhenjiang vinegarmicrobial interactionLactobacillusAcetobactervolatile flavor compounds
镇江香醋主要以大米、糯米和麦麸为原料,经糖化、酒精发酵和醋酸发酵三个阶段酿造而成[1]。它的特征风味物质主要包括乙酸、乳酸、苯乙醇、苯乙酸3-甲基丁醛、2, 3-丁二酮、3-羟基-2-丁酮、乙酸乙酯和四甲基吡嗪等[2]。其中,苯乙醇、乙酸乙酯、2, 3-丁二酮和3-羟基-2-丁酮等也是四川麸醋、山西老陈醋中的关键风味物质[3-4]。醋酸发酵阶段作为酿醋的关键环节,对镇江香醋风味物质的形成和产品质量具有重要影响,这一阶段的优势微生物主要分布在乳酸杆菌属(Lactobacillus)和醋酸杆菌属(Acetobacter)[5]。中国的传统谷物醋依照酿醋原料及生产工艺的不同被划分为多个品类,包括山西老陈醋、四川麸醋和天津独流老醋等,研究表明,乳酸杆菌属和醋酸杆菌属在这些传统谷物醋醋酸发酵过程中均为高丰度微生物[6-8]。醋酸杆菌属和乳酸杆菌属微生物不仅在数量上占据优势,也是参与乙酸、乳酸及多种风味物质形成的重要功能菌[9]。
前期的研究表明,镇江香醋酿造过程在多种醋酸杆菌和乳酸杆菌的共同参与下完成。通过宏基因组和克隆文库分析镇江香醋酿造菌群发现巴斯德醋杆菌Acetobacter pasteurianus和乳酸杆菌是参与乙偶姻代谢的主要功能微生物[10]。基于乳酸合成关键酶的扩增子测序分析发现罗伊氏乳杆菌Lactobacillus reuteri和瑞士乳杆菌L. helveticus分别是镇江香醋发酵过程中产D-和L-乳酸的关键功能菌[11]。醋酸杆菌物种种类相对单一,基于变性梯度凝胶电泳及克隆文库分析发现在镇江香醋醋醅中主要检测到的是巴斯德醋杆菌、波莫醋杆菌A. pomorum和中间葡糖醋杆菌Gluconacetobacter intermedius等[12]。前期的这些研究对镇江香醋发酵过程中参与重要风味物质形成的关键功能菌有了一定认识,但这些微生物之间的交互作用对镇江香醋风味品质的影响有待进一步研究。
本文围绕实验室前期从镇江香醋醋醅中筛选出的优势菌株2株醋酸杆菌和8株乳酸杆菌来研究醋醅主要微生物间的交互作用,探索了异位和原位模拟共培养状态下微生物的菌体形态、生长情况及主要代谢物的变化,分析了两两微生物的相互作用类型以及共培养对挥发性风味物质的影响,以期加深对酿醋功能微生物之间错综复杂交互作用机制的认识。
1 材料和方法 1.1 材料
1.1.1 菌株及培养基: 试验所用的2株醋酸杆菌(巴斯德醋杆菌A. pasteurianus G3-2和波莫醋杆菌A. pomorum G15-6)和8株乳酸杆菌(副干酪乳杆菌L. paracasei E1-1、瑞士乳杆菌L. helveticus M3-1、罗伊氏乳杆菌L. reuteri GE7-1、植物乳杆菌L. plantarum M10-1、发酵乳杆菌L. fermentum M10-3、干酪乳杆菌L. casei E10-1、桥乳杆菌L. pontis M17-5和希氏乳杆菌L. hilgardii M3-4)均分离筛选自镇江香醋醋醅。
(1) MRS培养基(g/L):蛋白胨10,牛肉膏10,酵母提取物5,葡萄糖20,柠檬酸二铵2,乙酸钠5,K2HPO4 2,MnSO4·H2O 0.19,MgSO4·7H2O 0.58,吐温80 1 mL,pH 6.2,121 ℃高压蒸汽灭菌20 min,配制固体MRS培养基时添加2%琼脂。
(2) 肉汤培养基(g/L):葡萄糖25,胰蛋白胨10,牛肉膏10,酵母提取物5,NaCl 3,pH 7.0,121 ℃高压蒸汽灭菌20 min,配制固体肉汤培养基时添加2%琼脂。
(3) 醋醅原位模拟培养基(wine-bran medium,WB培养基):在镇江香醋生产中,醋酸发酵阶段麸皮和酒醪用量的比例为1.9:4.5–5.2左右,因此,按1.9:5.2的比例称取原料,经混合、超声浸泡、过滤、灭菌后得到的浸出液为WB培养基。
1.1.2 主要试剂及仪器: (1) 主要试剂:MRS/肉汤培养基原料(国药集团化学试剂有限公司,分析纯)、酒醪及麸皮等WB培养基原料(江苏恒顺醋业股份有限公司)、2-辛醇、乙酸及乳酸(Sigma-Aldrich公司,色谱级)、其他化学试剂(国药集团化学试剂有限公司,分析纯)。
(2) 主要仪器:酸碱滴定仪(太仓市实验设备厂)、紫外分光光度计UV-2100 (上海尤尼克仪器有限公司)、日立S-4800场发射扫描电子显微镜(日本日立株式会社);Dionex Ultimate 3000高效液相色谱仪(戴安中国有限公司)、Trace MS气相色谱质谱仪(美国FINNIGANMAT公司)、Synergy H1 Hybrid Multi-Mode Reader (BioTek Instruments)。
1.2 异位与原位共培养实验 将乳酸杆菌和醋酸杆菌进行平板菌落计数,制备菌体密度为107 CFU/mL的种子液,按照1%的接种量接种到含有100 mL培养基的250 mL三角瓶中。
1.2.1 异位共培养: 培养方式为乳酸杆菌使用MRS培养基静置培养;醋酸杆菌使用肉汤培养基(添加3%乙醇)旋转式振荡培养,转速为220 r/min;乳酸杆菌和醋酸杆菌按照1:1 (接种的体积量都为1%)分别接种至MRS培养基(添加3%乙醇)静置共培养和肉汤培养基(添加3%乙醇)进行旋转式振荡共培养。培养温度为37 ℃,培养时间为72 h,定时取样测定菌株生长和代谢情况,设置3个平行实验。
1.2.2 模拟原位系统共培养: 乳酸杆菌和醋酸杆菌分别在WB培养基中进行模拟原位纯培养和共培养,共培养接种比例为1:1。为模拟镇江香醋翻醅工艺的供氧模式,共培养过程采用间歇振荡方式培养,间歇振荡的模式为220 r/min (8 h),再0 r/min (8 h),然后220 r/min (8 h),如此循环,尽可能在接近原位环境状态下考察乳酸杆菌和醋酸杆菌的交互作用关系,设置3个平行实验。
1.3 加性模型法对微生物相互作用类型的预测: 将指数生长末期的乳酸杆菌和醋酸杆菌纯培养液稀释至OD=0.04,按照1:1的接种比例进行两两组合共培养,在多功能微孔板检测仪(synergy H1 hybrid multi-mode reader)上共培养48 h后,用磷酸缓冲液(PBS)将生长至稳定期的培养物按照1︰30的比例稀释,再精确测量最终的OD值。按照加性模型计算相互作用分数[13]。
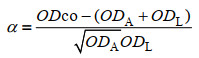 |
1.4 微生物生长的检测 取发酵过程菌液1 mL,离心(12000 r/min,5 min)后去上清液,1 mL PBS缓冲液重悬浮后用紫外分光光度计测量OD600的变化情况。
1.5 还原糖、乙醇及总酸的检测 运用DNS比色法,测量还原糖含量。利用重铬酸钾比色法测定乙醇含量。用滴定法测定总酸含量,以0.05 mol/L标准氢氧化钠溶液进行滴定,以pH 8.2为滴定终点。
1.6 有机酸的检测 使用色谱柱Waters Atlantis T3 (4.6 mm× 250 mm,5 μm)测定有机酸;流动相:20 mmol/L NaH2PO4,调pH 7.2;进样体积:10 μL;流速:0.7 mL/min;柱温:30 ℃;检测波长:UV210 nm[9]。
1.7 动力学参数的计算 比生长速率:使用Origin软件对OD600值进行Logistic非线性拟合得到拟合曲线,再经Origin软件进一步处理数据得出比生长速率曲线;底物的比消耗速率和产物的比合成速率与比生长速率的方法类似。
比生长速率μ,葡萄糖比消耗速率Qs以及总酸、乙酸及乳酸的比生成速率Qp参照公式(1–3)。
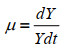 | 公式(1) |
 | 公式(2) |
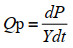 | 公式(3) |
1.8 醋醅原位模拟发酵中挥发性风味物质的检测 采用气相色谱-质谱(GC-MS)方法对挥发性产物进行检测[14]。样品处理:取8 mL发酵液,在固相微萃取样品瓶中加入2.5 g固体氯化钠,并加入5 μL 2-辛醇溶液(2.62 g/L)为内标。萃取条件:顶空固相微萃取。GC条件:进样口温度为250 ℃,色谱柱规格为TG-WAMS (60 m×250 μm×0.25 μm, Thermo,USA),以氦气为载气,不分流进样;升温程序为:40 ℃恒温2 min,以3 ℃/min速率升温至130 ℃,以6 ℃/min速率升温至200 ℃,再以8 ℃/min速率升温至230 ℃维持8 min。MS条件:EI电离源,离子源温度为260 ℃,界面温度为200 ℃,离子源能量为70 eV,电子源扫描范围为25–350 amu。将色谱峰质谱结果与NIST08谱库和Willey谱库中数据比对,与谱库中某种化合物匹配度达到800或以上时,认为该峰代表物质与库中化学物质相同,实现定性。根据内标2-辛醇的峰面积与浓度进行定量分析。
2 结果和分析 2.1 基于加性模型预测醋醅主要微生物交互作用类型 根据加性模型计算结果(表 1),A. pasteurianus G3-2和L. hilgardii M3-4、L. pontis M17-5、L. casei E10-1的相互作用分数α小于0,推测它们之间为拮抗作用;和L. paracasei E1-1、L. helveticus M3-1、L. reuteri GE7-1、L. plantarum M10-1、L. fermentum M10-3之间的相互作用分数α大于0,呈协同作用(表 1)。A. pomorum G15-6和L. helveticus M3-1之间α为正值,表现为协同作用;和L. fermentum M10-3、L. hilgardii M3-4之间α为0,推测它们之间相互影响较小;和L. paracasei E1-1、L. reuteri GE7-1、L. plantarum M10-1、L. casei E10-1、L. pontis M17-5之间α小于0,呈拮抗作用(表 1)。根据加性模型分析结果可初步断定醋酸杆菌和乳酸杆菌之间的相互作用类型具有种间特异性。
表 1. 加性模型预测交互作用类型 Table 1. Interaction types predicted by additive model
| Scores | M3-1 | E1-1 | M10-1 | M10-3 | M3-4 | M17-5 | E10-1 | GE7-1 |
| G3-2 | 0.16 | 0.07 | 0.33 | 0.28 | –0.23 | –0.05 | –0.16 | 0.33 |
| G15-6 | 0.27 | –0.33 | –0.26 | 0 | 0 | –0.19 | –0.07 | –0.50 |
表选项
2.2 醋醅主要微生物的交互作用关系 在镇江香醋醋酸发酵阶段,醋酸杆菌和乳酸杆菌是处于绝对主导地位的微生物,醋酸杆菌和乳酸杆菌之间的交互作用在推动群落演替和保证镇江香醋品质的稳定性方面具有重要作用。
2.2.1 异位状态下醋醅主要微生物之间的交互作用: 通过分析醋酸杆菌和乳酸杆菌两两组合在纯培养和共培养中最大比生长和比代谢速率的变化,发现大部分共培养体系的比生长速率和比代谢速率优于纯培养体系,但有些组合在振荡或静置共培养中表现不一致(表 2)。整体来看,醋酸菌1 A. pasteurianus G3-2与乳酸菌L. helveticus M3-1、L. plantarum M10-1、L. hilgardii M3-4、L. casei E10-1、L. reuteri GE7-1无论在静置共培养还是振荡共培养状态中最大比生长速率和比代谢速率优于纯培养;与乳酸菌L. paracasei E1-1在静置共培养时乙酸和乳酸的最大比生成速率都比纯培养低,振荡共培养时总酸和乙酸的比生成速率也有一定程度的下降;与乳酸菌L. fermentum M10-3、L. pontis M17-5共培养时整体的比代谢速率和纯培养相差不大,与乳酸菌L. fermentum M10-3在振荡和静置共培养中最大比生长速率都有降低,与乳酸菌L. pontis M17-5在静置共培养时最大比生长速率下降。醋酸菌2 A. pomorum G15-6与乳酸菌L. plantarum M10-1、L. fermentum M10-3、L. hilgardii M3-4、L. pontis M17-5、L. reuteri GE7-1在两种状态下共培养整体表现优于纯培养;与乳酸菌L. helveticus M3-1和L. paracasei E1-1在振荡共培养中总酸和乙酸的最大比生成速率和纯培养相比有所下降,静置共培养中乙酸的最大比生成速率也有下降,但总酸和纯培养相差不大。
表 2. 异位状态醋酸杆菌与乳酸杆菌共培养最大生长和代谢比速率的变化 Table 2. Changes of specific growth and metabolic rate of Acetobacter and Lactobacillusin vitro co-culture
| Co-culture groups | A. pasteurianus G3-2 | A. pomorum G15-6 | ||||||||||
| Δa | Δb | Δc | Δd | Δe | Δa | Δb | Δc | Δd | Δe | |||
| L. helveticus M3-1 | S | 0.02 | 0.12 | 5.6 | 0.65 | –0.38 | 0.25 | 0.23 | 0.07 | –0.23 | 0.95 | |
| A | 0.03 | –0.01 | 4.5 | 1.9 | 0.1 | 0.12 | 0.51 | –0.37 | –0.19 | 0.45 | ||
| L. paracasei E1-1 | S | 0.06 | 0.07 | 0.14 | –0.53 | –0.71 | 0.19 | 0.87 | 0.22 | –0.16 | –0.02 | |
| A | 0.51 | 0.04 | –1.21 | –0.76 | 0.20 | 0.07 | 0.70 | –0.30 | –0.34 | 0.84 | ||
| L. plantarum M10-1 | S | 0.11 | 0.78 | –0.09 | –0.10 | 0.54 | 0. 16 | 0.84 | 1.99 | –0.12 | 1.38 | |
| A | 0.09 | 0.83 | 1.72 | 0.36 | 0.49 | 0.21 | 0.03 | 2.61 | –0.04 | 0.90 | ||
| L. fermentum M10-3 | S | –0.01 | 0.05 | –0.89 | –0.57 | 0.08 | –0.04 | 0.92 | –0.14 | 0.57 | 0.19 | |
| A | –0.30 | 0.28 | 0.02 | 0.14 | –0.13 | –0.02 | 0.32 | 0.86 | 0.83 | 0.67 | ||
| L. hilgardii M3-4 | S | 0.26 | 0.75 | 2.18 | 1.24 | 0.67 | 0.27 | 0.25 | 1.19 | 0.27 | 0.35 | |
| A | 0.12 | 0.23 | 1.11 | 0.93 | –0.31 | 0.20 | 0.83 | 0.96 | 0.21 | 0.32 | ||
| L. pontis M17-5 | S | –0.46 | 0.15 | 0.29 | –0.52 | 0.22 | –0.04 | 0.94 | 0.75 | 0.29 | –0.18 | |
| A | 0.03 | 0.47 | 0.32 | 0.02 | –0.21 | 0.20 | 0.20 | 0.78 | 0.16 | 0.99 | ||
| L. casei E10-1 | S | –0.19 | 0.13 | 1.14 | 0.62 | 0.48 | –0.14 | –0.37 | 0.03 | 0.24 | 0.37 | |
| A | 0 | 0.34 | 1.16 | 0.43 | 0.77 | 0 | 0.57 | 0.07 | –0.01 | 0.44 | ||
| L. reuteri GE7-1 | S | –0.21 | 0 | –0.19 | 3.25 | 0.14 | 0.20 | 0.84 | 3.19 | 0.36 | 0.03 | |
| A | 0.03 | 0.12 | –0.30 | 2.24 | 0.02 | 0.10 | 0.45 | 2.10 | 0.30 | 0.27 | ||
| A: shaking co-culture; S: static culture; Δa–Δe represent the differences of (Δa) maximum specific growth rate, (Δb) maximum specific consumption rate of glucose, (Δc) maximum specific production rate of total acid, (Δd) maximum specific production rate of acetic acid and (Δe) maximum specific production rate of lactic acid through minus the results of co-culture by mono-culture. Positive numbers: enhancement; negative numbers: reducement; 0: no differences. | ||||||||||||
表选项
2.2.2 模拟原位状态下醋醅主要微生物之间的交互作用: 我们进一步参考镇江香醋生产中醋醅环境条件进行原位模拟培养,结果表明醋酸杆菌与乳酸杆菌在原位模拟培养状态下也表现出多样的相互作用关系(表 3)。其中,醋酸菌A. pasteurianus G3-2和乳酸菌L. helveticus M3-1、L. paracasei E1-1、L. plantarum M10-1、L. fermentum M10-3、L. reuteri GE7-1共培养能够提高还原糖和乙醇的消耗速率;与乳酸菌L. hilgardii M3-4、L. pontis M17-5共培养还原糖的最大消耗速率比纯培养要高,总酸的最大生成速率比纯培养低;与乳酸菌L. casei E10-1共培养代谢产物的速率和共培养相差不大。第二株醋酸菌A. pomorum G15-6与乳酸菌L. helveticus M3-1共培养时乙醇的最大消耗速率优于纯培养;与乳酸菌L. casei E10-1、L. reuteri GE7-1共培养时还原糖最大消耗速率及总酸的最大生成速率优于纯培养;与乳酸菌L. paracasei E1-1、L. plantarum M10-1、L. pontis M17-5共培养时整体的代谢速率比纯培养低;与乳酸菌L. fermentum M10-3、L. hilgardii M3-4共培养时底物的消耗速率及总酸的生成速率和纯培养相差不大。
表 3. 原位模拟状态醋酸杆菌与乳酸杆菌共培养最大生长和代谢速率的变化 Table 3. Changes of growth and metabolic rate of Acetobacter and Lactobacillus in situ co-cultured
| Co-culture groups | A. pasteurianus G3-2 | A. pomorum G15-6 | |||||
| Δa | Δb | Δc | Δa | Δb | Δc | ||
| L. helveticus M3-1 | 0.41 | 0.17 | 0 | –0.23 | 0.17 | –0.03 | |
| L. paracasei E1-1 | 0.01 | 0.19 | 0.02 | –0.14 | –0.29 | –0.02 | |
| L. plantarum M10-1 | 0.38 | 0.20 | 0.04 | –0.22 | 0 | –0.30 | |
| L. fermentum M10-3 | 0.24 | 0.01 | 0.15 | 0.03 | –0.05 | 0 | |
| L. hilgardii M3-4 | 0.31 | –0.27 | –0.19 | 0.09 | 0.08 | 0 | |
| L. pontis M17-5 | 0.32 | 0.01 | 0.07 | 0.06 | 0.02 | –0.32 | |
| L. casei E10-1 | 0.27 | 0 | 0.03 | 0.29 | 0 | 0.11 | |
| L. reuteri GE7-1 | 0.17 | 0.26 | 0.03 | 0.19 | 0.02 | 0.14 | |
| S/A: intermittent shaking co-culture; Δa-Δc represent the differences of (Δa) maximum consumption rate of glucose, (Δb) maximum consumption rate of ethanol, (Δc) maximum production rate of total acid through minus the results of co-culture by mono-culture. Positive numbers: enhancement; negative numbers: reducement; 0: no difference. | |||||||
表选项
2.3 A.pasteurianus G3-2及L. helveticus M3-1的交互作用
2.3.1 异位状态下A. pasteurianus G3-2及L. helveticus M3-1的交互作用: 我们进一步针对醋醅菌群中的高丰度微生物A. pasteurianus和L. helveticus进行了互作关系的研究[15]。两株菌的振荡共培养和静置共培养的最大比生长速率都略高于A. pasteurianus G3-2和L. helveticus M3-1纯培养体系(图 1-A,B)。A. pasteurianus G3-2纯培养和振荡共培养体系中残糖最大比消耗速率相差不大,但最终振荡共培养体系中残糖量比纯培养低。L. helveticus M3-1纯培养和静置共培养体系均在前24 h内快速消耗葡萄糖,比消耗速率达到最大,其中静置共培养体系中残糖的最大比消耗速率高于纯培养体系(图 1-C,D)。总酸的变化趋势基本呈现先快速上升再逐渐下降或者趋于稳定的趋势,静置和振荡共培养体系中最大比生成速率都优于纯培养体系(图 1-E,F)。共培养中乙酸的最大比生成速率都优于纯培养体系,其中振荡共培养体系醋酸产量提高了86.6%左右(图 1-G,H)。静置共培养体系相较于纯培养体系乳酸的最大比生成速率有一定降低,可能是L. helveticus M3-1产生的部分乳酸被A. pasteurianus G3-2利用(图 1-I,J)。结合以上代谢特征发现,A. pasteurianus G3-2及L. helveticus M3-1共培养能够加快它们对底物的利用,使得代谢产物的生成速率有不同程度的提高。
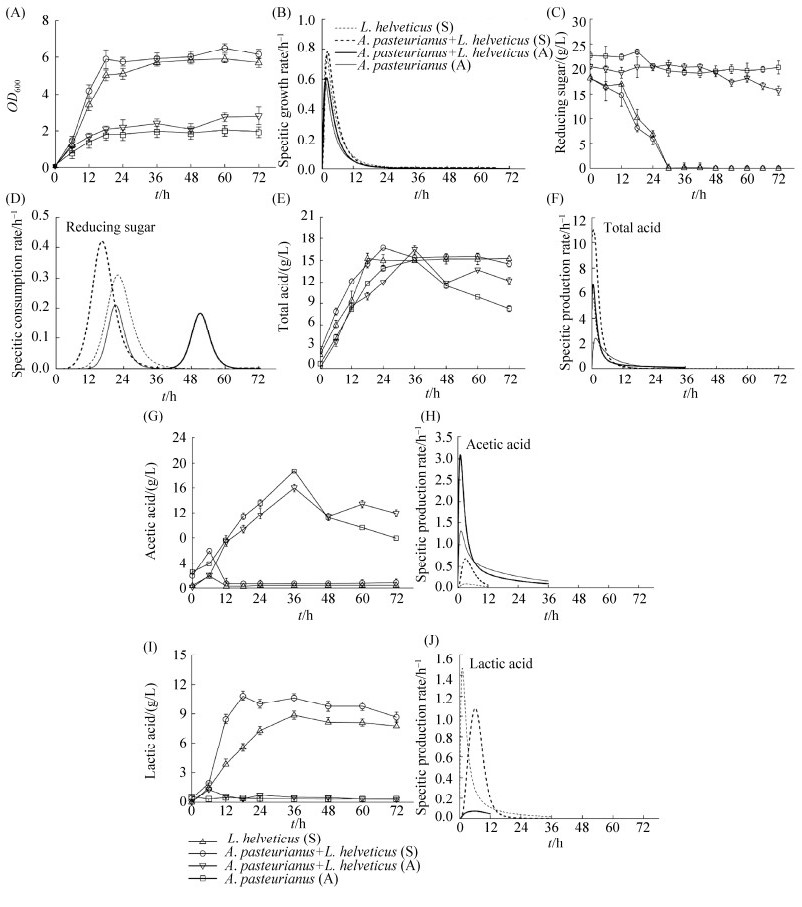 |
| 图 1 A. pasteurianus G3-2和L. helveticus M3-1异位共培养时生长和代谢的变化 Figure 1 The changes of growth and metabolism of A. pasteurianus G3-2 and L. helveticus M3-1 in vitro co-culture. A-J represent the quantity changes and specific rate of growth (A, B), glucose (C, D), total acid (E, F), acetic acid (G, H) and lactic acid (I, J). A: shaking co-culture; S: static culture. |
| 图选项 |
2.3.2 模拟原位状态下A. pasteurianus G3-2及L. helveticus M3-1的交互作用: 镇江香醋醋醅的主要原料有种醅、麸皮及酒醪等,复杂的营养基底可能会影响微生物之间的交互作用类型。乙醇是WB培养基中的重要碳源,在原位共培养中的乙醇的消耗速率低于纯培养(图 2-A),总酸的最大生成速率略优于纯培养体系。因此原位共培养中A. pasteurianus G3-2及L. helveticus M3-1能够利用多种营养物质,在一定程度上促进酸的积累(图 2-B)。
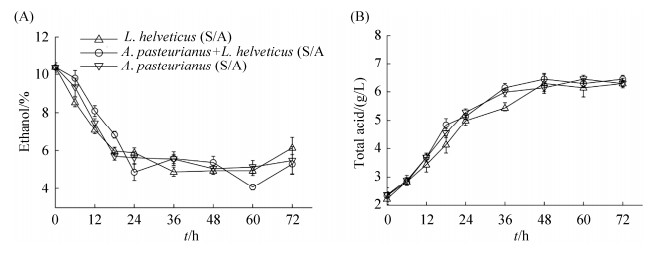 |
| 图 2 A. pasteurianus G3-2与L. helveticus M3-1在原位共培养中代谢指标的变化 Figure 2 The changes of metabolism of A. pasteurianus G3-2 and L. helveticus M3-1 in situ co-culture. A and B represent the content changes of ethanol (A) and total acid (B). A: shaking co-culture; S: static culture; S/A: intermittent shaking co-culture. |
| 图选项 |
2.4 模拟醋醅系统原位共培养中挥发性风味物质的变化 醋酸杆菌及乳酸杆菌在原位模拟培养时,部分共培养组合表现出令人愉悦的香味。因此,对A. pasteurianus G3-2、L. helveticus M3-1及L. reuteri GE7-1纯培养及共培养60 h的样品进行GC-MS分析,分析共培养对挥发性风味物质的影响(表 4)。A. pasteurianus G3-2与L. helveticus M3-1及L. reuteri GE7-1共培养中2, 3-丁二酮、异戊酸、乙酸乙酯和甲酸辛酯等风味物质的含量明显高于纯培养,且2, 3-丁二酮只在共培养时被检出。A. pasteurianus G3-2与L. helveticus M3-1及L. reuteri GE7-1共培养时2, 3-丁二酮的含量分别达到了9.87 mg/L及14.28 mg/L。
表 4. 原位培养体系中关键挥发性物质含量 Table 4. Contents of key volatile compounds of in situ culture system
| Content/(mg/L) | A | B | C | A+B | A+C | D |
| 3-Methyl-1-butanol | 724.82 | 726.68 | 879.48 | 725.02 | 792.01 | 793.42 |
| Phenylethyl alcohol | 792.46 | 767.51 | 995.01 | 790.19 | 887.91 | 860.88 |
| Total alcohols | 5314.23 | 5311.13 | 6518.77 | 5414.65 | 6181.32 | 5828.80 |
| 2-Furaldehyde | Nd | 30.52 | 32.54 | Nd | 22.76 | 53.19 |
| Benzaldehyde | 81.56 | 108.01 | 120.52 | 55.84 | 80.36 | 117.39 |
| Total aldehydes | 145.85 | 198.68 | 267.08 | 123.51 | 167.41 | 183.31 |
| Diacetyl | Nd | Nd | Nd | 9.87 | 14.28 | Nd |
| Total ketones | 5.76 | 5.59 | 5.39 | 15.10 | 19.97 | 3.63 |
| Isovaleric acid | 7.89 | 3.30 | 4.49 | 8.75 | 4.50 | 3.11 |
| Total acids | 149.68 | 100.92 | 39.67 | 255.06 | 155.37 | 86.54 |
| Ethyl acetate | 243.02 | 172.73 | 169.37 | 247.63 | 300.84 | 174.80 |
| Isoamyl acetate | 18.24 | 9.42 | 8.88 | 14.63 | 13.50 | Nd |
| Octyl formate | Nd | Nd | Nd | 1.80 | 2.13 | Nd |
| Ethyl phenylacetate | 31.75 | 33.85 | 37.63 | 28.87 | 33.06 | 44.48 |
| Ethyl 3-phenylpropionate | 13.04 | Nd | Nd | 11.79 | 6.56 | Nd |
| γ-Nonanolactone | Nd | 4.37 | Nd | Nd | Nd | Nd |
| Ethyl Stearate | Nd | Nd | Nd | Nd | 3.40 | Nd |
| Total esters | 1900.63 | 1546.26 | 1861.59 | 1826.58 | 1919.56 | 1221.44 |
| Total heterocycles | 74.31 | 32.09 | 39.05 | 77.16 | 33.18 | 45.10 |
| Nd: undetected; A: A. pasteurianus; B: L. helveticus; C: L. reuteri; D: control group. | ||||||
表选项
3 讨论 3.1 醋醅主要微生物在异位和原位状态下的生长和代谢 L. helveticus M3-1纯培养和静置共培养体系均在前24 h内快速消耗葡萄糖,比消耗速率达到最大,其中静置共培养体系中还原糖的最大比消耗速率优于纯培养体系(图 1-C,D),葡萄糖和乙醇是镇江香醋固态酿造过程中可利用的主要碳源[16],实验室此前的研究表明乳酸杆菌在包含乙醇和葡萄糖的培养基中优先利用葡萄糖,几乎不利用乙醇;醋酸杆菌更倾向以乙醇作为碳源,因此A. pasteurianus G3-2和L. helveticus M3-1在底物的利用方面不存在竞争关系。静置共培养前期乳酸含量迅速上升,18 h之后保持稳定,最大比消耗速率也低于L. helveticus M3-1纯培养体系(图 1-I, J),推测是总酸(主要是乙酸)含量逐渐上升,开始抑制乳酸杆菌的生长。由于分子量低和脂溶性强,乙酸能够很容易地穿透细菌细胞膜抑制乳酸杆菌的生长[17]。已有研究表明,在谷物醋的酿造中,随着总酸的增加,乳酸杆菌数量逐渐降低,醋酸杆菌在后期占据优势[5]。
采用原位模拟共培养来对A. pasteurianus G3-2和L. helveticus M3-1的交互作用进行进一步的研究。乙醇是WB培养基中的重要碳源,在原位共培养中的乙醇的消耗速率低于纯培养(图 2-A),总酸的最大生成速率略优于纯培养体系(图 2-B)。WB培养基中营养物质丰富,A. pasteurianus G3-2除了利用培养基中的乙醇,也会利用L. helveticus M3-1产生的乳酸和其他碳源,因此乙醇的消耗速率可能比纯培养低。原位培养基对于研究群落中的微生物交互作用具有重要作用,但其存在营养成分复杂、体系不稳定、制作工艺复杂等问题,因此,构建一种重复性好的原位模拟培养基来辅助解读群落交互作用具有重要意义。
3.2 醋醅主要微生物在不同培养状态下的相互作用类型 对比原位和异位下相互作用以及不同乳酸杆菌和醋酸杆菌的交互作用,可以发现醋酸杆菌和乳酸杆菌之间的交互作用具有种间特异性和环境特异性。A. pasteurianus G3-2和L. helveticus M3-1、L. plantarum M10-1、L. pontis M17-5及L. reuteri GE7-1在振荡、静置状态下相互作用一致,A. pomorum G15-6和L. paracasei E1-1之间的代谢特征在原位和异位下一致,和其他乳酸杆菌在3种共培养状态下都不一致。原位模拟状态下采用醋醅浸出液做培养基,营养成分的改变会影响相互作用类型。Megee等[18-19]研究发现核黄素营养缺陷L. casei和S. cerevisiae共培养体系中添加核黄素时,两者之间相互作用类型为竞争;不添加核黄素时,两者的相互作用关系为共生。相互作用类型随着营养条件的改变而改变。乳酸杆菌是兼性厌氧菌,醋酸杆菌是好氧菌,静置培养时供氧量低对乳酸杆菌的生长有利,振荡培养时供氧量高对醋酸杆菌的生长更有利,也会导致相互作用发生改变。
3.3 醋醅主要微生物共培养下风味物质的代谢差异 为了研究共培养对挥发性风味物质的代谢影响,我们选取原位模拟状态下A. pasteurianus G3-2与L. helveticus M3-1和L. reuteri GE7-1共培养和纯培养发酵液,分析挥发性风味物质的差异,重点关注了余永健等[2]基于多元统计学方法筛选的特征性风味物质,检测结果列于表 4中。从表中可以看出共培养中异戊酸、乙酸乙酯和甲酸辛酯等风味物质的含量明显优于纯培养,其中重要风味物质2, 3-丁二酮只在共培养中生成。A. pasteurianus G3-2与L. helveticus M3-1或L. reuteri GE7-1共培养时,2, 3-丁二酮的含量分别达到了9.87 mg/L及14.28 mg/L。2, 3-丁二酮经还原反应可以生成乙偶姻,它们是食醋中的重要香味贡献化合物,且是川芎嗪生成的重要底物[20-21]。有研究表明,丙酮酸是2, 3-丁二酮的重要前体物质,提高丙酮酸的胞内浓度可以有效促进双乙酰的生成[22]。在共培养体系中,乙酸、乳酸及柠檬酸等有机酸的积累量增多,可能会促进丙酮酸到2, 3-丁二酮这一代谢支路中编码乙酰乳酸合成酶、柠檬酸裂解酶及草酰乙酸脱羧酶等基因的表达,促进2, 3-丁二酮的积累,具体的代谢机理有待于进一步研究。Comasio等也发现外源添加柠檬酸可以促进L. casei纯培养体系中双乙酰、乙偶姻等风味物质的积累,这和我们的推测一致[23-24]。
References
| [1] | Lu ZM, Wang ZM, Zhang XJ, Mao J, Shi JS, Xu ZH. Microbial ecology of cereal vinegar fermentation: insights for driving the ecosystem function. Current Opinion in Biotechnology, 2018(49): 88-93. |
| [2] | Yu YJ, Lu ZM, Yu NH, Xu W, Li GQ, Shi JS, Xu ZH. HS-SPME/GC-MS and chemometrics for volatile composition of Chinese traditional aromatic vinegar in the Zhenjiang region. Journal of the Institute of Brewing, 2012, 118(1): 133-141. DOI:10.1002/jib.20 |
| [3] | Tang QX, He GQ, Huang J, Wu CD, Jin Y, Zhou RQ. Characterizing relationship of microbial diversity and metabolite in Sichuan Xiaoqu. Frontiers in Microbiology, 2019(10): 696. |
| [4] | Zhu YP, Zhang FF, Zhang CN, Yang L, Fan GS, Xu YQ, Sun BG, Li XT. Dynamic microbial succession of Shanxi aged vinegar and its correlation with flavor metabolites during different stages of acetic acid fermentation. Scientific Reports, 2018, 8(1): 8612. DOI:10.1038/s41598-018-26787-6 |
| [5] | Wang ZM, Lu ZM, Shi JS, Xu ZH. Exploring flavour-producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar. Scientific Reports, 2016(6): 26818. |
| [6] | Nie ZQ, Zheng Y, Xie SK, Zhang XL, Song J, Xia ML, Wang M. Unraveling the correlation between microbiota succession and metabolite changes in traditional Shanxi aged vinegar. Scientific Reports, 2017(7): 9240. |
| [7] | Ai M, Qiu X, Huang J, de Wu C, Jin Y, Zhou RQ. Characterizing the microbial diversity and major metabolites of Sichuan bran vinegar augmented by Monascus purpureus. International Journal of Food Microbiology, 2019(292): 83-90. |
| [8] | Nie ZQ, Zheng Y, Wang M, Han Y, Wang YN, Luo JM, Niu DD. Exploring microbial succession and diversity during solid-state fermentation of Tianjin duliu mature vinegar. Bioresource Technology, 2013(148): 325-333. |
| [9] | Wu LH, Lu ZM, Zhang XJ, Wang ZM, Yu YJ, Shi JS, Xu ZH. Metagenomics reveals flavour metabolic network of cereal vinegar microbiota. Food Microbiology, 2017(62): 23-31. |
| [10] | Lu ZM, Liu N, Wang LJ, Wu LH, Gong JS, Yu YJ, Li GQ, Shi JS, Xu ZH. Elucidating and regulating the acetoin production role of microbial functional groups in multispecies acetic acid fermentation. Applied and Environmental Microbiology, 2016, 82(19): 5860-5868. DOI:10.1128/AEM.01331-16 |
| [11] | Chai LJ, Shen MN, Sun J, Deng YJ, Lu ZM, Zhang XJ, Shi JS, Xu ZH. Deciphering the d-/l-lactate-producing microbiota and manipulating their accumulation during solid-state fermentation of cereal vinegar. Food Microbiology, 2020(92): 103559. |
| [12] | 许伟. 镇江香醋醋酸发酵过程微生物群落及其功能分析. 江南大学博士学位论文, 2011. |
| [13] | Andrés AD, Benjamin O, Ren D, Tani T, Zachary FH, Zehra TG, William BL, Kerwyn CH. Bacterial interspecies interactions modulate pH-mediated antibiotic tolerance. eLife, 2020(9): e51493. |
| [14] | Xu PX, Chai LJ, Qiu T, Zhang XJ, Lu ZM, Xiao C, Wang ST, Shen CH, Shi JS, Xu ZH. Clostridium fermenticellae sp. nov., isolated from the mud in a fermentation cellar for the production of the Chinese liquor, baijiu. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(3): 859-865. DOI:10.1099/ijsem.0.003254 |
| [15] | Shen MN, Lu ZM, Zhang XJ, Chai LJ, Yu YJ, Shi JS, Xu ZH. Species-level diversity of lactate-producing bacteria in acetic acid fermentation of Zhenjiang aromatic vinegar. Chinese Journal of Applied and Environmental Biology, 2019, 25(6): 1434-1440. (in Chinese) 沈咪娜, 陆震鸣, 张晓娟, 柴丽娟, 余永建, 史劲松, 许正宏. 镇江香醋醋酸发酵阶段产乳酸功能细菌的物种多样性. 应用与环境生物学报, 2019, 25(6): 1434-1440. |
| [16] | Wang ZM, Lu ZM, Yu YJ, Li GQ, Shi JS, Xu ZH. Batch-to-batch uniformity of bacterial community succession and flavor formation in the fermentation of Zhenjiang aromatic vinegar. Food Microbiology, 2015(50): 64-69. |
| [17] | Fernández A, álvarez-Ordó?ez A, López M, Bernardo A. Effects of organic acids on thermal inactivation of acid and cold stressed Enterococcus faecium. Food Microbiology, 2009, 26(5): 497-503. DOI:10.1016/j.fm.2009.03.002 |
| [18] | Megee RD, Drake JF, Fredrickson AG, Tsuchiya HM. Studies in intermicrobial symbiosis. Saccharomyces cerevisiae and Lactobacillus casei. Canadian Journal of Microbiology, 1972, 18(11): 1733-1742. DOI:10.1139/m72-269 |
| [19] | Little AEF, Robinson CJ, Peterson SB, Raffa KF, Handelsman J. Rules of engagement: interspecies interactions that regulate microbial communities. Annual Review of Microbiology, 2008(62): 375-401. |
| [20] | Xiao ZJ, Zhao L, Tian L, Wang LH, Zhao JY. GC-FID determination of tetramethylpyrazine and acetoin in vinegars and quantifying the dependence of tetramethylpyrazine on acetoin and ammonium. Food Chemistry, 2018(239): 726-732. |
| [21] | Xu W, Xu QP, Chen JH, Lu ZM, Xia R, Li GQ, Xu ZH, Ma YH. Ligustrazine formation in Zhenjiang aromatic vinegar: changes during fermentation and storing process. Journal of the Science of Food and Agriculture, 2011, 91(9): 1612-1617. DOI:10.1002/jsfa.4356 |
| [22] | Peyer LC, Zannini E, Arendt EK. Lactic acid bacteria as sensory biomodulators for fermented cereal-based beverages. Trends in Food Science & Technology, 2016(54): 17-25. |
| [23] | Comasio A, Harth H, Weckx S, De Vuyst L. The addition of citrate stimulates the production of acetoin and diacetyl by a citrate-positive Lactobacillus crustorum strain during wheat sourdough fermentation. International Journal of Food Microbiology, 2019(289): 88-105. |
| [24] | Cogan TM, O'Dowd M, Mellerick D. Effects of pH and sugar on acetoin production from citrate by Leuconostoc lactis. Applied and Environmental Microbiology, 1981, 41(1): 1-8. DOI:10.1128/aem.41.1.1-8.1981 |
