李毅1,2

 , 党研茹2, 任雪冰2, 察倩倩2, 秦启龙2, 夏呈强3, 冯焱1, 李宏1, 张锋1
, 党研茹2, 任雪冰2, 察倩倩2, 秦启龙2, 夏呈强3, 冯焱1, 李宏1, 张锋1 1. 山西农业大学生命科学学院, 山西 太谷 030801;
2. 山东大学微生物技术国家重点实验室, 山东 青岛 266237;
3. 山西农业大学动物科学学院, 山西 太谷 030801
收稿日期:2021-03-01;修回日期:2021-04-08;网络出版日期:2021-04-12
基金项目:山西省优秀博士来晋工作奖励项目(SXYBKY2019025);山西农业大学科技创新基金项目(2020BQ39);国家自然科学基金(31870101)
作者简介:李毅,博士,山西农业大学讲师,毕业于山东大学。主要从事水生微生物分子生态学研究。通过宏基因组学、全基因组学以及培养组学技术研究水生微生物多样性、基因组进化及其生态适应机制,重点研究环境中抗生素抗性细菌菌株的资源分类及抗性基因(ARGs)的赋存特征与迁移机制。曾以第一作者在Environmental Microbiology、Frontiers in Microbiology、International Journal of Systematic and Evolutionary Microbiology等期刊上发表SCI论文7篇.
*通信作者:李毅, Tel: +86-354-6286908;E-mail: liyi@sxau.edu.cn.
摘要:[目的] 马里亚纳海沟是地球表面最深的海沟,环境极端多样,如高压、低温及无光,拥有独特的微生物资源。本研究旨在探究马里亚纳海沟不同深度水生细菌形态特征并挖掘可培养细菌资源。[方法] 采集马里亚纳海沟7个层位海水(2-8727 m),利用原子力显微镜与扫描电镜观察水生微生物的形态特征;采用2种常规培养基(1/5×2216E和1/30×2216E)及6种选择性培养基(有机碳氮组合),结合切向流与高压富集培养进行水生细菌分离与鉴定。[结果] 从不同深度水样中发现多种大小不一的细菌类群(130 nm-1.5 μm),以球菌和杆菌为主。在表层水体中常见颗粒附着的细菌,在深层水体中常见自由游动的细菌。共鉴定365株可培养水生细菌,隶属于3个门、31个属与56个种。γ-变形菌纲(Gammaproteobacteria)是绝对优势类群(占据可培养细菌总数的62.7%),相对丰度在深层水体中高于浅层。交替单胞菌属(Alteromonas,21.8%)和亚硫酸杆菌属(Sulfitobacter,19.1%)是主要优势属,在浅层水体中占绝对优势。稀释的2216E与氨基酸培养基对海杆菌属的选择性更好,葡萄糖-甘露糖培养基与牛磺酸-乙醇酸培养基对稀有细菌的选择性更好。7株菌(5种)是潜在的新型细菌。此外,通过切向流富集培养与压力筛选培养分别分离得到70株(22属)可通过0.22-μm细菌(0.22-μm-passable bacteria)与33株(8属)耐压细菌。[结论] 马里亚纳海沟不同深度水样中不同营养利用型细菌、可通过0.22-μm细菌与耐压细菌及其形态均具有丰富的多样性。本研究所获得的不同类型的细菌菌株为研究细菌在马里亚纳海沟中生物地球化学功能及其营养类型差异和高压适应机制奠定了菌株基础。
关键词:马里亚纳海沟可培养水生细菌多样性水体
Diversity of culturable aquatic bacteria at different depths of the Mariana Trench
Yi Li1,2

 , Yanru Dang2, Xuebing Ren2, Qianqian Cha2, Qilong Qin2, Chengqiang Xia3, Yan Feng1, Hong Li1, Feng Zhang1
, Yanru Dang2, Xuebing Ren2, Qianqian Cha2, Qilong Qin2, Chengqiang Xia3, Yan Feng1, Hong Li1, Feng Zhang1 1. College of Life Sciences, Shanxi Agricultural University, Taigu 030801, Shanxi Province, China;
2. State Key Laboratory of Microbial Technology, Shandong University, Qingdao 266237, Shandong Province, China;
3. College of Animal Sciences, Shanxi Agricultural University, Taigu 030801, Shanxi Province, China
Received: 1 March 2021; Revised: 8 April 2021; Published online: 12 April 2021
*Corresponding author: Yi Li, Tel: +86-354-6286908;E-mail: liyi@sxau.edu.cn.
Foundation item: Supported by the Excellent Talents Come to Shanxi to Reward Scientific Research Projects (SXYBKY2019025), by the Scientific and Technological Innovation Programs of Shanxi Agricultural University (2020BQ39) and by the National Natural Science Foundation of China (31870101)
Abstract: [Objective] The Mariana Trench is the deepest site on earth with diverse extreme conditions (e.g., ultra-high hydrostatic pressure, low temperature and lack of light). It contains abundant microbial resources. The aim of this study is to explore aquatic microbial morphological characteristics and to mine culturable bacterial resources from different depths of the Mariana Trench. [Methods] Seawaters of seven depths (2-8727 m) from the Mariana Trench were collected. Aquatic microbial morphological characteristics were observed by atomic force microscopy and scanning electron microscopy. Combined with enrichment culture by using tangential flow system and high pressure device, two kinds of conventional media (1/5×2216E and 1/30×2216E) and six kinds of selective media (made up of combinations of organic carbon and nitrogen) were used for isolation and cultivation of aquatic bacteria. [Results] Various aquatic bacteria with different sizes (130 nm-1.5 μm) were found at different depths, dominated by spherical or rod-shaped bacteria. Particle-associated bacteria were common in surface seawaters and free-living bacteria were common in deep seawaters. Belonging to 3 phyla, 31 genera and 56 species, a total of 365 strains were identified. Gammaproteobacteria dominated (accounting for 62.7% of the total isolates) and its relative abundance in deep waters was higher than that in shallow waters. Alteromonas (21.8%) and Sulfitobacter (19.1%) were the most abundant genera, dominated in shallow water samples. The diluted 2216E and amino acid medium were found to have a better selectivity to Sulfitobacter. The selectivity of glucose-mannose medium (GM) or taurine-glycolic acid medium (TG) to rare bacteria was better. Seven strains (five species) were potential novel bacteria. In addition, 70 0.22-μm-passable strains (22 genera) and 33 piezotolerant strains (8 genera) were isolated, respectively. [Conclusion] There were rich diversities of different trophic, 0.22-μm-passable and piezotolerant bacteria and their morphologies at different water depths of the Mariana Trench. This study provided unique resources of aquatic microorganisms to investigate their trophic types, high-pressure adaptation mechanisms and biogeochemical roles in the Mariana Trench.
Keywords: the Mariana Trenchculturable aquatic bacteriadiversitywater column
海洋是地球上最古老的生境,平均深度为3688 m,占据了地球总表面积的71%和生物圈总体积的90%[1]。海洋中微生物种类繁多,数量巨大[2],占据地球全部初级生产力的一半左右[3]。海洋水体在垂直剖面上被分为5个区域:真光层区(0–200 m)、中层区(200–1000 m)、深层区(1000–4000 m)、深渊区(4000–6000 m)和超深渊区(> 6000 m)[4]。由于理化特性(如阳光,压力,温度,溶解氧和养分)的差异,不同深度区域孕育了独特的微生物群落[5],这些微生物呈现高度系统发育多样性[6]。深海探测技术的发展进一步加快了深海资源勘探的步伐[7]。深度超过6000 m的深渊海沟,因地形上的相对隔离与较高的静水压力[5],成为研究深渊生态系统的最佳区域。
马里亚纳海沟位于太平洋西部马里亚纳群岛附近,这里的挑战者深渊是地球上最深的地方(约11000 m)。研究报道,马里亚纳海沟真核微生物群落组成随水深发生明显变化[8]。Takuro等发现挑战者深渊中的细菌与古菌群落结构从海面到海沟底部(0–10257 m)也显著不同,且在底层水体(> 10000 m)中存在丰富的异养微生物[9]。根据海沟的地形以及与俯冲相关的物理化学特征,这些异养微生物的高丰度可能是由于对局部的有机碳高代谢活性所致,而不是对上层海水光合作用产生POM的利用[4, 10]。例如,深渊冰居菌(Glaciecola)、海栖菌(Oceanicola)和油杆菌(Oleibacter)可以降解大型有机聚合物[11]。此外,一些独特的深渊氨氧化菌与亚硝酸氧化菌也可以从无机材料中获取能量[9]。Liu等也发现大量的深渊海洋螺菌目(Oceanospirillales)类群可以通过转录烷烃降解基因进行碳氢化合物的降解[5]。因此,深渊区存在极高的微生物碳循环率[12]。马里亚纳海沟独特的生态环境使其成为挖掘有用微生物和基因资源的新的宝库[13]。然而,这些研究大都依赖于16S rRNA基因高通量以及宏基因组测序等未培养技术,无法准确反映该地区微生物的代谢潜能与生态功能。
借助于可培养方法能够在菌株水平上对微生物进行功能特性研究,并将其作为物种库与功能基因库进行资源开发和应用。由于采样技术限制,早期从马里亚纳海沟中分离培养出的微生物较少。1968年,Quigley等从马里亚纳海沟10373 m沉积物中分离培养出假单胞菌(Pseudomonas)与气单胞菌(Aeromonas)[14]。之后,研究者们从海沟沉积物中分离培养出多个嗜压细菌[15],这些菌种的基因组与浅层海水中的近亲极为不同[16]。此外,多位****发现马里亚纳海沟沉积物中可培养微生物具有丰富的多样性,并不因环境恶劣(如超高静水压力、低温、含氧量低和黑暗)而种类单一[10, 13, 17]。然而,迄今关于马里亚纳海沟可培养微生物的研究大多集中在沉积物环境中,尽管一些研究也从海沟不同水层中发现了一些新的微生物物种[18-19],但对海沟水体中可培养水生微生物的认识仍十分有限[13],尚缺乏在不同实验条件下(如多种培养基、多种培养方式等)对海沟水生微生物的形态观察与规模化分离培养。
本研究从马里亚纳海沟海面到近底层采集7个层位海水,采用8种改良培养基,利用切向流系统与高压培养装置对不同微生物类群进行了规模化分离培养,结合显微技术探究了马里亚纳海沟不同深度水生微生物形态特征和多样性分布规律,深入认识及挖掘了该特殊海洋环境中的微生物资源。本研究为深渊微生物资源挖掘及其生命特征解析奠定了菌株基础。
1 材料和方法 1.1 样品采集与处理 本研究于2015年12月在马里亚纳海沟利用船载CTD (SBE19-CTD)采集7个层位海水样品,采样具体信息如表 1所示。一部分原位水样在4 ℃保存,用于细菌的传统培养与高压培养;另一部分水样用0.22 μm滤膜过滤,截留常规大小的微生物类群后,使用30 kDa孔径切向流系统[20]对过滤海水浓缩100–400倍,用于可以通过0.22 μm孔径过滤器的细菌[21] (即可通过0.22-μm细菌,0.22-μm-passable bacteria)的富集培养。此外,分别取50 mL原位水样与切向流浓缩样品,加入终浓度为2.5%的戊二醛溶液,固定30 min后,保存于–80 ℃冰箱中,用于后续的细菌形态观察。
表 1. 马里亚纳海沟采集站位信息 Table 1. Information of sampling station from the Mariana Trench
| Layer | Station | Depth/m | Longitude/E | Latitude/N | Cultured pressure/MPa |
| Shallow layer | MT0K | 2 | 142°28.183′ | 10°47.477′ | - |
| MT1K | 991 | 142°28.900′ | 11°09.648′ | 18.4 | |
| MT2K | 1759 | 142°28.183′ | 10°47.477′ | 24.3 | |
| Deep layer | MT4K | 3699 | 142°28.000′ | 11°38.000′ | 32.8 |
| MT5K | 5367 | 142°28.000′ | 11°31.000′ | 37.6 | |
| MT7K | 7262 | 142°28.678′ | 11°22.516′ | 43.1 | |
| MT9K | 8727 | 142°28.678′ | 11°22.516′ | 49.7 |
表选项
1.2 原位细菌表型观察 分别取1 mL戊二醛固定的原位水样与切向流浓缩样品,一部分样品用超纯水洗3–5次,每次8000 r/min离心2 min,用于原子力显微镜(atomic force microscope,AFM)观察;另一部分样品参照Hu等[22]的方法进行制备,用于扫描电镜(scanning electron microscope,SEM)观察。
1.3 培养基 本研究采用8种不同的培养基对马里亚纳海沟不同深度水生细菌进行分离培养。2种常规培养基(BM):稀释5倍2216E(BM5)和稀释30倍2216E (BM30)培养基。2种有机碳源培养基:在葡萄糖-甘露糖培养基(Glucose-Mannose,GM)基础上分别添加微量酵母粉(OXOID)与维生素混合物(作为生长因子)。4种有机碳氮源培养基:分别以20种常见氨基酸(索莱宝,中国)与牛磺酸(生工,中国)作为碳氮源,以葡萄糖(国药,中国)、甘露糖(国药,中国)及乙醇酸(生工,中国)作为碳源进行组合,分为两大类——氨基酸类培养基(amino acids medium,AAM)与牛磺酸-乙醇酸培养基(Taurine-Glycolic acid medium,TG)。上述培养基的详细配方见表 2。
表 2. 培养基的成分与制备 Table 2. Ingredients and preparation procedures for culture media
| Medium types | Medium subtypes | Medium name | Medium ingredients |
| Basic media | BM | BM5 | 1/5×2216E[23] |
| BM30 | 1/30×2216E | ||
| Organic carbon media | GM | GMY | 0.2% Glucose+0.2% Mannose+0.2% NH4NO3+0.234% K2HPO4+0.002% FeCl3+ 0.005% Yeast extract |
| GMV | 0.2% Glucose+0.2% Mannose+0.2% NH4NO3+0.234% K2HPO4+0.002% FeCl3+Vitamin mix[24] | ||
| Organic carbon and nitrogen media | AAM | GMAA | 0.2% Glucose+0.2% Mannose+0.2% Amino acid mix[24]+0.234% K2HPO4+0.002% FeCl3+0.005% Yeast extract |
| AA | 0.4% Amino acid mix+0.234% K2HPO4+0.002% FeCl3+0.005% Yeast extract | ||
| TG | TGY | 0.2% Taurine+0.2% Glycolic acid+0.2% NH4NO3+0.234% K2HPO4+0.002% FeCl3+0.005% Yeast extract | |
| TGV | 0.2% Taurine+0.2% Glycolic acid+0.2% NH4NO3+0.234% K2HPO4+0.002% FeCl3+Vitamin mix | ||
| *1/5×2216E and 1/30×2216E are diluted 10 times and 50 times in 2216E medium, respectively. All tested media were added 3% sea salt (Sigma), adjusted pH 7.5–8.0 and then sterilized at 115 ℃ for 30 min. | |||
表选项
1.4 水生细菌的培养与分离纯化
1.4.1 常规培养: 分别取5个层位(MT0K、MT1K、MT2K、MT4K与MT9K)的原位海水样品,利用无菌海水(蒸馏水中添加3%海盐)对其依次稀释至10–1、10–2和10–3倍,取100 μL不同稀释梯度的样品稀释液,用一次性无菌涂布棒分别涂布至上述8种固体培养基上,每种培养基每个稀释梯度设置3个平行,置于10 ℃培养箱进行培养。
1.4.2 切向流富集培养: 分别取50 μL 4个层位(MT0K、MT1K、MT2K与MT4K)的切向流浓缩样品,按1%的接种量加入到BM5和BM30液体培养基中进行复苏与富集培养,每组设置3个平行,将试管置于振荡式微生物培养箱中,10 ℃、180 r/min培养30 d。将每个层位的富集液均匀混合后进行上述梯度稀释,分别涂布至2216E固体培养基上,置于10 ℃培养箱进行可通过0.22-μm细菌培养。
1.4.3 高压筛选培养: 分别取30 μL 7个深层(MT0K、MT1K、MT2K、MT4K、MT5K、MT7K与MT9K)的原位海水与过0.22 μm海水样品,加入到BM5液体培养基中,利用涡旋振荡仪振荡5 min。充分混匀后,用一次性无菌注射器(5 mL)吸入2 mL培养液和2 mL无菌空气,然后用无菌帽封堵注射器。将注射器放入高压培养釜中,利用微生物高压培养装置(飞宇石油化工,中国)将培养釜加压至不同压力(表 1),每组设置3个平行,10 ℃水浴静置培养30 d。缓慢释放培养釜中压力,将获得的不同层位注射器中的培养液分别进行上述梯度稀释,涂布至2216E固体培养基上,置于10 ℃培养箱进行培养。在不同的培养方式下,细菌培养1–4周。根据菌落的形态与颜色特征,挑取不同的单菌落,于2216E固体培养基上用连续划线法进行分离纯化,并将获得的纯菌株制备甘油管,置于–80 ℃冰箱长期保存。
1.5 细菌16S rRNA基因鉴定与系统发育树的构建 使用商业细菌基因组DNA提取试剂盒(百泰克,中国)提取菌株基因组。利用NanoDrop微量分光光度计(Thermo Fisher Scientific,美国)测定DNA浓度及纯度。以提取的细菌DNA为模板,利用通用引物27F (5′-AGAGTTTGATCCTGGC TCAG-3′)和1492R (5′-TACGGTTACCTTGTTAC GACTT-3′),扩增细菌16S rRNA基因。PCR扩增体系和反应条件参照Du等的方法[25]。PCR产物经1%琼脂糖凝胶电泳检测合格后,送至济南博尚生物技术有限公司进行纯化和测序。获得的16S rRNA基因序列通过EzBioCloud数据库(http://www.ezbiocloud.net/)与模式菌株进行相似性比对,确定其分类地位。利用MEGA 7软件与邻近法(Neighbor-joining algorithm)构建细菌16S rRNA基因系统发育树,并用网站EvolView (http://www.evolgenius.info/evolview/)进一步完善美化进化树。所有菌株的16S rRNA基因序列上传至GenBank数据库,登录号为MW674938– MW675302。
2 结果和分析 2.1 马里亚纳海沟水生微生物形态特征 AFM与SEM观察结果显示,不同层位切向流浓缩海水中存在多种细菌,并以球菌与杆菌为主(图 1-A–G)。其中,表层海水中细菌数目多于其他层位,并且发现的球菌大小为200–500 nm,可被颗粒物包裹(图 1-A),也可在水体中自由游动(图 1-C),或者相互粘连形成生物多聚体(图 1-D);有些短杆菌也具有颗粒附着的生活方式(图 1-B)。在MT1K、MT2K与MT4K样品中也发现多种大小不一细菌类群(0.13–1.50 μm),以自由游动的生活方式为主(图 1-E–G)。相比于切向流样品,原位水样中细菌多以杆菌为主,且多与大型颗粒物附着或分布于颗粒物附近(图 1-H–K)。原位水样中多数杆菌的体积大于切向流浓缩海水细菌,但我们也发现了罕见的小型杆菌(< 500 nm) (图 1-J)。以上研究结果表明马里亚纳海沟水体中微生物形态具有丰富的多样性。
 |
| 图 1 马里亚纳海沟水生微生物的AFM和SEM观察 Figure 1 AFM (A–C) and SEM (D–K) images of aquatic bacterial cells from the Mariana Trench. A: Particle-associated spherical bacteria; B: particle-associated rod-shaped bacteria; C, G: free-living spherical bacteria; D: cell-associated spherical bacteria; E–F, H–K: free-living rod-shaped bacteria. A–G: 0.2-μm-passable bacteria. |
| 图选项 |
2.2 马里亚纳海沟可培养水生细菌多样性 自马里亚纳海沟7个水层样品共分离获得365株细菌,隶属于3个门、6个纲、12个目、20个科、31个属与56个种。其中,变形菌门(Proteobacteria)细菌占绝对优势,共有341株分离菌株(占总分离菌株数的93.4%)隶属该门中的α-变形菌纲(Alphaproteobacteria)和γ-变形菌纲(Gammaproteobacteria) (图 2)。其他分离菌株隶属于拟杆菌门(Bacteroidetes,21株)和厚壁菌门(Firmicutes,3株),分别占总分离菌株的5.8%和0.8% (图 2-A)。在纲水平,γ-变形菌纲包含11个属共229株,菌株数目最多(占总菌株数62.7%) (图 2-B)。其次是α-变形菌纲(13属112株)与黄杆菌纲(Flavobacteriia,4属18株),占比分别为30.7%与4.9%。其他3个纲都只包含1个属,相对丰度均小于1%。其中,芽孢杆菌纲(Bacilli)细菌有3株,Balneolia细菌2株,噬纤维菌纲(Cytophagia)细菌1株。在属水平,交替单胞菌(Alteromonas)菌株数目最多(81株,分属于4个交替单胞菌属物种),占总分离菌株数的21.8% (图 3)。亚硫酸杆菌属(Sulfitobacter)为第二大优势属(71株),该属菌株占细菌分离总数的19.1%。海杆菌属(Marinobacter)、盐单胞菌属(Halomonas)与假交替假单胞菌属(Pseudoalteromonas)菌株出现的频率及多样性也比较高,分别为62株(隶属于5个物种)、41株(10个物种)和28株(3个物种)。此外,小红卵菌属(Rhodovulum)、芽单胞菌属(Blastomonas)和王祖农菌属(Zunongwangia)等8个属分别仅含有1株菌。
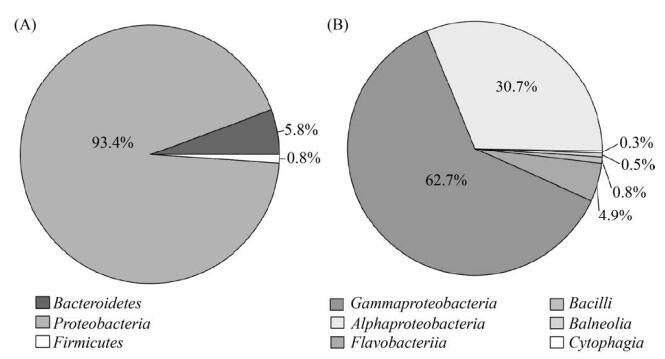 |
| 图 2 马里亚纳海沟可培养水生细菌的分布 Figure 2 Distribution in different phyla (A) and classes (B) of cultivable aquatic bacteria from seawater samples of the Mariana Trench. |
| 图选项 |
 |
| 图 3 马里亚纳海沟水体中隶属于不同细菌属的可培养细菌相对丰度 Figure 3 Relative abundance of cultivable bacteria belonging to different genera isolated from seawaters of the Mariana Trench. |
| 图选项 |
2.3 不同培养基可培养水生细菌多样性 本研究采用2种常规培养基及6种有机碳氮培养基对马里亚纳海沟水体样品中的细菌进行分离培养,共获得262株水生细菌,隶属于3个纲17个属。GMAA培养基中获得的菌株最多,为53株(9属),其次是BM5、GMV和AA培养基,分别获得47株(7属)、37株(9属)和36株(9属) (图 4)。在纲水平,除α-变形菌纲在GMV培养基中数目最多外,γ-变形菌纲在其余7种培养基上都占绝对优势,且在AA培养基上占比最高,达75%。BM5与GMY培养基缺少黄杆菌纲细菌(图 4-A)。在属水平,交替单胞菌属的菌株数目最多(69株),且在8种培养基中都分离得到(图 4-B)。亚硫酸杆菌属与海杆菌属菌株也均在8种培养基中分离得到。而科贝特氏属(Cobetia)、列文虎克菌属(Leeuwenhoekiella)及玫瑰变色菌属(Roseovarius)细菌菌株分别仅在TGY、BM30和TGY培养基中分离得到。在4种亚类培养基中(表 2),分别有8、10、11与12个属的细菌类群在BM、GM、AAM与TG培养基中被培养(图 4-C)。此外,在BM5、GMV及GMAA培养基中均可分离到5个水层样品中的细菌,而表层海水样品中的细菌主要在BM30培养基中分离得到(40.5%) (图 4-D)。
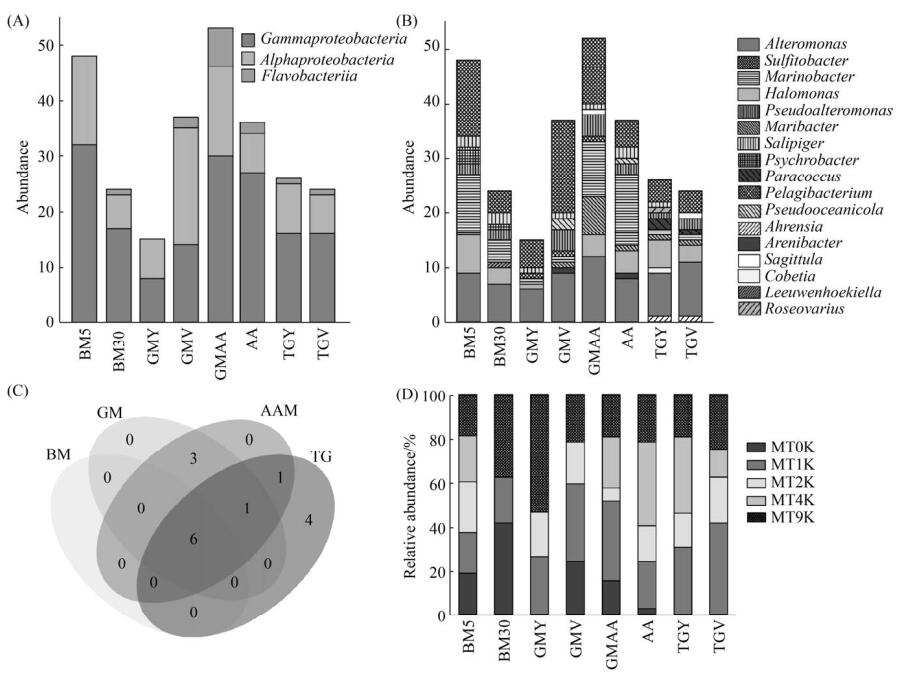 |
| 图 4 8种不同培养基分离培养的水生细菌多样性 Figure 4 Diversity of aquatic bacteria isolated and cultured in 8 different media. A: at class level; B: at genus level; C: venn diagram of differential genera; D: at different water layers. |
| 图选项 |
2.4 不同深度水体中可培养细菌多样性 从海沟表层到深层,分别分离培养出6属37株、9属70株、8属44株、6属48株及5属63株水生细菌(图 5-A)。γ-变形菌纲细菌在深层水体中的相对丰度(MT4K与MT9K;29.4%)显著高于浅层水体(MT0K、MT1K及MT2K;13.8%) (图 5-B)。与之相反,α-变形菌纲细菌主要分布在浅层水体,占比为80.9%。所有黄杆菌纲细菌只在MT0K与MT1K样品中被分离到。在属水平,分别有1、5、3与2个属的细菌类群仅在MT0K、MT1K、MT2K及MT9K样品中分离,而2个属在5个层位水体中都有发现(图 5-C)。交替单胞菌属细菌在海沟所有水层样品中都有发现,但60.9%分布在表层海水中(图 5-D);亚硫酸杆菌属细菌主要分布在浅层水体中(95.4%)。其他属如海杆菌属细菌在表层水体和深层水体(MT4K)的相对丰度都较高;而88.9%的盐单胞菌属细菌菌株在深层水体中分离得到,70.6%的假交替单胞菌细菌菌株在MT2K样品中被分离。此外,所有栖海杆菌属(Maribacter,11株)细菌菌株仅在MT1K样品中被分离,而10株箭头菌属(Sagittula)细菌菌株与3株远洋杆菌属(Pelagibacterium)细菌菌株仅在MT9K中分离得到。因此,在海沟不同深度水体中,可培养细菌的丰度与多样性存在明显差异。
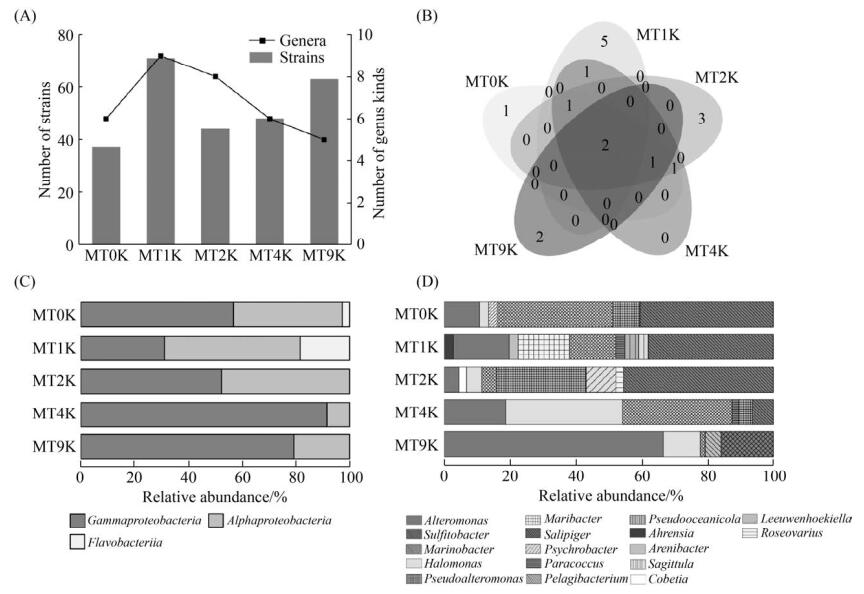 |
| 图 5 马里亚纳海沟不同深度分离的水生细菌多样性 Figure 5 Diversity of aquatic bacteria isolated from different depths of the Mariana Trench. A: numbers and kinds of isolates; B: venn diagram of differential genera; C: at class level; D: at genus level. |
| 图选项 |
2.5 可培养过0.22-μm细菌多样性 本研究采用切向流系统对过0.22 μm滤膜的马里亚纳海沟水样进行浓缩,利用浓缩液分离培养过0.22-μm细菌(0.22 μm-passable bacteria)。共获得70株细菌,隶属于5个纲22个属。其中,分别有29、11、9和21株细菌在MT0K、MT1K、MT2K及MT4K样品中分离。在门水平,变形菌门和拟杆菌门细菌分别占分离菌株的90.0%和10.0%。在属水平,海旋菌属(Thalassospira)、盐单胞菌属与海杆菌属细菌相对丰度最高,其次是交替单胞菌属与假交替单胞菌属细菌(图 6-A)。这些优势菌群广泛分布于各个层位水体中(图 6-B)。然而,一些低丰度菌群对不同深度水层有一定选择性。例如,丽希亚女神菌属(Nisaea)、Balneola、Marinoscillum等7个属细菌类群仅在表层海水中分离得到,而小红卵菌属与油杆菌属细菌仅在MT4K样品中分离得到。另外,本次富集培养实验共分离得到7株新型细菌菌株,它们与已知细菌种模式菌株的16S rRNA基因最高序列相似性均低于98.65%[26],可能代表潜在的新分类单元,分属于5个物种,疑似新种率为10.0% (表 3)。
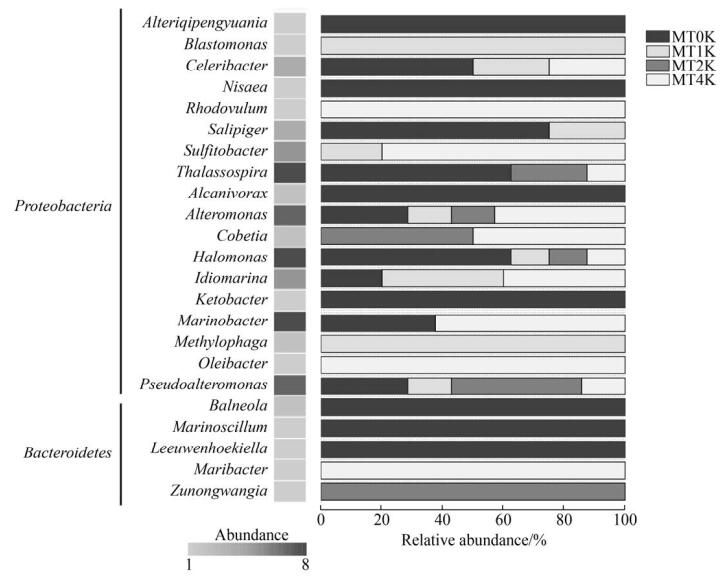 |
| 图 6 马里亚纳海沟过0.22-μm细菌多样性 Figure 6 Diversity of 0.22-μm-passable bacteria at different depths of the Mariana Trench. |
| 图选项 |
表 3. 马里亚纳海沟潜在新型水生菌株 Table 3. Potential novel taxa of aquatic bacteria in the Mariana Trench
| Strains | Closest species | Similarity/% | Accession number |
| MT0-11 | Balneola alkaliphila CM41_14bT | 98.58 | EU008564 |
| MT0-50 | Ketobacter alkanivorans GI5T | 98.43 | KY303768 |
| MT2-44 | Alteromonas mediterranea DET | 98.34 | CP001103 |
| MT4-12 | Oleibacter marinus DSM 24913T | 97.59 | jgi.1096629 |
| MT4-27 | Rhodovulum iodosum N1T | 96.30 | Y15011 |
表选项
2.6 可培养耐压细菌多样性 通过对马里亚纳海沟表层以下水体的压力模拟实验,共获得33株耐压细菌(8属) (图 7)。其中,海杆菌属细菌是第一大优势类群,相对丰度为36.4%,分布在不同压力层中(图 7-A、B)。其次是盐单胞菌属与交替单胞菌属细菌,主要在MT4K样品中分离得到。假交替单胞菌属菌株在MT2K、MT3K及MT9K样品中均有发现;而所有芽孢杆菌(Bacillus)菌株仅在MT9K样品中发现,栖海杆菌、海旋菌及亚硫酸杆菌细菌菌株仅在MT1K样品中分离得到。进一步发现,MT2K与MT3K样品中分离耐压菌株数目最多,种类也较多,而MT5K样品中获得的耐压菌株数目和多样性都最少(图 7-B)。此外,通过原位与过0.22 μm培养液比较,66.7%的耐压菌株是在原位培养液中分离,隶属于7个属,而过滤培养液中只发现3个属。有趣的是,海杆菌属与交替单胞菌属细菌在两类样品中都有发现,盐单胞菌属、芽孢杆菌属、栖海杆菌属、海旋菌属及亚硫酸杆菌属细菌仅在原位培养液中分离,所有假交替单胞菌属细菌仅在过滤培养液中分离得到(图 7-C)。
 |
| 图 7 马里亚纳海沟耐压细菌多样性 Figure 7 Diversity of piezotolerant bacteria at different depths of the Mariana Trench. A: phylogenetic tree; B: abundance at genus level; C: the frequency of different genera in original or filtered seawaters. |
| 图选项 |
3 讨论 为了解马里亚纳海沟不同深度水生细菌在菌株水平的代谢潜能与生理生化特征,本研究利用3种培养方式,在8种培养基上对可培养细菌进行了规模化分离纯化与鉴定。获得的365株细菌隶属于变形菌门、拟杆菌门和厚壁菌门,这与之前利用测序技术[9]或培养技术[13, 17]从马里亚纳海沟水体中获得的结果相似。Zhao等[17]通过纯培养方法发现马里亚纳海沟水体中α-变形菌纲、γ-变形菌纲与黄杆菌纲细菌为优势菌群,与本研究结果一致(图 2-B),但其丰度最高的是α-变形菌纲细菌[17],与本研究γ-变形菌纲细菌占主导地位(62.7%)的结果不同,这可能与所选择的培养基不同有关。事实上,γ-变形菌类群在全球其他海域丰度也较高,如南大西洋[27]、东海和南海[28]。本研究中的优势属主要为交替单胞菌属、亚硫酸杆菌属、海杆菌属、盐单胞菌属与假交替单胞菌属细菌,这与通过未培养方法研究的结果相符[5]。其中,交替单胞菌属细菌相对丰度最高,且主要在深层MT9K样品中分离得到(图 5-D)。与此相一致,之前的研究也发现交替单胞菌属菌株在马里亚纳海沟8289 m水层中分离获得的频率较高[17]。基因组分析结果表明,这些深渊交替单胞菌可以附着在快速沉降的大颗粒有机物上,并对其降解利用而生长[29]。在其他高通量测序研究中发现的一些丰富类群,如假单胞菌和放线菌[5],在本研究中并未分离得到,推测可能是由于不同培养方式及培养条件导致。Lin等研究发现,放线菌基因组GC含量较高(> 50%),且能产生多种生物活性物质[26],本研究所使用的低浓度或单一营养物质可能无法维持他们生长与代谢需要。因此,马里亚纳海沟水体优势细菌的高丰度可能与其较高的环境适应性有关。
众所周知,常规的海洋细菌培养基如2216E的营养浓度远高于海洋细菌的生长环境,对于生长速度慢的细菌可能有抑制作用[30];且利用天然培养基(主要成分为酵母粉和蛋白胨)很难获取独特的有价值的微生物资源。鉴于此,本研究利用寡营养培养法与已知碳氮源培养法对传统培养基进行改良。结果表明,共获得17个属的可培养细菌,多样性低于以前分离得到的33属[13],这种差异可能是由于培养条件的不同导致。本研究中的培养基营养成分单一(有机碳氮培养基)或营养贫瘠(稀释的2216E),属于选择性培养基,偏向于筛选能利用特定碳氮源或具有寡营养生活方式的细菌。在4大亚类培养基中,稀释的2216E与氨基酸培养基对海杆菌属的选择性更好。作为海洋中常见的优势菌群[13, 17],列文虎克菌属与嗜冷杆菌属细菌菌株仅在稀释的2216E培养基中分离得到;而一些稀有细菌如远洋杆菌属(Pelagibacterium)、科贝特氏属(Cobetia)菌株等仅在特定的碳氮源培养基中分离得到(图 4-B),这可能与其对不同碳氮源的选择利用性有关。结合Zhao等的研究结果[17],我们推测,不同营养浓度梯度的天然培养基(例如原2216E培养基及不同稀释倍数的2216E培养基)和不同营养类型的选择性培养基(例如BM和TG培养基)的组合可能有助于获得多样化的可培养细菌。另外,温度是调节微生物代谢和生长活力的重要因素[26],不同的温度梯度培养可作为常规培养条件的补充,有利于分离得到种类更丰富的微生物。此外,随着培养组学的发展,微流控单细胞分选技术与高通量极限稀释培养法[31]可以提高微生物的分选效率,通过扩大微生物培养的通量而进一步提高微生物的可培养率。
通过切向流浓缩,本研究共获得70株可通过0.22-μm细菌(5纲22属),多样性高于常规培养细菌类群(3纲17属),且种类不同。Nakai等通过宏基因组技术研究发现,马里亚纳海沟深海热液中可通过0.22-μm微生物与0.22 μm滤膜上微生物的功能特征也显著不同,其中与膜转运及毒力因子相关的基因占主导地位[21]。1981年,Torrella和Morita从海水中分离出两种过滤细菌(0.2 μm-passable bacteria)类型,一种是复苏后大于0.2 μm;而另一种复苏后仍然小于0.2 μm,称超微细菌(ultramicrobacteria)[32]。本研究通过原子力显微镜与扫描电镜也观察到超微细菌与常规大小细菌(图 1)。这些超微细菌基因组较小,且具有寡营养的生活方式[1],可在海洋中营养十分贫瘠的环境中生存,例如Sphingomonas alaskensis AFO1[33]、Sphingopyxis alaskensis RB2256[34]及Pelagibacter ubique HTCC1062[23]。需要考虑的是,本研究在水体过滤过程中,随着过滤系统压力增大,一些大于0.22 μm的微生物可能无法严格被0.22 μm滤膜截留而进入切向流系统。推测这也是我们筛选到较多盐单胞菌属、海杆菌属及交替单胞菌属等大于0.2 μm细菌类群的原因。此外,我们也分离得到多株海洋中的新类群(表 2),进一步说明该富集系统有利于增大可培养新型细菌多样性。
根据微生物对压力的耐受情况可以将其分为常压菌、耐压菌、嗜压菌与极端嗜压菌[35]。通常海水深度每下降100 m,压力增加1 MPa。作为海洋最深处,马里亚纳海沟(约11000 m)最大压力可达110 MPa。之前****从马里亚纳海沟分离多株极端嗜压菌,他们不能在常压下生存,例如Colwellia sp. MT41,最适压力可达103 MPa[15]。本研究中也从马里亚纳海沟不同深度水体中分离得到33株耐压细菌,分属于8个属,包括海杆菌属、盐单胞菌属、交替单胞菌属和假交替单胞菌属等。不一致的是,目前常见的嗜压细菌主要是γ-变形菌类群中的希瓦氏菌属(Shewanella)、冷单胞菌属(Psychromonas)、发光杆菌属(Photobacterium)、科尔韦尔氏菌属(Colwellia)、硫代深海嗜压菌属(Thioprofundum)及摩替亚氏菌属(Moritella)等属,以及部分α-和δ-变形菌类群[36]。这些类群在脂肪酸的组成、压力调控元件、嗜压基因的表达、运动性等方面逐渐形成了有别于常压微生物的独特机制[35]。例如,在高压条件下,耐压希瓦氏菌WP3细胞膜中的不饱和脂肪酸和支链脂肪酸含量增加[37]。本研究中,所有的芽孢杆菌仅在MT9K样品中分离得到(图 7),而此前关于从深海环境中分离到的芽孢杆菌的耐压特性的研究较少[38]。此外,本研究中33.3%的耐压菌株属于可通过0.22-μm细菌。之前研究报道,深海微生物在高静水压下通过体积变小导致其分子系统构象和超分子结构变化,以更紧凑的结构形式适应深海的高压环境[39]。本研究所获得的不同类型细菌菌株可作为模式生物,以探究其营养类型、在深渊环境中的生物地球化学功能及高压适应机制。
References
| [1] | Lauro FM, McDougald D, Thomas T, Williams TJ, Egan S, Rice S, DeMaere MZ, Ting L, Ertan H, Johnson J, Ferriera S, Lapidus A, Anderson I, Kyrpides N, Munk AC, Detter C, Han CS, Brown MV, Robb FT, Kjelleberg S, Cavicchioli R. The genomic basis of trophic strategy in marine bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(37): 15527-15533. DOI:10.1073/pnas.0903507106 |
| [2] | Li Y, Sun LL, Sun ML, Su HN, Zhang XY, Xie BB, Chen XL, Zhang YZ, Qin QL. Vertical and horizontal biogeographic patterns and major factors affecting bacterial communities in the open South China Sea. Scientific Reports, 2018, 8: 8800. DOI:10.1038/s41598-018-27191-w |
| [3] | Arrigo KR. Marine microorganisms and global nutrient cycles. Nature, 2005, 437(7057): 349-355. DOI:10.1038/nature04159 |
| [4] | Xue CX, Liu JW, Lea-Smith DJ, Rowley G, Lin HY, Zheng YF, Zhu XY, Liang JC, Ahmad W, Todd JD, Zhang XH. Insights into the vertical stratification of microbial ecological roles across the deepest seawater column on Earth. Microorganisms, 2020, 8(9): 1309. DOI:10.3390/microorganisms8091309 |
| [5] | Liu JW, Zheng YF, Lin HY, Wang XC, Li M, Liu Y, Yu M, Zhao MX, Pedentchouk N, Lea-Smith DJ, Todd JD, Magill CR, Zhang WJ, Zhou S, Song DL, Zhong HH, Xin Y, Yu M, Tian JW, Zhang XH. Proliferation of hydrocarbon-degrading microbes at the bottom of the Mariana Trench. Microbiome, 2019, 7(1): 47. DOI:10.1186/s40168-019-0652-3 |
| [6] | Brown MV, Philip GK, Bunge JA, Smith MC, Bissett A, Lauro FM, Fuhrman JA, Donachie SP. Microbial community structure in the North Pacific Ocean. The ISME Journal, 2009, 3(12): 1374-1386. DOI:10.1038/ismej.2009.86 |
| [7] | Jamieson AJ, Fujii T, Mayor DJ, Solan M, Priede IG. Hadal trenches: the ecology of the deepest places on Earth. Trends in Ecology & Evolution, 2010, 25(3): 190-197. |
| [8] | Jing HM, Zhang Y, Li YD, Zhu WD, Liu HB. Spatial variability of picoeukaryotic communities in the Mariana Trench. Scientific Reports, 2018, 8: 15357. DOI:10.1038/s41598-018-33790-4 |
| [9] | Nunoura T, Takaki Y, Hirai M, Shimamura S, Makabe A, Koide O, Kikuchi T, Miyazaki J, Koba K, Yoshida N, Sunamura M, Takai K. Hadal biosphere: insight into the microbial ecosystem in the deepest ocean on Earth. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(11): E1230-E1236. DOI:10.1073/pnas.1421816112 |
| [10] | Hansell D, Carlson C, Repeta D, Schlitzer R. Dissolved organic matter in the ocean: a controversy stimulates new insights. Oceanography, 2009, 22(4): 202-211. DOI:10.5670/oceanog.2009.109 |
| [11] | Tian JW, Fan L, Liu HD, Liu JW, Li Y, Qin QL, Gong Z, Chen HT, Sun ZB, Zou L, Wang XC, Xu HZ, Bartlett D, Wang M, Zhang YZ, Zhang XH, Zhang CL. A nearly uniform distributional pattern of heterotrophic bacteria in the Mariana Trench interior. Deep Sea Research Part I: Oceanographic Research Papers, 2018, 142: 116-126. DOI:10.1016/j.dsr.2018.10.002 |
| [12] | Glud RN, Wenzh?fer F, Middelboe M, Oguri K, Turnewitsch R, Canfield DE, Kitazato H. High rates of microbial carbon turnover in sediments in the deepest oceanic trench on Earth. Nature Geoscience, 2013, 6(4): 284-288. DOI:10.1038/ngeo1773 |
| [13] | Huang Y, Qin WJ, Dai H, Zhang RY, Quan ZX. Microbial isolation and biodiversity analysis of water samples at different depth in the Mariana Trench. Microbiology China, 2020, 47(9): 2720-2731. (in Chinese) 黄莹, 秦纹静, 戴红, 张汝毅, 全哲学. 马里亚纳海沟不同深度水样微生物分离与多样性分析. 微生物学通报, 2020, 47(9): 2720-2731. |
| [14] | Quigley MM, Colwell RR. Properties of bacteria isolated from deep-sea sediments. Journal of Bacteriology, 1968, 95(1): 211-220. DOI:10.1128/jb.95.1.211-220.1968 |
| [15] | Yayanos AA, Dietz AS, Van Boxtel R. Obligately barophilic bacterium from the Mariana Trench. Proceedings of the National Academy of Sciences of the United States of America, 1981, 78(8): 5212-5215. DOI:10.1073/pnas.78.8.5212 |
| [16] | Lauro FM, Chastain RA, Blankenship LE, Yayanos AA, Bartlett DH. The unique 16S rRNA genes of piezophiles reflect both phylogeny and adaptation. Applied and Environmental Microbiology, 2007, 73(3): 838-845. DOI:10.1128/AEM.01726-06 |
| [17] | Zhao XX, Liu JW, Zhou S, Zheng YF, Wu YH, Kogure K, Zhang XH. Diversity of culturable heterotrophic bacteria from the Mariana Trench and their ability to degrade macromolecules. Marine Life Science & Technology, 2020, 2(2): 181-193. DOI:10.1007/s42995-020-00027-1?utm_medium=cpc |
| [18] | Li Y, Sun XM, Li J, Song XY, Qin QL, Su HN, Chen XL, Zhang YZ, Fan SJ, Zhang XY. Marinomonas profundi sp. nov., isolated from deep seawater of the Mariana Trench. International Journal of Systematic and Evolutionary Microbiology, 2020, 70(11): 5747-5752. DOI:10.1099/ijsem.0.004472 |
| [19] | He XX, Liu RH, Liang JC, Li YY, Zhao XX, Ran LM, Ahmad W, Zhang XH. Winogradskyella ouciana sp. nov., isolated from the hadal seawater of the Mariana Trench. International Journal of Systematic and Evolutionary Microbiology, 2021, 71(3). DOI:10.1099/ijsem.0.004687 |
| [20] | Li ZS, Wang M, Luo ZX, Liu L, Xia J, Gong Z, Jiang Y, Shao HB, Chen HT, Tian JW. Vertical distribution and dynamic variation of virioplankton in the Mariana Trench. Oceanologia et Limnologia Sinica, 2018, 49(6): 1251-1258. (in Chinese) 李中石, 汪岷, 罗志祥, 刘璐, 夏骏, 宫政, 姜勇, 邵红兵, 陈洪涛, 田纪伟. 马里亚纳海沟浮游病毒垂直分布及动态变化. 海洋与湖沼, 2018, 49(6): 1251-1258. |
| [21] | Nakai R, Abe T, Takeyama H, Naganuma T. Metagenomic analysis of 0.2-μm-passable microorganisms in deep-sea hydrothermal fluid. Marine Biotechnology, 2011, 13(5): 900-908. DOI:10.1007/s10126-010-9351-6 |
| [22] | Hu CH, Xu Q, Sun X, Yu H, Yuan YQ. Several biological typical samples preparation methods of scanning electron microscope. Hubei Agricultural Sciences, 2016, 55(20): 5389-5392. (in Chinese) 胡春辉, 徐青, 孙璇, 于浩, 袁玉清. 几种典型扫描电镜生物样本制备. 湖北农业科学, 2016, 55(20): 5389-5392. |
| [23] | Zobell CE. Studies on marine bacteria. I-The cultural requirements of heterotrophic aerobes. Journal of Marine Research, 1941, 4: 42-75. |
| [24] | Li Y, Wang ZB, Zhang XY, Dang YR, Sun LL, Zhang WP, Fu HH, Yang GP, Wang M, McMinn A, Chen XL, Chen Y, Wang S, Zhang YZ, Qin QL. Experimental evidence for long-term coexistence of copiotrophic and oligotrophic bacteria in pelagic surface seawater. Environmental Microbiology, 2021, 23(2): 1162-1173. DOI:10.1111/1462-2920.15321 |
| [25] | Du R, Yu M, Cheng JG, Zhang JJ, Tian XR, Zhang XH. Diversity and sulfur oxidation characteristics of cultivable sulfur oxidizing bacteria in hydrothermal fields of Okinawa Trough. Acta Microbiologica Sinica, 2019, 59(6): 1036-1049. (in Chinese) 杜瑞, 于敏, 程景广, 张静静, 田晓荣, 张晓华. 冲绳海槽热液区可培养硫氧化细菌多样性及其硫氧化特性. 微生物学报, 2019, 59(6): 1036-1049. |
| [26] | Lin Y, Liu RH, Zhou S, Zhu XY, Wang JY, Zhang XH. Diversity of culturable heterotrophic bacteria from sediments of the Mariana Trench and their ability to degrade dimethylsulfoniopropionate (DMSP). Acta Microbiologica Sinica, 2021: 1-21. (in Chinese) 林钰, 刘荣华, 周顺, 朱晓雨, 王金燕, 张晓华. 马里亚纳海沟沉积物可培养异养细菌的多样性及其DMSP降解能力. 微生物学报, 2021: 1-21. DOI:10.13343/j.cnki.wsxb.20200668 |
| [27] | Wang K, Yan PS, Ma R, Jia WW, Shao ZZ. Diversity of culturable bacteria in deep-sea water from the South Atlantic Ocean. Bioengineered, 2017, 8(5): 572-584. DOI:10.1080/21655979.2017.1284711 |
| [28] | Lu JW, Zhang XQ, Du LL, Yang ZJ, Wu M, Lu LD. Bacterial isolation and diversity analysis of four seawater sampling sites of the East China Sea and the South China Sea. Journal of Zhejiang University: Science Edition, 2012, 39(4): 443-449. (in Chinese) 卢婧雯, 张心齐, 杜丽丽, 杨志坚, 吴敏, 卢龙斗. 中国东海及南海近海4采样点海水可培养细菌的多样性研究. 浙江大学学报: 理学版, 2012, 39(4): 443-449. DOI:10.3785/j.issn.1008-9497.2012.04.018 |
| [29] | Koch H, Dürwald A, Schweder T, Noriega-Ortega B, Vidal-Melgosa S, Hehemann JH, Dittmar T, Freese HM, Becher D, Simon M, Wietz M. Biphasic cellular adaptations and ecological implications of Alteromonas macleodii degrading a mixture of algal polysaccharides. The ISME Journal, 2019, 13(1): 92-103. DOI:10.1038/s41396-018-0252-4 |
| [30] | Zhuang K, Hu XJ, Cao YC, Xu YN, Zhang JS, Wen GL. Bacterial community structure and its utilization characteristics of carbon sources in water of South China Sea under different low-nutrient culture conditions. Microbiology China, 2020, 47(9): 2697-2710. (in Chinese) 庄康, 胡晓娟, 曹煜成, 许云娜, 张建设, 文国樑. 不同寡营养培养条件下南海水体细菌群落结构及其对碳源的利用特征. 微生物学通报, 2020, 47(9): 2697-2710. |
| [31] | Huang XZ, Li PJ, Zhou MF, Li YW, Ou XW, Chen P, Guggenberger G, Liu BF. A high-throughput ultrasonic spraying inoculation method promotes colony cultivation of rare microbial species. Environmental Microbiology, 2021, 23(2): 1275-1285. DOI:10.1111/1462-2920.15386 |
| [32] | Torrella F, Morita RY. Microcultural study of bacterial size changes and microcolony and ultramicrocolony formation by heterotrophic bacteria in seawater. Applied and Environmental Microbiology, 1981, 41(2): 518-527. DOI:10.1128/aem.41.2.518-527.1981 |
| [33] | Eguchi M, Ostrowski M, Fegatella F, Bowman J, Nichols D, Nishino T, Cavicchioli R. Sphingomonas alaskensis strain AFO1, an abundant oligotrophic ultramicrobacterium from the North Pacific. Applied and Environmental Microbiology, 2001, 67(11): 4945-4954. DOI:10.1128/AEM.67.11.4945-4954.2001 |
| [34] | Williams TJ, Ertan H, Ting L, Cavicchioli R. Carbon and nitrogen substrate utilization in the marine bacterium Sphingopyxis alaskensis strain RB2256. The ISME Journal, 2009, 3(9): 1036-1052. DOI:10.1038/ismej.2009.52 |
| [35] | Li XG, Xu J, Xiao X. High pressure adaptation of deep-sea microorganisms and biogeochemical cycles. Microbiology China, 2013, 40(1): 59-70. (in Chinese) 李学恭, 徐俊, 肖湘. 深海微生物高压适应与生物地球化学循环. 微生物学通报, 2013, 40(1): 59-70. |
| [36] | Jebbar M, Franzetti B, Girard E, Oger P. Microbial diversity and adaptation to high hydrostatic pressure in deep-sea hydrothermal vents prokaryotes. Extremophiles, 2015, 19(4): 721-740. DOI:10.1007/s00792-015-0760-3 |
| [37] | Wang F, Xiao X, Ou HY, Gai YB, Wang FP. Role and regulation of fatty acid biosynthesis in the response of Shewanella piezotolerans WP3 to different temperatures and pressures. Journal of Bacteriology, 2009, 191(8): 2574-2584. DOI:10.1128/JB.00498-08 |
| [38] | Yu LB, Tang XX, Wei SP, Qiu YK, Xu X, Xu GX, Wang QL, Yang Q. Two novel species of the family Bacillaceae: Oceanobacillus piezotolerans sp. nov. and Bacillus piezotolerans sp. nov., from deep-sea sediment samples of Yap Trench. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(10): 3022-3030. DOI:10.1099/ijsem.0.003559 |
| [39] | Mota MJ, Lopes RP, Delgadillo I, Saraiva JA. Microorganisms under high pressure-Adaptation, growth and biotechnological potential. Biotechnology Advances, 2013, 31(8): 1426-1434. |
